喹诺酮类和四环素类药物均属于广谱抗生素[1-3],可有效预防和治疗多种传染病,还具有促进动物生长、提高饲料利用率[4-5]等作用,因此常被广泛用于大规模畜禽养殖,且这些抗生素在畜禽产品中也时有检出[6-8],如果通过食用畜禽类食品摄入过量抗生素,不仅容易使人体产生一定的耐药性,而且健康还会受到不同程度的损害[9-10],因此畜禽类食品中抗生素的检测能为食品安全风险监测及监管工作提供技术和数据支持,在确保日常饮食安全方面起着至关重要的作用。
目前,抗生素类药物的检测方法主要有微生物检测法[11]、免疫检测法[12-13]、高效液相色谱法[14-15]和色谱-质谱联用法[16-18],其中液相色谱-质谱联用法既可以分离目标物又能对目标物进行定性与定量分析,具有灵敏度高、定性准确和可以同时检测多种目标物等优点,近年来被广泛应用于抗生素类兽药的分析和检测[19-20],但是目前采用液相色谱-质谱联用法同时检测多种喹诺酮类和四环素类抗生素的研究较少。QuEChERS(quick, easy,cheap, effective, rugged, safe)法具有快速、简单、便宜、有效、耐用和安全等优点,是一种可以提取食品中农药和兽药残留等化学污染物的新型前处理技术[21-24],但是使用QuEChERS法同时提取禽内脏食品中多种喹诺酮类和四环素类抗生素的研究较少。针对上述问题,本研究建立采用QuEChERS-高效液相色谱-质谱联用法同时检测鸡胗和鸡肝中15 种喹诺酮类和四环素类抗生素的分析测定方法。
1 材料与方法
1.1 材料与试剂
实验所用样品来自本实验室参与的食品安全风险监测所采集的100 份样品,其中鸡胗样品51 份,鸡肝样品49 份。
15 种标准品:恩诺沙星(纯度99.9%)、环丙沙星(纯度94.0%)、氧氟沙星(纯度99.0%)、培氟沙星(纯度92.1%)、诺氟沙星(纯度97.2%)、洛美沙星(纯度99.4%)、沙拉沙星(纯度95.0%)、恶喹酸(纯度98.0%)、达氟沙星(纯度94.0%)、氟甲喹(纯度98.3%)、二氟沙星(纯度96.1%)、四环素(纯度98.0%)、金霉素(纯度94.6%)、强力霉素(纯度98.7%)、土霉素(纯度95.6%) 德国Dr.Ehrenstorfer公司;甲醇、乙腈、甲酸(均为色谱纯) 德国Merk公司;Discovery® DSC-18吸附剂 美国Supelco公司;玻璃纤维滤纸 美国GE Healthcare公司。
1.2 仪器与设备
1260-6460高效液相色谱-三重串联四极杆质谱联用仪美国Agilent公司;AE160电子分析天平 梅特勒-托利多仪器(上海)有限公司;3K15高速冷冻离心机 德国Sigma公司;Vortex-genie 2涡旋振荡器 美国Scientific Industries公司;超纯水系统 美国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
用甲醇将15 种单一标准品分别配制成质量浓度为100 μg/mL的单标储备液,再用甲醇将上述各单标储备液混合,配制成15 种抗生素质量浓度均为1 μg/mL的混合标准工作液,然后用空白基质提取液稀释,配制成质量浓度分别为2、5、10、20、40、60、80 ng/mL的系列混合标准溶液。
1.3.2 样品前处理
取适量内脏样品去筋、粉碎均匀,准确称取均质后的样品5.0 g于50 mL塑料离心管内,加入10 mL冰乙酸-乙腈-水混合提取液(1∶84∶15,V/V)和0.1 g乙二胺四乙酸二钠(Na2EDTA),涡旋混匀1 min,超声15 min,4 ℃、9 000 r/min离心5 min,上清液用玻璃纤维滤纸过滤到15 mL塑料离心管中,加入250 mg Discovery® DSC-18吸附剂,涡旋混匀1 min,9 000 r/min离心2 min,取1 mL样液,用0.22 μm有机滤膜过滤,上机检测。
1.3.3 色谱及质谱条件
1.3.3.1 色谱条件
色谱柱为Agilent ZORBAX Eclipse Plus C18柱(3.0 mm×100 mm,18 μm);流动相:A相为体积分数0.1%甲酸,B相为甲醇;流速0.3 mL/min;柱温35 ℃;进样量5 μL,梯度洗脱具体条件详见表1。
表 1 15 种抗生素的梯度洗脱条件
Table 1 Gradient elution conditions for separation of 15 antibiotics
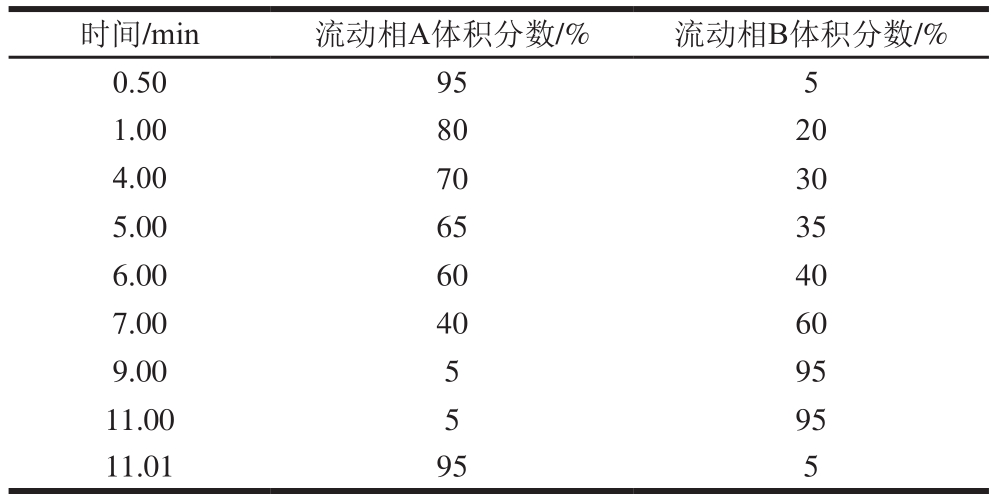
时间/min 流动相A体积分数/% 流动相B体积分数/%0.50 95 5 1.00 80 20 4.00 70 30 5.00 65 35 6.00 60 40 7.00 40 60 9.00 5 95 11.00 5 95 11.01 95 5
1.3.3.2 质谱条件
使用电喷雾电离源正离子模式(electrospray ionization,ESI+)检测,干燥气温度325 ℃,干燥气流速10 L/min,雾化气电压45 psi,鞘气温度350 ℃,鞘气流速11 L/min,毛细管电压4 000 V。
1.3.4 结果计算
样品中喹诺酮类和四环素类抗生素残留量按下式计算。
式中:X为样品中待测组分含量/(μg/kg);ρ为测定液中待测组分质量浓度/(ng/mL);V为提取液体积/mL;m为样品质量/g。
1.4 数据处理
采用Excel软件计算平均加标回收率、相对标准偏差(relative standard deviation,RSD)和样品中喹诺酮类和四环素类抗生素残留量,其他数据处理、标准曲线的制作和色谱图均采用Masshunter定性和定量分析软件(美国Agilent公司)。
2 结果与分析
2.1 色谱条件和质谱参数的选择
2.1.1 色谱条件的优化和选择
由于四环素类抗生素在酸性条件下易形成差向异构体,在碱性条件下易降解[25],因此本研究先采用中性流动相体系甲醇-水体系进行实验,结果发现,色谱峰拖尾严重;向水相中加入0.1%甲酸,同时更换不同有机相进行比较,结果发现,在乙腈-0.1%甲酸和甲醇-乙腈(2∶3,V/V)-0.1%甲酸体系下色谱峰峰形较好且仪器灵敏度较高,但是分离效果不理想,而甲醇-0.1%甲酸体系下的色谱峰峰形虽然没有前2 种流动相体系下尖锐且仪器响应值稍低,但是色谱峰峰形对称且分离效果相对理想,综合评定分离效果、响应强度及实验结果的稳定性等指标,选用甲醇-0.1%甲酸流动相体系。
2.1.2 质谱参数的优化和选择
在ESI+条件下,分别对15 种药物的单一标准溶液进行母离子扫描,确定每种药物的母离子和碎裂电压,再进行子离子扫描,选择信号最强且选择性好的子离子为定量离子,信号次强且选择性好的子离子为定性离子,同时优化碰撞能量,每种药物尽量选择与其他药物不同的定量和定性离子对,如果条件不允许,2 种药物最多共用1 个离子对,如氟甲喹和恶喹酸。优化后的母离子和子离子、碎裂电压和碰撞能量如表2所示。
采用优化后的色谱条件和质谱参数进行测定,15 种喹诺酮类和四环素类抗生素混合标准溶液(100 ng/mL)的多反应监测(multiple reaction monitoring,MRM)色谱图如图1所示,由于恶喹酸和氟甲喹具有1 对相同的母离子和子离子,因此会分别出现2 个峰。
表 2 15 种喹诺酮类和四环素类抗生素的质谱参数
Table 2 MS parameters for 15 quinolones and tetracyclines antibiotics

注:*. 定量离子。
抗生素 母离子(m/z) 子离子(m/z) 碎裂电压/V 碰撞能量/eV金霉素 479.1 462.0* 114 9 444.0 17土霉素 461.2 443.1* 119 5 426.0 13四环素 445.2 427.1* 114 5 410.0 13强力霉素 445.1 428.0* 114 30 201.0 40二氟沙星 400.0 382.1* 140 20 356.1 20沙拉沙星 386.1 368.1* 130 20 342.1 15氧氟沙星 362.0 318.1* 130 15 261.1 26恩诺沙星 360.0 316.2* 130 18 245.0 20达氟沙星 358.1 340.1* 140 25 255.0 46洛美沙星 352.1 308.1* 140 22 265.1 18培氟沙星 334.1 316.2* 130 20 290.2 16环丙沙星 332.1 314.1* 135 20 231.0 42诺氟沙星 320.0 302.1* 130 17 276.1 13恶喹酸 262.1 244.0* 100 13 160.0 40氟甲喹 262.0 244.0* 150 13 202.0 30
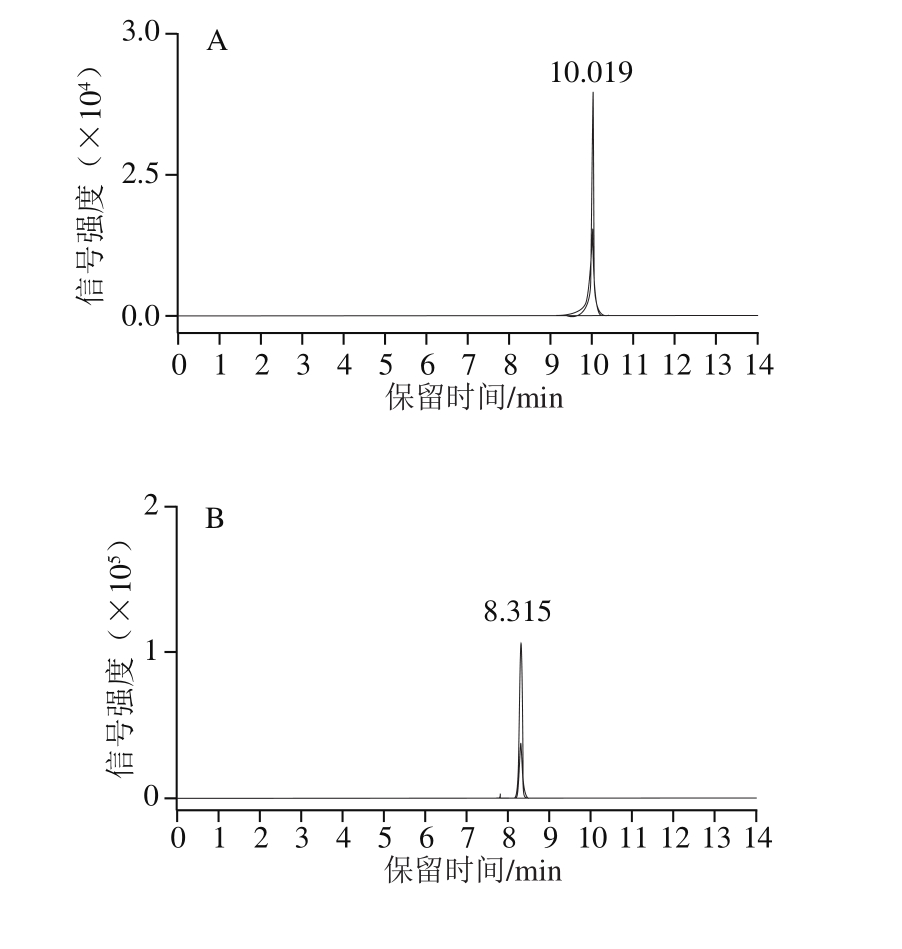
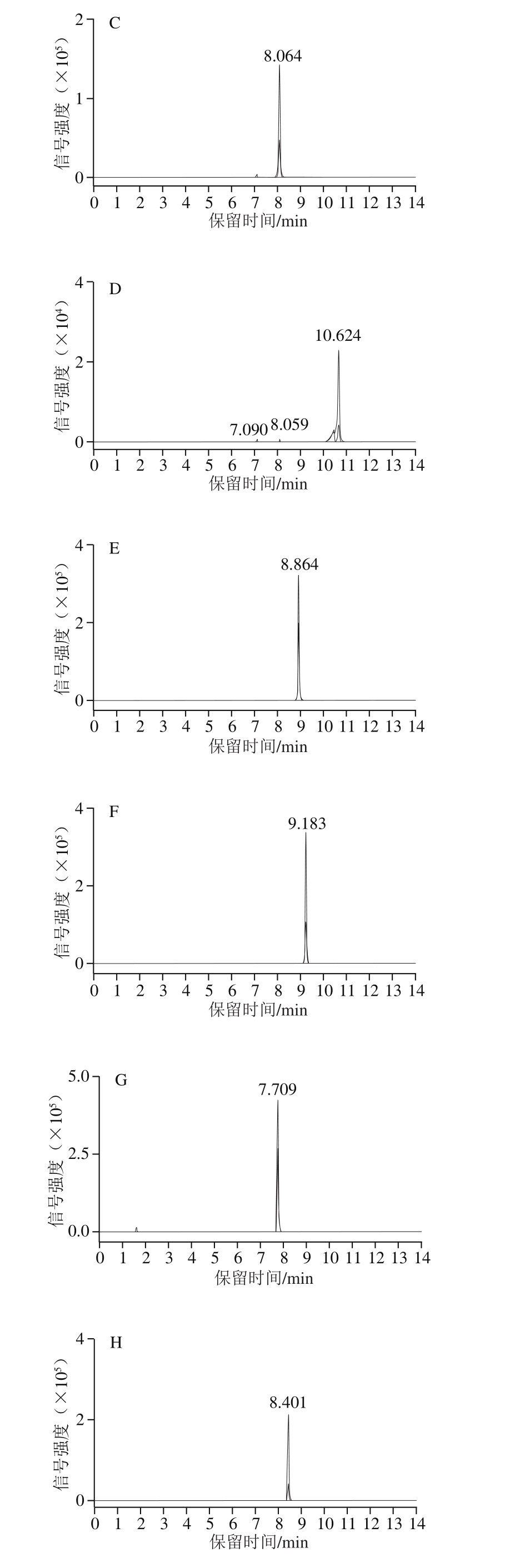


图 1 15 种喹诺酮类和四环素类抗生素混合标准溶液MRM色谱图
Fig. 1 MRM chromatograms for mixed standard solution of 15 quinolone and tetracycline antibiotics
2.2 方法的线性范围、检出限和定量限
表 3 15 种喹诺酮类和四环素类抗生素的标准曲线、相关系数、检出限及定量限
Table 3 Standard curve equations, correlation coefficients, detection limits and quantification limits of 15 quinolones and tetracyclines antibiotics
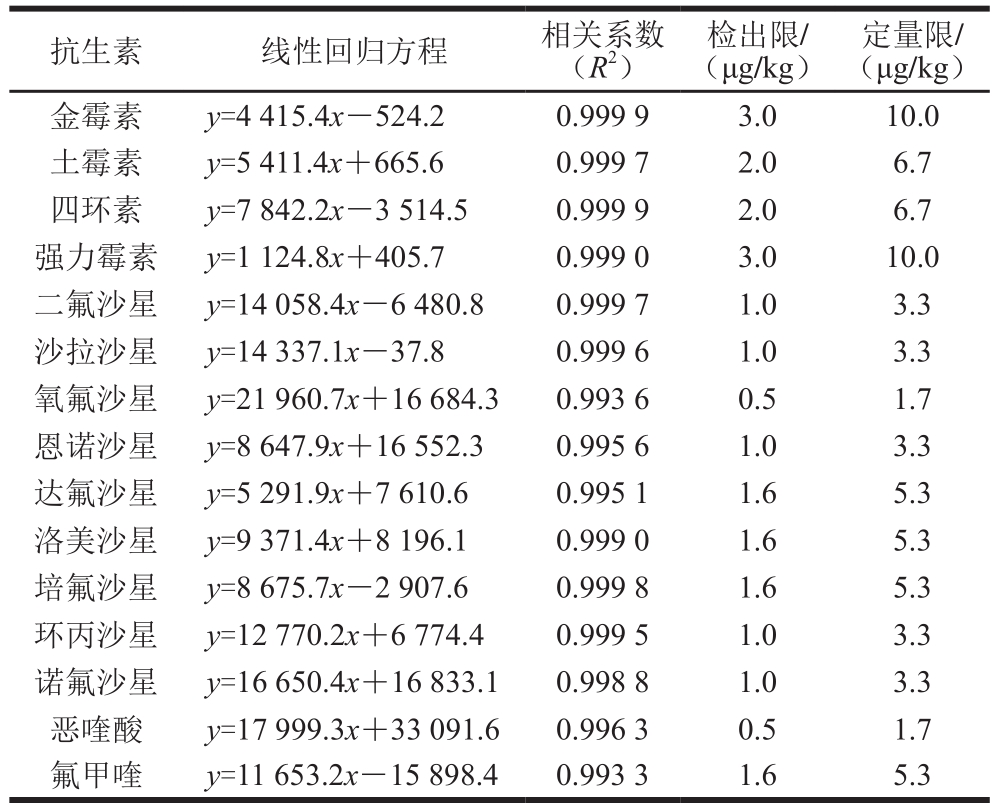
检出限/(μg/kg)抗生素 线性回归方程 相关系数(R2)定量限/(μg/kg)金霉素 y=4 415.4x-524.2 0.999 9 3.0 10.0土霉素 y=5 411.4x+665.6 0.999 7 2.0 6.7四环素 y=7 842.2x-3 514.5 0.999 9 2.0 6.7强力霉素 y=1 124.8x+405.7 0.999 0 3.0 10.0二氟沙星 y=14 058.4x-6 480.8 0.999 7 1.0 3.3沙拉沙星 y=14 337.1x-37.8 0.999 6 1.0 3.3氧氟沙星 y=21 960.7x+16 684.3 0.993 6 0.5 1.7恩诺沙星 y=8 647.9x+16 552.3 0.995 6 1.0 3.3达氟沙星 y=5 291.9x+7 610.6 0.995 1 1.6 5.3洛美沙星 y=9 371.4x+8 196.1 0.999 0 1.6 5.3培氟沙星 y=8 675.7x-2 907.6 0.999 8 1.6 5.3环丙沙星 y=12 770.2x+6 774.4 0.999 5 1.0 3.3诺氟沙星 y=16 650.4x+16 833.1 0.998 8 1.0 3.3恶喹酸 y=17 999.3x+33 091.6 0.996 3 0.5 1.7氟甲喹 y=11 653.2x-15 898.4 0.993 3 1.6 5.3
按照优化后的检测方法对2~80 ng/mL系列混合标准溶液进行检测,以各标准物质的质量浓度为横坐标(x),以相应的定量离子峰面积为纵坐标(y),绘制标准曲线。由表3可知,当15 种抗生素质量浓度在2~80 ng/mL范围内时,各标准物质质量浓度与其响应值存在良好的线性关系,R2均大于0.993。以信噪比(RS/N)=3时对应的15 种药物质量浓度确定该方法的检出限为0.5~3.0 μg/kg,以RS/N=10时对应的15 种药物质量浓度确定该方法的定量限为1.7~10.0 μg/kg,检出限和定量限均小于我国规定的禽内脏中喹诺酮类和四环素类抗生素最高残留限量[26](洛美沙星、培氟沙星、氧氟沙星、诺氟沙星等禁止检出的药物[27]除外),满足实验要求。
2.3 方法的准确度和精密度
采用加标回收实验对文中所述方法的准确度和精密度进行验证,空白基质样品选用不含本研究中15 种喹诺酮类和四环素类抗生素的阴性鸡胗和鸡肝样品,15 种药物的加标量分别为10、20、50 μg/kg,每个加标量重复6 次实验。由表4可知,空白基质样品中15 种抗生素的平均加标回收率为75.2%~104.4%,RSD为2.7%~8.7%,满足待测组分含量小于0.1 mg/kg时加标回收率60%~120%的要求[28]。
表 4 鸡胗和鸡肝中15 种喹诺酮类和四环素类抗生素的加标回收率和RSD(n=6)
Table 4 Recoveries and RSD of 15 quinolones and tetracyclines antibiotics from spiked chicken gizzard and liver samples (n= 6)
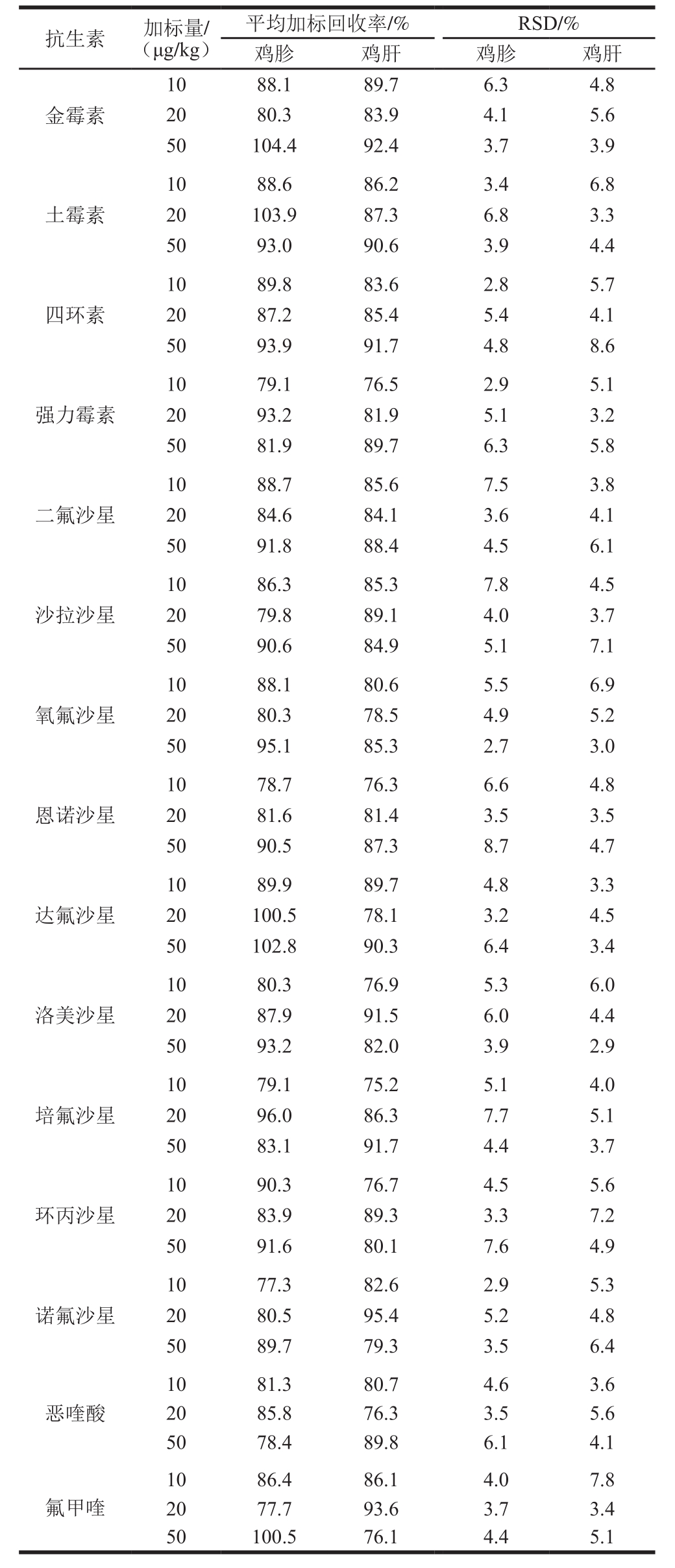
金霉素10 88.1 89.7 6.3 4.8 20 80.3 83.9 4.1 5.6 50 104.4 92.4 3.7 3.9土霉素10 88.6 86.2 3.4 6.8 20 103.9 87.3 6.8 3.3 50 93.0 90.6 3.9 4.4四环素10 89.8 83.6 2.8 5.7 20 87.2 85.4 5.4 4.1 50 93.9 91.7 4.8 8.6强力霉素10 79.1 76.5 2.9 5.1 20 93.2 81.9 5.1 3.2 50 81.9 89.7 6.3 5.8二氟沙星10 88.7 85.6 7.5 3.8 20 84.6 84.1 3.6 4.1 50 91.8 88.4 4.5 6.1沙拉沙星10 86.3 85.3 7.8 4.5 20 79.8 89.1 4.0 3.7 50 90.6 84.9 5.1 7.1氧氟沙星10 88.1 80.6 5.5 6.9 20 80.3 78.5 4.9 5.2 50 95.1 85.3 2.7 3.0恩诺沙星10 78.7 76.3 6.6 4.8 20 81.6 81.4 3.5 3.5 50 90.5 87.3 8.7 4.7达氟沙星10 89.9 89.7 4.8 3.3 20 100.5 78.1 3.2 4.5 50 102.8 90.3 6.4 3.4洛美沙星10 80.3 76.9 5.3 6.0 20 87.9 91.5 6.0 4.4 50 93.2 82.0 3.9 2.9培氟沙星10 79.1 75.2 5.1 4.0 20 96.0 86.3 7.7 5.1 50 83.1 91.7 4.4 3.7环丙沙星10 90.3 76.7 4.5 5.6 20 83.9 89.3 3.3 7.2 50 91.6 80.1 7.6 4.9诺氟沙星10 77.3 82.6 2.9 5.3 20 80.5 95.4 5.2 4.8 50 89.7 79.3 3.5 6.4恶喹酸10 81.3 80.7 4.6 3.6 20 85.8 76.3 3.5 5.6 50 78.4 89.8 6.1 4.1氟甲喹10 86.4 86.1 4.0 7.8 20 77.7 93.6 3.7 3.4 50 100.5 76.1 4.4 5.1
2.4 样品前处理方法的选择
表 5 QuEChERS法和SPE法处理鸡胗和鸡肝中15 种喹诺酮类和四环素类抗生素的加标回收率(n=6)
Table 5 Recoveries of 15 quinolones and tetracyclines antibiotics from spiked chicken gizzard and liver samples tested by solid phase extraction(SPE) versus QuEChERS method (n= 6)
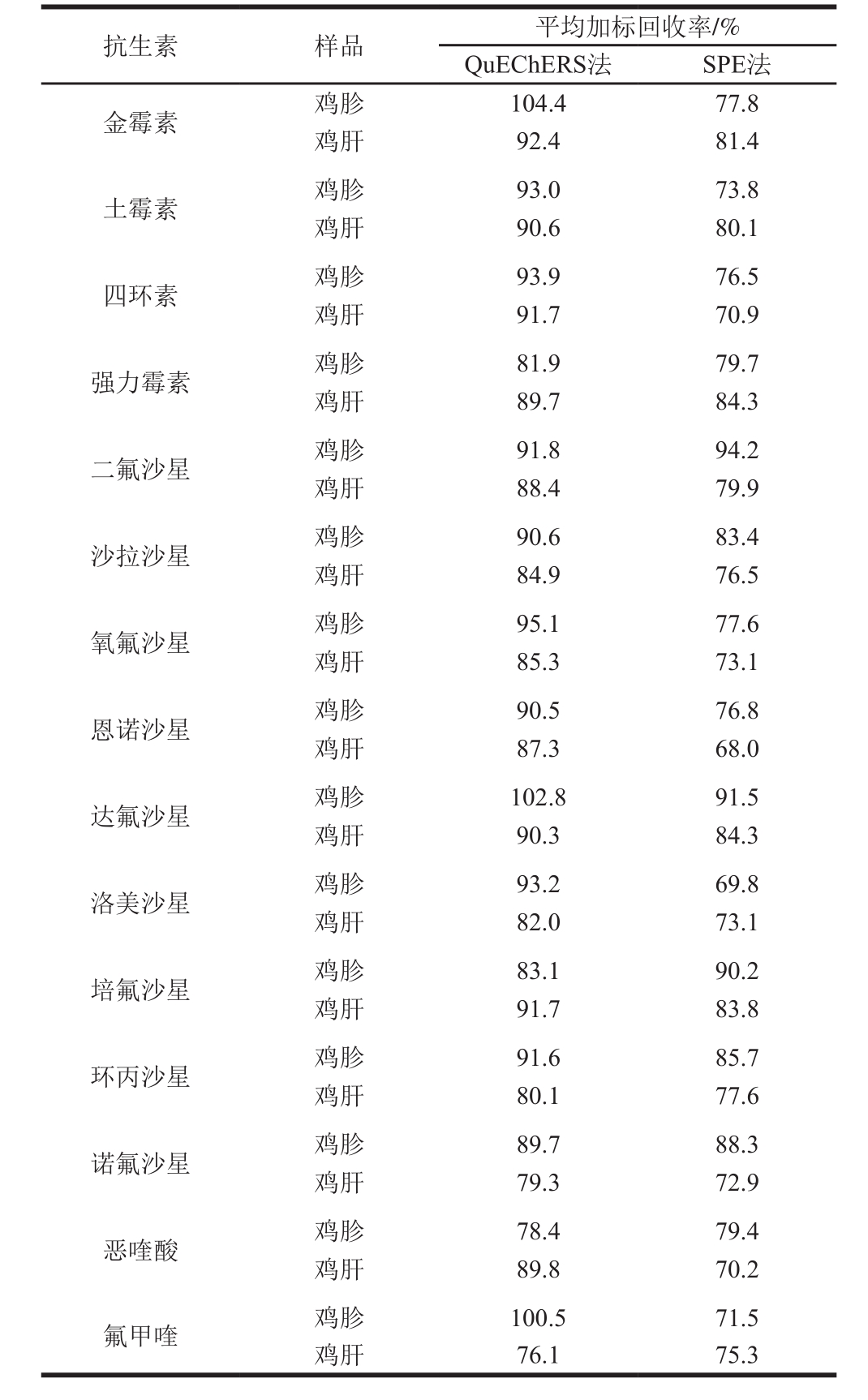
抗生素 样品 平均加标回收率/%QuEChERS法 SPE法金霉素 鸡胗 104.4 77.8鸡肝 92.4 81.4土霉素 鸡胗 93.0 73.8鸡肝 90.6 80.1四环素 鸡胗 93.9 76.5鸡肝 91.7 70.9强力霉素 鸡胗 81.9 79.7鸡肝 89.7 84.3二氟沙星 鸡胗 91.8 94.2鸡肝 88.4 79.9沙拉沙星 鸡胗 90.6 83.4鸡肝 84.9 76.5氧氟沙星 鸡胗 95.1 77.6鸡肝 85.3 73.1恩诺沙星 鸡胗 90.5 76.8鸡肝 87.3 68.0达氟沙星 鸡胗 102.8 91.5鸡肝 90.3 84.3洛美沙星 鸡胗 93.2 69.8鸡肝 82.0 73.1培氟沙星 鸡胗 83.1 90.2鸡肝 91.7 83.8环丙沙星 鸡胗 91.6 85.7鸡肝 80.1 77.6诺氟沙星 鸡胗 89.7 88.3鸡肝 79.3 72.9恶喹酸 鸡胗 78.4 79.4鸡肝 89.8 70.2氟甲喹 鸡胗 100.5 71.5鸡肝 76.1 75.3
GB/T 21312——2007《动物源性食品中14 种喹诺酮兽药物留检测方法 液相色谱-质谱/质谱法》[29]和GB/T 21317——2007《动物源性食品中四环素类兽药残留量检测方法 液相色谱-质谱/质谱法与高效液相色谱法》[30]采用EDTA-Mcllvaine缓冲液-固相萃取(solid-phase extraction,SPE)法(下面统称SPE法)对样品进行前处理,本研究将QuEChERS提取法与之进行比较,结果表明:在操作方面,QuEChERS提取法所用的耗材和试剂相对较少,不需要进行SPE和氮吹浓缩,操作较为简单;在检出限和定量限方面,由于SPE法多一步氮吹浓缩样液的过程,因此在样品取样量、提取液体积和检测仪器都相同的前提下,其方法检出限和定量限要比采用QuEChERS提取法低;在方法准确度方面,当鸡胗和鸡肝空白基质样品加标水平为50 μg/kg时,采用QuEChERS提取法检测时15 种喹诺酮类和四环素类抗生素的平均加标回收率为76.1%~104.4%,采用SPE法检测时的平均加标回收率为68.0%~94.2%,除鸡胗基质中的二氟沙星、培氟沙星和恶喹酸用QuEChERS法提取检测时的平均加标回收率低于SPE法外,其余均高于SPE法(表5),这可能是由于SPE法过程较为复杂,步骤较多,在提取、净化和浓缩过程中导致提取目标物损失较多。综上所述,当进行批量实验同时不追求较低检出限和定量限时,采用QuEChERS提取法进行检测可以有效提高实验效率和加标回收率,节省操作时间。
2.5 实际样品检测
使用本研究建立的实验方法对51 份鸡胗和49 份鸡肝样品中的15 种喹诺酮类和四环素类抗生素残留进行检测,共检出18 份阳性样品,15 种抗生素的总检出率为21.38%,检出药物分别为恩诺沙星(3.48 μg/kg)、金霉素(11.4~40.9 μg/kg)、土霉素(10.8~154.0 μg/kg)、四环素(11.3~20.4 μg/kg)和强力霉素(12.3~46.9 μg/kg)。采用GB/T 21312——2007和GB/T 21317——2007中的检测方法分别对18 份阳性样品进行复检,发现检测结果与本研究方法一致,但是操作更便捷、耗时更短,说明本研究建立的方法准确性和实用性较好。
3 结 论
建立一种可以同时对鸡胗和鸡肝中15 种喹诺酮类和四环素类抗生素进行定性和定量分析的检测方法,使用QuEChERS法进行样品前处理,样液采用高效液相色谱-质谱联用法进行检测,操作简单、效率高、准确性好、成本低,能够为鸡胗和鸡肝及其相关食品的安全风险监测与监管工作提供技术支持。
[1] ZHANG Bo. Quinolone derivatives and their antifungal activities:an overview[J]. Archiv der Pharmazie, 2019, 352(5): e1800382.DOI:10.1002/ardp.201800382
[2] BAYLISS M A J, RIGDOVA K, KYRIAKIDES M, et al. Challenges in the bioanalysis of tetracyclines: epimerisation and chelation with metals[J]. Journal of Chromatography B, 2019, 1134/1135: 121807.DOI:10.1016/j.jchromb.2019.121807.
[3] 曹荥玉, 汤庆会, 余沛芝, 等. 超高效液相色谱-串联质谱法快速测定水中四环类抗生素[J]. 净水技术, 2019, 38(7): 23-26; 59.DOI:10.15890/j.cnki.jsjs.2019.07.004.
[4] DIBNER J J, RICHARDS J D. Antibiotic growth promoters in agriculture: history and mode of action[J]. Poultry Science, 2005,84(4): 634-643. DOI:10.1093/ps/84.4.634.
[5] NIEWOLD T A. The nonantibiotic anti-inflammatory effect of antimicrobial growth promoters, the real mode of action? A hypothesis[J]. Poultry Science, 2007, 86(4): 605-609. DOI:10.1093/ps/86.4.605.
[6] 孙言凤, 肖永华, 黄常刚, 等. 2016——2018年湖北省鸡肉和鸡蛋中四环素类药物残留监测分析[J]. 现代预防医学, 2019, 46(14): 2554-2557.
[7] 刘少颖, 黄希汇, 胡柯君, 等. 杭州市动物性食品中喹诺酮类抗生素残留水平及安全性评价[J]. 中国卫生检验杂志, 2018, 28(18): 2280-2285.
[8] 白云岗, 高志斌, 赵培贺, 等. 常见动物源性食品中兽药残留监测结果分析[J]. 食品研究与开发, 2019, 40(17): 183-186. DOI:10.12161/j.issn.1005-6521.2019.17.032.
[9] 郝海红, 程古月, 戴梦红, 等. 对动物饲料中禁用抗菌促生长剂的反思[J]. 中国农业科学, 2015, 48(3): 594-603. DOI:10.3864/j.issn.0578-1752.2015.03.18.
[10] 王彦斌. 抗生素在畜禽养殖业中的应用、潜在危害及去除[J]. 农业开发与装备, 2015(12): 38; 20. DOI:10.3969/j.issn.1673-9205.2015.12.033.
[11] OKEMAN L, CROUBELS S, CHERLET M, et al. Evaluation and establishing the performance of different screening tests for tetracycline residues in animal tissues[J]. Food Additives and Contaminants, 2004,21(2): 145-153. DOI:10.1080/02652030310001639567.
[12] 袁晓春. 多重胶体金免疫层析法检测乳品中β-内酰胺类、四环素类、头孢氨苄抗生素残留[J]. 饲料博览, 2019(7): 41-47.DOI:10.3969/j.issn.1001-0084.2019.07.012.
[13] 于颖, 徐桂花. 酶联免疫吸附法在肉制品中抗生素检测中的应用[J].肉类研究, 2009, 23(1): 48-51.
[14] 余佩瑶, 陈传胜, 刘寒冰, 等. 固相萃取-高效液相色谱法同时测定鸡粪中四环素类、喹诺酮类和磺胺类抗生素[J]. 色谱, 2019, 37(5):518-524. DOI:10.3724/SP.J.1123.2018.11006.
[15] 葛云芝, 于小波, 周光宏. 高效液相色谱法同时测定鸡肉中3 种四环素类抗生素残留[J]. 食品科学, 2013, 34(10): 180-183. DOI:10.7506/spkx1002-6630-201310039.
[16] 曹艳平, 辛成龙, 季萍. 同位素稀释气相色谱-三重四极杆质谱测定虾仁中氯霉素[J]. 分析科学学报, 2015, 31(4): 545-547.DOI:10.13526/j.issn.1006-6144.2015.04.023.
[17] 刘培勇, 张惠, 米之金, 等. 两步液液萃取-固相萃取净化结合高效液相色谱-串联质谱法测定猪肉中11 种磺胺类兽药残留[J]. 色谱,2019, 37(10): 1098-1104. DOI:10.3724/SP.J.1123.2019.04005.
[18] 张婧, 贡松松, 吴剑平, 等. 超高效液相色谱-四极杆-静电场轨道阱高分辨质谱快速筛查与确证猪尿中74 种抗生素及其他化合物[J]. 分析测试学报, 2019, 38(8): 905-912. DOI:10.3969/j.issn.1004-4957.2019.08.003.
[19] 黄坤, 吴婉琴, 罗彤, 等. QuEChERS-超高效液相色谱-串联质谱法同时测定畜禽肉中11 种喹诺酮类兽药残留[J]. 肉类研究, 2019,33(3): 40-45. DOI:10.7506/rlyj1001-8123-20190210-025.
[20] 梅英杰, 史新宇, 董瑾, 等. 超高效液相色谱-串联质谱法同时检测鸡肉中氯霉素、四环素、金霉素和土霉素[J]. 食品与发酵工业, 2017,43(8): 240-245. DOI:10.13995/j.cnki.11-1802/ts.011905.
[21] YAO Wei, ZHANG Zihao, SONG Shuangyu, et al. Multi-residue analysis of 34 pesticides in black pepper by QuEChERS with d-SPE vs. d-SLE cleanup[J]. Food Analytical Methods, 2019, 12(1): 176-189.DOI:10.1007/s12161-018-1350-7.
[22] CHEN Jian, WEI Zhen, CAO Xianying. QuEChERS pretreatment combined with ultra-performance liquid chromatography-tandem mass spectrometry for the determination of four veterinary drug residues in marine products[J]. Food Analytical Methods, 2019, 12(5): 1055-1066.DOI:10.1007/s12161-018-01431-1.
[23] 邓慧芬, 张建莹, 黄科, 等. QuEChERS-液相色谱-串联质谱法测定蔬菜中105 种农药残留[J]. 色谱, 2018, 36(12): 1211-1222.DOI:10.3724/SP.J.1123.2018.09012.
[24] 董李学, 张立田, 项爱丽, 等. QuEChERS-LC-MS/MS法测定牛奶中喹诺酮类药物[J]. 食品工业, 2019, 40(1): 314-317.
[25] 李伟明, 鲍艳宇, 周启星. 四环素类抗生素降解途径及其主要降解产物研究进展[J]. 应用生态学报, 2012, 23(8): 2300-2308.
[26] 中华人民共和国农业农村部. 动物性食品中兽药最高残留限量[EB/OL].(2002-12-24) [2020-01-15]. http://www.moa.gov.cn/gk/tzgg_1/gg/200302/t20030226_59300.htm.
[27] 中华人民共和国农业农村部. 中华人民共和国农业部公告第2292号[EB/OL]. (2015-09-01) [2020-01-15]. http://www.moa.gov.cn/govpublic/SYJ/201509/t20150907_4819267.htm.
[28] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 实验室质量控制规范 食品理化检测: GB/T 27404——2008[S].北京: 中国标准出版社, 2008.
[29] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 动物源性食品中14 种喹诺酮药物残留检测方法 液相色谱-质谱/质谱法: GB/T 21312——2007[S]. 北京: 中国标准出版社, 2007.
[30] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 动物源性食品中四环素类兽药残留量检测方法 液相色谱-质谱/质谱法与高效液相色谱法: GB/T 21317——2007[S]. 北京: 中国标准出版社, 2007.