致癌、致突变性杂环胺形成于家庭常用烹调温度下加热的肉类中,含量在ng/g水平。自1977年烤鱼及其烟气提取物中被发现含有致突变性物质,并在其后被命名为杂环胺以来[1],已在加工肉制品中分离鉴定出25 种以上杂环胺[2-3]。根据结构的不同,杂环胺可分为氨基咪唑氮杂芳烃和氨基咔啉类杂环胺,即IQ型杂环胺和非IQ型杂环胺。IQ型杂环胺中的2-氨基-1-甲基-6-苯基-咪唑并[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)含量较高,分布范围较广,能引发实验动物多种器官产生肿瘤[4-5],而且能通过胎盘转移到子代大鼠体内并提高其患乳腺癌的风险[6],因而受到世界各国研究者的普遍关注。氨基咔啉类杂环胺包括α-咔啉类、β-咔啉类(9H-吡啶并[3,4-b]吲哚(9H-pyrido[3,4-b]indole,norharman)、1-甲基-9H-吡啶并[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,harman))、γ-咔啉类和δ-咔啉类,其中β-咔啉类杂环胺是所有杂环胺中最为特殊的一类。由于Harman和Norharman缺乏环外氨基,在Ames实验中不能表现出致突变性,但能提高包括3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1)和3,4-苯并芘在内的其他化合物的致突变性[7],因此Harman和Norharman通常被称为“助突变物”。此外,Harman和Norharman还被报道与人类的帕金森病、颤动、成瘾、癌症等一系列疾病有关[8],因此其形成与危害不容忽视。
模型体系是研究杂环胺形成及其影响因素的有效工具。与肉的复杂体系相比,模型体系中许多副反应大大减少,同时感兴趣的反应被简化,例如2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉等杂环胺最初是在模型体系中合成,之后才在加工肉制品中分离出来[9]。PhIP、Harman和Norharman是杂环胺家族中最为常见、含量也较高的3 种,在各类肉制品的检测中均有报道[10-13],因此,本研究用模型体系进一步探讨其形成规律,旨在为我国肉制品消费的安全性提供依据。
1 材料与方法
1.1 材料与试剂
PhIP、Norharman、Harman标准品 加拿大Toronto Research Chemicals公司;L-色氨酸、L-苯丙氨酸、肌酸酐(均为生化试剂) 上海楷洋生物技术有限公司;高良姜素(3,5,7-三羟基黄酮)、槲皮素(3,3',4',5,7-五羟基黄酮)、山柰酚(3,4',5,7-四羟基黄酮)(均为色谱纯) 美国Sigma公司;二甘醇(二乙二醇)(色谱纯) 上海阿拉丁试剂有限公司;甲醇(色谱纯)美国Tedia公司;乙腈(色谱纯) 美国ROE公司;无水乙醇(色谱纯) 西陇科学股份有限公司。
1.2 仪器与设备
12通道固相萃取装置 德国CNW公司;e2695高效液相色谱(high performance liquid chromatography,HPLC)仪、2998二极管阵列检测器、2475荧光检测器 美国Waters公司;TSK gel ODS-80TM色谱柱(25 cm×4.6 mm,5 μm,80 Å) 日本Tokyo公司;Delta 320A pH计、AL104电子天平 瑞士Mettler-Toledo公司;DGG-9240电热干燥箱 上海森信仪器厂。
1.3 方法
1.3.1 模型体系的构建
PhIP模型:在25 mL小烧杯中加入66 mg苯丙氨酸、45 mg肌酸酐、36 mg葡萄糖和4 mL体积分数80%的二甘醇,搅拌均匀;Norharman模型Ⅰ及Harman模型Ⅰ:在25 mL小烧杯中加入82 mg L-色氨酸和4 mL体积分数80%的二甘醇,搅拌均匀;Norharman模型Ⅱ及Harman模型Ⅱ:在25 mL小烧杯中加入82 mg L-色氨酸、36 mg葡萄糖和4 mL体积分数80%的二甘醇,搅拌均匀。
1.3.1.1 加热温度对3 种杂环胺形成的影响
分别在100、125、150、175、200 ℃温度下加热20 min。每个温度下均待电热干燥箱升温到相应温度并稳定5 min后再放入烧杯并开始计时,20 min后立即将小烧杯置于碎冰中以终止反应。
1.3.1.2 加热时间对3 种杂环胺形成的影响
保持电热干燥箱温度为(150±2) ℃,分别加热10、20、30、40、50、60、90、120 min,加热相应时间后立即将小烧杯置于碎冰中以终止反应。
1.3.1.3 高良姜素及其类似物对3 种杂环胺形成的影响
分别称取高良姜素、山柰酚和槲皮素各135、143、151 mg,加入PhIP模型、Norharman模型Ⅰ及Harman模型Ⅰ中,于150 ℃条件下加热1 h,反应结束后立即将小烧杯置于碎冰中以终止反应,同时以上述不加高良姜素、山柰酚和槲皮素在相同条件下反应的模型作为对照。
1.3.2 杂环胺含量测定
参照Yao Yao等[14]的方法,取0.1 mL反应液,用甲醇稀释20 倍后经HPLC测定。同时检测色氨酸、Norharman和Harman的色谱条件为:TSK gel ODS-80TM色谱柱(25 cm×4.6 mm,5 μm,80 Å),柱温30 ℃,紫外检测器波长280 nm,流速1 mL/min,流动相及梯度洗脱程序如表1所示。
表 1 杂环胺测定流动相及梯度洗脱程序
Table 1 Mobile phase gradient program for detection of HAs

时间/min 流动相A(乙腈)体积分数/%流动相B(0.05 mol/L醋酸铵-醋酸缓冲液,pH 3.2)体积分数/%0 15 85 6 45 55 10 15 85
1.3.3 反应后体系吸光度测定
参照Wu Mingchang等[15]的方法,取0.1 mL反应液,用甲醇稀释40 倍后用分光光度法测定其在420 nm波长处的吸光度(A420 nm)。
1.4 数据处理
以上所有处理均分别称取2 份样品,进行重复测定(n=2)。所得数据采用SAS 9.0统计软件进行方差分析,用Duncan's多重比较法进行差异显著性分析,用Origin 9.0软件作图。
2 结果与分析
2.1 加热温度对PhIP、Norharman和Harman形成的影响
由图1可知,随着加热温度的升高,反应后PhIP模型体系的颜色逐渐加深,加热温度100、125、150、175、200 ℃条件下,经40 倍稀释后模型体系A420 nm分别为0.002、0.005、0.153、0.423、0.676;Norharman、Harman模型体系的颜色也逐渐加深,A420 nm均随加热温度的升高逐渐增大,表明加热温度对3 种杂环胺的形成有明显影响。
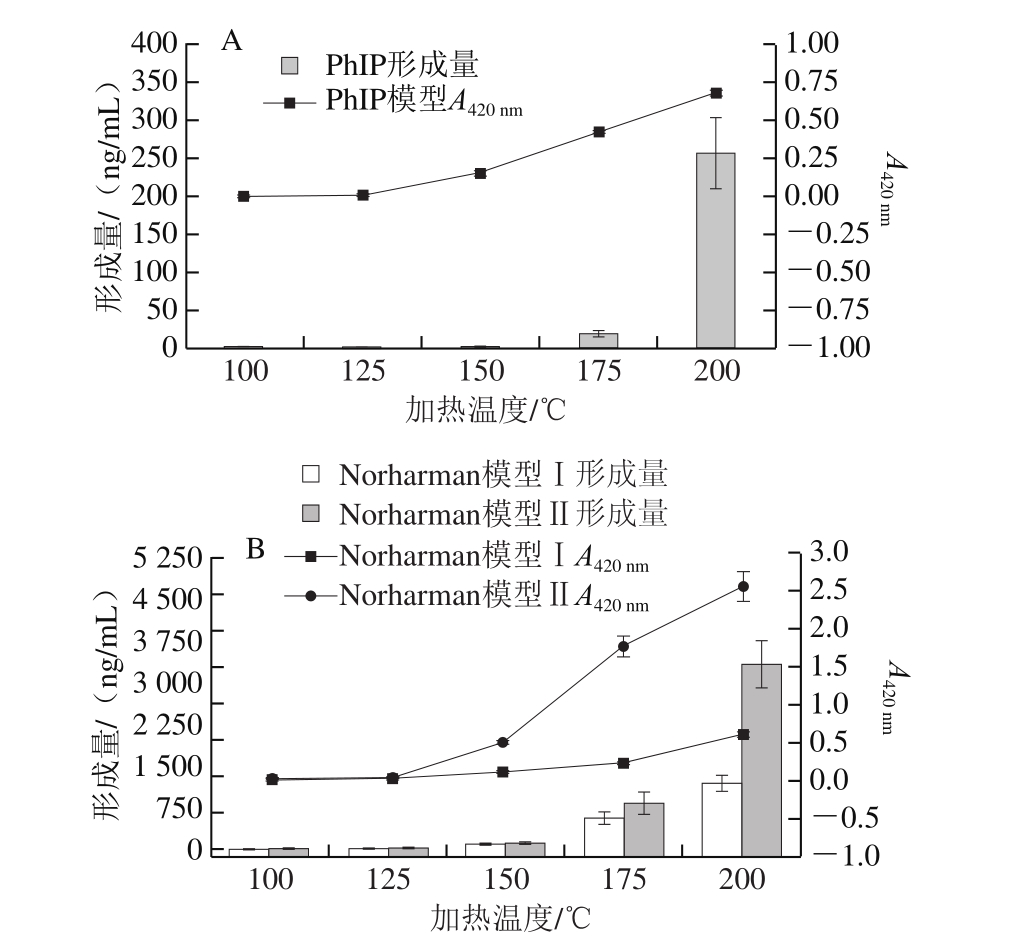
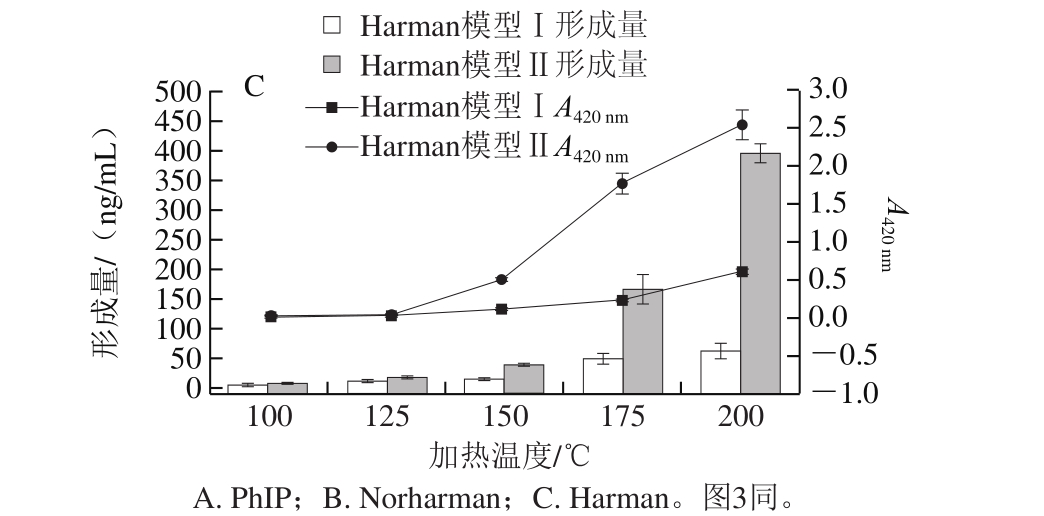
图 1 不同温度条件下加热20 min后3 种杂环胺形成量及模型体系吸光度
Fig. 1 Comparison of the amount of three HAs formed and the absorbance of model system after heating for 20 min at different temperatures
由图1A可知,在加热20 min条件下,100、125 ℃反应不能形成PhIP;150 ℃反应仅能形成微量的PhIP;175 ℃反应条件下PhIP的形成量有所上升,为18.23 ng/mL;而当加热温度上升到200 ℃时,PhIP的形成急速加剧,形成量急剧增加到255.59 ng/mL。在不同温度条件下加热20 min,PhIP形成量对比如图2A所示,Norharman模型Ⅰ、Harman模型Ⅰ中二者的形成量对比如图2B所示。Oguri[16]、Cheng[17]等研究表明,苯丙氨酸、肌酸、肌酸酐和葡萄糖的四元模型体系在128 ℃加热2 h、125 ℃加热2.5 h条件下PhIP形成量分别为3.34、28.30 nmol/mmol苯丙氨酸此本研究结果与此具有一定的可比性。
由图1B、C可知,直接加热色氨酸即能产生β-咔啉,反应后Norharman模型Ⅰ和Harman模型Ⅰ的颜色变化较PhIP模型更为缓和,随加热温度的升高,Norharman和Harman形成量的增多也较PhIP更为平稳。Norharman和Harman在100 ℃加热20 min条件下就能产生,形成量分别为3.11、4.91 ng/mL,加热温度125、150、175、200 ℃条件下分别增长至原来的8.0、30.4、182.4、383.4 倍及2.3、3.0、10.0、12.4 倍。就Norharman和Harman形成量而言,前者的形成量显著高于后者,在加热温度100~200 ℃条件下,Norharman的形成量分别为Harman的0.6、2.2、6.5、11.6、19.5 倍。近年来,关于表没食子儿茶素没食子酸酯[18]、柚皮素[19]及VB6[20]对PhIP形成抑制的研究进一步证实苯乙醛是PhIP形成的中间体。因此,色氨酸在加热时很有可能通过形成相关的吲哚醛类衍生物中间体而进一步形成Harman和Norharman。
在色氨酸中加入其物质的量一半的葡萄糖,Norharman和Harman的形成量均高于直接加热色氨酸处理组,表明葡萄糖可能起催化作用,或葡萄糖在加热过程中产生的物质也参与β-咔啉的形成。在加热温度100~200 ℃条件下,Norharman模型Ⅱ中Norharman的形成量分别为9.33、30.94、111.29、829.11、3 326.18 ng/mL,分别是Norharman模型Ⅰ中Norharman形成量的3.0、1.3、1.2、1.5、2.8 倍;Harman模型Ⅱ中Harman的形成量为7.14、17.08、38.48、166.19、394.49 ng/mL,分别是Harman模型Ⅰ中Harman形成量的1.45、1.53、2.62、3.40、6.44 倍。
各模型中杂环胺的形成量与其对应的吸光度相关性良好,PhIP模型、Norharman模型Ⅰ、Harman模型Ⅰ、Norharman模型Ⅱ、Harman模型Ⅱ相关系数分别为0.85、0.99、0.92、0.90、0.89,均在0.8以上。

图 2 不同温度条件下加热20 min后PhIP(A)及Norharman模型Ⅰ、H
arman模型Ⅰ(B)的HPLC图
Fig. 2 Chromatograms of PhIP model (A) and norharman and harman model Ⅰ (B) heated for 20 min at different temperature
2.2 加热时间对PhIP、Norharman和Harman形成的影响
由于PhIP、Norharman和Harman 3 种杂环胺在150 ℃加热条件下能够形成且从150 ℃开始形成速率加快,因此研究150 ℃加热条件下不同加热时间对3 种杂环胺形成的影响。

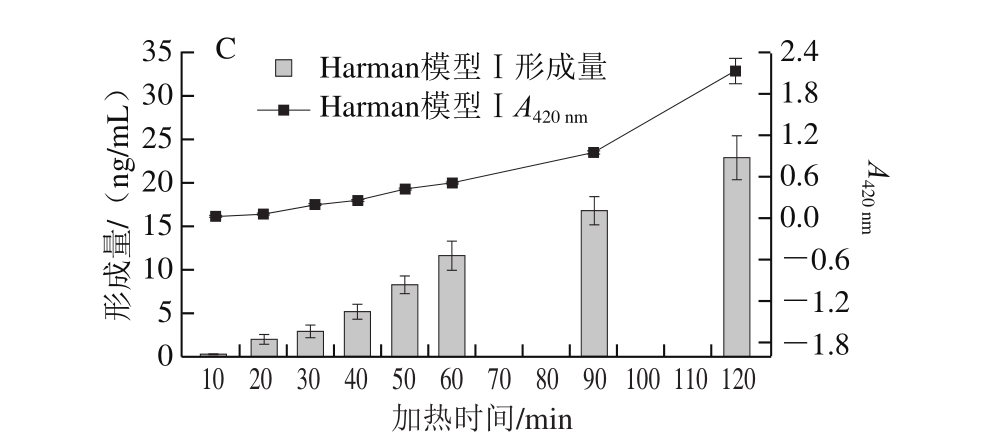
图 3 150 ℃条件下加热不同时间后3 种杂环胺形成量及模型体系吸光度
Fig. 3 Comparison of the amount of three HAs formed and the absorbance of model system after heating for different times at 150 ℃
由图3可知,150 ℃加热30 min时开始检测到PhIP,加热30、40、50、60、90、120 min后其形成量分别为2.88、10.55、43.93、46.42、158.95、275.37 ng/mL。Norharman和Harman在150 ℃加热10 min的条件下即能微量产生,形成量分别为0.90、0.25 ng/mL;随着加热时间的延长,Norharman和Harman的形成量均不断增加,加热120 min后形成量分别达582.25、22.89 ng/mL。PhIP模型、Norharman模型Ⅰ、Harman模型Ⅰ中杂环胺的形成量与其对应的吸光度相关性良好,相关系数分别为0.93、0.96、0.94。与Norharman模型Ⅰ、Harman模型Ⅰ相比,Norharman模型Ⅱ、Harman模型Ⅱ只多加了葡萄糖,Norharman和Harman形成随加热时间的变化趋势相似,因此只采用Norharman模型Ⅰ、Harman模型Ⅰ对加热时间的影响进行研究。
本研究结果表明,加热温度和加热时间对杂环胺的形成具有显著影响,加热温度越高、加热时间越长,形成的杂环胺也就越多,这与前人[21-23]研究结果相一致。Solyakov等[21]报道,锅煎鸡胸肉在140 ℃条件下加工14 min仅能产生微量的PhIP(<0.1 ng/g),170 ℃条件下加工16 min产生的PhIP量也很少,只有0.7 ng/g,而加热温度上升到190 ℃时,加工18 min的PhIP形成量迅速上升到29.7 ng/g,220 ℃条件下PhIP的形成更为迅速,仅锅煎14 min其含量即能达到38.2 ng/g。Iwsaki等[22]报道,烤牛排至三成熟或五成熟时检测不出杂环胺,当烤至全熟时PhIP含量为0.70 ng/g,而当烤至过熟时,PhIP含量迅速增长到16.27 ng/g。由此可见,降低加工温度,特别是控制加工温度在175 ℃之下能有效减少PhIP的形成。
2.3 同时检测色氨酸、Norharman和Harman的色谱条件探索及实际样品检测
早在1982年,Sugimura等[24]就提出,色氨酸是Harman和Norharman形成的前体物质。为更加明了地反映色氨酸热解与Norharman、Harman形成的关系,本研究在前期研究[14]基础上试图建立一种同时检测色氨酸、Norharman和Harman 3 种物质的方法。由于杂环胺标样溶于甲醇中,因此本研究首先把色氨酸也溶解在甲醇中,并与Norharman和Harman混合,配制成3 种物质的混合标样(质量浓度均为5.00 μg/mL),然后考察其在测定杂环胺的乙腈及pH 3.2、0.05 mol/L醋酸铵-醋酸缓冲液二元流动相体系中是否能分离并检测。结果表明,3 种物质均有一定的紫外吸收且分离度良好。为优化检测条件,提高3 种物质对紫外吸收的响应强度,用二极管阵列检测器在210~400 nm对3 种物质进行全波长扫描。理论上色氨酸在波长220、280 nm左右有最大吸收,而Norharman和Harman分别在225、250、300 nm有最大吸收。色氨酸、Norharman和Harman的全波长扫描结果如图4所示。
图 4 色氨酸、Norharman和Harman的全波长紫外吸收扫描图
Fig. 4 Full-wavelength UV absorption spectra of tryptophan,norharman and harman
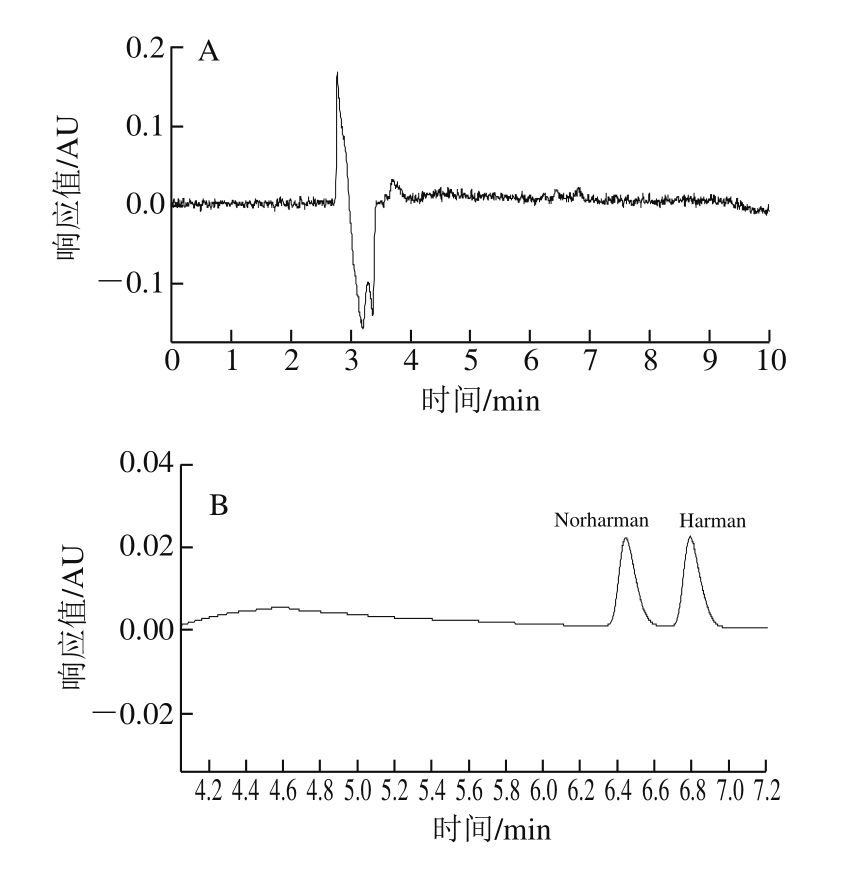

图 5 色氨酸、Norharman和Harman混合标样在不同紫外检测波长下的峰形对比
Fig. 5 Comparative peak shape of mixture of tryptophan, norharman and harman standards at different UV wavelengths
由图5可知:在220 nm波长条件下,色氨酸、Norharman和Harman的响应强度均不高;在250 nm或300 nm波长条件下(峰形相似),Norharman和Harman均有最大吸收但色氨酸无吸收;在280 nm波长条件下,Norharman和Harman的响应强度虽略低于250 nm及300 nm,但3 种物质均有较高的吸收且峰型良好,因此确定同时检测3 种物质的波长为280 nm。
将5.00 μg/mL色氨酸、Norharman和Harman三元混合标样梯度稀释至2.00、1.00、0.50、0.20、0.05 μg/mL,以各组分的质量浓度为横坐标、峰面积为纵坐标绘制标准曲线。结果表明,3 种物质在0.05~5.00 μg/mL质量浓度范围内线性良好,相关系数均大于0.99。
2 μg/mL色氨酸、Norharman和Harman混合标样的色图谱如图6所示。
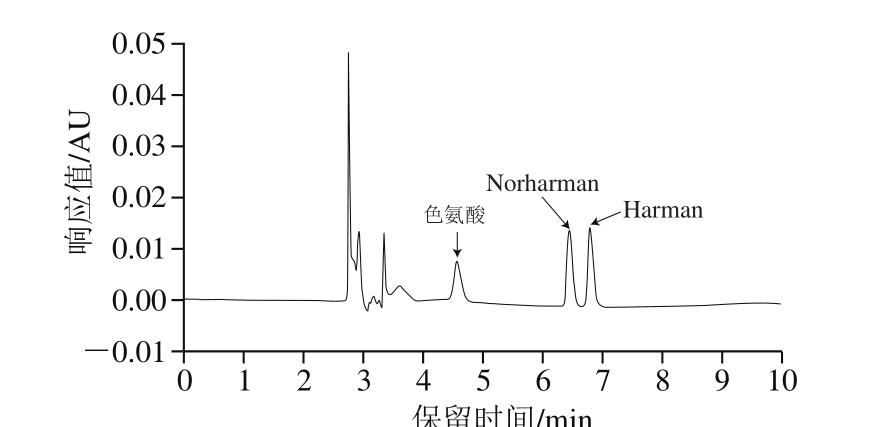
图 6 2 μg/mL色氨酸、Norharman和Harman混合标样HPLC图
Fig. 6 Chromatograms of standard mixture of tryptophan, norharman and harman at concentration of 2 μg/mL
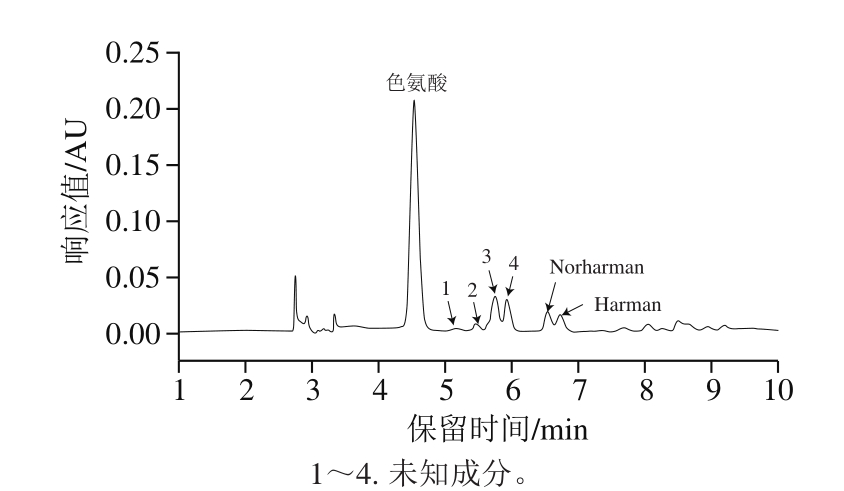
图 7 2 μg/mL色氨酸在200 ℃条件下加热20 min的HPLC图
Fig. 7 Chromatograms of tryptophan (2 μg/mL) heated at 200 ℃ for 20 min
由图7可知,在200 ℃条件下直接单独加热色氨酸20 min后,体系组成成分中大部分色氨酸并未发生热解,只有一小部分形成了Norharman和Harman,还有4 种未知成分,很有可能是色氨酸热解形成Norharman和Harman过程中的中间体。
2.4 高良姜素及其类似物对PhIP、Norharman和Harman形成的影响
良姜为姜科植物高良姜(Alpinia officinarum Hance)的干燥根茎,具有温胃散寒、消食止痛等功效[25]。良姜在我国常作为香辛料用于各类肉制品的加工,其主要生理活性物质为二苯基庚烷类、挥发油类、黄酮类、糖苷类和苯丙素类等[26-28]。其中,黄酮类化合物具有广泛的抗氧化活性,而本实验室前期研究已表明,良姜能显著降低Harman和Norharman含量(P<0.05),在显著抑制2-氨基-3,7,8-三甲基咪唑并[4,5-f]喹喔啉形成的同时不会产生新的杂环胺,抑制效果较好[29],因此选取高良姜素及其类似物槲皮素和山柰酚进一步探讨其对PhIP、Harman和Norharman形成的影响。
表 2 高良姜素及其类似物对PhIP、Norharman和Harman形成的影响
Table 2 Influence of three flavonols on the formation of PhIP,norharman and harman
n
g/mL

注:同列小写字母不同,表示差异显著(P<0.05)。
组别 PhIP形成量 Norharman形成量 Harman形成量对照 46.43±9.43a 145.33±14.23ab 11.59±1.70ab高良姜素 41.45±4.73ab 121.09±9.33b 8.20±1.86b山柰酚 38.57±6.65ab 170.82±4.80a 14.74±2.47a槲皮素 25.05±3.27b 169.70±8.39a 13.75±1.43a
由表2可知,高良姜素和山柰酚能降低PhIP的形成量,但与对照组相比差异不显著,而槲皮素能有效抑制PhIP的形成,抑制率达46.1%。高良姜素能减少Norharman和Harman的形成量,而山柰酚和槲皮素能增加其形成量,但与对照组差异均不显著。李彩君[30]、李智勇[31]等报道,良姜中高良姜素的含量在10 mg/g左右,槲皮素和山柰酚的含量较低,为0.5 mg/g左右。因此,良姜对杂环胺形成的影响是上述促进与抑制因素共同作用的结果。综合以上分析,良姜在杂环胺的减控方面是一种较好的香辛料。
3 结 论
随着加热温度的升高与加热时间的延长,模型体系中PhIP、Norharman和Harman的形成量均不断增多,其中PhIP对加热温度较为敏感,100、125 ℃反应20 min不能形成PhIP,150 ℃加热时形成量开始逐渐增多,175~200 ℃加热时形成量急剧增加。本研究探索出一种同时检测色氨酸、Norharman和Harman的方法,证实色氨酸是Norharman和Harman的前体物。单独加热色氨酸即能产生Norharman和Harman,但加入葡萄糖时Norharman和Harman的形成量有所提高。高良姜素及其类似物均能在一定程度上减少PhIP的形成,但只有高良姜素能降低Harman和Norharman的形成量,而山柰酚和槲皮素不但没有抑制作用反而在一定程度上提高了Harman和Norharman的形成量,进一步证实β-咔啉类杂环胺形成的复杂性。
[1] NAGAO M, HONDA M, SEINO Y, et al. Mutagenicities of smoke condensates and the charred surface of fish and meat[J]. Cancer Letters, 1977, 2(4/5): 221-226. DOI:10.1016/S0304-3835(77)80025-6.
[2] SANZ ALAEJOS M, AYALA J H, GONZÁLEZ V, et al. Analytical methods applied to the determination of heterocyclic aromatic amines in foods[J]. Journal of Chromatography B, 2008, 862(1/2): 15-42.DOI:10.1016/j.jchromb.2007.11.040.
[3] BARZEGAR F, KAMANKESH M, MOHAMMADI A, et al.Heterocyclic aromatic amines in cooked food: a review on formation,health risk-toxicology and their analytical techniques[J]. Food Chemistry, 2019, 280: 240-254. DOI:10.1016/j.foodchem.2018.12.058.
[4] SKOG K I, JOHANSSON M A E, JÄGERSTAD M I. Carcinogenic heterocyclic amines in model systems and cooked foods: a review on formation, occurrence and intake[J]. Food and Chemical Toxicology,1998, 36(9/10): 879-896. DOI:10.1016/S0278-6915(98)00061-1.
[5] SUGIMURA T, WAKABAYASHI K, NAKAGAMA H, et al.Heterocyclic amines: mutagens/carcinogens produced during cooking of meat and fish[J]. Cancer Science, 2004, 95(4): 290-299.DOI:10.1111/j.1349-7006.2004.tb03205.x.
[6] ITO N, HASEGAWA R, IMAIDE K, et al. Carcinogenicity of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) in the rat[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1997, 376(1/2): 107-114. DOI:10.1016/S0027-5107(97)00032-8.
[7] NAGAO M, YAHAGI T, SUGIMURA T. Differences in effects of norharman with various classes of chemical mutagens and amounts of S-9[J]. Biochemical and Biophysical Research Communications, 1978,83(2): 373-378. DOI:10.1016/0006-291X(78)91000-8.
[8] PFAU W, SKOG K. Exposure to β-carbolines norharman and harman[J]. Journal of Chromatography B, 2004, 802(1): 115-126.DOI:10.1016/j.jchromb.2003.10.044.
[9] NEGISHI C, WAKABAYASHI K, YAMAIZUMI Z, et al.Identification of 4,8-DiMeIQx, a new mutagen[J]. Mutation Research,1985, 147: 267-268. DOI:10.1016/0165-1161(85)90099-8.
[10] REARTES G, DI PAOLA NARANJO R, EYNARD A, et al.Cooking methods and the formation of PhIP (2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine) in the crust of the habitually consumed meat in Argentina[J]. Food and Chemical Toxicology, 2016, 92: 88-93.DOI:10.1016/j.fct.2016.03.026.
[11] ZHANG Lang, DU Hongzhen, ZHANG Pin, et al. Heterocyclic aromatic amine concentrations and quality characteristics of traditional smoked and roasted poultry products on the northern Chinese market[J]. Food and Chemical Toxicology, 2020, 135: 110931.DOI:10.1016/j.fct.2019.110931.
[12] YU Di, YU Shujuan. Effects of some cations on the formation of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) in a model system[J]. Food Chemistry, 2016, 201: 46-51. DOI:10.1016/j.foodchem.2016.01.066.
[13] ZENG Maomao, WANG Junhui, ZHANG Mengru, et al. Inhibitory effects of Sichuan pepper (Zanthoxylum bungeanum) and sanshoamide extract on heterocyclic amine formation in grilled ground beef patties[J]. Food Chemistry, 2018, 239: 111-118. DOI:10.1016/j.foodchem.2017.06.097.
[14] YAO Yao, PENG Zengqi, WAN Kehui, et al. Determination of heterocyclic amines in braised sauce beef[J]. Food Chemistry, 2013,141(3): 1847-1853. DOI:10.1016/j.foodchem.2013.05.010.
[15] WU Mingchang, MA Chiayu, YANG Chiching, et al. The formation of IQ type mutagens from Maillard reaction in ethanolic solution[J]. Food Chemistry, 2011, 125(2): 582-587. DOI:10.1016/j.foodchem.2010.08.067.
[16] OGURI A, SUDA M, TOTSUKA Y, et al. Inhibitory effects of antioxidants on formation of heterocyclic amines[J]. Mutation Research, 1998, 402(1/2): 237-245. DOI:10.1016/s0027-5107(97)00303-5.
[17] CHENG K W, CHEN Feng, WANG Mingfu. Inhibitory activities of dietary phenolic compounds on heterocyclic amine formation in both chemical model system and beef patties[J]. Molecular Nutrition and Food Research, 2007, 51(8): 969-976. DOI:10.1002/mnfr.200700032.
[18] CHENG K W, WONG C C, CHAO J F, et al. Inhibition of mutagenic PhIP formation by epigallocatechin gallate via scavenging of phenylacetaldehyde[J]. Molecular Nutrition and Food Research, 2009,53(6): 716-725. DOI:10.1002/mnfr.200800206.
[19] CHENG K W, WONG C C, CHO C K, et al. Trapping of phenylacetaldehyde as a key mechanism responsible for naringenin's inhibitory activity in mutagenic 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine formation[J]. Chemical Research in Toxicology, 2008, 21(10): 2026-2034. DOI:10.1021/tx800220h.
[20] WONG D, CHENG K W, WANG M F. Inhibition of heterocyclic amine formation by water-soluble vitamins in Maillard reaction model systems and beef patties[J]. Food Chemistry, 2012, 133(3): 760-766.DOI:10.1016/j.foodchem.2012.01.089.
[21] SOLYAKOV A, SKOG K. Screening for heterocyclic amines in chicken cooked in various ways[J]. Food and Chemical Toxicology,2002, 40(8): 1205-1211. DOI:10.1016/S0278-6915(02)00054-6.
[22] IWASAKI M, KATAOKA H, ISHIHARA J, et al. Heterocyclic amines content of meat and fish cooked by Brazilian methods[J]. Journal of Food Composition and Analysis, 2010, 23(1): 61-69. DOI:10.1016/j.jfca.2009.07.004.
[23] KHAN I A, LIU D M, YAO M J, et al. Inhibitory effect of Chrysanthemum morifolium flower extract on the formation of heterocyclic amines in goat meat patties cooked by various cooking methods and temperatures[J]. Meat Science, 2019, 147: 70-81.DOI:10.1016/j.meatsci.2018.08.028.
[24] SUGIMURA T, NAGAO M, WAKABAYASHI K. Metabolic aspects of the comutagenic aspects of comutagenic action of norharman[J].Advances in Experimental Medicine and Biology, 1982, 136b: 1011-1025. DOI:10.1007/BF00834390.
[25] 中华人民共和国卫生部药典委员会. 中华人民共和国药典[M].北京: 化学工业出版社, 2005: 202.
[26] 周改莲, 辛宁黄, 陆良. 高良姜的化学成分研究[J]. 时珍国医国药,2008(6): 1376-1378.
[27] 安宁, 杨世林, 邹忠梅, 等. 高良姜黄酮类化学成分的研究[J]. 中草药, 2006(5): 663-664. DOI:10.3321/j.issn:0253-2670.2006.05.007.
[28] 袁媛, 周伟, 付云飞, 等. 气相色谱-质谱联用法结合保留指数对高良姜挥发油成分的分析[J]. 分析测试学报, 2016(6): 692-697.DOI:10.3969/j.issn.1004-4957.2016.06.010.
[29] 姚瑶, 彭增起, 邵斌, 等. 20 种市售常见香辛料的抗氧化性对酱牛肉中杂环胺含量的影响[J]. 中国农业科学, 2012, 45(20): 4252-4259.DOI:10.3864/j.issn.0578-1752.2012.20.015.
[30] 李彩君, 黄劲梅, 谢培山, 等. HPLC法测定高良姜中高良姜素的含量[J]. 中药新药与临床药理, 2002(1): 41-42. DOI:10.3321/j.issn:1003-9783.2002.01.017.
[31] 李智勇, 孙冬梅, 张建军. HPLC法测定高良姜中高良姜素和山柰素的含量[J]. 中华中医药杂志, 2010(9): 1368-1370.