狮子头是我国淮扬菜系中的一道传统名菜,由肥肉和瘦肉拌以鸡蛋、荸荠或莲藕、葱、姜等配料斩成肉糜,制作成拳头大小的肉丸,经炸制或煮制而成[1-2]。狮子头蛋白质、脂肪含量丰富、口感软嫩,深受消费者喜爱。然而,国内外学者对狮子头的研究大多停留在工艺开发、保鲜贮藏阶段,狮子头贮藏品质劣变机理及工业化生产适应性等方面的研究却鲜有报道。唐建华等[3]采用正交试验法确定清炖狮子头的最佳工艺,结果表明,加热时间对狮子头的口感影响较明显。鲍会梅等[4]通过感官评价法研究狮子头制作过程中肥瘦肉比和炖制时间对其品质的影响。周晓燕等[5]探究狮子头制作过程中的原料配比和加热时间,并通过质构测定明确狮子头口感与工艺参数之间的关系。Turgut等[6]将石榴皮提取物添加到牛肉丸中,研究其在牛肉丸冻藏期间的抗氧化活性,结果表明,石榴皮提取物能有效抑制脂肪和蛋白质氧化。Akcan等[7]对含有月桂和鼠尾草提取物的乳清蛋白可食用膜对熟肉丸的抗氧化保护作用进行研究,结果表明,涂抹该可食用膜可延缓熟肉丸冻藏过程中的氧化。上述关于狮子头加工工艺及配方的研究对明确狮子头的主要工艺标准十分必要,但要实现狮子头等中华传统炖煮类肉制品的标准化和工业化,对其贮藏期间的品质变化规律进行研究也显得尤为重要。
传统狮子头的熟制或经油炸或经高温炖煮,致使成品中具有较重过熟味。低温熟制可以较好地保留其营养价值和风味,然而较低的加热温度使原料肉以及加工过程中污染的微生物难以彻底被杀灭,造成产品在贮藏、销售过程中发生微生物引起的腐败变质[8]。目前,肉制品中微生物及群落多样性的研究大多为基于传统培养的菌株鉴定法和免培养的分子生物学技术方法。基于传统培养的菌株鉴定法易操作、成本低,但也存在一些突出的缺点,如耗时长、菌种易污染、灵敏度低,并且对于不可培养的微生物无法鉴定[9]。而分子生物学技术的出现则弥补了传统菌株鉴定法的缺点[10]。随着分子生物学技术的进一步发展,高通量测序技术因其通量大、灵敏度高和成本低的优点广泛应用于各个领域[11]。高通量测序技术可对数百万个DNA分子同时测序,根据16S rRNA基因序列分析特定环境中微生物群体的构成情况或基因的组成以及功能特性[12-13]。Solieri等[14]采用高通量测序对意大利传统香醋中的酵母菌群进行分析测定,获得香醋中全部酵母菌信息。Aldrete-Tapia等[15]采用高通量测序技术对墨西哥手工制造干酪中的细菌菌群多样性和群落结构进行分析,研究干酪制作中细菌群体的变化情况,发现嗜热链球菌和德氏乳杆菌是其中的优势菌群。Zhang Qiuqin等[16]采用高通量测序法对含有玫瑰多酚的自然发酵干香肠中的微生物进行研究,结果表明,玫瑰多酚可选择性地改变乳酸菌的丰度和生长速率。上述研究结果表明,高通量测序技术可用于测定香醋、干酪和香肠等食品中微生物菌落结构及其动态变化,且对于寻找优势微生物种群具有积极作用。
本研究采用低温熟制方法煮制狮子头,研究其在冷藏过程中的感官品质、质构、蛋白质和脂肪氧化降解情况,并采用Illumina Miseq PE300平台的高通量测序法对4 ℃条件下冷藏的狮子头中微生物的多样性和菌群变化规律进行分析,对于探究狮子头冷藏期间品质劣变机理、推进低温肉制品产业的发展具有重要意义。
1 材料与方法
1.1 材料与试剂
猪后臀尖和背膘 北京顺鑫农业鹏程食品分公司。
细菌基因组DNA快速提取试剂盒、Taq PCR Master Mix、琼脂糖 北京博迈德生物技术有限公司;AxyPrep DNA凝胶回收试剂盒 美国Axygen公司;FastPfu DNA Polymerase 北京TransGen公司;2%琼脂糖凝胶西班牙Biowest公司;其他测试分析用试剂均为国产分析纯。
1.2 仪器与设备
SW-CI-IF超净工作台 苏净集团安泰公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;GeneAmp® 9700 PCR仪 美国ABI公司;QuantiFluorTM-ST蓝色荧光定量系统 美国Promega公司;5424R冷冻离心机 德国艾本德股份公司;DZQ400-2D真空包装机上海鼎利轻工机械制造有限公司;YP-2002电子分析天平常州市衡正电子仪器有限公司。
1.3 方法
1.3.1 狮子头的制作
将肥瘦肉分开,分别斩成肉粒(5 mm×5 mm×5 mm),按肥瘦肉质量比4∶6分别放入容器中。按肉总质量计,先后将配料食盐1.6%、淀粉2.5%、荸荠15%、蛋液约10%、酱油2%、料酒2%、白砂糖1%、葱姜各1%以及冷水10%加入其中,搅拌均匀。取50 g肉馅,将其搓圆后放入85 ℃热水中加热,至中心温度达到80 ℃后取出,冷却至室温后真空包装。之后85 ℃水浴30 min进行二次杀菌,冷却后置于4 ℃冰箱中贮藏。分别于贮藏0、14、28、35、42、49 d取样进行测定。
1.3.2 狮子头感官评价
表 1 狮子头感官评价表
Table 1 Criteria for sensory evaluation of Shizitou

感官评分 色泽 外观 气味 组织状态21~25 色泽正常,富有光泽 状态,无异物,无霉点 固有香味浓郁 切面紧实,按压后无凹陷16~20 色泽正常,有光泽具有产品应有的外观无明显异物,无霉点 固有香味较浓郁 切面较紧实,按压后无明显凹陷11~15 色泽较暗淡,稍有光泽外观状态较好,切面略松散,按压后轻微凹陷6~10 色泽较暗淡,外观状态一般,偶有较小霉点固有香味清淡,略有异味切面较松散,按压后凹陷,且发黏0~5 色泽暗淡,无光泽 外观状态较差,有霉斑 固有香味消失,有腥臭味或氨臭味无光泽 外观差,发霉严重 有强烈的腥臭味或氨臭味 无切面,按压后软烂
由8 位经过培训的感官评价人员组成感官评价小组,从狮子头的色泽、外观、气味和组织状态4 个方面进行评价,感官评分标准见表1。每项分值均为25 分,总分为100 分。
1.3.3 质构测定
将狮子头样品切成1 cm×1 cm×1 cm的立方块,对样品的硬度、内聚性、弹性和咀嚼性进行测定。质构仪探头:P/45;测试前速率3 mm/s,测试速率1 mm/s,测试后速率5 mm/s;循环次数:2 次;触发类型:自动;触发点负载5.0 g;压缩样品高度30%。
1.3.4 硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARs)值测定
参照白艳红[17]的方法测定。称取10.0 g绞碎的狮子头样品,加入50 mL 7.5 g/100 mL三氯乙酸溶液(含0.1 g/100 mL乙二胺四乙酸二钠),匀浆2 min;吸取5 mL匀浆液与5 mL 0.02 mol/L硫代巴比妥酸溶液混合均匀,将混合液于沸水浴加热40 min;待混合液冷却至室温后3 000 r/min离心5 min,取5 mL上清液与5 mL氯仿混匀,静置10 min后取上清液分别于532、600 nm波长处测定吸光度。TBARs值以每千克肉中丙二醛的含量表示,按下式计算。
1.3.5 羰基含量测定
参考Armenteros等[18]的方法,并略做修改。称取1 g狮子头肉糜样品,加入10 mL pH 7.4焦磷酸缓冲液(含2.0 mmol/L焦磷酸钠、10 mmol/L Tris-马来酸盐、100 mmol/L氯化钾、2.0 mmol/L氯化镁和2.0 mmol/L乙二醇二乙醚二胺四乙酸),4 000 r/min匀浆60 s;取2 份0.1 mL匀浆液分别置于2 mL离心管中,加入1 mL 10 g/100 mL三氯乙酸溶液,旋涡振荡30 s后10 000 r/min离心5 min;弃上清,1 组加入1 mL 2 mol/L盐酸溶液,用于蛋白质浓度测定,另1 组加入1 mL 0.2 g/100 mL二硝基苯肼溶液(溶于2 mol/L盐酸),用于蛋白质羰基含量测定;混匀后将2 组混合液于20 ℃水浴振荡1 h,之后加入1 mL 10%三氯乙酸溶液,混匀后10 000 r/min条件下离心5 min;弃去上清液,加入2 mL乙醇-乙酸乙酯混合液(1∶1,V/V),8 000 r/min离心5 min,该步骤重复2 次;弃去上清液,加入1.5 mL 20 mmol/L磷酸盐缓冲液(pH 6.5,含6 mol/L盐酸胍),振荡混匀;8 000 r/min离心2 min,除去不溶性成分后分别在280 nm和370 nm波长处测定,计算蛋白质浓度或羰基含量,样品中每毫克蛋白质羰基含量表示为nmol/mg[18]。
1.3.6 总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[19]中的半微量定氮法。
1.3.7 狮子头微生物菌群多样性测定
于无菌环境中称取10.0 g不同贮藏时间狮子头样品,加入20 mL无菌生理盐水(0.85 g/100 mL氯化钠溶液),混匀后于4 ℃、300 r/min条件下离心5 min,取上清液于4 ℃、10 000 r/min条件下离心10 min,收集沉淀。参照细菌基因组DNA提取试剂盒说明书对待测样品的DNA进行提取,随后用1%琼脂糖凝胶电泳检测所提取DNA的质量。对细菌DNA进行扩增,引物为338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。聚合酶链式反应(polymerase chain reaction,PCR)扩增反应体系包括5×FastPfu Buffer 4 μL、dNTP(2.5 mmol/L)2 μL、DNA模板10 ng、正反向引物各0.8 μL和FastPfu Taq酶0.4 μL,ddH2O补齐至20 µL。PCR扩增参数设置为:95 ℃预变性3 min后,按照95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸45 s进行29 个循环,最后于72 ℃延伸10 min,反应结束后PCR产物经2%琼脂糖凝胶电泳检测。扩增合格的产物由上海美吉生物医药科技有限公司使用Illumina Miseq PE300高通量测序平台对样品进行测序。按97%相似性标准进行操作分类单元(operational taxonomic unit,OTU)聚类,参照Silva 16S rRNA基因数据库,对OTU代表序列进行物质注释分析。在此基础上,使用Mothur程序对97%相似水平上的OTU代表序列进行Alpha多样性分析,计算Sobs指数、反映微生物群落丰度的Chao1、ACE指数、反映微生物群落多样性的Simpson、Shannon指数和反映微生物群落覆盖率的Coverage指数。
1.4 数据处理
使用Excel 2010和SPSS 16.0等数据处理软件进行数据分析,结果以平均值±标准差表示,P<0.05表示差异显著;采用Origin 9.0软件绘图。
2 结果与分析
2.1 狮子头贮藏期间感官评分变化
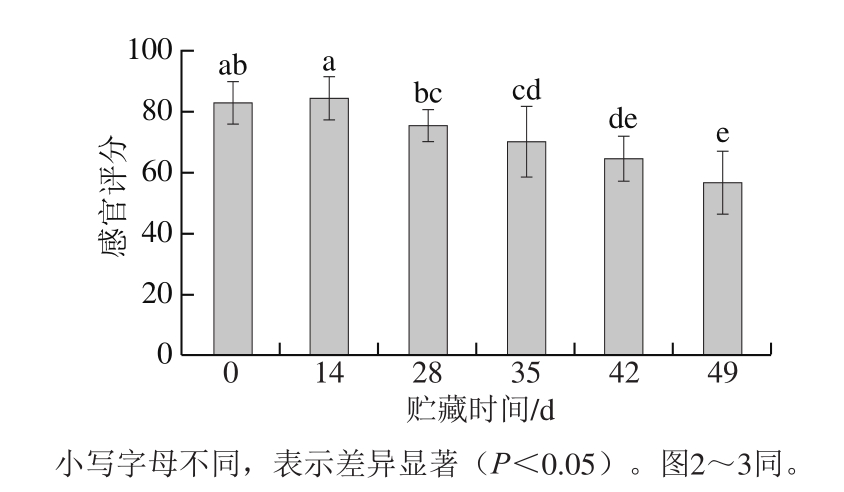
图 1 狮子头贮藏期间感官评分变化
Fig. 1 Changes in sensory evaluation score of Shizitou during chilled storage
由图1可知,贮藏过程中狮子头的感官评分随着贮藏时间的延长呈现逐渐下降趋势,由初始的83.19 分下降至贮藏末期的56.81 分。贮藏初期(0~14 d),狮子头感官评分无显著变化;当贮藏时间延长至28 d时,其感官评分显著下降(P<0.05)。狮子头4 ℃冷藏过程中,随着贮藏时间的延长,产品表现出少许渗油现象,同时色泽逐渐变暗,产品固有味道逐渐变淡,上述现象可能是狮子头在较长时间的贮藏过程中脂肪、蛋白质氧化以及微生物共同作用的结果。
2.2 狮子头贮藏期间质构特性变化
表 2 狮子头贮藏期间质构特性变化
Table 2 Changes in texture of Shizitou during chilled storage

注:同列小写字母不同,表示差异显著(P<0.05)。
贮藏时间/d 硬度/g 内聚性 弹性/mm 咀嚼性/mJ 0 362.27±6.41ab 0.73±0.01ab 3.13±1.11a 7.23±1.24a 14 359.67±30.52a0.72±0.03ab 2.68±0.20a 6.69±1.08a 28 399.53±25.58bc0.72±0.03ab 2.54±0.03a 7.21±0.43a 35 409.87±14.49c0.76±0.03b 3.11±0.63a 9.55±2.39a 42 431.53±11.94c0.73±0.03ab 2.92±0.64a 8.85±1.58a 49 441.73±25.78c0.68±0.02a 2.96±0.82a 8.59±1.68a
由表2可知,随着贮藏时间的延长,狮子头的硬度显著增加(P<0.05),嫩度降低,这可能是由于狮子头经真空包装和二次杀菌后导致汁液流失所致。内聚性反映了咀嚼时样品抵抗受损并紧密连接使其保持完整的性质,揭示了样品内部结合力的大小。狮子头的内聚性随着贮藏时间的延长略有下降,可能是随着贮藏时间的延长,狮子头中肥瘦肉的结合逐渐变松散,使内聚性降低。随着贮藏时间的延长,狮子头弹性和咀嚼性均无显著变化,可能是由于狮子头酥软的特性使其在受到压力后结构破坏较小,弹性较好。
2.3 狮子头贮藏期间TBARs值和羰基含量变化
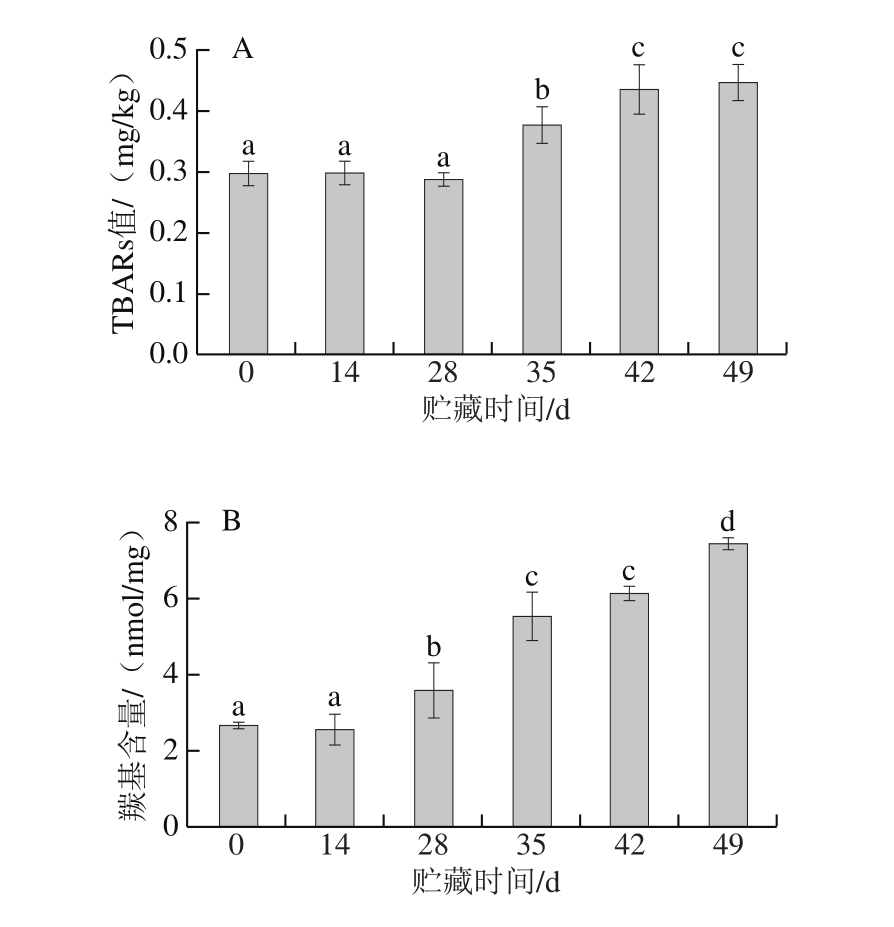
图 2 狮子头贮藏期间TBARs值(A)和羰基含量(B)变化
Fig. 2 Changes in TBARs value (A) and carbonyl content (B) of Shizitou during chilled storage
由图2可知,随着贮藏时间的延长,狮子头TBARs值和羰基含量均逐渐升高。TBARs值反映的是肉制品中不饱和脂肪酸氧化分解后形成的以丙二醛为代表的次级反应产物的量,是评价肉制品氧化程度的常用指标[20]。随着氧化程度的加深,次级产物不断增多,使TBARs值不断升高。贮藏初期(0~28 d),狮子头TBARs值变化不显著,从贮藏第28天开始,TBARs值开始显著升高(P<0.05);到贮藏末期(42~49 d),TBARs值变化趋缓,但升高趋势依然显著(P<0.05),至第49天时TBARs值为0.46 mg/kg。
蛋白质羰基含量的增加是蛋白质氧化的主要表现形式,通常将羰基含量作为表示蛋白质氧化程度的指标。狮子头贮藏期间蛋白质羰基含量与TBARs值变化情况基本一致。贮藏初期(0~14 d),羰基含量没有显著变化,贮藏14~28 d,羰基含量开始显著增加(P<0.05),这可能是由脂肪氧化诱发蛋白质氧化加速造成的。
2.4 狮子头贮藏期间TVB-N含量变化
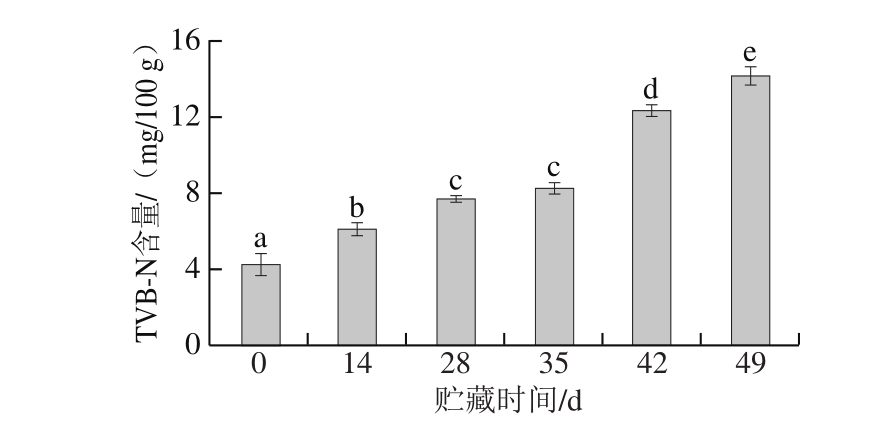
图 3 狮子头贮藏期间TVB-N含量变化
Fig. 3 Changes in TVB-N content of Shizitou during chilled storage
TVB-N是指动物性食品中的蛋白质在内源酶及微生物的作用下发生分解产生的具有挥发性的氨、伯胺、仲胺和叔胺等低级碱性含氮化合物。由图3可知,贮藏前期(0~35 d),狮子头TVB-N含量缓慢升高,贮藏后期(42~49 d)迅速升高,这可能是由于产品在二次杀菌后,残存的微生物活性不足,对蛋白质的分解能力较弱,随着贮藏时间的延长,残存微生物开始大量繁殖,导致狮子头中的蛋白质被较快分解,从而使TVB-N含量快速升高。
2.5 狮子头中微生物OTU分类及Alpha多样性分析
采用Illumina Miseq PE300平台对4 ℃冷藏条件下狮子头中的微生物16S rRNA的V3~V4区域进行高通量测序。共获得有效序列数为302 240,平均有效序列长度为435.67 bp。
由表3可知,贮藏初期,狮子头中OTU数为721,冷藏28 d时升高到1 247,贮藏末期(第49天)时又降低到678,表明在贮藏过程中微生物种类先增加后逐渐减少,与谢萍[21]对散装酱卤鸭肉制品中微生物多样性和Zhang Yingtong等[22]对肴肉冷藏过程中微生物群落变化的研究结果相一致。此外,Shannon指数和Simpson指数的变化趋势同样表明,狮子头贮藏期间微生物多样性先增加后逐渐下降。覆盖率均在99.9%以上,表明本次测序结果可以很好地反映样品中微生物群落结构的丰度,因此测序结果能够比较准确地反映狮子头贮藏期间微生物群落的真实情况。Alpha多样性指数测定结果与OTU结果相一致,而Chao1指数略高于OTU值,表明可能样品中存在一些微生物未被鉴定出来[23]。
表 3 狮子头中微生物群落丰度和Alpha多样性指数
Table 3 Microbial community abundance and Alpha diversity index in Shizitou
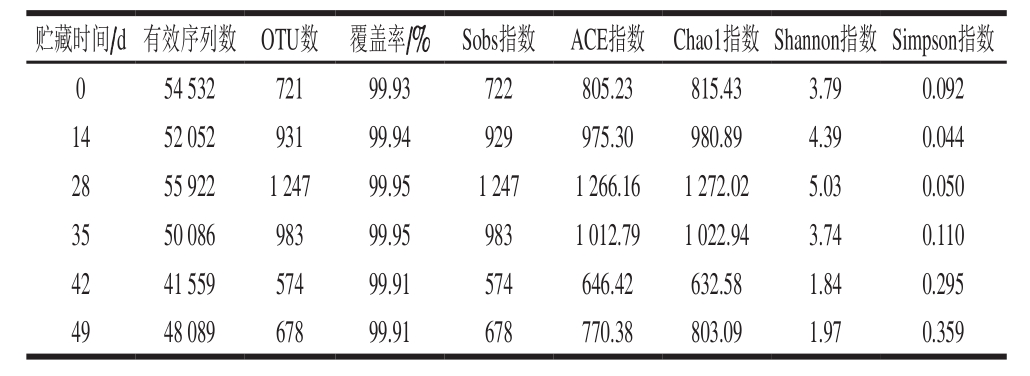
贮藏时间/d 有效序列数 OTU数 覆盖率/% Sobs指数 ACE指数 Chao1指数 Shannon指数 Simpson指数0 54 532 721 99.93 722 805.23 815.43 3.79 0.092 14 52 052 931 99.94 929 975.30 980.89 4.39 0.044 28 55 922 1 247 99.95 1 247 1 266.16 1 272.02 5.03 0.050 35 50 086 983 99.95 983 1 012.79 1 022.94 3.74 0.110 42 41 559 574 99.91 574 646.42 632.58 1.84 0.295 49 48 089 678 99.91 678 770.38 803.09 1.97 0.359
上述实验结果可能是由于低温杀菌使狮子头中部分细菌处于亚致死或芽孢状态、细菌数量少,未被检出。随着贮藏时间的延长,处于亚致死或芽孢状态的细菌逐渐复苏(萌发)并大量繁殖,使狮子头中被检出的微生物多样性和丰度同时增加。而随着贮藏时间的进一步延长,微生物之间进行种间竞争,优势微生物丰度进一步增加,而另外一些微生物的生长则受到抑制,导致微生物多样性降低。
2.6 狮子头中微生物群落组成分析
2.6.1 基于门水平的微生物群落组成分析

图 4 狮子头贮藏期间基于门水平的微生物群落结构变化
Fig. 4 Changes in bacteria community structure at the phylum level of Shizitou during storage
由图4可知,4 ℃条件下贮藏的狮子头中检测出的微生物主要为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝藻菌门(Cyanobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes)7 种已知菌门。贮藏0 d时,以厚壁菌门、蓝藻菌门和变形菌门为主,其相对丰度分别为26.6%、31.2%和24.9%。随着贮藏时间的延长,狮子头中厚壁菌门微生物数量逐渐增加,至贮藏末期(49 d)时其相对丰度已高达81.3%,为主要优势菌群。厚壁菌门细菌为一类具有较强耐热性的微生物[16],较低的熟制温度未能将厚壁菌门微生物全部杀灭,贮藏期间其重新利用营养物质生长繁殖。而随着贮藏时间的延长,蓝藻菌门、变形菌门、放线菌门和拟杆菌门相对丰度均逐渐降低,分别降至3.9%、6.3%、5.8%和2.5%。其中,贮藏中期(28 d)出现酸杆菌门和绿弯菌门细菌,其相对丰度分别为1.8%和2.5%,该时期微生物种类增多表明此时期微生物多样性较高。以上结果表明,随着贮藏时间的延长,狮子头中的微生物主要以厚壁菌门为主,是贮藏末期的优势菌群。
2.6.2 基于属水平的微生物群落组成分析
由图5A可知,贮藏初期,狮子头中属水平的主要微生物为蓝藻细菌(Cyanobacteria),但随着贮藏时间的延长其相对丰度逐渐下降。除了蓝藻细菌属外,贮藏0 d时,狮子头中微生物多样性较高,其主要微生物包括不动杆菌属(Acinetobacter)、乳球菌属(Lactococcus)、微球菌属(Macrococcus),相对丰度分别为9.49%、6.07%和5.36%。贮藏至28 d时,蓝藻细菌属仍然是主要菌群,但是微生物多样性增加,相对于贮藏0 d时出现环丝菌属(Brochothrix)、拟杆菌属(Bacteroides)、库克菌属(Kocuria)、红球菌属(Rhodococcus)和金黄杆菌属(Chryseobacterium)等。而贮藏中期(35 d)时,梭状芽孢杆菌属(Clostridium)相对丰度逐渐增多,开始成为狮子头中占主要地位的微生物菌群,贮藏49 d时其相对丰度升高至55.76%。而类芽孢杆菌属(Paenibacillus)为狮子头贮藏末期第2位优势菌群,其相对丰度达到21.10%。
由图5B可知,贮藏0、14、28、35 d狮子头的微生物群落结构较为相似,而贮藏42 d和贮藏49 d狮子头的微生物群落结构更为相似。以上结果表明,狮子头在4 ℃贮藏期间,其微生物多样性在贮藏中期(28 d)达到最高,而随着贮藏时间继续延长,其微生物多样性降低,贮藏末期其主要优势菌群为梭状芽孢杆菌属(Clostridium)和类芽孢杆菌属(Paenibacillus)。
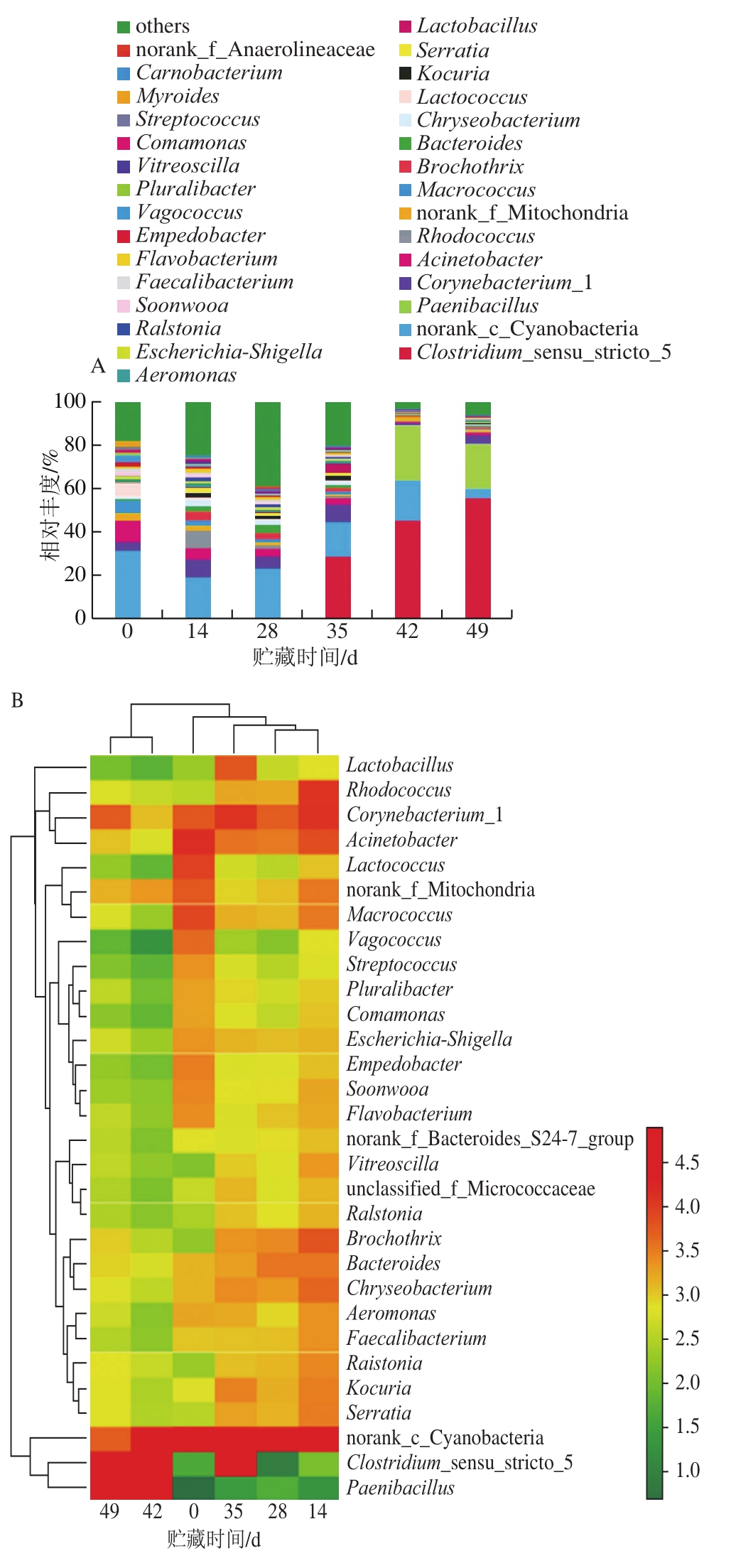
图 5 狮子头贮藏期间基于属水平的微生物群落结构变化(A)和物种丰度聚类图(B)B
Fig. 5 Changes in bacteria community structure at the genus level of Shizitou during storage (A) and species abundance clustering (B)
本研究制作的狮子头冷藏过程中存在的细菌主要为嗜冷菌,如黄杆菌属、变形杆菌属、不动杆菌属、莫拉氏菌属等,均为肉类中常见的腐败菌属。贮藏后期(35~49 d),狮子头中的优势菌群为梭状芽孢杆菌属(Clostridium)和类芽孢杆菌属(Paenibacillus),这2 种微生物是肉类中常见腐败菌,其芽孢比较耐热,其中梭状芽孢杆菌100 ℃煮沸1 h仍能存活,而类芽孢杆菌属是芽孢杆菌的分支,芽孢杆菌的孢子100 ℃加热3 h才可被杀死。本研究中,狮子头制作过程熟制温度和二次杀菌温度均为85 ℃,不能将梭状芽孢杆菌和类芽孢杆菌孢子全部杀灭,贮藏后芽孢逐渐萌发并进一步生长繁殖成为优势菌。Cousin[24]、Walker[25]等发现,梭状芽孢杆菌属在温度较低时生长较慢,但是当温度稍高时,其生长代谢可以产生气体,从而使产品有一种硬干酪成熟时的后熟味。Dainty[26]、Lawson[27]等研究发现,梭状芽孢杆菌可以使真空包装的肉、鱼和真空烹调过的牛肉腐败。类芽孢杆菌属是芽孢杆菌属的分支,1993年将类芽孢杆菌属从芽孢杆菌属中分离出来[28-29]。类芽孢杆菌属的孢子可在极端条件下存活,高温、压力、生物杀菌剂和紫外线照射都不能将其完全杀灭,且由于菌株含冷适应相关蛋白,因此即使在低温条件下类芽孢杆菌仍能较好地生长[30-31],该特性可能是狮子头贮藏后期类芽孢杆菌属相对丰度较高的原因。
3 结 论
低温狮子头在冷藏期间硬度显著增加、嫩度和内聚性下降,脂肪和蛋白质也出现明显的氧化。贮藏初期,狮子头中微生物种类较多,随着贮藏时间延长,微生物种类有所降低;贮藏末期,优势微生物主要为梭状芽孢杆菌属(55.76%)和类芽孢杆菌属(21.10%)。微生物的生长繁殖加速了狮子头中蛋白质等营养物质的降解,同时降解的营养物质也进一步促进了微生物生长。因而,微生物的生长繁殖及脂肪、蛋白质的氧化降解共同导致狮子头贮藏期间感官评分逐渐降低,出现色泽逐渐变暗、产品固有味道逐渐变淡等现象。因此,如何控制耐热性的梭状芽孢杆菌和类芽孢杆菌的生长、提高低温杀菌狮子头和其他低温杀菌肉制品的安全性,将是今后的研究重点。本研究结果对于中华传统狮子头的工业化生产具有借鉴意义。
[1] 朱文政, 徐艳, 钱祥羽, 等. 狮子头加工过程中脂肪及脂肪酸组分的变化[J]. 食品与机械, 2019, 35(6): 49-53. DOI:10.13652/j.issn.1003-5788.2019.06.008.
[2] 杨欢, 刘毅, 邵乐乐, 等. 真空包装狮子头货架期预测模型的建立[J]. 食品工业科技, 2019(19): 266-272. DOI:10.13386/j.issn1002-0306.2019.19.046.
[3] 唐建华, 周晓燕. 清炖狮子头的试验研究[J]. 食品工业, 2010(5): 27-30.
[4] 鲍会梅, 丁玉勇, 王宏. 清炖狮子头最佳工艺及脂肪蛋白质比例测定[J]. 食品研究与开发, 2004, 25(5): 129-130. DOI:10.3969/j.issn.1005-6521.2004.05.048.
[5] 周晓燕, 唐建华, 陈剑, 等. 影响狮子头口感的关键工艺标准研究[J].食品科学, 2010, 31(16): 145-150.
[6] TURGUT S S, ISIKI F, SOYER A. Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage[J]. Meat Science, 2017, 129: 111-119.DOI:10.1016/j.meatsci.2017.02.019.
[7] AKCAN T, ESTEVEZ M, SERDAROĞLU M. Antioxidant protection of cooked meatballs during frozen storage by whey protein edible fi lms with phytochemicals from Laurus nobilis L. and Salvia off i cinalis[J].LWT-Food Science and Technology, 2017, 77: 323-331. DOI:10.1016/j.lwt.2016.11.051.
[8] JOS H J, HUIS I V. Microbial and biochemical spoilage of foods: an overview[J]. International Journal of Food Microbiology, 1996, 33:1-18. DOI:10.1016/0168-1605(96)01139-7.
[9] 田建军, 张开屏, 杨明阳, 等. 应用Illumina MiSeq测序技术比较风干肉中细菌多样性和微生物安全性[J]. 食品科学, 2019, 40(8): 33-40.DOI:10.7506/spkx1002-6630-20180504-043.
[10] 向东, 汤沂, 裘芳, 等. 快速检测方法在食品微生物检测中的应用[J].食品科技, 2019(3): 81-82. DOI:10.16736/j.cnki.cn41-1434/ts.2019.15.027.
[11] 蔡教英, 王小玉, 姚丽锋, 等. 冰鲜鸽肉贮藏过程中的微生物菌群多样性[J]. 肉类研究, 2018, 32(9): 41-46. DOI:10.7506/rlyj1001-8123-201809008.
[12] BELLA J M D, BAO Y, GLOOR G B, et al. High throughput sequencing methods and analysis for microbiome research[J]. Journal of Microbiological Methods, 2013, 95(3): 401-414. DOI:10.1016/j.mimet.2013.08.011.
[13] SOON W W, HARIHARAN M, SNYDER M P. High-throughput sequencing for biology and medicine[J]. Molecular Systems Biology,2013, 9: 640. DOI:10.1038/msb.2012.61.
[14] SOLIERI L, GIUDICI P. Yeasts associated to traditional balsamic vinegar: ecological and technological features[J]. International Journal of Food Microbiology, 2008, 125(1): 36-45. DOI:10.1016/j.ijfoodmicro.2007.06.022.
[15] ALDRETE-TAPIA A, ESCOBAR-RAMÍREZ M C, TAMPLIN M L,et al. High-throughput sequencing of microbial communities in Poro cheese, an artisanal Mexican cheese[J]. Food Microbiology, 2014,44(6): 136-141. DOI:10.1016/j.fm.2014.05.022.
[16] ZHANG Qiuqin, JIANG Mei, RUI Xin, et al. Effect of rose polyphenols on oxidation, biogenic amines and microbial diversity in naturally dry fermented sausages[J]. Food Control, 2017, 78: 324-330.DOI:10.1016/j.foodcont.2017.02.054.
[17] 白艳红. 低温熏煮香肠腐败机理及生物抑菌研究[D]. 杨凌: 西北农林科技大学, 2005: 28.
[18] ARMENTEROS M, HEINONEN M, OLLILAINEN V, et al. Analysis of protein carbonyls in meat products by using the DNPH-method,fluorescence spectroscopy and liquid chromatography-electrospray ionisation-mass spectrometry (LC-ESI-MS)[J]. Meat Science, 2009,83(1): 104-112. DOI:10.1016/j.meatsci.2009.04.007.
[19] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 中国标准出版社, 2016: 1-3.
[20] CHEN Kai, SHAO Lele, HUO Yunfeng, et al. Antimicrobial and antioxidant effects of a hydroxypyridinone derivative containing an oxime ether moiety and its application in shrimp preservation[J]. Food Control, 2019, 95: 157-164. DOI:10.1016/j.foodcont.2018.08.008.
[21] 谢萍. 散装酱卤鸭肉制品微生物多样性与货架期预测模型的研究[D].南昌: 江西农业大学, 2015: 20-60.
[22] ZHANG Yingtong, YAO Yongjie, GAO Leifeng, et al. Characterization of a microbial community developing during refrigerated storage of vacuum packed Yao meat, a Chinese traditional food[J]. LWTFood Science and Technology, 2018, 90: 562-569. DOI:10.1016/j.lwt.2018.01.005.
[23] WANG Taojun, ZHAO Liang, SUN Yanan, et al. Changes in the microbiota of lamb packaged in a vacuum and in modified atmospheres during chilled storage analysed by high-throughput sequencing[J]. Meat Science, 2016, 121: 253-260. DOI:10.1016/j.meatsci.2016.06.021.
[24] COUSIN M A. Presence and activity of psychrotrophic microorganisms in milk and dairy products: a review[J]. Journal of Food Protection,1982, 45(2): 172-207. DOI:10.4315/0362-028X-45.2.172.
[25] WALKER S J. Major spoilage micro-organisms in milk and dairy products[J]. International Journal of Dairy Technology, 2010, 41(4):91-92. DOI:10.1111/j.1471-0307.1988.tb00606.x.
[26] DAINTY R H. Chemical/biochemical detection of spoilage[J].International Journal of Food Microbiology, 1996, 33(1): 19-33.DOI:10.1016/0168-1605(96)01137-3.
[27] LAWSON P, DAINTY R H, KRISTIANSEN N, et al. Characterization of a psychrotrophic Clostridium causing spoilage in vacuum-packed cooked pork: description of Clostridium algidicarnis sp. nov[J].Letters in Applied Microbiology, 2010, 19(3): 153-157. DOI:10.1111/j.1472-765X.1994.tb00930.x.
[28] ASH C, FARROW J A E, WALLBANKS S, et al. Phylogenetic heterogeneity of the genus Bacillus revealed by comparative analysis of small-subunitribosomal RNA sequences[J]. Letters in Applied Microbiology, 2010, 13(4):202-206. DOI:10.1111/j.1472-765X.1991.tb00608.x.
[29] GRADY E N, MACDONALD J, LIU L, et al. Current knowledge and perspectives of Paenibacillus: a review[J]. Microbial Cell Factories,2016, 15(1): 203. DOI:10.1186/s12934-016-0603-7.
[30] GOPAL N, HILL C, ROSS P R, et al. The prevalence and control of Bacillus and related spore-forming bacteria in the dairy industry[J]. Frontiers in Microbiology, 2015, 6: 1418. DOI:10.3389/fmicb.2015.01418.
[31] SWITT A I M, ANDRUS A D, RANIERI M L, et al. Genomic comparison of sporeforming bacilli isolated from milk[J]. BMC Genomics, 2014, 15(1): 1-17. DOI:10.1186/1471-2164-15-26.