肉类食品在人类饮食结构中占据至关重要的位置。随着经济的发展,我国肉类食品消费逐年增加,相关的食品安全问题日益凸显,引起政府和社会各界的高度重视[1-2]。2013年爆发的“马肉风波”曾经使多个欧洲国家卷入丑闻,引起消费者反感[3]。在肉类食品加工过程中,不法商贩为了赚取更高利润,常以质量差、价格低的肉类冒充优质高价肉类[4-5]。因饲养周期短、价格低,鸭肉常作为牛羊肉掺假的原材料[6-7],这种掺假行为损害了消费者利益,扰乱了市场规则[8-9]。因此,研究掺假牛羊肉的快速检测方法至关重要。
肉类食品的鉴别方法主要有感官鉴别、核酸扩增技术、理化方法和免疫学方法[10-13]。感官方法主要是通过视觉、嗅觉、味觉和触觉对肉类进行鉴别,主观性较强,不能满足检测要求[14-15]。核酸扩增技术检测结果准确性较高,是目前国际上检测肉类食品掺假的主流方法[16-18],该技术对操作人员的要求较高,所用仪器价格昂贵,不适合基层实验室的应用和现场快速检测[19-20]。电子鼻结合气相色谱-质谱联用检测掺假肉类有一定的准确性[21-22],但需要检测多种挥发性物质,操作过程和结果处理均较为繁琐。免疫学检测技术是基于抗原抗体的特异性结合捕获待检物质,以酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法应用最为广泛[23],该方法具有灵敏度高、特异性强、操作简单等优点,常作为快速筛查手段[24-25]。几种方法具有各自的特点,在实际应用中常将不同技术联合使用,以达到检测目的。ELISA方法适合现场快速检测,但是在肉类食品加工过程中,其蛋白质成分会发生变性,因此抗原的热稳定性至关重要[26-27]。骨骼肌肌钙蛋白I(skeletal muscle troponin I,sTnI)具有较高的特异性和热稳定性,是理想的抗原之一[28-29]。Liu Lihua等[30]以猪sTnI为抗原制备单克隆抗体,利用夹心ELISA法能够检出鸡肉和牛肉中0.05%和0.10%的猪肉成分,并可以检出大豆饲料中经过高温处理的猪肉成分。本研究将鸭骨骼肌经煮沸提取、电泳得到sTnI条带,并制备其特异性单克隆抗体,对抗体性能进行评价,为鸭肉免疫学鉴定方法的建立和检测产品的研究提供参考。
1 材料与方法
1.1 材料与试剂
丙烯酰胺、亚甲基双丙烯酰胺、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate polyacrylamide,SDS)、三羟甲基氨基甲烷、聚乙二醇、HAT培养基(50×)Hybri-MaxTM、HT培养基(50×)Hybri-MaxTM、免疫球蛋白亚型试剂盒 美国Sigma公司;细胞培养板、DMEM培养基 美国Gibco公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG) 北京中杉金桥生物科技有限公司;其他试剂均为国产分析纯。
BALB/c小鼠 河北医科大学实验动物中心。
1.2 仪器与设备
4710超声破碎仪 美国Cole-Parmer仪器公司;Heraus Multifuge高速冷冻离心机、ND2000超微量核酸蛋白测定仪、1510酶标仪 德国Thermo公司;MCO-15AC二氧化碳培养箱 日本Sanyo公司;SW-CJ-2FD净化工作台 苏州净化设备有限公司;CKX41SF倒置显微镜日本Olympus公司。
1.3 方法
1.3.1 抗原的提取及鉴定
取鸭骨骼肌,去除脂肪和结缔组织,研磨混匀,称取20 g,加入0.15 mol/L NaCl溶液(1∶2,m/V),涡旋混匀后,超声提取5 min(100 W),煮沸20 min后,5 000×g离心20 min;去除沉淀,取上清过滤后作为检测原。另取20 g研磨后的鸭骨骼肌,按照上述方法处理,离心后取上清于121 ℃高压处理30 min,5 000×g离心30 min;上清用Whatman 1号滤纸过滤,滤液加入90%乙醇(1∶3.74,V/V),静置2 h;混合液7 000×g离心20 min,取沉淀烘干,为免疫原提取物[27]。选择12%分离胶、5%浓缩胶,对抗原进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electropheresis,SDS-PAGE)鉴定,将含有目的条带的电泳胶加生理盐水研磨后用于免疫[31]。
1.3.2 动物免疫及杂交瘤细胞株制备
向研磨后的电泳胶中加入等体积佐剂免疫BALB/c小鼠,颈背部多点注射,1 次电泳免疫3 只小鼠,每2 周免疫1 次,第3次免疫后7~10 d断尾取血,分离血清,间接ELISA方法检测血清抗体效价。选取血清效价最高的小鼠进行细胞融合[31]。融合后置于HAT培养基中,于37 ℃、5% CO2培养箱中培养,10~12 d后换用HT培养基,用间接ELISA方法检测。检测结果为阳性的孔,挑选吸光度较高、状态较好的细胞,通过有限稀释法进行亚克隆,直至得到分泌单一抗体的杂交瘤细胞株。
1.3.3 单克隆抗体制备
将获得的阳性杂交瘤细胞株扩大培养,并分别进行冻存和制备腹水。BALB/c小鼠腹腔注射石蜡油7 d后,于腹腔注射杂交瘤细胞约106 个,7~10 d后待腹部膨大抽取腹水,经辛酸-硫酸铵沉淀方法[31]纯化,得到单克隆抗体。
1.3.4 单克隆抗体效价测定
采用间接ELISA法[32]进行效价测定,具体步骤如下:将质量浓度为5 μg/mL的检测原加入96 孔酶标板,每孔100 μL,4 ℃包被过夜;以含体积分数0.1%吐温-20的0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)作为洗液,洗涤3 次,每次用量300 mL,拍干(下同);每孔加入含体积分数10%小牛血清的洗液200 μL,37 ℃孵育2 h,洗涤、拍干;将单克隆抗体以1∶200、1∶400、1∶800…倍比稀释,每孔加入100 μL,37 ℃孵育45 min,洗涤、拍干;每孔加入100 μL稀释10 000 倍的HRP标记山羊抗小鼠IgG,37 ℃孵育30 min,洗涤、拍干;每孔加入显色液100 μL,37 ℃避光反应15 min;每孔加入50 μL终止液终止反应;450 nm波长处测定吸光度(A)。阴性对照孔吸光度为A1,各待测阳性孔吸光度为A2,以A2/A1≥2.1作为效价测定结果。
1.3.5 单克隆抗体亚型测定
按免疫球蛋白亚型试剂盒说明书步骤进行测定。
1.3.6 单克隆抗体特异性测定
分别包被牛、羊、鸡、鸭、鱼骨骼肌提取物,用间接ELISA方法测定单克隆抗体与不同骨骼肌提取物的效价。测定方法同1.3.4节,提取物制备方法与检测原提取方法相同。
1.3.7 免疫印迹
参考康洁[31]的方法,SDS-PAGE后转膜,经封闭、洗膜,孵育一抗、二抗,显色后拍照。
1.3.8 单克隆抗体亲和力测定
以4 个不同质量浓度(1、0.5、0.25、0.125 μg/mL)检测原进行包被,将纯化的单克隆抗体倍比稀释,用Batty饱和法[23]进行测定。以抗体质量浓度的对数为横坐标,以对应的A450 nm为纵坐标,绘制“S”型曲线。按下式计算亲和常数(Ka)。
式中:ρ为当检测原质量浓度为a时,吸光度最高值的50%所对应的抗体质量浓度/(μg/mL);ρ'为当检测原质量浓度为b时,吸光度最高值的50%所对应的抗体质量浓度/(μg/mL);a=nb,n为稀释倍数。
1.4 数据处理
采用Gradpad作图软件、Excel软件、化学发光凝胶成像系统进行数据处理。
2 结果与分析
2.1 抗原的提取
对鸭骨骼肌进行提取后,经烘干得到固体免疫原提取物99.5 mg,得率为0.5%。用超微量核酸蛋白测定仪测得检测原质量浓度为8.2 mg/mL。
2.2 抗原SDS-PAGE鉴定结果
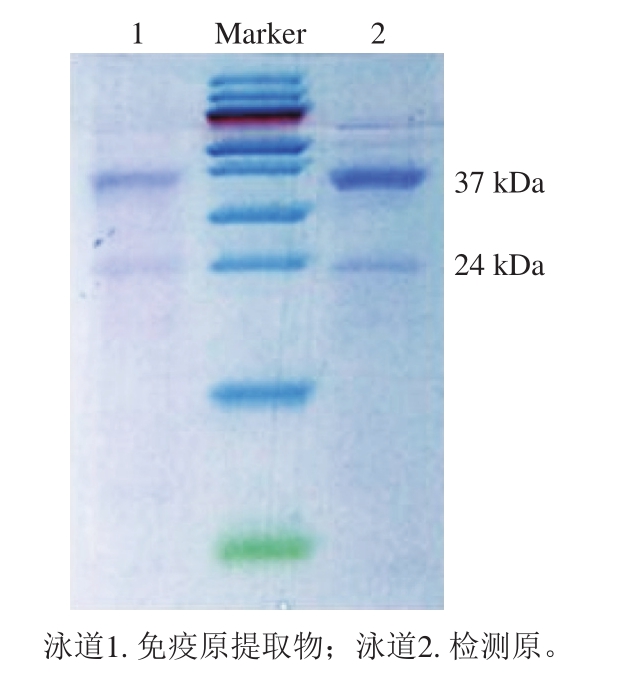
图 1 提取物的SDS-PAGE鉴定结果
Fig. 1 SDS-PAGE analysis of extracts
由图1可知,带形清晰、颜色较深的条带有2 条,对应的分子质量约为37、24 kDa,与文献[31]报道的骨骼肌TnT、TnI亚基相符,证明提取物是鸭TnI。选取分子质量24 kDa的sTnI用于免疫。
2.3 杂交瘤细胞株的筛选
经过3~4 次亚克隆,筛选出分泌抗鸭sTnI单克隆抗体的阳性杂交瘤细胞株2 株,与其分泌的单克隆抗体均分别命名为3E7、4D3。2 株阳性杂交瘤细胞株诱导的腹水经辛酸-硫酸铵沉淀,用超微量核酸蛋白测定仪测得其蛋白质量浓度分别为6.6、7.9 mg/mL,表示抗鸭sTnI单克隆抗体制备成功。
2.4 单克隆抗体效价测定结果
表 1 单克隆抗体效价
Table 1 Titer of monoclonal antibody
单克隆抗体 3E7 4D3效价 1∶1.02×105 1∶1.28×104
由表1可知,3E7的效价为1∶1.02×105,4D3的效价为1∶1.28×104,2 株抗体效价均较高。
2.5 单克隆抗体亚型测定结果
采用间接ELISA方法测定2 株单克隆抗体的亚型。杂交瘤细胞分泌的单克隆抗体与不同亚型的抗体显色有明显差异,3E7、4D3均与IgG1抗体反应的A450 nm最高,与IgM抗体反应的A450 nm较低,约为0.25,而与IgG2a、IgG2b、IgG3和IgA的反应均为阴性,因此3E7、4D3分泌的抗体类型为IgG1。
2.6 单克隆抗体特异性测定
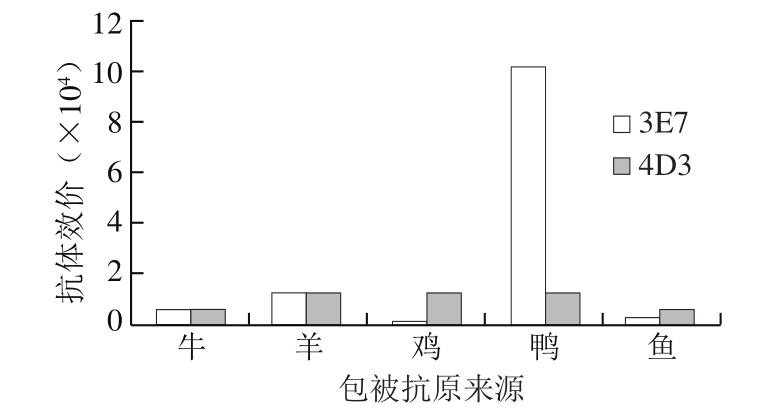
图 2 单抗交叉反应结果
Fig. 2 Results of cross reaction of monoclonal antibody
由图2可知:3 E 7与鸭骨骼肌提取物反应效价达1∶1.02×105,与羊骨骼肌提取物反应效价为1∶1.28×104,与牛、鸡、鱼骨骼肌提取物反应效价均在1∶1.00×104以下;4D3与羊、鸡、鸭骨骼肌提取物反应效价为1∶1.28×104,与牛、鱼骨骼肌提取物反应效价均在1∶1.0×104以下。综合评价得出,3E7效价较高、特异性较好,将其用于下一步实验。
2.7 单克隆抗体免疫印迹
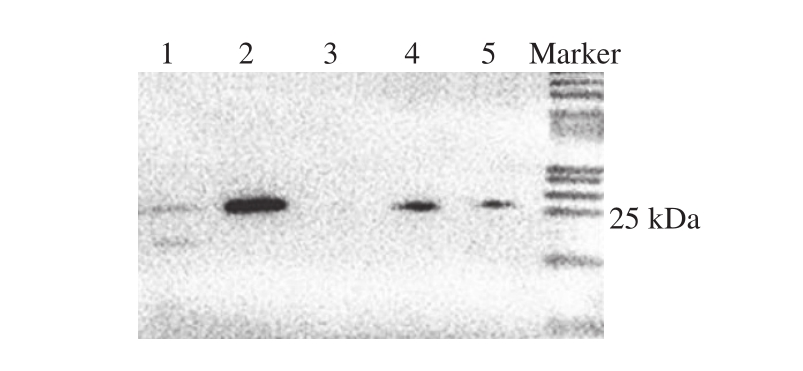
图 3 3E7与骨骼肌提取物特异反应的免疫印迹图谱
Fig. 3 Immunoblot analysis of specif i c response of 3E7 to skeletal muscle extract
泳道1. 鱼骨骼肌提取物;泳道2. 鸭骨骼肌提取物;泳道3. 鸡骨骼肌提取物;泳道4. 羊骨骼肌提取物;泳道5. 牛骨骼肌提取物。
由图3可知,3E7分别与转印有牛、羊、鸡、鸭、鱼骨骼肌提取物的聚偏二氟乙烯膜反应,显色后在鸭骨骼肌提取物的24 kDa条带位置出现单一条带,与牛、羊骨骼肌提取物有轻微反应,但条带显色与鸭骨骼肌提取物相比明显较浅,与鸡、鱼骨骼肌提取物无明显反应,初步证实3E7能结合鸭骨骼肌提取物,主要结合sTnI亚基,与鸡、鱼骨骼肌提取物无明显交叉,与牛、羊骨骼肌提取物部分交叉。
2.8 单克隆抗体亲和力测定结果
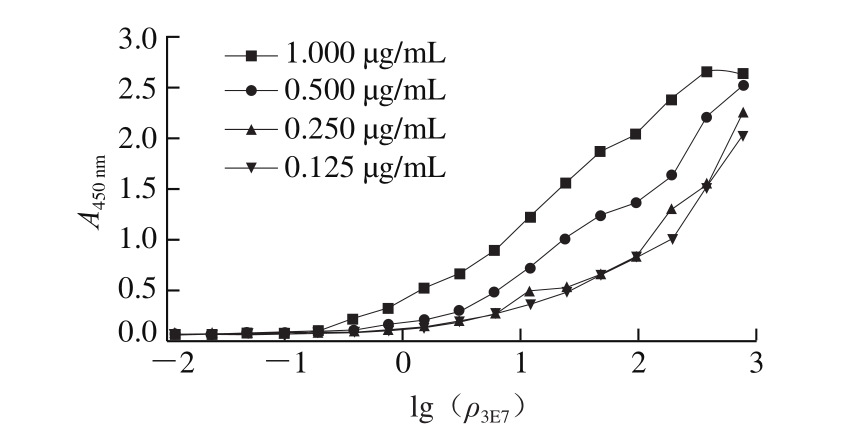
图 4 3E7亲和力测定结果
Fig. 4 Determination of aff i nity of monoclonal antibody toward 3E7
Ka反映了抗体的亲和力,用Batty饱和法测定3E7的Ka。“S”型曲线如图4所示,经计算,抗体3E7的Ka为5.9×105 L/mol。
3 结 论
将鸭骨骼肌经过粗提,免疫小鼠后进行融合,筛选高效价、高特异性的细胞进行亚克隆,最后获得稳定分泌抗鸭sTnI单克隆抗体的细胞株2 株。通过小鼠体内诱生腹水,用辛酸-硫酸铵沉淀方法进行纯化,得到单克隆抗体。经过鉴定,单抗3E7效价高,与鸡、鱼骨骼肌提取物无交叉反应,亚型为IgG1型,Ka为5.9×105 L/mol。免疫印迹结果显示,单抗3E7能够区分鸭骨骼肌提取物和牛、羊、鸡、鱼骨骼肌提取物,在24 kDa处显色,证明单抗3E7是抗鸭sTnI的抗体,且可以用于区分鸭骨骼肌组织与牛、羊、鸡、鱼骨骼肌组织。本研究结果能够为食品中鸭肉源性成分免疫学鉴别方法的建立提供参考。
[1] 田晓静, 王俊, 崔绍庆. 电子鼻快速检测区分羊肉中的掺杂鸡肉[J]. 现代食品科技, 2013, 29(12): 2997-3001. DOI:10.13982/j.mfst.1673-9078.2013.12.038.
[2] 骆训国, 栗绍文, 周蕾蕾, 等. 夹心ELISA方法检测生肉混合物中的猪肉成分的研究[J]. 动物医学进展, 2010, 31(增刊1): 20-22.DOI:10.16437/j.cnki.1007-5038.2010.s1.004.
[3] 程欣, 何玮玲, 黄明. 实时荧光PCR法检测食品中鸭肉成分[J]. 食品科学, 2013, 34(24): 92-96. DOI:10.7506/spkx1002-6630-201324019.
[4] 王建昌, 王金凤, 陈瑞春, 等. 鸭肉冒充牛羊肉的分子生物学检测[J].肉类研究, 2012, 26(6): 20-23.
[5] 熊蕊, 郭凤柳, 刘晓慧, 等. 牛羊肉中掺杂猪肉的PCR方法的建立和初步应用[J]. 食品工业, 2014, 35(8): 199-202.
[6] 张小莉, 魏玲, 李宝明, 等. 肉制品掺假鉴别技术研究进展[J]. 食品安全质量检测学报, 2014, 5(10): 3190-3196. DOI:10.19812/j.cnki.jfsq11-5956/ts.2014.10.039.
[7] 葛忠源. 各种食品动物肉种鉴别[J]. 青海畜牧兽医杂志, 2014, 44(2):55-56.
[8] 王綪, 李璐, 王佳奕, 等. 电子鼻结合气相色谱-质谱法对宁夏小尾寒羊肉中鸭肉掺假的快速检测[J]. 食品科学, 2017, 38(20): 222-228.DOI:10.7506/spkx1002-6630-201720032.
[9] 侯东军, 杨红菊, 于雷, 等. 环介导恒温扩增法鉴定牛羊肉中的搀杂肉[J]. 食品工业科技, 2012, 33(22): 60-62. DOI:10.13386/j.issn1002-0306.2012.22.037.
[10] 王珊, 李志娟, 苗丽. 微滴式数字PCR与实时荧光PCR检测羊肉制品中羊源和猪源性成分方法的比较[J]. 肉类工业, 2015(7): 38-41.
[11] TIAN Xiaojing, WANG Jun, CUI Shaoqing. Analysis of pork adulteration in minced mutton using electronic nose of metal oxide sensors[J]. Journal of Food Engineering, 2013, 119(4): 744-749.DOI:10.1016/j.jfoodeng.2013.07.004.
[12] CHEN F C, HSIEH Y H P, BRIDGMAN R C. Monoclonal antibodies against troponin I for the detection of rendered muscle tissues in animal feedstuffs[J]. Meat Science, 2002, 62(4): 405-412.DOI:10.1016/S0309-1740(02)00029-3.
[13] 马永征, 马冬, 白娣斯, 等. 免疫学检测肉类制品掺假研究进展[J].肉类研究, 2012, 26(9): 26-29.
[14] 冯涛, 杨韩, 张颖洁, 等. CPA-核酸试纸条检测鸭肉源性成分方法的建立和优化[J]. 核农学报, 2016, 30(11): 2151-2159.
[15] 孙艳华, 张智禹, 牛晋阳, 等. PCR法快速检测熟肉制品中肉类来源[J].食品研究与开发, 2010, 31(5): 139-142.
[16] KOPPEL R, RUF J, ZIMMERLI F, et al. Multiplex real-time PCR for the detection and quantif i cation of DNA from beef, pork, chicken and turkey[J]. European Food Research and Technology, 2008, 227(4):1199-1203. DOI:10.1007/s00217-008-0837-7.
[17] KOPPEL R, DANIELS M, FELDERER N, et al. Multiplex real-time PCR for the detection and quantif i cation of DNA from duck, goose,chicken, turkey and pork[J]. European Food Research and Technology,2013, 236(6): 1093-1098. DOI:10.1007/s00217-013-1973-2.
[18] 张全芳, 马德源, 刘艳艳, 等. 利用多重PCR技术检测羊肉中掺杂狐狸肉的方法研究[J]. 山东农业科学, 2014, 46(12): 4-6; 10.DOI:10.14083/j.issn.1001-4942.2014.12.002.
[19] 杨华, 汪小福, 肖英平, 等. 牛肉及其制品中掺入鸡肉、鸭肉和猪肉的多重数字PCR快速检测方法研究[J]. 浙江农业学报, 2017, 29(6):994-1000.
[20] 李璐. 电子鼻结合GC-MS对羊肉掺假鸭肉的快速检测[D]. 杨凌: 西北农林科技大学, 2016: 2-8.
[21] NURJULIANA M, MAN Y B C, HASHIM D M, et al. Rapid identification of pork for halal authentication using the electronic nose and gas chromatography mass spectrometer with headspace analyzer[J]. Meat Science, 2011, 88(4): 638-644. DOI:10.1016/j.meatsci.2011.02.022.
[22] HAN Dong, MI Si, ZHANG Chunhui, et al. Characterization and discrimination of Chinese marinated pork hocks by volatile compound profiling using solid phase microextraction gas chromatographymass spectrometry/olfactometry, electronic nose and chemometrics[J].Molecules, 2019, 24(7): e1385. DOI:10.3390/molecules24071385.
[23] 李春生, 刘静静, 杜顺丰, 等. 呋喃唑酮代谢物单克隆抗体和胶体金免疫层析试纸条的研制[J]. 现代食品科技, 2017, 33(6): 326-331.DOI:10.13982/j.mfst.1673-9078.2017.6.048.
[24] CHEN F C, HSIEH Y H P. Porcine troponin I: a thermostable species marker protein[J]. Meat Science, 2002, 61(1): 55-60. DOI:10.1016/S0309-1740(01)00162-0.
[25] 樊晓博, 徐社会, 蒋宝, 等. 酶标抗原直接竞争ELISA方法检测呋喃唑酮代谢物残留[J]. 食品工业科技, 2015, 36(1): 318-322.DOI:10.13386/j.issn1002-0306.2015.21.057.
[26] 董洋洋. 实时荧光PCR对牛肉中掺入鸭肉和猪肉的定量检测研究[D].大庆: 黑龙江八一农垦大学, 2016: 2.
[27] CHEN F C, HSIEH Y H P, BRIDGMAN R C. Monoclonal antibodies to porcine thermal-stable muscle protein for detection of pork in raw and cooked meats[J]. Journal of Food Science, 1998, 63(1): 201-205.DOI:10.1111/j.1365-2621.1998.tb15709.x.
[28] 任君安. 羊肉及其制品中掺假动物源性成分数字PCR技术精准定量研究[D]. 北京: 中国农业大学, 2017: 4-7.
[29] 孙艳. 小尾寒羊三个慢型骨骼肌肌钙蛋白的基因克隆、结构特征及组织表达分析[D]. 泰安: 山东农业大学, 2016: 3.
[30] LIU Lihua, CHEN F C, DORSEY J L, et al. Sensitive monoclonal antibody-based sandwich ELISA for the detection of porcine skeletal muscle in meat and products[J]. Journal of Food Science, 2006, 71(1):M1-M6. DOI:10.1111/j.1365-2621.2006.tb12393.x.
[31] 康洁. 牛心肌肌钙蛋白T的分离纯化和单克隆抗体的制备[D]. 北京:北京结核病胸部肿瘤研究所, 2001: 3.
[32] 刘青涛. 牛羊肉骨粉夹心ELISA检测方法的建立[D]. 扬州: 扬州大学, 2006: 9-10.