四环素类(tetracyclines,TCs)药物是水产养殖业中常用的兽药和饲料添加剂,起到预防和治疗各类细菌性疾病的作用。综合分析中国和欧美等主要水产品生产国的用药情况可知,由于在养殖过程中长期大量使用,不遵守休药期,容易导致该类药物在机体中残留,危害人类身体健康,另一方面极易导致耐药菌株逐年增加,不仅降低药物疗效,也限制了其他抗生素的使用[1-2]。因此,国内外对TCs药物的使用采取了严格的监控,中国和欧美等多个国家已相继制定肉制品中TCs药物的最大残留限量(maximum residue limit,MRL)为100 μg/kg,国际食品法典委员会和日本规定MRL为200 μg/kg[3]。受监控的药物多以土霉素(oxytetracycline,OTC)、四环素(tetracycline,TC)、金霉素(chlortetracycline,CTC)和多西环素(doxycycline,DC)为主,在实际应用中,为避免耐药性、提高疗效和逃避监管,使用地美环素(demeclocycline,DMC)、美他环素(methacycline,MTC)、米诺环素(minocycline,MNC)和甲氯环素(meclocycline,MCC)等新型TCs药物替代被限量监管的药物用于水产、畜牧生产的潜在风险不断加大。此外,TCs药物不稳定,容易转变为药效极低、毒性更强的差向异构体[4-5]。因此,对新型TCs药物及代谢物4-差向土霉素(4-epi oxytetracycline,EOTC)、4-差向四环素(4-epi tetracycline,ETC)和4-差向金霉素(4-epi chlortetracycline,ECTC)进行检测非常必要。
目前,TCs药物残留量的检测方法主要有薄层色谱法[6-8]、酶联免疫法[9-11]、微生物法[12-14]、电化学分析法[15-16]、液相色谱法[17-19]和液相色谱-串联质谱法[20-22]等。薄层色谱法和酶联免疫法的优点是简单、快捷和不需要复杂仪器等,缺点是分辨率和灵敏度均不高,易出现假阳性,不可作为残留确证方法;微生物法耗时较长,易受其他抗生素干扰,专一性和精确度不高;液相色谱法是目前研究TCs药物残留最常用的检测方法[23-25],具有分析速度快和适用范围广等特点[26-28],但前处理比较复杂,分析时间长,易造成待检药物损失,上机分析易受基质干扰的影响[29-30]。液相色谱-串联质谱法能有效减少基质干扰,灵敏度更高,结果精确可靠[31],是TCs药物残留检测的首选方法。但到目前为止,同时检测水产品中新型TCs药物、常规TCs药物及其代谢物的相关报道还很少。
本研究选择水产品肌肉组织为分析对象,通过优化色谱流动相组成和洗脱程序,得到较好的色谱峰型;通过优化提取和净化条件,提高方法的适用性、回收率和检测效率;建立灵敏度高、专属性强的同时检测TCs药物及其代谢物的方法。
1 材料与方法
1.1 材料与试剂
水产品样品由养殖场抽取,样品数分别为对虾10 个、大黄鱼12 个、鲤鱼10 个、鲈鱼12 个、大菱鲆10 个、乌鳢10 个、梭子蟹10 个、扇贝10 个;空白水产品样品(质控样品)为未检出目标化合物的鲤鱼样品。
OTC(纯度97%)、TC(纯度95%)、CTC(纯度96%)、DC(纯度98%)、DMC(纯度92.8%)和MTC(纯度97.9%) 德国Dr.Ehrenstorfer公司;EOTC(纯度95%)、ETC(纯度93.8%)、ECTC(纯度>90%)、MNC(纯度97%)和MCC(纯度97%) 加拿大TRC公司。
十八烷基硅烷(octadecyl silane,C18)、N-丙基乙二胺(primary secondary amine,PSA)、氨基吸附剂(amino adsorbent,NH2)、石墨化炭黑(graphitized carbon black,GCB) 美国Agilent公司;甲醇、乙腈(均为色谱纯) 美国Tedia公司;NH4OAc(色谱纯)、Na2EDTA·2H2O、NaCl、NaOAc、MgSO4、Na2SO4、Na2HPO4·12H2O、C6H8O7·H2O(均为分析纯) 上海安谱科学仪器有限公司。
1.2 仪器与设备
TSQ Fortis三重四极杆质谱联用仪(配UltiMate 3000液相色谱系统) 美国Thermo公司;ZWF-334往复式振荡器 上海智城分析仪器制造有限公司;TDZ5-WS多管架自动平衡离心机 湖南湘仪实验室仪器开发有限公司;EOFO-945066数显型多管式漩涡混合器 美国Talboys公司;Syncore Polyvap平行蒸发仪 瑞士Buchi公司;H35循环水冷却器 莱伯泰科有限公司;Synergy UV超纯水系统、XS205DU电子天平 美国Mettler公司。
1.3 方法
1.3.1 溶液配制
分别称取各标准品适量,用甲醇溶解并定容,配制成质量浓度为100 μg/mL的单标储备液,置于棕色螺口样品瓶中,于-18 ℃冰箱中保存。分别取各标准储备液400 μL于同一容量瓶中,用甲醇定容至20 mL,配制成各化合物质量浓度为2000 μg/L的混合标准工作液,临用时分别移取适量工作溶液,用0.1%甲酸水溶液-甲醇(8∶2,V/V)配制成各化合物质量浓度分别为2、5、10、25、50、100、200、400、800、1200 μg/L的标准溶液,用于绘制标准工作曲线。
0.1 mol/L Na2EDTA-McIIvaine缓冲溶液:准确称取37.23 g Na2EDTA·2H2O、12.93 g C6H8O7·H2O和10.92 g Na2HPO4·12H2O溶解于0.9 L超纯水,用HCl调节pH值至4.0,转移至容量瓶,用超纯水定容至1 L,混合均匀。
1.3.2 样品处理
称取(5.00±0.05) g均质后的样品于50 mL离心管中,加入2 mL 0.1 mol/L Na2EDTA-McIIvaine缓冲溶液,匀浆30 s,用15 mL体积分数1%乙酸-乙腈清洗刀头,洗液并入样品离心管中,加入0.5 g NaCl,涡旋振荡1 min,再加入10 g无水Na2SO4(用前于650 ℃烘烤4 h),混匀,振荡提取10 min,4000 r/min离心5 min,将上清液转移至另一干净离心管中,向上清液中加入200 mg C18,振荡净化5 min,4000 r/min离心5 min,上清液转移至平行蒸发管中,45 ℃平行蒸发至干。用2 mL 0.1%甲酸水溶液-甲醇(8∶2,V/V)充分溶解残渣,过0.22 μm微孔滤膜,供液相色谱-串联质谱仪测定。
1.3.3 色谱条件
Thermo Hypersil GOLD C18色谱柱(100 mm×2.1 mm,3 μm);柱温35 ℃;样品室温度21 ℃,进样量10 μL;流速0.3 mL/min;流动相A为水(含体积分数0.1%甲酸),流动相B为甲醇;梯度洗脱程序:0~2 min,90%流动相A;2~3 min,90%~78%流动相A;3~10 min,78%流动相A;10~11 min,78%~60%流动相A;11~13 min,60%~30%流动相A;13~15 min,30%流动相A;15~15.1 min,30%~5%流动相A;15.1~16 min,5%流动相A;16~16.1 min,5%~90%流动相A;16.1~18 min,90%流动相A。
1.3.4 质谱条件
离子源为电喷雾电离源(electrospray ionization,ESI),正离子模式,多反应监测扫描;喷雾电压3500 V;离子传输管温度350 ℃;蒸发温度300 ℃;碰撞气压力1.5 mTorr(0.2 Pa);鞘气流速35 L/h;辅助气流速10 L/h。11种TCs兽药的其他质谱参数见表1。
表1 11种TCs兽药的质谱参数
Table 1 Mass spectrometry parameters for the detection of 11 tetracyclines
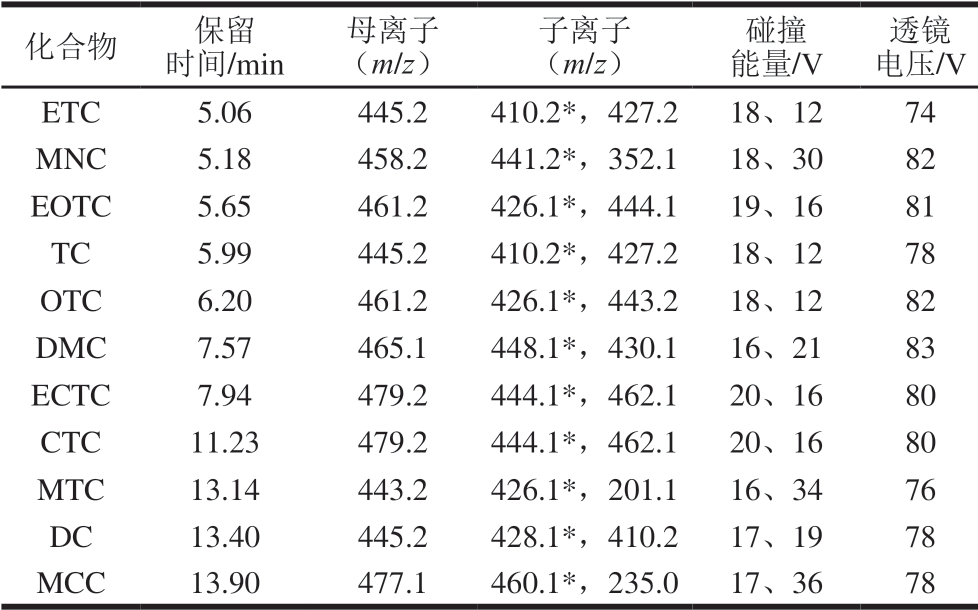
注:*. 定量离子。
化合物 保留时间/min母离子(m/z)子离子(m/z)碰撞能量/V透镜电压/V ETC 5.06 445.2 410.2*,427.2 18、12 74 MNC 5.18 458.2 441.2*,352.1 18、30 82 EOTC 5.65 461.2 426.1*,444.1 19、16 81 TC 5.99 445.2 410.2*,427.2 18、12 78 OTC 6.20 461.2 426.1*,443.2 18、12 82 DMC 7.57 465.1 448.1*,430.1 16、21 83 ECTC 7.94 479.2 444.1*,462.1 20、16 80 CTC 11.23 479.2 444.1*,462.1 20、16 80 MTC 13.14 443.2 426.1*,201.1 16、34 76 DC 13.40 445.2 428.1*,410.2 17、19 78 MCC 13.90 477.1 460.1*,235.0 17、36 78
1.3.5 结果计算
样品中TCs药物的含量按下式计算。
式中:X为样品中TCs药物含量/(μg/kg);ρ为样品溶液中TCs药物质量浓度/(μg/mL);V为样品溶液体积/mL;m为样品质量/kg。
1.4 数据处理
用Xcalibur软件进行色谱图采集及数据处理,用Excel 2016软件绘制柱状图。
2 结果与分析
2.1 仪器条件的优化
2.1.1 流动相优化
本研究分别以乙腈和甲醇作为有机相,考察在水相中添加体积分数0.1%甲酸、5 mmol/L NH4OAc、5 mmol/L NH4OAc(含体积分数0.1%甲酸)对色谱分离和质谱灵敏度的影响。结果表明:添加NH4OAc时11种TCs化合物的色谱峰拖尾严重(图1),这是由于NH4OAc不能完全阻断TCs化合物与色谱柱硅羟基的相互作用;仅添加甲酸,各化合物离子化效率更高,拖尾现象明显改善,灵敏度普遍较好;OTC和EOTC、TC和ETC、CTC和ECTC,这3 组差向异构体具有相同的准分子离子,m/z分别为461.2、445.2、479.2,要通过保留时间差异来区分,有机相选用乙腈和甲醇,都能将CTC和ECTC分离,但是,OTC和EOTC、TC和ETC 2 组差向异构体在有机相为乙腈的条件下,色谱峰形展宽,无法实现基线分离,不能对其准确定量,选用甲醇作为流动相的有机相时,色谱峰形尖锐,分离度和重复性更好。因此,本研究最终采用0.1%甲酸水溶液-甲醇作为流动相。ESI+模式下各化合物的选择离子色谱图见图2

图1 11种TCs兽药的总离子色谱图
Fig. 1 Total ion chromatograms of mixture of 11 tetracyclines


图2 11种TCs兽药混合标准溶液(50 μg/L)的选择离子色谱图
Fig. 2 Chromatograms of mixed standard solution of 11 tetracyclines(50 μg/L) in SRM mode
2.1.2 质谱条件优化
配制质量浓度为1 μg/mL的单标溶液,以流动注射的方式,在5 μL/min流速下,用ESI源分别进行正离子和负离子全扫描,所有TCs化合物响应最佳的准分子离子峰均在正离子模式下获得,均为[M+H]+;将其作为母离子进行二级质谱扫描,得到各化合物的碎片离子,根据欧盟决议有关质谱分析方法不得少于4 分的规定,选取丰度较强、信噪比较高的2 对子离子为特征离子,其中丰度相对较强的为定量离子,其次为定性离子;进一步优化碰撞能量和透镜电压。
设置六通阀,使初始色谱柱流出液切换至废液,从4 min开始切换至质谱采集数据,15 min后结束采集,切出质谱仪,确保大部分极性较强和极性较弱的杂质在4 min之前和15 min之后被洗脱在质谱仪之外,减轻对质谱仪的污染。
2.2 样品前处理条件的优化
2.2.1 提取剂的选择
水产品样品质地黏稠,绞碎后不容易分散,采用匀浆机分散样品,易出现部分样品附着在匀浆机捣杆上,造成待测化合物损失。本研究涉及的11种TCs化合物易与多价阳离子形成不溶性螯合物。EDTA是一个具有六齿配体的良好配合剂,可竞争配合基质中存在的大多数多价阳离子,使TCs化合物游离出来。实验发现,先加入Na2EDTA-McIIvaine缓冲溶液,既有利于分散样品,增加有机提取剂与样品的接触面积,又能够避免TCs化合物与多价阳离子发生反应。因此,在提取样品时应预先加入少量Na2EDTA-McIIvaine缓冲溶液,再加入适量有机提取剂。
水产品肌肉组织的主要基质干扰物是脂肪、蛋白质和少量色素。TCs化合物极性较强,选择极性溶剂作为提取剂,既可以保证提取效率,同时又尽可能地去除了基质中的干扰物。乙腈和甲醇均具有良好的沉淀蛋白质及提取TCs化合物的能力,然而用甲醇提取会带入更多的极性基质干扰物,增加后续净化难度,因此选择乙腈作为提取溶剂。
TCs化合物具有共同的氢化骈四苯母核,是两性物质,在碱性溶液中易降解,在酸性溶液中较稳定。乙腈中加入适量甲酸或乙酸,可维持TCs化合物的稳定性,但是随着pH值的不同会发生差向异构化和降解等反应,当pH<2时易发生消去反应生成脱水物,因此,本研究选择酸性相对较弱的乙酸。进一步对乙腈中乙酸的添加比例进行研究,发现体积分数1%乙酸乙腈的平均回收率高于2%乙酸乙腈与0.5%乙酸乙腈;1%乙酸乙腈pH值约4.0,而0.5%乙酸乙腈pH值约4.6,2%乙酸乙腈pH值约3.5,pH值太高或太低都会影响回收率。
本研究还比较了Na2EDTA-McIIvaine缓冲溶液与1%乙酸乙腈体积比分别为1∶15、2∶15、3∶15和4∶15时的提取效率,发现体积比为1∶15时,样品分散效果不好,且不能完全阻止TCs化合物发生螯合反应,大多数化合物回收率不足80%,体积比为2∶15和3∶15时,样品分散效果良好,CTC回收率分别为79.4%和77.1%,其余化合物回收率为80.5%~91.5%。随着水相含量增加,后续脱水剂用量加大,体积比为4∶15时,无水Na2SO4用量将不少于20 g,回收率也明显下降。因此,最终选择2 mL Na2EDTA-McIIvaine缓冲溶液和15 mL 1%乙酸乙腈作为提取溶剂。不同体积比的提取溶剂对11种TCs兽药回收率的影响见图3。

图3 11种TCs兽药在不同提取溶剂下的回收率
Fig. 3 Recoveries of 11 tetracyclines using different solvents
2.2.2 盐析剂和脱水剂的选择
乙腈与水互溶,蒸发浓缩难度大,因此在浓缩前应加入适量盐,诱导乙腈产生相分离,促使水相中的TCs化合物在相分离过程中被萃取到乙腈相。由于多价阳离子与TCs化合物存在螯合反应,本研究避开多价阳离子盐,选择NaCl与NaOAc 2种钠盐作为盐析剂,考察二者添加量分别为0.1、0.2、0.3、0.4、0.5 g时的盐析效果。结果表明,向提取溶剂中加入0.5 g钠盐即可诱导两相分离;NaCl作为盐析剂,TCs化合物的平均回收率为80%,NaOAc作为盐析剂会不同程度地降低TCs化合物的回收率,平均回收率降低至69%,这可能与NaOAc溶解后会改变溶液的pH值有关。进一步比较商用净化包常用的脱水剂无水MgSO4和无水Na2SO4的影响,当选用无水MgSO4作为脱水剂时,平均回收率仅为23%,可能与TCs化合物易与Mg2+形成螯合物,发生沉淀有关;另一个原因是TCs化合物热稳定性较差,无水MgSO4吸水瞬间释放大量热量,使溶液温度升高,导致化合物结构发生变化,无水Na2SO4则没有放热现象,平均回收率明显大于无水MgSO4。因此,无水Na2SO4更适合用作TCs残留检测的脱水剂。对比无水Na2SO4添加量为3、5、8、10、13 g的脱水效果,由于水产品本身含水量较高,当无水Na2SO4添加量小于8 g时,水层并未被完全吸收,添加量8 g基本将水层吸收,考虑到乙腈层中也含有少量水,添加10 g脱水剂,11种TCs化合物的回收率良好。故本研究选用0.5 g NaCl作为盐析剂,10 g无水Na2SO4作为脱水剂。
2.2.3 净化吸附剂的选择
样品经过提取,已经去除了绝大部分干扰物,但仍可能存在少量脂肪和色素等杂质,为了进一步提高净化效率,减少上机分析的基质效应,本研究采用分散固相萃取的净化方式,比较C18、PSA、NH2和GCB 4种吸附剂的净化效果。前3种均以硅胶为基质,分别键合C18、PSA和氨丙基。实验结果表明,GCB脱色效果最好,同时也吸附待测化合物,导致TCs化合物基本无回收;NH2净化样品在最终复溶过微孔滤膜后依然浑浊,上机分析会堵塞管路,污染仪器;PSA和C18净化效果良好,比较二者的回收率发现,使用PSA处理时的回收率仅为63%左右,使用C18处理时的回收率可提高到80%以上,原因是C18主要吸附油脂和弱极性、非极性物质,对待测化合物无明显吸附。故选择C18作为吸附剂。进一步比较C18用量为100、200、400、600 mg时对TCs化合物回收率的影响,结果表明,100 mg添加量的净化效果不佳,过量使用会吸附部分待测化合物,导致回收率降低,当C18用量为200 mg时,可获得满意的净化效果和回收率,见图4。
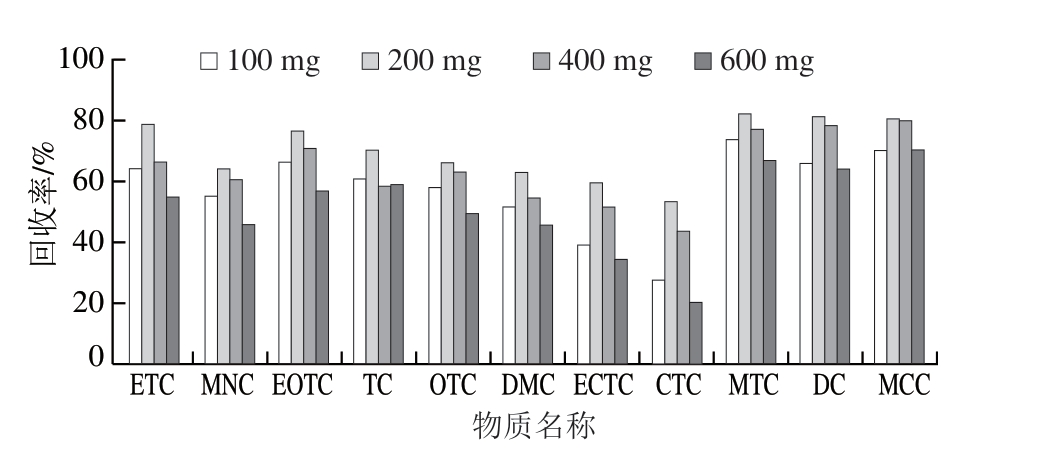
图4 11种TCs兽药在不同C18吸附剂用量下的回收率
Fig. 4 Recoveries of 11 tetracyclines using different C18 sorbents
2.3 方法学评价
2.3.1 线性关系、检出限与定量限
按1.3.1节的方法配制10 个质量浓度水平的工作液进行标准工作曲线的制作。在选定的色谱条件和质谱参数下进行检测,以目标化合物定量离子的峰面积(y)为纵坐标,质量浓度(x,μg/L)为横坐标绘制工作曲线,得到线性回归方程。
表2 11种TCs兽药的线性范围、相关系数、检出限、定量限、加标回收率和相对标准偏差(n=6)
Table 2 Linear ranges, correlation coefficients (r), LODs, LOQs,spiked recoveries and RSDs of 11 tetracyclines (n= 6)

注:LOQ. 定量限(limits of quantification);RSD. 相对标准偏差(relative standard deviation)。
化合物 线性范围/(μg/L)相关系数(r)检出限/(μg/kg)LOQ/(μg/kg)加标量LOQ 加标量2 倍LOQ 加标量5 倍LOQ回收率/% RSD/% 回收率/% RSD/% 回收率/% RSD/%ETC 5~800 0.9994 3.0 10 77.2 5.4 81.6 5.1 82.6 5.7 MNC 10~800 0.9990 5.9 20 75.2 8.7 78.3 8.2 83.3 7.3 EOTC 5~800 0.9996 3.1 10 74.5 4.9 80.2 4.5 87.2 5.0 TC 5~800 0.9997 3.0 10 70.3 4.1 83.1 4.1 85.6 5.3 OTC 5~800 0.9994 3.1 10 78.4 5.0 84.9 4.7 86.8 4.4 DMC 10~800 0.9989 6.0 20 68.9 7.5 75.7 8.0 80.1 6.5 ECTC 10~800 0.9987 6.0 20 61.4 10.6 73.6 10.3 76.9 9.6 CTC 10~800 0.9986 6.1 20 58.7 11.2 64.8 9.4 73.5 8.3 MTC 5~800 0.9993 2.9 10 87.5 5.2 83.4 3.9 90.7 3.8 DC 5~800 0.9995 3.0 10 83.1 4.8 87.3 4.5 88.0 4.0 MCC 5~800 0.9992 3.0 10 85.6 5.9 85.4 4.8 91.4 3.2
由表2可知,MNC、DMC、CTC和ECTC的线性范围为10~800 μg/L,其余化合物的线性范围为5~800 μg/L,相关系数为0.9986~0.9997,表明各化合物在相应的质量浓度范围内线性关系良好。以定量离子信噪比(RS/N)=3为样品的检出限(limits of detection,LOD),RS/N=10为LOQ,11种兽药的LOD为2.9~6.1 μg/kg,LOQ为10~20 μg/kg,能够满足中国、日本、欧盟的食品安全标准要求。
2.3.2 回收率与精密度
在水产品空白样品中添加11种兽药混合标准溶液,制备兽药含量分别为1 倍、2 倍和5 倍LOQ水平的加标样品,按上述前处理方法及测定条件进行回收率实验,每个浓度水平做6 次平行测定,以标准曲线定量。由表2可知,在LOQ添加水平下各化合物的响应良好,在2 倍和5 倍LOQ添加水平下,平均回收率普遍大于80%,RSD为3.2%~10.3%,表明该方法有良好的重复性,符合多残留分析的要求。
2.4 实际样品测定
将本研究建立的方法应用于检测水产品中TCs药物的残留量。采集养殖场的对虾、大黄鱼、鲤鱼、鲈鱼、大菱鲆、乌鳢、梭子蟹、扇贝养殖品种共84 个进行检测,同时检测质控样品。检测结果显示,质控样品回收率满足分析要求;实际样品中,2 份样品中检出MTC,残留量分别为3.73、1.89 μg/kg,1 份样品检出MCC,残留量为2.06 μg/kg,其含量均低于方法定量限,其他样品均未检出TCs兽药。
3 结 论
本研究解决了新型TCs药物、常规TCs药物及其代谢物由于结构相似、易相互转化导致的较难进行色谱分离、较难同时定性定量分析的难题,建立了水产品中11种TCs药物的分散固相萃取净化-液相色谱-串联质谱定量分析方法。分别对提取溶剂、盐析剂、脱水剂、吸附剂的选择与用量等样品前处理条件、液相色谱条件和质谱条件进行优化,采用改进的分散固相萃取方法处理样品,发挥其快速、简便、高通量的优势,与国标方法和现有文献方法相比,该方法增加了待检药物的数量,缩短了检测周期,节约了检测成本。建立的方法操作简便、快速、净化效果好,灵敏度、准确度和精密度均符合多残留检测技术的要求,为各食品检测机构提供了准确的定性和定量分析方法,有助于食品检测机构应对大批量的水产品样品TCs兽药残留的日常监控。
[1]KAYAAHMET F, COSKUN Y, ERARSLAN E, et al. Extensive esophageal damage resembling carcinoma due to tetracycline intake[J].Endoscopy, 2013, 45(Suppl 2): 258. DOI:10.1055/s-0033-1344560.
[2]MORFINOTERO R, MICHAEL J, DOWZICKY M S. Changes in MIC within a global collection of Acinetobacter baumannii collected as part of the tigecycline evaluation and surveillance trial, 2004 to 2009[J]. Clinical Therapeutics, 2012, 34(1): 101-112. DOI:10.1016/j.clinthera.2011.11.028.
[3]孙晓杰, 李兆新, 董晓, 等. SPE-LC-MS/MS检测不同水产品组织中四环素类药物残留的方法研究[J]. 中国渔业质量与标准, 2017,7(3): 44-51. DOI:10.3969/j.issn.2095-1833.2017.03.007.
[4]ZHENG Wenli, ZHANG Lifang, ZHANG Keyu, et al. Determination of tetracyclines and their epimers in agricultural soil fertilized with swine manure by ultra-high-performance liquid chromatography tandem mass spectrometry[J]. Journal of Integrative Agriculture, 2012,11(7): 1189-1198. DOI:10.1016/S2095-3119(12)60114-2.
[5]刘蓉蓉, 吴黎明, 周金慧, 等. 液相色谱-串联质谱法同时测定蜂蜜中4种四环素族抗生素及其3种差向异构体[J]. 食品科学, 2011,32(10): 232-236.
[6]SILVA M D, SALGADO L R N, HERIDA L. Methacycline: a review of analytical methods[J]. Current Pharmaceutical Analysis, 2012, 8(1):2-13. DOI:10.2174/157341212798995494.
[7]顾云, 曹晓云. 薄层色谱法鉴别土霉素的方法改进[J]. 天津药学,2015, 27(1): 12-14.
[8]钱英. 薄层色谱法测家禽肌肉组织中的四环素和土霉素[J]. 职业与健康, 2000(12): 37. DOI:10.13329/j.cnki.zyyjk.2000.12.034.
[9]BAGHANI A, MESDAGHINIA A, RAFIEIYAN M, et al.Tetracycline and ciprofloxacin multiresidues in beef and chicken meat samples using indirect competitive ELISA[J]. Journal of Immunoassay and Immunochemistry, 2019, 40(3): 328-342. DOI:10.1080/15321819.2019.1597735.
[10]BARANI A, FALLAH A A. Occurrence of tetracyclines,sulfonamides, fluoroquinolones and florfenicol in farmed rainbow trout in Iran[J]. Food and Agricultural Immunology, 2015, 26(3):420-429. DOI:10.1080/09540105.2014.950199.
[11]栾军, 王毅谦, 龙云凤, 等. 竞争化学发光酶免疫检测动物源性食品中四环素残留[J]. 食品工业科技, 2020, 41(4): 179-183.DOI:10.13386/j.issn1002-0306.2020.04.030.
[12]P R Z E N I O S T O S I W C Z Y N S K A M, P A T Y R A E,CHYTELPURCHATA M, et al. Occurrence of tetracyclines in feedingstuffs: results of a two-year study within the official control of feed[J]. Bulletin of the Veterinary Institute in Pulawy, 2016, 59(4):527-532. DOI:10.1515/bvip-2015-0079.
[13] 吴芹, 王玉莲, 袁宗辉. 动物源性食品中抗菌药残留的微生物学检测技术研究进展[J]. 中国畜牧兽医, 2017, 44(11): 3340-3350.DOI:10.16431/j.cnki.1671-7236.2017.11.033.
[14]范维, 高晓月, 李贺楠, 等. 高通量微生物显色法快速检测动物源性食品中抗生素残留[J]. 食品科学, 2017, 38(16): 239-244.DOI:10.7506/spkx1002-6630-201716038.
[15]孙雪梅. 环境水样中四环素的电化学分析方法研究[D]. 成都: 成都理工大学, 2017: 11-15.
[16]赵常志, 陶晟辰, 李莹, 等. 流动注射电化学发光分析法测定土霉素[J].辽宁师范大学学报(自然科学版), 2008, 31(4): 457-459.
[17]吴学贵, 王一晨, 黄肖凤, 等. 高效液相色谱法和高效液相色谱-串联质谱法测定水产品中的四环素类残留量[J]. 食品安全质量检测学报, 2020, 11(22): 8334-8340. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.22.035.
[18]余佩瑶, 陈传胜, 刘寒冰, 等. 固相萃取-高效液相色谱法同时测定鸡粪中四环素类、喹诺酮类和磺胺类抗生素[J]. 色谱, 2019, 37(5):518-524. DOI:10.3724/SP.J.1123.2018.11006.
[19] PHIROONSOONTORN N, SANSUK S, SANTALADCHAIYAKIT Y,et al. The use of dissolvable layered double hydroxide components in an in situ solid-phase extraction for chromatographic determination of tetracyclines in water and milk samples[J]. Journal of Chromatography A,2017, 1519: 38-44. DOI:10.1016/j.chroma.2017.09.005.
[20]王飞, 宓捷波, 李淑静, 等. 改良的QuEChERS样本前处理/高效液相色谱-串联质谱法检测猪肉中四环素类兽药的残留[J]. 分析测试学报, 2017, 36(2): 272-275. DOI:10.3969/j.issn.1004-4957.2017.02.021.
[21] 王浩, 赵丽, 杨红梅, 等. 液相色谱-串联质谱法测定牛奶中35种四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类抗生素残留[J].色谱, 2015, 33(9): 995-1001. DOI:10.3724/SP.J.1123.2015.04046.
[22]王志昱, 张桂芳, 张晓瑜, 等. QuEChERS-高效液相色谱-质谱联用法同时检测鸡胗和鸡肝中15种喹诺酮类和四环素类抗生素[J]. 肉类研究, 2020, 34(3): 51-57. DOI:10.7506/rlyj1001-8123-20200131-023.
[23]WU Xiajun, WANG Gengnan, YANG Kun, et al. Determination of tetracyclines in milk by graphene-based solid-phase extraction and high-performance liquid chromatography[J]. Analytical Letters, 2017,50(4): 641-650. DOI:10.1080/00032719.2016.1194853.
[24]范露, 靖涵之. 高效液相色谱法测定猪肉中土霉素、四环素和金霉素[J]. 中国食品添加剂, 2019, 30(3): 162-168. DOI:10.3969/j.issn.1006-2513.2019.03.018.
[25]王燕. 高效液相色谱法测定水产品中四环素类抗生素残留的分析[J].世界最新医学信息文摘, 2019, 19(23): 159-160.
[26]CHU P S, LOPEZ M, SERFLING S. Determination of 17 alphamethyltestosterone in muscle tissues of tilapia, rainbow trout, and salmon using liquid chromatography-tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2006, 54(9): 3193-3198.DOI:10.1021/jf052701r.
[27] SALEH S M K, MUSSAED A M, AIHARIRI F M. Determination of tetracycline and oxytetracycline residues in honey by high performance liquid chromatography[J]. Journal of Agricultural Science and Technology B, 2016, 6(2): 135-139. DOI:10.17265/2161-6264/2016.02.009.
[28]黄鸾玉, 杨姝丽, 吴祥庆, 等. 高效液相色谱法测定水产品中土霉素的残留量[J]. 理化检验(化学分册), 2018, 54(11): 1355-1358.
[29]夏洁贞, 区敏霞. 高效液相色谱法测定鸡肉中土霉素、四环素、金霉素和强力霉素残留量的方法优化探讨[J]. 现代食品, 2018(12):108-111. DOI:10.16736/j.cnki.cn41-1434/ts.2018.12.035.
[30] SOLLIEC M, ROYLACHAPELLE A, SAUVE S. Quantitative performance of liquid chromatography coupled to Q-exactive high resolution mass spectrometry (HRMS) for the analysis of tetracyclines in a complex matrix[J]. Analytica Chimica Acta, 2015, 853: 415-424.DOI:10.1016/j.aca.2014.10.037.
[31] SAKSIT S, SARANYA P, CHANAT C, et al. Multiclass analysis of antimicrobial drugs in shrimp muscle by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food and Drug Analysis, 2019, 27(1): 118-134. DOI:10.1016/j.jfda.2018.06.003.