宁夏盐池滩羊肉因风味独特、肉质鲜美、无膻味、脂肪含量较低且富含大量矿物质元素,受到广大消费者喜爱和追捧[1-3],宁夏盐池滩羊是西北地区特色畜种,繁殖快且具有较高产肉性能,为当地养殖户带来较高的经济效益[4-5]。然而目前消费市场中存在宁夏滩羊肉掺假的现象,如宁夏滩羊肉中掺入一定比例的其他畜禽肉,如鸡肉、猪肉、鸭肉等,或直接将其他畜禽肉用羊肉香精处理后充当宁夏滩羊肉进行销售。因此,准确并快速识别宁夏滩羊肉掺假具有重要意义。
鉴别畜产品掺假的常规方法主要有理化分析法[6-7]、气相色谱(gas chromatography,GC)法[8-10]、微生物法[11-13]和液相色谱法[14-16]、聚合酶链式反应法[17-18]、GC-质谱(GC-mass spectrometry,GC-MS)法等。这些常规检测方法虽严谨科学,但费时耗力、操作繁琐,且结果具有滞后性;感官评价的结果受主观因素影响明显,准确性低[19]。近些年,随着科技不断发展,涌现出较多快速检测方法,如近红外光谱法[20-21]、酶联免疫吸附法[22-23]、电子鼻法。新型快速检测方法具有无损、准确、操作简便等优势,已在畜产品掺假中得到应用。陈迎丽等[24]采用近红外光谱技术结合欧氏距离法或因子化法建立牛肉中掺入猪肉和鸡肉的快速、准确测定方法。王綪等[25]采用电子鼻和GC-MS法对宁夏小尾寒羊肉中掺假鸭肉进行检测,采用Fisher线性判别分析能区分不同样品,线性回归拟合分析相关系数高达0.965。
本研究利用GC-离子迁移色谱(GC-ion mobility spectrometry,GC-IMS)技术结合电子鼻进行检测,GC-IMS是一种新兴的快速检测方法,具有灵敏、无需前处理、操作简单的优点[26-28]。孟新涛等[29]采用GC-IMS技术较好区分羊肉中不同掺假比例(≤40%)猪肉和鸡肉。目前采用GC-IMS技术检测宁夏滩羊肉中掺杂的鸭肉相关研究还很少。
本研究以宁夏滩羊肉为研究对象,按照不同比例将鸭肉掺入滩羊肉中,利用GC-IMS和电子鼻技术采集掺假肉的气味图谱,后分别采用线性判别分析(linear discriminant analysis,LDA)、主成分分析(principal component analysis,PCA)和匹配矩阵对掺假滩羊肉进行区分,并以可视化的形式展示不同比例掺假滩羊肉的特征挥发性成分,旨在为宁夏滩羊肉及其掺假肉气味研究及快速判别提供数据支持。
1 材料与方法
1.1 材料
宁夏滩羊后腿肉和平谷鸭肉购自济南某大型购物中心,贮藏于0 ℃冰箱。用组织搅碎机将滩羊肉和鸭肉分别搅碎后待用。按照不同比例:滩羊肉、鸭肉质量比100∶0(CK组)、90∶10(A组)、80∶20(B组)、70∶30(C组)、60∶40(D组)、50∶50(E组)、0∶100(F组),将鸭肉分别加入到滩羊肉中搅拌均匀,放入自封袋中制备成掺假肉。
1.2 仪器与设备
F O X 4000 电子鼻 法国阿尔法莫斯公司;MS3 digital涡旋混匀器 德国艾卡设备有限公司;FlavourSpec1H1-00053 GC-IMS联用仪 德国G.A.S.公司;CTC-PAL自动进样装置 瑞士CTC Analytics AG公司;CLOT毛细管柱(30 mm×0.25 mm,0.50 μm)德国CS-Chromatographie Service GmbH公司。
1.3 方法
1.3.1 顶空GC-IMS测定条件及检测方法
GC-IMS单元参数:分析时间20 min,色谱柱类型FS-SE-54-CB-1(15 m,ID:0.53 mm),柱温60 ℃,载气/漂移气N2,IMS温度45 ℃。
自动顶空进样单元参数:进样体积500 μL,孵育时间10 min,孵育温度60 ℃,进样针温度65 ℃,孵化转速500 r/min。
顶空GC-IMS检测方法:取3.0 g样品,放入20 mL顶空进样瓶中,60 ℃孵化20 min,经顶空进样用FlavourSpec®风味分析仪进行测试,软件内置的NIST数据库和IMS数据库可对物质进行定性分析并可给出样品中挥发性有机物的差异谱图。
1.3.2 电子鼻检测
电子鼻测定参数:采集时间120 s,数据采集周期1.0 s,数据采集延迟600 s,流速150 mL/min,进样量1000 μL,注射速率1000 μL/s,孵化期480 s,孵化温度40 ℃,清洗时间120 s,注射器温度50 ℃,填充速率500μL/s。
采用LDA对样品进行分析,去除样品中差异较大的个体。FOX4000电子鼻由18 个传感器组成,各传感器响应特性见表1。
表1 FOX4000电子鼻各传感器响应特性
Table 1 Response characteristics of FOX4000 E-nose sensors

序号 传感器名称 传感器响应特性1 LY2/LG 对氧化能力较强的气体灵敏2 LY2/G 对有毒气体灵敏3 LY2/AA 对有机化合物灵敏4 LY2/GH 对有毒气体灵敏5 LY2/gCTL 对有毒气体灵敏6 LY2/gCT 对易燃气体灵敏7 T30/1 对有机化合物灵敏8 P10/1 对可燃气体灵敏9 P10/2 对易燃气体灵敏10 P40/1 对氧化能力较强的气体灵敏11 T70/2 对芳香族化合物灵敏12 PA/2 对有机化合物、有毒气体灵敏13 P30/1 对可燃气体、有机化合物灵敏14 P40/2 对氧化能力较强的气体灵敏15 P30/2 对有机化合物灵敏16 T40/2 对氧化能力较强的气体灵敏17 T40/1 对氧化能力较强的气体灵敏18 TA/2 对有机化合物灵敏
1.4 数据处理
采用SPSS 23.0软件进行数据分析;运用PCA、LDA对数据进行处理,Origin pro 2016软件进行绘图,二维可视化软件为LAV 2.0(G.A.S. Inc.)。
2 结果与分析
2.1 顶空GC-IMS技术分析结果
2.1.1 顶空GC-IMS图谱
由图1可知,纯滩羊肉中挥发性物质少于纯鸭肉,随着鸭肉掺入量增多,样品中挥发性物质也在增加。

图1 掺假宁夏滩羊肉的GC-IMS谱图
Fig. 1 GC-IMS topographic plots of adulterated Ningxia Tan sheep meat
由图2可知,根据各组间差异,将7 组肉样的挥发性有机物图谱大致划分成A、B、C、D、E 5 个不同区域,更易于区分各组间差异。纯滩羊肉和纯鸭肉所含挥发性物质中既有共同挥发性物质,又有自身特异性物质,且纯鸭肉所含挥发性物质种类明显多于纯滩羊肉。
C区域为纯滩羊肉和纯鸭肉均含有的乙醇、丙酮、2-丙醇及2-丁酮等挥发性物质,A区域为纯滩羊肉特有挥发性物质,如苯甲醛、3-甲硫基丙醛、癸醛等,D区域为纯鸭肉特有挥发性物质,如丁醛、E-2-辛烯醛、E-2-庚烯醛等。
在纯滩羊肉中,E区域的挥发性物质,如苯甲醛、甲硫基丙醛、癸醛、2-戊酮、乙偶姻等,伴随着掺入鸭肉比例的增加,含量逐渐降低;B区域的物质在纯鸭肉中含量较高,纯滩羊肉中含量很少,而随着掺入鸭肉比例的增加,其含量呈现逐渐增加的趋势,这些成分主要为壬醛、辛醛、庚醛、己醛、丁醛、E-2-辛烯醛、E-2-庚烯醛、乙醛、3-辛醇、1-辛烯-3-醇、1-己醇、1-戊醇、1-丁醇、2-丙醇、2-庚酮、环己酮、6-甲基-5-庚烯-2-酮、乙酸丙酯、乙酸乙酯及2-戊基呋喃等。

图2 掺假宁夏滩羊肉中挥发性风味物质图谱
Fig. 2 Spectrums of volatile organic components of adulterated Ningxia Tan sheep meat
2.1.2 掺假宁夏滩羊肉的相似度分析
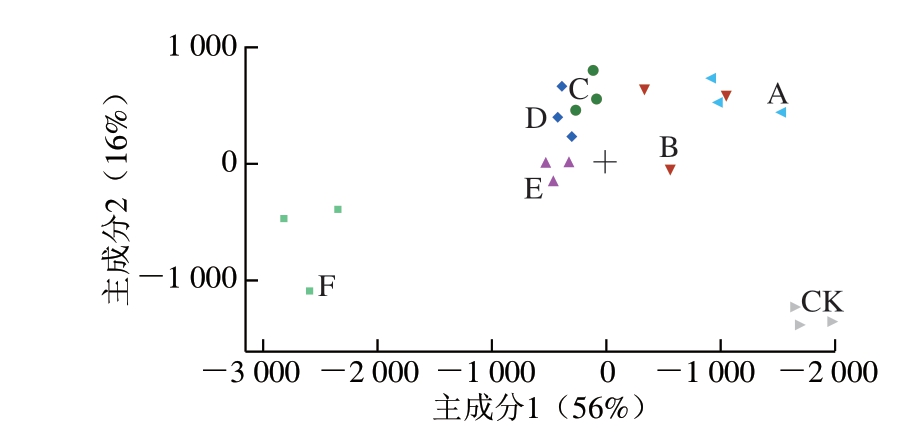
图3 掺假宁夏滩羊肉的PCA图
Fig. 3 PCA plot of adulterated Ningxia Tan sheep meat
PCA是通过降维方式将多个指标转换成少数几项具有代表性的综合指标的一种多元统计分析方法[30]。由图3可知,纯滩羊肉和纯鸭肉样品差异显著,A、B组有重叠部分,C、D组距离相近,说明2 组掺假比例相近,区分不明显。A~E组样品处于纯滩羊肉与纯鸭肉之间,随着鸭肉掺入比例的增加,各组样品逐渐从接近滩羊肉变为向纯鸭肉靠拢。
图4为掺假肉样匹配矩阵图,采用圆心面积大小及颜色深浅表示2 组样品间相似程度,圆心面积越大,颜色越深,表示2 组越相似;反之,圆心面积越小,颜色越浅,表示2 组相似度较低,差异明显。由图4可知,CK组与F组差异明显,说明纯滩羊肉与纯鸭肉所含挥发性物质差异明显。A、B、C、D、E组与CK、F组差异明显,但相邻2 组,如A和B组、C和D组差异不明显,区分度不高,说明顶空GC-IMS技术对于滩羊肉中掺假比例接近的鸭肉区分度不高,其原因可能为滩羊肉及鸭肉中含有某些挥发性成分含量较高,而顶空GC-IMS仪器的灵敏度较高,致使顶空GC-IMS无法区分相近比例掺假的样品。

图4 掺假宁夏滩羊肉匹配矩阵
Fig. 4 Matching matrix of adulterated Ningxia Tan sheep meat
2.2 电子鼻分析结果

图5 掺假比例50%宁夏滩羊肉的电子鼻传感器信号响应强度
Fig. 5 Sensor single intensity of 50% adulterated Ningxia Tan sheep meat
采集18 个传感器在120 s内响应强度的变化,响应强度大小反映此待测样品中某些挥发性物质在传感器中的响应情况。以掺假50%鸭肉的滩羊肉为例绘制传感器响应图。由图5可知,18 个传感器响应强度在120 s内变化明显。
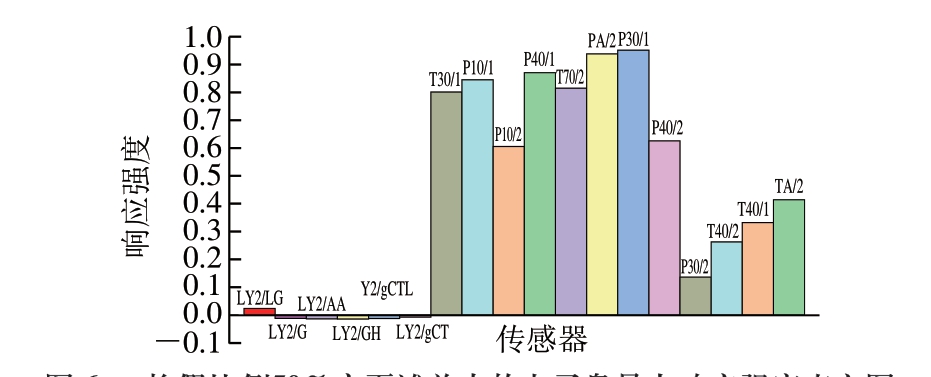
图6 掺假比例50%宁夏滩羊肉的电子鼻最大响应强度直方图
Fig. 6 Maximum response intensity histogram of various E-nose sensors of 50% adulterated Ningxia Tan sheep meat
图6为18 个传感器响应强度最大值的直方图,传感器T30/1、P10/1、P10/2、PA/2、P30/1、P10/1、P40/2、P40/1的响应强度最大值明显高于其他几组传感器,而传感器LY2/LG、LY2/G、LY2/AA、LY2/GH、LY2/gCTL、LY2/gCT的响应强度最大值较小。
表2 各主成分的累计贡献率
Table 2 Cumulative contribution ratios of principal components
主成分 1 2 3 4 5累计贡献率/% 81.03 91.85 97.61 99.03 99.96
采用PCA法对18 个传感器的响应强度进行特征值提取,由表2可知,经PCA分析后得出前5 个主成分的累计贡献率,已经达到99.96%,故选择前5 个主成分作为特征子集对样品进行定性分析。在提取的前5 个主成分中,主成分1和主成分2累计贡献率91.85%,说明这2 个主成分基本可以代表18 个电子鼻传感器检测出的样品所有基本特征信息。
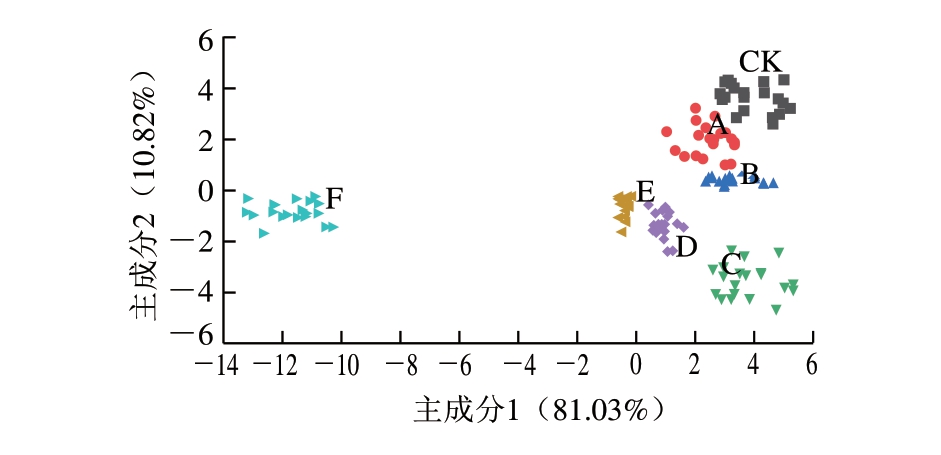
图7 掺假宁夏滩羊肉电子鼻信号强度特征值的LDA结果
Fig. 7 LDA plot of adulterated Ningxia Tan sheep meat
采用LDA对得到的特征值进行分析,由图7可知,除D、E组样品分布区域很接近外,其他样品可以被区分开。随着鸭肉掺假比例的增加,各样品分布区域在第1主成分方向上与CK组样品距离越来越远,呈现规律性分布,因此电子鼻能够更好地区分掺假不同比例鸭肉的滩羊肉,这与王綪等[25]对宁夏小尾寒羊肉中鸭肉掺假的快速检测结果一致。
2.3 多元线性回归拟合分析
以鸭肉掺假比例为因变量,以2.2节采用PCA从18 个电子鼻传感器响应值中提取的2 个主成分的特征值为自变量,随机选取70 个样品(7×10)作为建模集,28 个样品(7×4)为验证集,建立相应回归方程为y=0.3741-0.0510x1-0.0460x2,该回归模型的决定系数R2=0.9671,表明回归拟合度高,说明滩羊肉掺假鸭肉样品实际测定值与预测值拟合良好,建立的回归模型预测可靠程度较高。
3 结 论
采用GC-IMS及电子鼻测定滩羊肉中掺假的鸭肉,无需复杂的前处理,直接加入样品,顶空进样后可快速检测肉样中的挥发性有机组分,通过仪器配备的软件可得到样品的GC-IMS谱图、挥发性有机物的图谱、PCA结果等。采用PCA及相似度分析发现:纯鸭肉与纯滩羊肉样品差异显著,随着鸭肉掺入比例的增加,掺假组逐渐由接近滩羊肉向鸭肉靠拢,但GC-IMS技术对于鸭肉掺入比例相近的组别区分度不明显。对采集的电子鼻数据首先采用PCA进行降维,提取5 个主成分,其中主成分1和主成分2累积贡献率91.85%;后采用LDA进行分类,可较好区分掺假样品。采用多元线性回归分析,以鸭肉掺假比例及电子鼻传感器响应值进行拟合,得到回归方程决定系数为R2=0.9671,拟合度高,实际测定值与预测值具有较好的相关性。本研究结果为宁夏滩羊肉真伪鉴别快速检测及其品质控制提供了新的研究思路和有效的手段。
[1]尚梦玉, 王松磊, 何建国, 等. 基于NIR高光谱技术检测滩羊冷鲜肉颜色[J]. 食品工业, 2018, 39(9): 287-291.
[2]王雪蓉, 罗瑞明, 李亚蕾, 等. 综合肉样及环境矿物质元素信息的滩羊肉产地鉴别[J]. 食品科学, 2020, 41(18): 303-310. DOI:10.7506/spkx1002-6630-20190722-289.
[3]苑昱东, 尤丽琴, 罗瑞明, 等. 基于气相色谱-质谱和液相色谱-质谱技术的冷鲜滩羊肉贮藏中脂肪差异代谢物检测[J]. 食品科学, 2019,40(18): 203-210. DOI:10.7506/spkx1002-6630-20180724-297.
[4]马琴琴, 李铁军, 何流琴, 等. 不同粗饲料组合对宁夏滩羊生长性能、屠宰性能及肉品质的影响[J]. 动物营养学报, 2015, 27(6):1936-1942. DOI:10.3969/j.issn.1006-267x.2015.06.033.
[5]徐薇薇, 姚瑞基, 袁维新, 等. 宁夏滩羊后腿肉营养评价及挥发性风味物质分析[J]. 肉类研究, 2017, 31(10): 51-55. DOI:10.7506/rlyj1001-8123-201710008.
[6]刘友华, 白亚斌, 邱祝福, 等. 基于高光谱图像技术和波长选择方法的羊肉掺假检测方法研究[J]. 海南师范大学学报(自然科学版),2015, 28(3): 265-269. DOI:10.3969/j.issn.1674-4942.2015.03.008.
[7]WU Qiayu, ZHOU Guanghong, YANG Sasa, et al. SNP genotyping in sheep from northwest and east China for meat traceability[J].Journal of Consumer Protection and Food Safety, 2017, 12(2): 1-6.DOI:10.1007/s00003-017-1092-2.
[8]田晓静, 王俊, 崔绍庆. 羊肉纯度电子舌快速检测方法[J].农业工程学报, 2013, 29(20): 255-262. D O I:10.3969/j.issn.1002-6819.2013.20.033.
[9]GUPTA V, CHAKRAVARTI S, CHANDER V, et al. Polymerase spiral reaction (PSR): a novel, visual isothermal amplification method for detection of canine parvovirus 2 genomic DNA[J]. Archives of Virology, 2017, 162(7): 1995-2001. DOI:10.1007/s00705-017-3321-5.
[10]CHO A R, DONG H J, CHO S. Meat species identification using loopmediated isothermal amplification assay targeting species-specific mitochondrial DNA[J]. Korean Journal for Food Science of Animal Resources, 2014, 34(6): 799-807. DOI:10.5851/kosfa.2014.34.6.799.
[11] PAN Xiaodong, CHEN Jiang, CHEN Qing, et al. Authentication of pork in meat mixtures using PRM mass spectrometry of myosin peptides[J]. RSC Advances, 2018, 8(20): 11157-11162. DOI:10.1039/C8RA00926K.
[12]宋宏新, 刘建兰, 徐丹, 等. 羊乳制品中牛乳成分的荧光定量PCR检测方法研究[J]. 食品与发酵工业, 2018, 44(7): 287-291; 303.DOI:10.13995/j.cnki.11-1802/ts.014968.
[13]何鸿举, 朱亚东, 王魏, 等. 基于近红外高光谱成像快速无损检测注胶肉研究[J]. 食品工业科技, 2020, 41(10): 225-229.
[14]李莹莹, 张颖颖, 丁小军, 等. 液相色谱-串联质谱法对羊肉中鸭肉掺假的鉴别[J]. 食品科学, 2016, 37(6): 204-209. DOI:10.7506/spkx1002-6630-201606037.
[15] 古淑青, 詹丽娜, 赵超敏, 等. 基于液相色谱-串联质谱法的肉类特征肽段鉴别及掺假测定[J]. 色谱, 2018, 36(12): 85-94. DOI:10.3724/SP.J.1123.2018.08005.
[16]朱亚东, 何鸿举, 王魏, 等. 高光谱成像技术结合线性回归算法快速预测鸡肉掺假牛肉[J]. 食品工业科技, 2020, 41(4): 190-195.
[17]杨冬燕, 韦梅霞, 杨永存, 等. 多重荧光PCR鉴别羊肉掺假[J]. 食品安全质量检测学报, 2015, 6(2): 555-562.
[18] 杨冬燕, 杨永存, 李浩, 等. 双重PCR鉴别牛、羊肉掺假[J]. 中国卫生检验杂志, 2014, 24(23): 3379-3382.
[19] 郎玉苗, 杨春柳, 李翠, 等. 光谱技术在肉品掺杂掺假鉴别中的应用研究进展[J]. 肉类研究, 2019, 33(2): 72-77. DOI:10.7506/rlyj1001-8123-20181217-231.
[20]ZHANG Liguo, ZHANG Xin, NI Lijun, et al. Rapid identification of adulterated cow milk by non-linear pattern recognition methods based on near infrared spectroscopy[J]. Food Chemistry, 2014, 145: 342-348.DOI:10.1016/j.foodchem.2013.08.064.
[21]SUN Fei, CHEN Yu, WANG Kaiyang, et al. Identification of genuine and adulterated pinellia ternata by mid-infrared (MIR) and nearinfrared (NIR) spectroscopy with partial least squares-discriminant analysis (PLS-DA)[J]. Analytical Letters, 2019, 53(6): 1-23.DOI:10.1080/00032719.2019.1687507.
[22] 任秀, 骆海朋, 崔生辉. 酶联免疫吸附法和D N A 检测法在肉类鉴别中的应用[J]. 中国食品卫生杂志, 2015(1): 93-98.DOI:10.13590/j.cjfh.2015.01.024.
[23]于颖, 徐桂花. 酶联免疫吸附法在肉制品中抗生素检测中的应用[J].肉类研究, 2009, 23(1): 48-51.
[24]陈迎丽, 何钰, 龚会琴, 等. 基于欧式距离法或因子化法的近红外光谱技术对牛肉掺假鉴定的研究[J]. 食品研究与开发, 2019, 40(15):141-146. DOI:10.12161/j.issn.1005-6521.2019.15.023.
[25]王綪, 李璐, 王佳奕, 等. 电子鼻结合气相色谱-质谱法对宁夏小尾寒羊肉中鸭肉掺假的快速检测[J]. 食品科学, 2017, 38(20): 222-228.DOI:10.7506/spkx1002-6630-201720032.
[26] GALLEGOS J, ARCE C, JORDANO R, et al. Target identification of volatile metabolites to allow the differentiation of lactic acid bacteria by gas chromatography-ion mobility spectrometry[J]. Food Chemistry,2017, 220: 362-370. DOI:10.1016/j.foodchem.2016.10.022.
[27] GARRIDO-DELGADO R, DOBAO-PRIETO M D M, ARCE L, et al.Determination of volatile compounds by GC-IMS to assign the quality of virgin olive oil[J]. Food Chemistry, 2015, 187: 572-579.DOI:10.1016/j.foodchem.2015.04.082.
[28]VAUTZ W, FRANZKE J, ZAMPOLLI S, et al. On the potential of ion mobility spectrometry coupled to GC pre-separation: a tutorial[J].Analytica Chimica Acta, 2018, 1024(18): 52-64. DOI:10.1016/j.aca.2018.02.052.
[29] 孟新涛, 张婷, 许铭强, 等. 基于气相离子迁移谱的羊肉掺伪快速鉴别方法[J]. 新疆农业科学, 2019, 56(10): 1939-1947. DOI:10.6048/j.issn.1001-4330.2019.10.020.
[30] GERHARD N, BIRKENMEIER M, SANDERS D, et al. Resolutionoptimized headspace gas chromatography-ion mobility spectrometry(HS-GC-IMS) for non-targeted olive oil profiling[J]. Analytical and Bioanalytical Chemistry, 2017, 409(16): 3933-3942. DOI:10.1007/s00216-017-0338-2.