新鲜牛皮是指从动物身上剥下,没有经过任何化学处理和机械加工的生牛皮。一般新鲜牛皮的主要成分随着动物种类、年龄、性别、生活环境的不同而略有变化[1]。我国是牛肉生产大国,也是牛皮生产大国,以皮为原料的产品制备工艺、产品质量、口感、特性等均与原料皮的形态、结构、特性密切相关,然而从目前的形势来看,由于我国牛皮皮质较差,屠宰场常以200~500 元/张的价格转售其他企业,未来的牛皮进口关税调减,会造成牛皮进口量增加,对我国牛皮行业造成较大冲击[2]。为了提高牛肉加工副产物的利用率,提高向农业方向的转变效率,将牛皮作为食品开发是优选之路,而国内外对于牛皮食用品质的研究几乎没有。煮制是牛皮可以作为食品原料的最基础的加工方法,因此,牛皮加热过程中的食用加工品质变化规律有相当大的研究价值。
肉品质包括外观、食用和营养品质,肉牛品质又受屠宰质量、品种、年龄、成熟度等因素影响[3-4],其中品种是重要的影响因素[5],如今市场上已有很多以牛皮作为原材料的加工产品。欧阳平一等[6]以带皮牛肉作为原料,选择2因素3水平的正交试验优化带皮牛肉嫩化工艺,结果表明,木瓜蛋白酶可以使带皮牛肉的口感更佳。黎英等[7]也运用Box-Behnken组合设计优化泡椒牛皮的泡制工艺参数。李敬[8]基于M值法等方法初步构建泡椒牛皮感官评价的指标体系。除此之外,目前牛皮作为功能性食品或深加工原料也有所加工和利用[9]。但国内外目前对牛皮食用品质进行系统研究的实验较少。
胶原蛋白是多细胞生物中含量最丰富、分布最广泛的蛋白质之一。在生物体内,胶原蛋白与聚多糖等成分一起形成精密、有序的细胞间网络结构,对机体细胞的发育、迁移以及机体组织的形成和功能发挥等均有重要作用[10]。胶原蛋白有很强的生物力学功能,在截留、贮存、运输及细胞信号转导等方面有重要作用[11],在众多领域有所应用[12]。目前,国内外对于不同品种牛皮中提取的胶原蛋白结构差异性对比研究还很少。
西门塔尔牛肉用价值高、产量高、出栏量大,是一种常见的肉乳两用牛,牛皮品质相对较高,因此是我国最常见的肉用牛种[13-14]。安格斯牛肉用性能良好,是专门化肉用牛中肉质最佳的品种,也是唯一用品种名称作为肉品牌名称的肉牛品种[15],但牛皮品质相对较差,出售价格也相对较低。而牦牛[16]是除人类以外生活在海拔最高处的哺乳类动物,牦牛同北极熊、南极企鹅共同被列为世界未被污染的三大品种动物。牦牛特殊的生长环境使其食用品质和营养价值特异性明显,如果能合理利用牦牛皮蛋白,其将是一大潜在资源[16],但是牦牛皮的出售价格大幅低于前二者,有些牦牛皮甚至当废物丢弃,污染环境。本研究选择国内具有代表性的3种牛(西门塔尔牛、安格斯牛、牦牛)的牛皮作为原材料,借鉴肉品质的研究方法,适当加以改进,对不同品种牛皮的食用品质以及从中分别提取的胶原蛋白的显微结构进行初步研究。
1 材料与方法
1.1 材料与试剂
选择健康无病、年龄2~3 岁的阉牛,采用击晕处死放血,再迅速剥下整张牛皮。实验原料分别来自内蒙古额尔敦羊业股份有限公司生产的安格斯牛牛皮、青海夏华清真肉食品有限公司生产的牦牛牛皮和河北燕城食品有限公司生产的西门塔尔牛牛皮。
氢氧化钠、盐酸、硫酸 国药集团化学试剂(北京)有限公司;五水合硫酸铜 上海阿拉丁生化科技股份有限公司;硫酸钾、甲基红指示剂、溴甲基酚绿指示剂、亚甲基蓝指示剂 上海源叶生物科技有限公司;无水乙醚 上海泰坦科技股份有限公司;戊二醛 北京凯国科技有限公司;乙酸 生工生物工程(上海)股份有限公司;无特殊说明外实验用试剂均为分析纯。
1.2 仪器与设备
刮刀 美国吉列公司;JZ-300色差仪 日本Konica-Minolta公司;DK-S28恒温水浴锅 上海树立仪器仪表有限公司;FA2004分析天平(感量0.001 g和0.0001 g) 瑞士梅特勒-托利多仪器有限公司;DGG-9240A电热鼓风干燥箱 上海森信实验仪器有限公司;Kjeltec 8200自动凯氏定氮仪 丹麦Foss公司;TA.XT plus质构仪 英国SMS公司;G-075马弗炉 无锡玛瑞特科技有限公司;ZNCL-BS磁力搅拌器 澳大利亚Kewlab公司;Y005真空冷冻干燥机 青岛博瑞设备制造有限公司;SU300扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 牛皮的预处理
市场常见牛皮脱毛的方法有物理方法和化学方法[17-18]。常用的物理方法有烫漂脱毛法和蒸汽脱毛法,常用的化学方法有碱处理法、酶处理法及碱酶联用方法等[19-20]。为保证材料的原始性,采用物理脱毛方法。
取新鲜牛胴体剥下的整皮进行分割,将3 个品种牛背部皮切成40 cm×40 cm的方块备用,取上述处理好的牛皮进行清洗,用剃刀刮去表面毛发,脱毛的同时将毛根部位同时清除。再次清洗,剔除多余脂肪后备用。
将处理好的安格斯牛、牦牛、西门塔尔牛的背部皮切割成10 cm×10 cm的方块放入蒸煮袋中,于80 ℃分别加热10、20、30、40、50、60 min后取出冷却至室温。
1.3.2 牛皮涨润度变化测定
由于牛皮中含有大量蛋白质,蛋白质受热会吸水膨胀,导致牛皮厚度和质量改变,直接影响牛皮作为食品原料的总价值。牛皮的质量损失率和厚度损失率按式(1)~(2)计算。

1.3.3 牛皮基本营养成分测定
水分含量:采用直接干燥法,参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;粗脂肪含量:采用索氏提取法,参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;粗蛋白含量:采用凯氏定氮法,参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》。
1.3.4 牛皮质构测定
使用P50型圆柱形探头,将冷却后的牛皮切成1 cm见方的小块,测试速率1.0 mm/s,测试后速率2.0 mm/s,压缩程度50%,触发力5.0 g,停留时间5.0 s。测定牛皮加热熟化过程中的硬度、弹性、咀嚼性和黏附性。
1.3.5 牛皮白度测定
将牛皮的平行切面设定为牛皮内部,将牛皮靠近毛根处真皮层设定为牛皮外部。牛皮中蛋白质含量极高,因此将牛皮的色差用白度表示。采用色差仪对牛皮色差进行测定,测定时确保内部油脂清理干净,记录相应的亮度值(L*)、红绿值(a*)和黄蓝值(b*),每个样品平行测定3 次,白度按式(3)计算。
1.3.6 牛皮中胶原蛋白的提取及扫描电子显微镜观察
牛皮胶原蛋白的提取参考王杉杉[21]的酸法提取,并稍加改进。为保证实验的准确性,以下步骤均在4 ℃条件下进行操作。称取一定质量预处理好的3种牛皮加入到0.5 mol/L乙酸溶液中,料液比1∶15,溶胀12 h,然后用高速组织捣碎机间隙匀浆,转速12000 r/min,匀浆过程中保持温度处于25 ℃以下;称取一定质量的上述匀浆液,以料液比1∶25加入0.5 mol/L乙酸溶液,调节溶液pH值至2~3,使用涡旋振荡器,设定温度为4 ℃酸提64 h,8000 r/min离心15 min,回收沉淀后再次提取,收集2 次离心后的上清液;向上清液中缓慢加入NaCl,并不断搅拌使其盐析,NaCl最终浓度为0.9 mol/L;静置分层12 h,8000 r/min离心20 min;收集絮状物,用0.5 mol/L乙酸溶液复溶,置于0.1 mol/L乙酸溶液中透析24 h,然后用蒸馏水透析2~3 d,最后冷冻干燥备用。
扫描电子显微镜观察:将冻干牛皮胶原蛋白样品分别用镊子放在导电胶带粘好的样品台上,避免蛋白颗粒的重叠影响结构观察,用离子溅射镀膜后进行显微结构观测。
1.4 数据处理
采用SPSS Statistics 17.0及Excel 2010软件进行数据处理及作图。
2 结果与分析
2.1 牛皮加热过程中质量损失率与厚度损失率变化

图1 不同品种牛皮加热过程中质量损失率的变化
Fig. 1 Changes in mass loss percentage during heating of hides
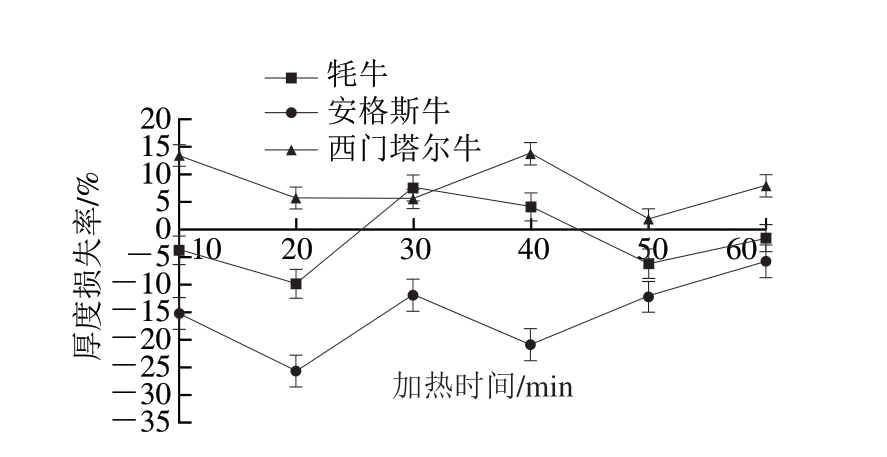
图2 不同品种牛皮加热过程中厚度损失率的变化
Fig. 2 Changes in thickness loss percentage during heating of hides
由图1~2可知,3种牛皮质量损失率随加热时间延长均呈现逐步下降的趋势,其中,牦牛皮质量损失率最大,安格斯牛皮最小。安格斯牛皮、牦牛皮和西门塔尔牛皮的质量损失率分别在加热10、30、60 min时达到最大值,加热40 min达到最小值。3种牛皮厚度损失率变化趋势均呈“W”型,西门塔尔牛皮煮制后涨发,牦牛皮25~45 min煮制会缩小,其他时间会造成涨发现象,而西门塔尔牛皮则一直处于煮制后厚度缩小的状态。总体来讲,安格斯牛皮的煮制质量损失最小,西门塔尔牛皮煮制质量损失较小,牦牛皮煮制厚度损失较小。
2.2 牛皮加热过程中基础营养成分含量变化
表1 不同品种牛皮加热过程中基础营养成分含量变化
Table 1 Changes in basic nutrients in hides during heating%

注:同行小写字母不同,表示差异显著(P<0.05)。表3同。
指标 组别加热时间/min 0 10 20 30 40 50 60水分含量安格斯牛皮 66.97±1.29a 67.73±2.44a 69.02±2.35a 68.47±3.02a 69.48±3.40a 68.85±2.46a 70.10±2.98a牦牛皮 66.88±1.74d 63.42±1.25bc63.13±1.11bc61.90±1.05ab 61.01±0.81a 63.56±1.10bc 63.97±0.87c西门塔尔牛皮 67.64±1.92a 66.62±1.72a 64.99±1.91a 66.35±1.19a 66.52±1.18a 66.32±1.81a 66.66±1.85a蛋白质含量安格斯牛皮 31.92±0.74c 30.34±0.42b 30.33±0.69b 30.08±0.41b 27.96±0.60a 27.49±0.24a 27.64±0.29a牦牛皮 33.69±0.42a 36.71±0.60c 35.85±0.51bc 35.26±0.30b 35.85±0.34bc 36.81±1.48c 35.74±0.23bc西门塔尔牛皮 33.65±0.44a 35.51±0.69bc 36.40±0.48d 34.75±0.45bc34.27±0.42ab34.73±0.07bc34.23±0.53ab脂肪含量安格斯牛皮 3.52±0.02g 2.41±0.05f 2.28±0.03e 2.04±0.12d 1.93±0.01c 0.82±0.02b 1.41±0.02a牦牛皮 0.62±0.01d 0.43±0.03c 0.32±0.02b 0.32±0.02b 0.32±0.02b 0.24±0.01a 0.26±0.03a西门塔尔牛皮 0.66±0.02d 0.42±0.02c 0.33±0.01b 0.41±0.03c 0.42±0.03c 0.42±0.01c 0.24±0.02a
牛皮中蛋白质含量高达30%~35%,随着品种和年龄等有所差异[22]。由表1可知,加热过程中,安格斯牛皮蛋白质含量明显低于其他2种牛皮。牛皮中水分含量的高低将直接影响牛皮产品的弹性、咀嚼性等一系列食用特性,加热过程中,由于蛋白质含量的下降较为明显,安格斯牛皮的水分含量呈现逐步上升的趋势,但差异不显著。这是由于牛皮中蛋白质在加热条件下产生了不同程度的损失,和刘晶晶等[23]研究结果相同。安格斯牛皮脂肪含量明显高于牦牛皮和西门塔尔牛皮,且加热过程中损失率较高,而牦牛皮和西门塔尔牛皮的脂肪含量煮制过程中变化速率相对较缓,可能是由于安格斯牛经过育肥后导致脂肪沉积,脂肪含量偏高。
2.3 牛皮加热过程中质构参数变化
牛皮的机械物理性质将会直接影响牛皮熟化后的食用品质[24-27]。蛋白质在高温下会变性,而蛋白质的变化直接反应在牛皮的硬度变化中。由表2可知,加热过程中3种牛皮的硬度均呈现先升高后降低的变化趋势,安格斯牛皮、西门塔尔牛皮和牦牛皮的硬度依次降低。牦牛皮和西门塔尔牛皮的硬度出现最高值早于安格斯牛皮,这可能是由于安格斯牛皮蛋白质含量较低,硬度变化较慢。
牛皮煮制熟化过程中的弹性是影响牛皮食用性能的重要参数[28-29],而牛皮的弹性变化一般由牛皮中所含有的水分、胶原蛋白和弹性蛋白及其相互作用造成。牛皮煮制熟化过程中弹性先升高后逐渐趋近平缓,这可能是由蛋白质的变性过程导致的。
表2 不同品种牛皮加热过程中质构特性的变化
Table 2 Changes in texture characteristics of hides during heating

注:同列小写字母不同,表示同一指标、不同加热时间差异显著(P<0.05)。
指标 加热时间/min 安格斯牛皮 牦牛皮 西门塔尔牛皮硬度/N 0 262.49±37.68b 90.33±41.31a 155.31±22.46cd 10 280.85±39.01b 208.83±66.65b 248.89±19.08e 20 282.10±91.81b 200.09±46.66b 94.24±14.19ab 30 186.21±37.67a 206.69±63.37b 163.85±13.57d 40 181.31±53.39a 184.24±27.72b 120.50±13.49ab 50 121.68±28.31a 171.86±38.99b 124.52±13.17bc 60 162.17±36.51a 185.45±36.61b 81.56±19.26a黏附性/(g·s)0 -8.80±0.85a -5.01±2.08a -5.74±2.11a 10 -0.84±0.21e -1.75±1.73a -2.14±2.08bc 20 -2.88±0.92cd -1.67±1.59a -1.10±0.94c 30 -1.34±0.75de -1.62±1.54a -2.57±0.71abc 40 -3.66±0.70bc -2.25±0.43a -1.20±0.26bc 50 -1.27±0.90de -1.49±0.57a -2.42±2.00abc 60 -4.81±0.81b -1.37±1.24a -4.58±0.52ab咀嚼性/N 0 131.98±17.22a 26.02±12.01a 39.55±8.66a 10 256.90±42.34b 170.97±47.19b 196.49±72.73d 20 238.56±92.25b 186.01±40.44b 85.26±16.90ab 30 151.21±39.23a 211.58±90.66b 139.72±10.96c 40 126.43±40.42a 164.88±38.53b 107.76±28.38bc 50 108.18±22.34a 159.38±50.16b 97.91±17.29bc 60 109.02±45.33a 171.33±44.68b 78.42±25.53ab弹性0 0.79±0.06a 0.60±0.13a 0.56±0.07a 10 1.00±0.06b 0.93±0.10b 1.07±0.10c 20 0.99±0.04b 1.02±0.05c 0.98±0.07bc 30 1.00±0.09b 1.05±0.07c 0.90±0.18b 40 0.96±0.05b 1.01±0.03c 1.05±0.11bc 50 1.00±0.04b 1.04±0.07c 0.89±0.08b 60 0.97±0.05b 1.04±0.06c 0.95±0.10bc
安格斯牛皮咀嚼性峰值出现在加热10 min左右;牦牛皮加热过程中的咀嚼性变化不显著;西门塔尔牛皮熟化过程中,咀嚼性峰值出现在加热10 min,之后呈现逐渐下降的趋势,并于40 min后趋于平稳。
2.4 牛皮加热过程中白度变化
表3 不同品种牛皮加热熟化过程白度的变化
Table 3 Changes in color difference of hides during heating
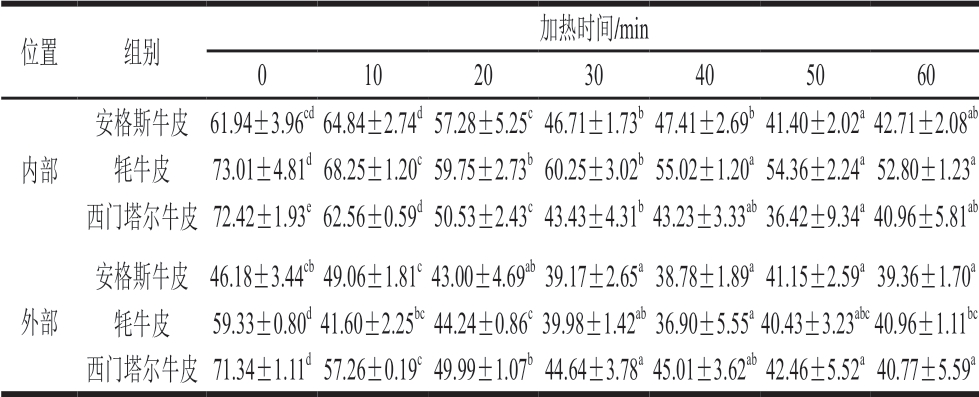
位置 组别加热时间/min 0 10 20 30 40 50 60内部安格斯牛皮 61.94±3.96cd 64.84±2.74d 57.28±5.25c 46.71±1.73b 47.41±2.69b 41.40±2.02a 42.71±2.08ab牦牛皮 73.01±4.81d 68.25±1.20c 59.75±2.73b 60.25±3.02b 55.02±1.20a 54.36±2.24a 52.80±1.23a西门塔尔牛皮 72.42±1.93e 62.56±0.59d 50.53±2.43c 43.43±4.31b 43.23±3.33ab 36.42±9.34a 40.96±5.81ab外部安格斯牛皮 46.18±3.44cb 49.06±1.81c 43.00±4.69ab 39.17±2.65a 38.78±1.89a 41.15±2.59a 39.36±1.70a牦牛皮 59.33±0.80d 41.60±2.25bc 44.24±0.86c 39.98±1.42ab 36.90±5.55a 40.43±3.23abc 40.96±1.11bc西门塔尔牛皮 71.34±1.11d 57.26±0.19c 49.99±1.07b 44.64±3.78a 45.01±3.62ab 42.46±5.52a 40.77±5.59a
由表3可知,牛皮的内外部白度于加热20 min后均呈现显著下降的趋势,20 min前后变化有显著差异,内外牛皮的白度均逐渐趋向一致,安格斯牛皮和牦牛皮的内部白度显著高于外部白度,由于加热会导致蛋白质凝胶化,白度降低甚至变得透明,考虑加热20 min牛皮蛋白变性程度较高,因此前后变化差异显著。
2.5 牛皮中提取的胶原蛋白扫描电子显微镜观察结果

图3 安格斯牛皮、牦牛皮、西门塔尔牛皮胶原蛋白纤维微观结构(×50000)
Fig. 3 Collagen fiber structure of Angus cattle, yak and Simmental cattle hides observed by SEM (× 50000)
由图3可知,在50000 倍的视野中,安格斯牛皮、牦牛皮、西门塔尔牛皮胶原蛋白的微观结构均呈多孔网状结构,并有较为明显的差异,这和张强等[30]的研究结果相同。3种胶原蛋白结构均保持了原有的网状结构,其中安格斯牛皮胶原蛋白中的胶原纤维簇相较牦牛、西门塔尔牛皮胶原蛋白的直径更大,网状结构更加明显,边缘较为清晰,光滑无断层,而西门塔尔牛皮胶原蛋白的纤维簇更加细长,直径更细,边缘较为光滑、清晰,但是网状结构相比安格斯牛皮胶原蛋白不够清晰。相比之下,牦牛皮胶原蛋白的纤维簇直径极细,边缘多呈现破碎状,有很多裂痕,网状结构较为明显,加工过程中更容易被破坏,可以初步判断,从安格斯牛皮中提取的胶原蛋白可能更能较好保持胶原纤维的网状结构,可以为其作为功能性食品、生物医学材料及化妆品等提供理论依据[31],对于其结构的稳定性及自组装能力还应进一步研究。
3 讨 论
牛皮是一种蛋白质含量极高的原料,不同品种牛皮蛋白质结构及含量的微小差异会直接影响牛皮的质构、色差等一系列物理特性,并直接影响牛皮的成熟方法和作为食用材料的商业价值。首先由于蛋白质的膨胀、分散到结构断裂最终变性的动态过程,蛋白质及水分均有所流失,导致营养物质含量不同,造成后续加热过程中食用品质的变化差异。而综合考虑营养价值,牦牛皮的基础营养价值相较而言更符合高蛋白低脂肪的健康食品,但由于牦牛皮的角质层较薄,持水性较差,导致加热过程出现大量水分流失的现象,因此质构特性较差。为了生产高档雪花肉,安格斯牛大多是经过育肥后进行屠宰,所以其牛皮脂肪含量也较高。随加热温度的改变,蛋白质分子间膨胀、挤压程度上升,氢键断裂、蛋白质结构改变,质构较为明显的表现为咀嚼性和硬度先增加后降低,由于牦牛皮较高的蛋白含量且本身质地轻薄,所以变化率较高。不同品种牛皮加热过程中品质指标峰值出现的时间和数值都有所差异,其中安格斯牛皮和牦牛皮的咀嚼性和硬度明显较高,相较而言,这2种牛皮作为食品原料不太适用。而西门塔尔牛皮的质构特性和营养特性均较佳,适合作为食用原料。牛皮的内外部白度于加热20 min后显著下降,并逐渐趋向一致。
随着加热时间延长,牛皮内部蛋白质发生变性,水分无法渗透到表面,导致黏附性降低。安格斯牛皮脂肪含量较高,蛋白质含量较低且损失率高,因此处理后黏附性快速降低,而牦牛皮黏附性在处理过程中差异不明显,安格斯牛皮和西门塔尔牛皮加热50 min时又出现黏附性增加的现象,考虑是由于牛皮蛋白质变性产生凝胶,附着在牛皮表层,使得表面黏附力增强。且由于蛋白质变性,胶原蛋白纤维结构粗化,反映到牛皮的质构参数为弹性、硬度、咀嚼性升高。不同品种牛皮加热过程中各指标呈现的差异性可为不同品种牛皮的加工方式提供指导。
此外,3种牛皮所提取的Ⅰ型胶原蛋白结构中,安格斯牛皮胶原蛋白纤维直径较粗,能较好维持胶原纤维的网状结构,从提取效果来看,安格斯牛皮相比牦牛和西门塔尔牛皮更适合提取胶原蛋白。随着加热过程的进行,牛皮蛋白质微观结构变化明显,反映到物体表面则呈现食用品质的变化。综合数据分析结果可看出,安格斯牛皮的蛋白质含量较低,脂肪含量较高,营养价值相对其他2种牛皮更低,咀嚼性和硬度峰值较高,但提取的Ⅰ型胶原蛋白结构致密性更好,直径更大,相较而言适合作为提取结构性材料使用。西门塔尔牛皮和牦牛皮在营养价值方面的差异性不大,质构出现的峰值时间点较为一致,但牦牛皮的咀嚼性峰值高于西门塔尔牛皮,且牦牛皮质量损失率较大,商业利用率低于西门塔尔牛皮。
4 结 论
为保证得到的Ⅰ型胶原蛋白结构更好,可选用安格斯牛皮作为提取材料。无论作为食用材料、功能性食品或生物医学材料,牛皮都有较好的发展潜力及研究价值。因此,应根据实际生产需求选择适宜的深加工方式。
[1]但卫华, 曾睿. 生物质与生物质工程[J]. 中国皮革, 2002, 11(31):31-35. DOI:10.13536/j.cnki.issn1001-6813.2002.11.010.
[2]曹兵海, 曹建民, 孙宝忠, 等. 牛皮进口关税调减对我国肉牛产业的影响分析[J]. 中国畜牧杂志, 2014, 50(24): 11-22. DOI:10.3969/j.issn.0258-7033.2014.24.002.
[3]HILDRUM K I, RØDBOTTEN R, HØY M, et al. Classification of different bovine muscles according to sensory characteristics and Warner Bratzler shear force[J]. Meat Science, 2009, 83(2): 229-234.DOI:10.1016/j.meatsci.2009.05.016.
[4]LI X, BABOL J, WALLBY A, et al. Meat quality, microbiological status and consumer preference of beef gluteus medius aged in a dry ageing bag or vacuum[J]. Meat Science, 2013, 95(2): 229-234.DOI:10.1016/j.meatsci.2013.05.009.
[5]REALINI C E, I FURNOLS M F, GUERRERO L, et al. Effect of finishing diet on consumer acceptability of Uruguayan beef in the European market[J]. Meat Science, 2009, 81(2): 302-307.DOI:10.1016/j.meatsci.2008.10.005.
[6]欧阳平一, 杨冬萍. 带皮牛肉酶法嫩化及保鲜新工艺研究[J]. 湖南农业科学, 2010(2): 85-86. DOI:10.16498/j.cnki.hnnykx.2010.03.002.
[7]黎英, 陈小红, 陈雪梅, 等. 响应面法优化即食泡牛皮食品工艺条件研究[J]. 中国调味品, 2014, 39(1): 50-56. DOI:10.3969/j.issn.1000-9973.2014.01.013.
[8]李敬. 牛皮酶法脱毛工艺优化及其对食用质量的影响[D]. 北京: 中国农业科学院, 2016: 30-36.
[9]李学艳, 蔡邦肖, 夏仙兵. 畜禽副产物资源利用中的膜技术应用[J].中国食品学报, 2012, 12(10): 163-168. DOI:10.16429/j.1009-7848.2012.10.030.
[10]赵燕, 鲁亮, 杨玲, 等. 草鱼皮胶原的体外自组装动力学研究[J].食品科学, 2014, 35(11): 21-26. DOI:10.7506/spkx1002-6630-201411005.
[11]张达江, 王亮. Ⅰ型胶原蛋白的结构、功能及其应用研究的现状与前景[J]. 生物技术通讯, 2006, 17(2): 265-269.
[12]秦溪. 鱼皮胶原为基质的胶原蛋白肠衣的制备及其性能研究[D].南宁: 广西大学, 2015: 8-9.
[13]张志宏, 郭杰, 李旭光, 等. 中国西门塔尔牛(草原类型群)品种资源调查报告[J]. 畜牧与饲料科学, 2018, 39(1): 79-81. DOI:10.16003/j.cnki.issn1672-5190.2018.01.020.
[14] 梁宝利. 养殖西门塔尔牛是农民脱贫致富的好途径[J]. 中国畜牧业,2019(6): 90.
[15]李文. 安格斯牛[J]. 农村百事通, 2017(16): 36.
[16]王靖, 徐芳, 张婧捷, 等. 牦牛蛋白质研究进展[J]. 西南民族大学学报(自然科学版), 2019, 45(2): 111-116. DOI:10.11920/xnmdzk.2019.02.001.
[17]王艺伦. 使用牛蹄、皮脱毛工艺及其营养品质的研究[D]. 兰州: 甘肃农业大学, 2018: 9-14.
[18]张娜, 刘恬, 段人杰. 烫毛工艺对猪肉安全及其加工品质的影响[J].肉类工业, 2011(1): 4-5.
[19] ZAMBARE V P, NILEGAONKAR S S, KANEKAR P P. Production of an alkaline protease by Bacillus cereus MCM B-326 and its application as a dehairing agent[J]. World Journal of Microbiology and Biotechnology,2007, 23(11): 1569-1574. DOI:10.1007/s11274-007-9402-y.
[20] KANDASAMY N, VELMURUGAN P, SUNDARVEL A, et al. Ecobenign enzymatic dehairing of goatskins utilizing a protease from a Pseudomonas fluorescens species isolated from fish visceral waste[J].Journal of Cleaner Production, 2012, 25(4): 27-33. DOI:10.1016/j.jclepro.2011.12.007.
[21]王杉杉. 牦牛皮胶原蛋白的提取及其活性肽的制备[D]. 绵阳: 西南科技大学, 2018: 15-16.
[22]张小娟. 牛皮胶原蛋白的水解及其抗氧化性研究[D]. 西安: 西北大学, 2012: 1.
[23]刘晶晶, 雷元华, 李海鹏, 等. 加热温度及时间对牛肉胶原蛋白特性及嫩度的影响[J]. 中国农业科学, 2018, 51(5): 977-990.DOI:10.3864/j.issn.0578-1752.2018.05.015.
[24]夏建新, 王海滨, 徐群英. 肌肉嫩度仪与质构仪对燕麦复合火腿肠测定的比较研究[J]. 食品科学, 2010, 31(3): 145-149.
[25]KHALAJI S, MANAFI M, OLFATI Z, et al. Replacing soybean meal with gelatin extracted from cow skin and corn protein concentrate as a protein source in broiler diets[J]. Poultry Science, 2016, 95(2): 287-297.DOI:10.3382/ps/pev330.
[26]陈立业, 郭兆斌, 刘耀娜, 等. 不同卤制方式对酱牛肉营养品质和质构特性的影响[J]. 粮食深加工及食品, 2019, 44(8): 104-107.DOI:10.16465/j.gste.cn431252ts.20190830.
[27]梁辉, 戴志远. 物性分析仪在食品质构测定方面的应用[J]. 食品研究与开发, 2006, 27(4): 119-121.
[28]TIAN Xiaojing, WU Wei, YU Qianqian, et al. Quality and proteome changes of beef M. longissimus dorsi cooked using water bath and ohmic heating process[J]. Innovative Food Science and Emerging Technologies, 2016, 34: 259-266. DOI:10.1016/j.ifset.2016.02.013.
[29] CHRISTENSEN L, GUNVIG A, TØRNGREN M A, et al.Sensory characteristics of meat cooked for prolonged times at low temperature[J]. Meat Science, 2012, 90(2): 485-489. DOI:10.1016/j.meatsci.2011.09.012.
[30]张强, 王倩倩, 陆剑锋, 等. 不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J]. 现代食品科技, 2014, 30(5): 104-110. DOI:10.13982/j.mfst.1673-9078.2014.05.025.
[31]卢珍华, 郭彩华, 叶鹏, 等. 养殖花鳗鲡鱼皮胶原蛋白的特性分析[J]. 淡水渔业, 2019, 49(6): 100-106. DOI:10.13721/j.cnki.dsyy.2019.06.016.