大鲵(Andrias davidianus)俗称“娃娃鱼”,属脊索动物门、两栖纲、有尾目、隐鳃鲵科[1]。大鲵的种类包括中国大鲵、日本大鲵和美洲隐鳃鲵,中国大鲵的人工养殖范围极广,主要集中在湖南、陕西等地。汉中大鲵养殖规模占全国的70%以上[2]。大鲵浑身都是宝,黏液、皮肤、肌肉、骨头和油脂均有较高的营养价值和药用价值,大鲵机体中肌肉占比达体质量的50%左右,皮占比5%左右。经常食用大鲵有益智、延缓衰老、提高造血和免疫功能的功效,同时也可预防心脑血管疾病、恶性贫血和恶性肿瘤等疾病[3]。
大鲵肉粉中含有抗疲劳、抗免疫的功能成分[4]。李莉等[5]对大鲵肌肉、大鲵皮的营养成分进行比较,得出大鲵肉、尾脂和大鲵皮均具有较高的营养价值。大鲵肉中含有肌原纤维蛋白、肌浆蛋白、碱溶性蛋白和肌基质蛋白,将肌浆蛋白、肌原纤维蛋白提取后的剩余肉渣部分主要为肌基质蛋白。杨慧等[6]从大鲵肌肉中分离出肌浆蛋白、肌原纤维蛋白及肌基质蛋白,并对几种蛋白特性进行测定,结果表明,从大鲵肌肉中获得的3 类蛋白质结构和功能完整。肌基质蛋白主要包含胶原蛋白和弹性蛋白,且二者均为构成结缔组织的主要成分。胶原蛋白为一个或几个由α-链组成的三螺旋结构区域,以不溶性大分子与蛋白多糖、糖蛋白等黏合在一起的形式存在于组织内[7]。胶原蛋白为构成肌肉结缔组织的主要成分,与肌肉的柔嫩、老化密切相关。胶原蛋白存在于大鲵皮中的结缔组织,不仅是肌肤真皮层中支撑皮肤构架的主要“黏合剂”,也与弹力纤维一起构成网状的支撑体,使皮肤细胞变得丰满,呈现弹性与润泽,保持皮肤细腻光滑,有效防止肌肤老化。胶原蛋白的提取方法主要包括酸法[8-9]、碱法[7]、盐法[10]、热水法[11]和酶法[12-14]。酸法提取一般可不破坏胶原蛋白结构,但提取获得的胶原蛋白分子质量较大,且提取率较低,不利于人体消化吸收。酶解法较为常见,提取条件温和。目前有关胶原蛋白的提取研究主要集中于猪皮、鱼皮等。王锡念等[15]比较不同提取方式对鮟鱇鱼鱼皮中胶原蛋白的提取效果,结果显示,利用超声-双酶法提取率最佳;韩玮等[16]以罗非鱼皮为研究对象,将通过微生物发酵法、热水法、酸法、碱法制备的胶原蛋白进行比较,结果表明,微生物发酵法制备胶原蛋白得率显著高于热水法和碱法,发酵法制备得到的胶原蛋白具有完整的三螺旋结构,较高的溶解性、持水性和乳化性,并具有一定的吸水、吸油性;赵然等[17]对国内外水产动物提取胶原蛋白方式进行综述,表明从水产动物获取胶原蛋白前景良好;肖岚等[18]对猪皮中胶原蛋白进行提取,发现酶解猪皮中胶原蛋白具有抗氧化性。有关来源于大鲵的胶原蛋白研究主要集中于大鲵皮,李莉等[19]通过响应面法优化酶法提取大鲵皮胶原蛋白的工艺条件,得出最优条件为加酶量16.5%、液料比15 mL/g、酶解时间29 h;李静等[20]得出利用高温高压可提高利用大鲵皮制作胶原蛋白肽的提取率;周艳华等[21-22]优化大鲵皮酶解工艺,得出制备抗氧化肽最佳工艺为酶添加量7000 U/g、pH 8.5、55 ℃条件下酶解4 h,羟自由基清除率为83.15%,并作毒理学评价;徐阳等[23]以大鲵胶原蛋白多肽粉制得口服液并作安全性评价,结果表明,在15 g/kg mb剂量下,SD大鼠未见异常,无异常死亡;欧阳力剑等[24]对大鲵皮中胶原蛋白及应用进行综述。然而有关大鲵肌肉中胶原蛋白及肌基质蛋白的深入报道极少。
本研究以大鲵肌肉中提取获得的肌基质蛋白与大鲵皮为原料,分别用乙酸、胃蛋白酶提取胶原蛋白,比较2种来源、同种提取方式获得的胶原蛋白异同,对大鲵肌肉提取可溶性蛋白后的肌基质蛋白中胶原蛋白进行开发利用,为大鲵肌基质蛋白的高附加值利用开辟新的途径。
1 材料与方法
1.1 材料与试剂
大鲵肉、大鲵皮 陕西理工大学陕西省资源生物重点实验室。
冰乙酸 天津永晟精细化工有限公司;胃蛋白酶(酶活力3000~3500 U/mg) 安徽宏达生物工程有限公司;氯化钠、柠檬酸 天津市盛奥化学试剂有限公司;L-羟脯氨酸、氯胺T 上海源叶生物科技有限公司;无水乙酸钠、正丙醇、柠檬酸 国药集团化学试剂有限公司;二甲氨基苯甲醛、高氯酸、异丙醇 无锡市亚泰联合化工有限公司。
1.2 仪器与设备
UV-1750紫外-可见分光光度计 日本岛津仪器公司;DK-98-Ⅱ恒温水浴锅 天津市泰斯特仪器有限公司;JA5003分析天平 上海舜宇恒平科学仪器有限公司;PE28 pH计 瑞士梅特勒-托利多仪器有限公司;TGL-20M冷冻离心机 湖南湘仪离心机仪器有限公司;VERTEX70傅里叶红外光谱仪 德国Bruker公司;飞钠(Phenom)台式扫描电子显微镜 美国FEI公司;SNB-2数字黏度计 上海伦捷机电仪表有限公司;DZF-6050真空干燥箱 上海一恒科学仪器有限公司;DYCZ-24DN垂直电泳仪 北京六一生物科技有限公司。
1.3 方法
1.3.1 大鲵皮与肌基质蛋白中胶原蛋白的提取
1.3.1.1 大鲵皮中胶原蛋白的提取
称取新鲜大鲵皮50.0 g,按料液比1∶10(m/V)加入0.10 mol/L氢氧化钠,于4 ℃浸泡过夜,中间更换3 次浸泡液,流水冲洗后人工去除大鲵皮上的肌肉和油脂,加入5 g碳酸氢钠和0.5 g柠檬酸揉搓大鲵皮除去脂肪,再用酵母发酵去味,用流水彻底洗净大鲵皮,切成0.5 cm×0.5 cm的小片,放入聚乙烯袋中,保存在-40 ℃备用。
准确称取处理后大鲵皮100.0 g,按液料比1∶20(m/V)加入0.5 mol/L乙酸,于4 ℃冰箱提取24 h(不时搅拌),取出后用纱布过滤,而后将初滤液置于高速冷冻离心机中离心(4 ℃、10000 r/min、15 min),取上清液,加入NaCl至终浓度为0.9 mol/L。将此溶液置于4 ℃冰箱中盐析过夜后,转移到截留分子质量为7000 Da的透析袋中,去离子水透析3 d,真空冷冻干燥后即得酸溶性胶原蛋白粉末[5]。
对酸提后纱布过滤的剩余物继续用胃蛋白酶进行酶解,调节体系pH值为5.0,40 ℃水浴锅中酶解4 h,酶解结束后于100 ℃水浴加热10 min灭酶,取出后用纱布过滤,将初滤液置于高速冷冻离心机中离心(4 ℃、10000 r/min、15 min),取上清液,加入NaCl至终浓度为0.9 mol/L,4 ℃盐析过夜后,转移到截留分子质量为7000 Da的透析袋中,用去离子水透析2 d,真空冷冻干燥后即得胃蛋白酶解胶原蛋白粉末。
胶原蛋白酸提取率、胃蛋白酶提取率按照式(1)~(2)计算。
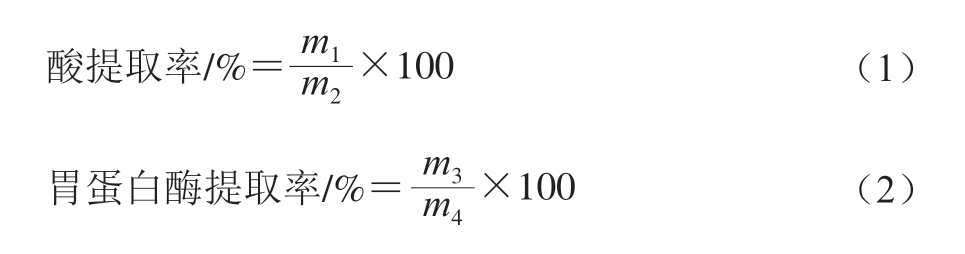
式中:m1为酸溶性胶原蛋白干粉质量/g;m2为酸提前大鲵皮质量/g;m3为胃蛋白酶解胶原蛋白干粉质量/g;m4为胃蛋白酶提取前大鲵皮质量/g。
1.3.1.2 大鲵肉肌基质蛋白中胶原蛋白的提取
称取已绞碎的大鲵肉糜50.0 g,加入4 倍体积0.05 mol/L、pH 7.5的磷酸盐缓冲液,在磁力搅拌辅助下提取3 h,4 ℃、8000 r/min离心10 min,收集上清液,沉淀物中再加入上述磷酸盐缓冲液,重复上述操作,将上清液合并即得水溶性肌浆蛋白。向沉淀中加入4 倍含0.6 mol/L NaCl的磷酸盐缓冲溶液,磁力搅拌辅助提取8 h,4 ℃、8000 r/min离心10 min,重复上述操作,合并上清液,即得盐溶性肌原纤维蛋白。所得沉淀用蒸馏水反复洗涤5 次,即得肌基质蛋白。将肌基质蛋白冷冻干燥,研磨成粉末置于-12 ℃冰箱备用[7]。
准确称取冷冻干燥的肌基质蛋白粉末5.00 g,其余操作与胶原蛋白酸法提取率、胃蛋白酶法提取率计算同1.3.1.1节。
1.3.2 紫外光谱测定
将分别从大鲵肉肌基质蛋白、大鲵皮中采用不同提取方式制备的1 mg/mL胶原蛋白溶液置于紫外-可见分光光度计卡槽中,测定200~800 nm波长范围的吸光度,间隔1 nm,绘制吸光度随波长变化的曲线图。
1.3.3 红外光谱测定
采用溴化钾压片法[25]:准确称取200.0 mg溴化钾粉末6 份,5 份分别与1 mg胶原蛋白冻干粉样品混匀,另1 份作空白对照,置于玛瑙钵体中研成细粉后进行压片。使用红外光谱仪测定4000~400 cm-1内的透过率。
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)测定
分别对从大鲵肉肌基质蛋白、大鲵皮中制备的胶原蛋白进行SDS-PAGE测定[26]。
1.3.5 胶原蛋白中羟脯氨酸含量测定
1.3.5.1 羟脯氨酸标准曲线建立
称取50.0 mg L-羟脯氨酸于100 mL容量瓶中,加蒸馏水充分溶解,加入200 μL 3 mol/L硫酸溶液,蒸馏水定容,得到标准溶液。移取5.00 mL上述标准溶液至500 mL容量瓶中,用蒸馏水定容,再分别吸取10、20、30、40 mL于100 mL容量瓶中,蒸馏水定容,得到标准工作液,质量浓度依次为0.5、1.0、1.5、2.0 μg/mL(临用时配制)。以L-羟脯氨酸质量浓度(μg/mL)为横坐标,吸光度为纵坐标绘制标准曲线,得标准曲线方程为y=0.207x+0.017(R2=0.9997)。
1.3.5.2 试样羟脯氨酸含量测定
称取0.4 g样品于具塞三角瓶中,加入3 mL 3 mol/L硫酸溶液,盖紧塞子,105 ℃干燥箱恒温16 h。将经硫酸水解后的溶液转移至25 mL容量瓶中,取1 mL 3 mol/L硫酸溶液洗涤三角瓶,将洗涤液转移至容量瓶中,用蒸馏水定容备用。
移取4 mL处理好的样品溶液于比色管中,加入2 mL氯胺T溶液,室温下放置20 min后避光加入2 mL显色剂,用塑料薄膜进行封口。将比色管迅速放入60 ℃水浴锅中水浴20 min,取出后用流水冷却比色管至少3 min,室温下放置30 min,以蒸馏水为空白对照,测定558 nm波长处的吸光度,带入L-羟脯氨酸标准曲线,得出试样中羟脯氨酸质量浓度。羟脯氨酸含量按式(3)计算[27]。

式中:X为样品中羟脯氨酸含量/%;ρ为由标准曲线得到的试样中羟脯氨酸质量浓度/(μg/mL);m为样品质量/g;V为吸取试样溶液的体积/mL。
1.3.6 胶原蛋白扫描电子显微镜观察
取少许胶原蛋白冷冻干燥粉末,将直径12 mm双面碳导电胶片粘贴在钉型样品台上,而后将样品均匀覆盖在胶片表面,用镊子将钉型样品台夹起放置于电镜标准样品杯中,旋转样品杯,动力除尘器吹几次除去灰尘后放置于电镜载物台,调节最佳视野和放大倍数对样品进行微观结构观察。
1.3.7 黏度测定
取冷冻干燥后胶原蛋白,制备50 mL 2.5 mg/mL胶原蛋白溶液于室温静置20 min后,用SNB-2黏度计SP2、SP3转子测定黏度。
1.4 数据处理
结果以平均值±标准差表示,采用Origin 8.5软件进行绘图,Excel软件进行数据分析。
2 结果与分析
2.1 大鲵皮和大鲵肌基质蛋白中胶原蛋白提取率
酸法提取胶原蛋白主要是由于乙酸可以破坏胶原蛋白分子间的离子键,使蛋白发生胶原纤维膨胀而溶解,酶法则是利用蛋白酶使胶原蛋白溶解。
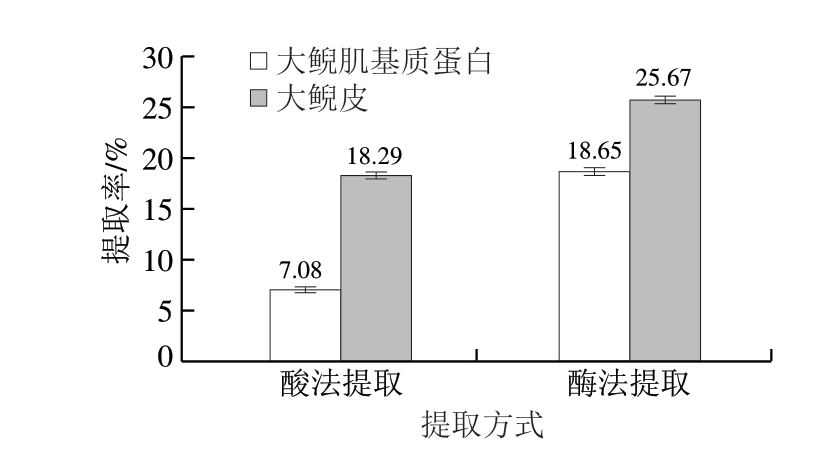
图1 大鲵皮和大鲵肌基质蛋白中不同提取方式的胶原蛋白提取率
Fig. 1 Extraction yields of collagen by different extraction methods
from giant salamander skin and muscle matrix protein
由图1可知,利用酶法提取得到的大鲵皮和大鲵肌基质蛋白中胶原蛋白的提取率均优于酸法提取。大鲵皮胶原蛋白酸法提取率为肌基质蛋白酸法提取率的2 倍以上。总体分析,大鲵肌基质蛋白中胶原蛋白含量低于大鲵皮,大鲵皮中2种胶原蛋白总提取率比肌基质蛋白中总提取率高18.23%。
2.2 大鲵皮和大鲵肌基质蛋白中胶原蛋白的紫外光谱测定结果
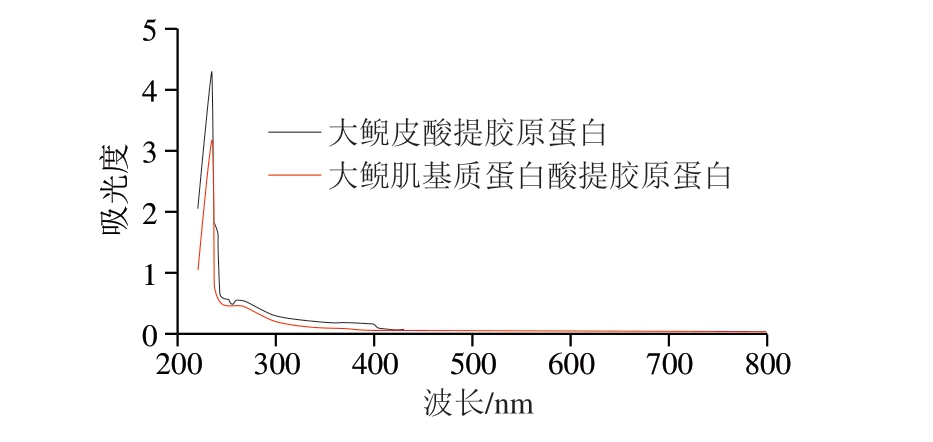
图2 大鲵皮和大鲵肌基质蛋白中酸法提取胶原蛋白紫外光谱比较
Fig. 2 Comparison of UV spectra of acid extracted collagens from giant salamander skin and muscle matrix protein
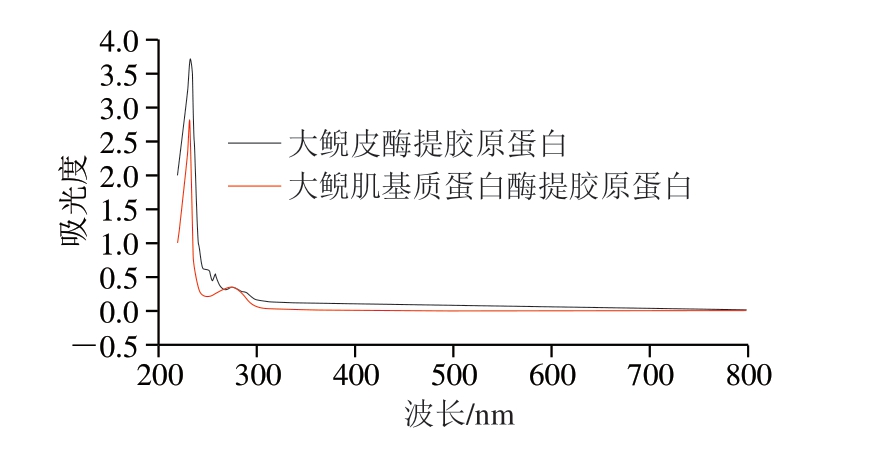
图3 大鲵皮和大鲵肌基质蛋白中酶法提取胶原蛋白紫外光谱比较
Fig. 3 Comparison of UV spectra of enzyme extracted collagens from giant salamander skin and muscle matrix protein
色氨酸(280 nm)、酪氨酸(275 nm)和苯丙氨酸(257 nm)等在近紫外区会出现较强的光吸收。由图2~3可知,大鲵皮、大鲵肌基质蛋白的酸法提取、胃蛋白酶提取胶原蛋白最大吸收峰均位于232 nm波长附近,与顾赛麒等[28]研究的大鲵皮胶原蛋白、鲶鱼皮胶原蛋白(233 nm)[29]、鲢鱼皮胶原蛋白(232 nm)[30]的最大紫外吸收峰波长基本一致。其次在250~280 nm波长处也都有吸收峰,酸提法得到的2种胶原蛋白在257 nm波长处有苯丙氨酸的特征吸收峰,胃蛋白酶提取得到的2种胶原蛋白在280 nm波长处有色氨酸的特征吸收峰,大鲵皮中提取获得的胶原蛋白较大鲵肉中提取获得的胶原蛋白吸收峰更显著。2种来源、不同提取方式获得的胶原蛋白紫外吸收特性差异不明显。
2.3 大鲵皮和大鲵肌基质蛋白中胶原蛋白红外光谱测定结果

图4 大鲵皮和大鲵肌基质蛋白中酸法提取胶原蛋白红外光谱比较
Fig. 4 Comparison of IR spectra of acid extracted collagens from giant salamander skin and muscle matrix protein

图5 大鲵皮和大鲵肌基质蛋白中酶法提取胶原蛋白红外光谱比较
Fig. 5 Comparison of IR spectra of enzyme extracted collagens from giant salamander skin and muscle matrix protein
由图4~5可知:酸提大鲵皮中胶原蛋白在酰胺A带(3390 cm-1左右)有明显吸收峰,酸提肌基质蛋白中胶原蛋白有近似吸收峰出现;酸提肌基质蛋白、大鲵皮中胶原蛋白均在酰胺B带(2955 cm-1左右)、酰胺Ⅰ带(1730 cm-1左右)、酰胺Ⅱ带(1600 cm-1)和酰胺Ⅲ带(1250 cm-1)有特征吸收峰。酶提法所得胶原蛋白特征吸收峰较多,在酰胺A带、酰胺B带等也有特征峰出现,2种胶原蛋白频率相似,但各特征吸收频率上吸收强度相差较大。2种酸提胶原蛋白和2种酶提胶原蛋白与顾赛麒等[28]研究结果相似,表明从大鲵肉肌基质蛋白、大鲵皮中提取的胶原蛋白三螺旋结构均较为完整。
2.4 大鲵皮和大鲵肌基质蛋白中胶原蛋白的SDS-PAGE结果
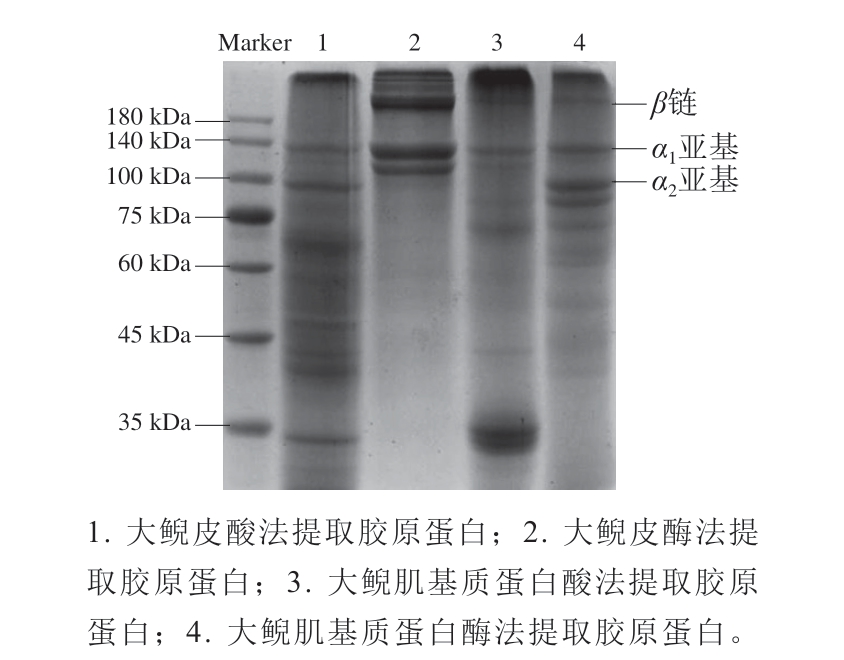
图6 大鲵皮和大鲵肌基质蛋白中提取胶原蛋白的SDS-PAGE图
Fig. 6 SDS-PAGE profiles of collagens extracted from the skin and muscle matrix protein of giant salamander
由图6可知,酸法和酶法提取大鲵肌基质蛋白、大鲵皮中的胶原蛋白均包含α1、α2亚基,分子质量93~130 kDa,也有分子质量约200 kDa的β链,均与已报道的Ⅰ型胶原蛋白特征一致[31],也与已报道的大鲵皮胶原蛋白电泳图条带相似[30]。酸提的2种胶原蛋白分子质量相差不大,基本符合Ⅰ型胶原蛋白特性,但大鲵皮中蛋白种类比肌基质蛋白中种类更多,而酶法提取的大鲵皮中胶原蛋白条带亮度比大鲵肌基质蛋白中提取的胶原蛋白条带亮度更大。
2.5 大鲵皮和大鲵肌基质蛋白中胶原蛋白的羟脯氨酸含量
表1 试样羟脯氨酸含量
Table 1 Content of hydroxyproline in samples

样品 羟脯氨酸含量/%大鲵肉 3.53±0.18大鲵肌基质蛋白 4.42±0.16大鲵肌基质蛋白酸法提取胶原蛋白 10.37±0.23大鲵肌基质蛋白酶法提取胶原蛋白 8.73±0.15大鲵皮 8.62±0.23大鲵皮酸法提取胶原蛋白 16.05±0.16大鲵皮酶法提取胶原蛋白 18.04±0.08
由表1 可知,从大鲵皮中提取的2种胶原蛋白羟脯氨酸含量最高,分别为(16.05±0.16)%和(18.04±0.08)%。大鲵肌基质蛋白中羟脯氨酸含量为(4.42±0.16)%,2种提取方式所得胶原蛋白中,酸提法得到的胶原蛋白羟脯氨酸含量最高,为(10.37±0.23)%,与不同提取所得大鲵皮胶原蛋白相比仍较低。
2.6 大鲵皮和大鲵肌基质蛋白中胶原蛋白的扫描电子显微镜观察结果
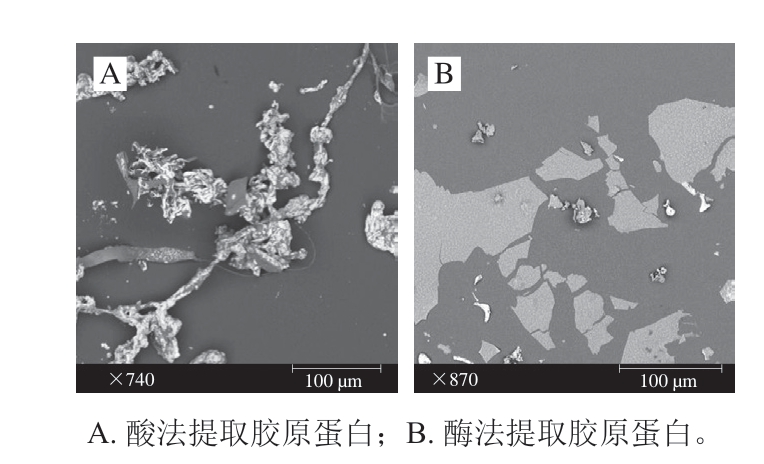
图7 大鲵肌基质蛋白中不同提取方式所得胶原蛋白扫描电镜图(×1000)
Fig. 7 Scanning electron micrographs of collagens extracted from of muscle matrix protein in giant salamander (×1000)

图8 大鲵皮及其不同提取方式所得胶原蛋白扫描电镜图(×1000)
Fig. 8 Scanning electron micrographs of collagens extracted from the skin of giant salamander (×1000)
由图7可知,乙酸提取大鲵肌基质蛋白中的胶原蛋白交联紧密,呈现致密网状结构,说明乙酸提取法能够很好保持胶原蛋白原有结构。经胃蛋白酶水解后,胶原蛋白的微观结构变化较大,交联片段明显被切碎。由图8可知,大鲵皮粉的结构呈网状块,酸法提取所得胶原蛋白较肌基质蛋白中的胶原蛋白片状较大,交联性好,但是有小分子物质聚焦在片状结构上。酶法提取的大鲵皮胶原蛋白表面光滑,呈片状结构,交联片段较完整。酸法提取、胃蛋白酶法提取的大鲵肌基质蛋白中胶原蛋白扫描电子显微镜结构与大鲵皮中胶原蛋白相差较大。
2.7 大鲵皮和大鲵肌基质蛋白中胶原蛋白的黏度
表2 不同提取方式所得胶原蛋白黏度
Table 2 Viscosity of collagens extracted by different methods
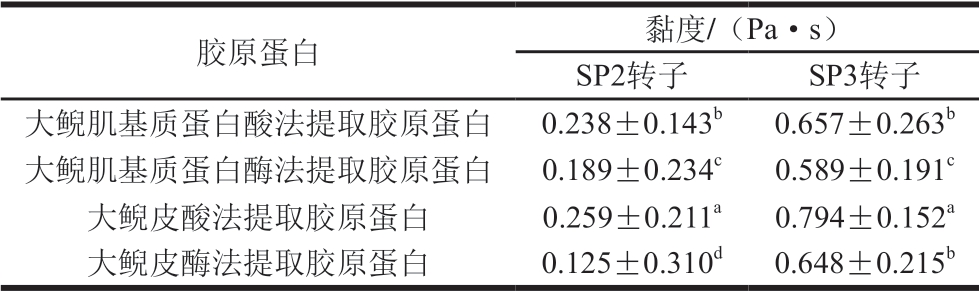
注:同列小写字母不同,表示差异显著(P<0.05)。
胶原蛋白 黏度/(Pa·s)SP2转子 SP3转子大鲵肌基质蛋白酸法提取胶原蛋白 0.238±0.143b 0.657±0.263b大鲵肌基质蛋白酶法提取胶原蛋白 0.189±0.234c 0.589±0.191c大鲵皮酸法提取胶原蛋白 0.259±0.211a 0.794±0.152a大鲵皮酶法提取胶原蛋白 0.125±0.310d 0.648±0.215b
由表2可知,大鲵肉肌基质蛋白、大鲵皮中酸法提取胶原蛋白的黏度均大于酶法提取,这是由于酶解时会破坏蛋白结构,影响蛋白黏度。大鲵皮酸提胶原蛋白黏度与大鲵肌基质蛋白酸提胶原蛋白差异显著(P<0.05)。
3 结 论
利用乙酸法提取大鲵皮、大鲵肌基质蛋白中的胶原蛋白,提取率分别为18.29%、7.08%,胃蛋白酶法提取大鲵皮、大鲵肌基质蛋白中的胶原蛋白提取率分别为25.67%、18.65%,大鲵皮中胶原蛋白总提取率比肌基质蛋白中高18.23%。大鲵皮酸提胶原蛋白中羟脯氨酸含量比肌基质蛋白中酸提胶原蛋白高5.68%,大鲵皮酶提胶原蛋白中羟脯氨酸含量比肌基质蛋白中高9.31%。大鲵肌基质蛋白中的酸提胶原蛋白、酶提胶原蛋白的紫外光谱特征分别与大鲵皮中2种胶原蛋白相似,红外光谱特征基本相似,吸收峰强度存在差异,且红外光谱均在酰胺A、B带和酰胺Ⅰ、Ⅱ、Ⅲ带有红外特征吸收峰,符合胶原蛋白特征,但大鲵皮的酸提、酶提胶原蛋白波动范围较小。肌基质蛋白的酸法和酶法提取胶原蛋白SDS-PAGE中可得到2 条α肽链和1 条β肽链,基本符合Ⅰ型胶原蛋白特征,酸提的2种胶原蛋白分子质量基本相同,但大鲵皮中蛋白种类比肌基质蛋白中种类更多,酶法提取大鲵皮胶原蛋白比肌基质蛋白中提取的胶原蛋白条带亮度更大、更清晰,蛋白含量更高。扫描电镜结果说明,酸法提取能较好维持大鲵皮、大鲵肌基质蛋白中胶原蛋白的网状结构,酶法提取则会将胶原蛋白酶解成小分子的胶原蛋白肽,但是大鲵皮的酶法提取胶原蛋白结构较肌基质蛋白中提取的胶原蛋白结构更为完整。
大鲵肉提取可溶性蛋白后的不溶性肌基质蛋白能够进一步提取胶原蛋白,且与大鲵皮中的胶原蛋白性能相近,可开发出优质的胶原蛋白,提高大鲵副产物的加工利用程度。
[1]辛茜, 陈德经, 陈小华, 等. 水酶法与热熔法提取大鲵油的精制工艺和品质比较研究[J]. 中国油脂, 2018, 43(12): 26-30. DOI:10.13386/j.issn1003-7969.2018.12.007.
[2]王海文. 我国大鲵Megalobatrachus davidianus (Blanchard)研究现状与发展前景的探讨[J]. 现代渔业信息, 2002(7): 5-8. DOI:10.13386/j.issn1004-8340.2002.07.002.
[3]高士贤, 戴定远, 范勤德. 常见药用动物[M]. 上海: 上海科学技术出版社, 1984: 140-141.
[4]曹洁, 余龙江, 崔永明, 等. 纯大鲵粉对小鼠抗疲劳作用及免疫功能的影响[J]. 四川动物, 2008(1): 149-152. DOI:10.3969/j.issn.1000-7083.2008.01.045.
[5]李莉, 顾赛麒, 王锡昌, 等. 人工养殖大鲵肌肉和鲵皮营养成分分析及评价[J]. 食品工业科技, 2012, 33(24): 385-388.
[6]杨慧, 陈德经, 陈海涛, 等. 大鲵肌肉分离蛋白特性[J]. 肉类研究,2020, 34(7): 28-32. DOI:10.7506/rlyj1001-8123-20200515-121.
[7]蒋挺大. 胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006: 2-5.
[8]WANG Lingzhao, YANG Bao, DU Xiuqiao, et al. Optimization of conditions for extraction of acid-soluble collagen from grass carp(Ctenopharyngodon idella) by response surface methodlogy[J]. Innovative Food Science and Emerging Technologies, 2008, 9(4): 604-607.DOI:10.1016/j.ifset.2008.03.001.
[9]ZENG Shaokui, ZHANG Chaohua, LIN Hong, et al. Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia (Oreochromis niloticus)[J]. Food Chemistry, 2009, 116:879-883. DOI:10.1016/j.foodchem.2009.03.038
[10] KOLODZJEJSKA I, SIKORSKI Z E, NIECKOWSKA C. Parameters affecting the isolation of collagen from squid (Illex argentinus)skins[J]. Food Chemistry, 1999, 66(2): 153-157. DOI:10.1016/S0308-8146(98)00251-9.
[11]钱曼. 鱼鳞胶原蛋白的提取与胶原海绵的制备研究[D]. 武汉: 华中科技大学, 2008. DOI:10.76666/d.y1394308.
[12] WOO J W, YU S J, CHO S M, et al. Extraction optimization and properties of collagen from yellowfin tuna (Thunnus albacares) dorsal skin[J]. Food Hydrocolloids, 2008, 22(5): 879-887. DOI:10.1016/j.foodhyd.2007.04.015.
[13] NALINANON S, BENJAKUL S, VISESSANGUAN W, et al. Use of pepsin for collagen extraction from the skin of bigeye snapper(Priacanthus tayenus)[J]. Food Chemistry, 2007, 104(2): 593-601.DOI:10.1016/j.foodchem.2006.12.035.
[14]郝林华, 李八方. 多棘海盘车体壁胶原蛋白的研究[J]. 中国水产科学, 1999(2): 3-5. DOI:10.3321/j.issn:1005-8737.1999.02.005.
[15]王锡念, 徐志善, 孙钦军, 等. 不同方法提取鮟鱇鱼皮胶原蛋白的比较和分析[J]. 食品研究与开发, 2019, 40(10): 80-87. DOI:10.3969/j.issn.1005-6521.2019.10.015.
[16]韩玮, 邢瀚文, 施文正, 等. 罗非鱼胶原蛋白4种制备方法比较研究[J]. 河南农业大学学报, 2020, 54(1): 102-108. DOI:10.16445/j.cnki.1000-2340.20200215.005.
[17]赵然, 曹敏杰, 王晶, 等. 水产动物源胶原蛋白的提取及应用研究进展[J]. 食品安全质量检测学报, 2020, 11(22): 8157-8165.
[18]肖岚, 李诚, 付刚, 等. 5种蛋白酶对猪皮胶原蛋白水解效果的比较研究[J]. 食品研究与开发, 2015, 36(17): 10-14. DOI:10.3969/j.issn.1005-6521.2015.17.003.
[19]李莉, 顾赛麒, 王锡昌, 等. 响应面法优化酶法提取大鲵皮胶原蛋白工艺[J]. 中国水产科学, 2013, 20(4): 876-883. DOI:10.3724/SP.J.1118.2013.00876.
[20]李静, 叶欣, 冉旭. 高温高压提高大鲵皮胶原蛋白肽提取率的研究[J].食品工业, 2015, 36(10): 1-5.
[21]周艳华, 张鹏飞, 李涛, 等. 干制大鲵皮胶原蛋白提取工艺优化[J].食品工业, 2020, 41(1): 1-4.
[22]周艳华, 谭璐, 李涛, 等. 酶解大鲵皮胶原蛋白制备抗氧化肽工艺研究[J]. 中国食品添加剂, 2019, 30(2): 111-117. DOI:10.3969/j.issn.1006-2513.2019.02.010.
[23]徐阳, 孙强, 李静, 等. 大鲵胶原蛋白多肽口服液的开发研究[J].食品工业, 2016, 37(3): 1-5.
[24]欧阳力剑, 符广勇. 大鲵皮肤中胶原蛋白的初步提取分析与应用研究[J]. 科学养鱼, 2017(1): 72-73.
[25]杨慧, 陈德经, 夏冬辉, 等. 大鲵皮肤色素提取工艺及抗氧化研究[J].天然产物研究与开发, 2019, 31(5): 887-894. DOI:10.16333/j.1001-6880.2019.5.023.
[26]林方养, 杨耀东, 万婕, 等. 几种不同SDS-PAGE凝胶电泳染色方法的比较[J]. 安徽农业科学, 2014, 42(8): 2295-2296.
[27]中国商业联合会商业标准中心, 国家加工食品质量监督检验中心(广州), 广州市产品质量监督检验所. 肉与肉制品 羟脯氨酸含量测定: GB/T 9695.23—2008[S]. 北京: 中国标准出版社, 2009.
[28]顾赛麒, 李莉, 王锡昌, 等. 人工养殖大鲵皮胶原蛋白的性质研究[J].食品科学, 2014, 35(19): 74-79. DOI:10.7506/spkx1002-6630-201409016.
[29]宫子慧, 林琳, 孟昌伟, 等. 乳酸提取鮰鱼皮胶原蛋白工艺优化[J]. 肉类研究, 2011, 25(7): 18-23. DOI:10.3969/j.issn.1001-8123.2011.07.007.
[30]张强, 王倩倩, 陆剑锋, 等. 不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J]. 现代食品科技, 2014, 30(5): 104-110.
[31] ZHAO Guanli, LIU Yanliu, REN Jiaoyan, et al. Effect of protease pretreatment on the functional properties of protein concentrate from defatted peanut flour[J]. Journal of Food Process Engineering, 2013,36(1): 9-17. DOI:10.1111/j.1745-4530.2011.00646.x.