生物胺是一类具有生物活性的低分子质量、极性或半极性的含氮有机化合物,主要包括组胺、腐胺、尸胺、亚精胺、精胺、色胺、酪胺、苯乙胺等。这些化合物通常是由蛋白质或游离氨基酸在微生物的氨基酸脱羧作用或醛和酮的氨基化作用、转氨作用等生化反应中产生[1]。富含蛋白质的肉制品等食物或在细菌暴露下进行发酵的食物中可能积累较高含量的生物胺,适量的生物胺对维持人体新陈代谢和免疫活性具有积极作用,但由于生物胺具有潜在毒性,当这类物质在人体内蓄积到一定程度时会引起变态反应等不良后果[2]。明确生物胺的形成和控制方法,对生物胺的含量进行准确、快速检测,可以有效监控肉制品中生物胺的形成和积累,科学评价肉制品的质量,保障肉制品的食用安全。因此,本文综述近年来国内外肉制品中生物胺的形成因素、检测技术、控制方法等方面的研究进展,以期为今后肉制品中生物胺的控制和风险监测提供参考。
1 生物胺的基本特性
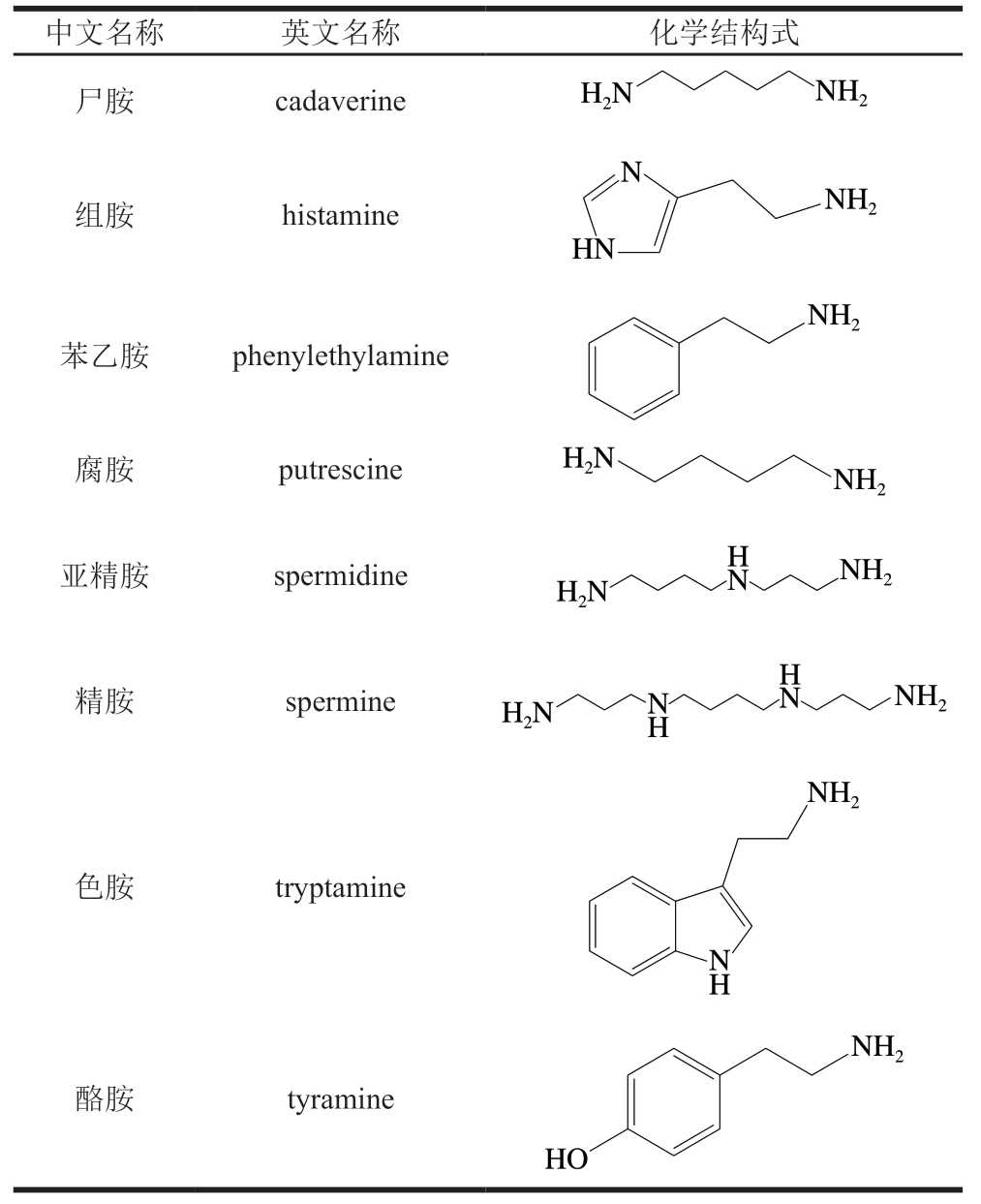
根据结构,生物胺可以分为3 种类型:脂肪族(腐胺、尸胺、精胺和亚精胺等)、芳香族(酪胺、苯乙胺等)和杂环类(组胺、色胺);根据氨基的数量,生物胺可以分为2 种类型:多胺类(精胺、亚精胺)和单胺类(酪胺、腐胺、尸胺、色胺和苯乙胺等)[3]。根据来源,生物胺可以分为2 种类型:内源性生物胺和外源性生物胺,内源性生物胺主要指在不同组织中合成产生并通过血液系统传递的神经递质,它们具有生长调节、神经传递、炎症介质等生理功能,包括儿茶酚胺类(多巴胺、去甲肾上腺素、肾上腺素)、吲哚胺类(5-羟色胺、褪黑素)和组胺类。外源性生物胺是经常能在食品原料和加工品中检测到的抗营养因子,通常是不同氨基酸在不同氨基酸脱羧酶的作用下脱去α-羧基形成的胺类化合物,例如:组氨酸脱羧形成组胺,色氨酸脱羧形成色胺,酪氨酸脱羧形成酪胺,赖氨酸脱羧形成尸胺[4-5]。通常外源性生物胺是肉制品等富含蛋白质的食品中生物胺类风险物质的主要来源。常见生物胺的基本信息见表1[6-7]。
表 1 常见生物胺的基本信息[6-7]
Table 1 Chemical structure of common biogenic amines[6-7]
?
人体适量摄入生物胺有利于健康,能够促进生长、增强代谢,但过量摄入则会引起面部潮红、发痒、皮肤过敏、呼吸受损、心动过速和呕吐等一系列不良反应,其中毒性最大的生物胺为组胺和酪胺。过度摄入组胺可能会导致头痛、荨麻疹、哮喘、消化障碍及血压异常等[8-9]。对于敏感人群,组胺的不耐受可能是由消化道中二胺氧化酶活性降低导致,这种解毒能力的降低可能来源于个体的遗传倾向或抗抑郁药、抗结核药等几种药物的协同作用[10]。过量摄入酪胺会引起高血压、头痛、出汗和瞳孔扩张等不良反应[11-12]。腐胺、尸胺等生物胺本身毒性虽然较小,但其作用类似于人工药物,可以结合二胺氧化酶,降低二胺氧化酶的解毒能力,使得组胺和酪胺的毒性增加,另外这些胺类还可与某些亚硝基化合物反应产生具有致癌作用的N-二甲基亚硝胺、N-亚硝基吡咯烷和N-亚硝基哌啶,也使得组胺和酪胺的毒理效应大大增加[13-14]。
目前,由于不同生物胺毒性差异较大,难以通过控制生物胺的总量来评估其毒性,同时不同种族、地域和国家的人群对生物胺的敏感性不同,中毒水平也随之变化,因此很难建立统一的生物胺毒性衡量尺度[8,15]。美国食品药品监督管理局规定,金枪鱼肉中组胺的最大摄入量为50 mg/kg[16]。欧洲食品安全局规定,正常人的组胺最大摄入量为每人每餐50 mg,酪胺最大摄入量为每人每餐600 mg,但对于服用第3代单胺氧化酶抑制剂的人群来说,酪胺的最大摄入量为每人每餐50 mg,对于服用经典单胺氧化酶抑制剂的人群来说,酪胺的最大摄入量为每人每餐6 mg[8],我国GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》[17]规定鲐鱼、金枪鱼等高组胺鱼类组胺含量应低于40 mg/100 g,其他海水鱼类中组胺含量应低于20 mg/100 g。随着研究水平的提高,各个国家对肉类等食品中生物胺的限量规定也会更加详细,进而保障人民的食品安全。
2 肉制品中生物胺的形成及影响因素
2.1 肉制品中生物胺的形成
肉制品中含有丰富的蛋白质,蛋白质在蛋白酶和肽酶的作用下分解形成游离氨基酸,游离氨基酸是生物胺形成过程中的重要前体物质,生物胺是游离氨基酸在微生物氨基酸脱羧酶催化下脱羧反应的产物,游离氨基酸含量直接影响生物胺的积累程度,因此肉制品生物胺的形成通常与肉制品中的蛋白质分解密切相关,游离氨基酸的脱羧基过程如下:
肉制品中生物胺形成的必要条件为具有氨基酸、寡肽等生物胺的前体物质、存在可分泌氨基酸脱羧酶的微生物、适宜微生物存活、繁殖及脱羧酶发挥活性的环境条件等[8,18-19]。研究发现,具有氨基酸脱羧酶活性的微生物主要来源于乳杆菌属、肠球菌属、肠杆菌属、假单胞菌属、片球菌属、乳球菌属等;肉制品中腐胺、酪胺、组胺和尸胺含量较高,产生这几种生物胺的微生物主要来源于乳杆菌属、肠杆菌属、假单胞菌属和肠球菌属等[20]。
2.2 肉制品中生物胺形成的影响因素
肉制品中普遍存在生物胺,肉制品中生物胺的含量主要由原料肉、生产工艺和贮藏条件等决定。
2.2.1 原料肉
原料肉的质量对肉制品中生物胺的形成有一定的影响,一方面,原料肉可以影响生物胺产生菌和腐败菌的生长,另一方面,原料肉中蛋白质丰富,为生物胺的形成提供底物,也为脱羧反应提供反应发生的场所。不同原料肉中生物胺的含量有差异,精胺和亚精胺是天然存在的生物胺类物质,在猪肉、羊肉、牛肉、鸡肉等新鲜原料肉中含量较高,其他生物胺类物质在新鲜原料肉中含量则相对较低[20]。但原料肉中富含蛋白质、水分活度较高、营养丰富,为埃希氏菌属、假单胞菌属、沙门氏菌属和乳酸菌属等具有氨基酸脱羧酶活性微生物的生长繁殖创造了良好条件,原料肉中微生物的种类和数量可直接影响肉制品中生物胺的含量,因此,肉的新鲜程度和微生物生长过程中发生的氨基酸脱羧反应决定了肉制品中生物胺的积累情况[21]。王新新等[22]对冷藏兔肉中的细菌进行分离纯化,检测分离到的菌株生物胺产生能力,研究发现,肠杆菌属的沙雷氏菌具有较强的生物胺产生能力,培养24 h后该菌产生苯乙胺0.05 mg/mL、腐胺0.41 mg/mL、尸胺0.23 mg/mL。Lu Shiling等[23]研究不同产地的42 份中式传统香肠样品,结果表明,肠杆菌总量与总生物胺含量具有高度相关性,说明原料所含微生物是影响中式传统香肠中生物胺形成的重要因素之一。原料肉中的脂肪含量会影响肉制品中生物胺的含量,脂肪含量越高,肉制品中总生物胺的含量越低[24]。
2.2.2 生产工艺
肉制品,尤其是发酵肉制品中生物胺的形成与所使用的发酵剂、原料肉自身和生产环境中所含有某些产胺微生物密切相关。发酵剂对肉制品中生物胺的影响较为复杂,不同菌种可能造成肉制品中不同生物胺的积累。原料肉和生产环境中存在的微生物部分具有分泌氨基酸脱羧酶的能力,可分解蛋白质产生氨基酸等生物胺的前体物质。在发酵过程中所形成的适宜温度条件、水分活度、pH值等工艺参数也可影响肉制品中的游离氨基酸脱羧形成生物胺,造成生物胺的积累。由于革兰氏阳性菌、革兰氏阴性菌、酵母菌均可以产生生物胺,但不同菌株的产胺能力有所不同。因此,不同发酵肉制品中生物胺的含量差异较大,同一类发酵肉制品中生物胺的含量也不尽相同。此外,在发酵过程中,微生物细胞对酸胁迫的反应也可激活脱羧反应,为微生物提供额外的能量来源[25]。Branko等[26]发现:在低温下进行干发酵香肠的发酵,成熟过程较为缓慢,随着香肠的成熟,水分活度由0.96降低至0.82,在一定程度上抑制了产胺腐败微生物的生长;在发酵成熟的第1阶段,pH值明显下降,微生物对酸胁迫的反应被激活,游离氨基酸增多,生物胺的形成增加;在发酵成熟的第2阶段,随着蛋白质降解和生物胺等碱性物质的积累,pH值升高;发酵香肠中微生物的菌群种类分析结果显示,乳酸菌为主要菌群,其次是肠球菌,而生产过程结束时假单胞菌和肠杆菌相继消失,乳酸菌和肠球菌是产生酪胺、腐胺、尸胺的主要菌种,肠杆菌是产生组胺的主要菌种,因此,随着干发酵香肠的成熟,酪胺、尸胺和腐胺的含量显著增加,但直到熟化过程结束未检出组胺。Anderegg等[27]在对62 个香肠样本的检测中发现,46 个样本中含有酪胺,20 个样本中含有腐胺,9 个样本中含有尸胺,8 个样本中含有组胺,且肠球菌和木糖葡萄球菌是酪胺的主要产生菌种。Favaro等[28]对肉制品中生物胺进行检测,结果表明,原料肉中仅含有少量的酪胺、亚精胺和精胺,发酵香肠和干腌肉制品中则含有较高含量的酪胺、腐胺和尸胺,说明生产过程促进了肉制品中生物胺的形成。
2.2.3 适宜的环境条件
适宜的环境条件有利于微生物生长、脱羧酶合成和脱羧酶活性的提高,可促进肉制品中生物胺的形成。影响微生物生长和脱羧酶活性的环境条件主要有pH值、贮藏温度、贮藏时间等。
2.2.3.1 pH值
pH值是影响肉制品中生物胺产生的关键因素,不仅影响微生物的生长,对氨基酸脱羧酶的活性也有重要影响。酸度的增加可抑制微生物的生长,氨基酸脱羧酶在酸性环境下具有较高活性,可促进游离氨基酸转变成生物胺的脱羧反应,但在低pH值环境中细菌为了抵抗外部酸性环境会产生更多氨基酸脱羧酶,二者共同作用决定了肉制品中生物胺的含量[29]。Branko等[26]认为适宜的pH值有助于生物胺的积累。王真真等[30]的研究显示,在真空包装条件下,冷却猪肉pH值在第2天降低到最低值,随后持续增加,相关性分析结果表明,冷却猪肉中腐胺、尸胺和酪胺的积累与pH值呈显著相关性。
2.2.3.2 贮藏温度
贮藏温度是肉制品中生物胺的形成和积累的重要影响因素之一。20~37 ℃是多数含脱羧酶细菌生长的最适温度,较高温度会提高蛋白质水解酶和氨基酸脱羧酶活性,低温下产生物胺微生物生长能力和产生物胺活性会受到抑制,生肉或熟肉制品在贮藏过程中,贮藏温度的升高会促进肉制品中部分生物胺类物质的形成。Ngapo等[31]研究发现,-1.7 ℃冷冻43 d的加拿大猪肉中腐胺、精胺和亚精胺含量高于等质量、4.0 ℃冷藏5 d的日本猪肉。Sun Xueying等[32]研究结果显示,所有干发酵香肠在20 ℃条件下贮藏过程中色胺、腐胺、尸胺、组胺和酪胺含量均增加,且20 ℃贮藏42 d后样本中生物胺的含量明显高于4 ℃贮藏样本中生物胺的含量。
2.2.3.3 贮藏时间
贮藏时间也是肉制品中生物胺形成的重要影响因素,贮藏时间的延长会造成肉制品中部分生物胺含量增加。Rabie等[33]发现,在4 ℃贮藏28 d过程中,牛肉香肠、马肉香肠和火鸡肉香肠中腐胺、酪胺、尸胺、组胺等生物胺含量明显增加,同时随着贮藏时间的延长,总生物胺含量呈上升趋势。Ngapo等[31]的研究发现,随着冷藏时间的延长,猪肉中腐胺、精胺和亚精胺含量增加,酪胺仅在-1.7 ℃冷藏43 d后才在某些样品中检测到,说明贮藏时间可影响肉制品中生物胺的形成。还有研究显示,7 ℃贮藏21 d过程中,鸡肉中精胺和亚精胺含量变化不大,但尸胺、腐胺和酪胺含量在贮藏7 d后显著增加[34]。
3 肉制品中生物胺的检测
近年来,随着检测技术和检测方法的不断革新,肉制品中生物胺的检测方法越来越灵敏、准确。迄今为止,已有多种分析方法被用于检测生物胺,最常用的检测方法有毛细管电泳色谱法[35]、高效液相色谱法和液相色谱-串联质谱法[36-37]及生物传感器法[38]。
3.1 肉制品中生物胺检测的前处理方法
由于肉制品中生物胺的含量较低且存在基质干扰,为了使样品中待测组分实现较高的回收率,同时降低基质干扰,提高检测灵敏度,样品在检测前通常需要进行前处理。目前常见的前处理方法有酸性液体脱蛋白法、液-液萃取法和固相萃取法等[39]。
3.1.1 酸性液体脱蛋白法
食品中生物胺的固液萃取常以盐酸溶液作为脱蛋白剂,但肉制品中蛋白质含量丰富,基质干扰严重,肉制品的脱蛋白溶剂常选用三氯乙酸和高氯酸等。但仅采用三氯乙酸、高氯酸等酸性溶剂脱蛋白并不彻底,提取物中仍残留很多干扰性杂质,在酸性液体脱蛋白处理后增加固相萃取等步骤可获得更好的除杂效果,Caroline等[40]采用固相萃取结合高氯酸进行猪肉样品前处理。
3.1.2 液-液萃取法
液-液萃取法是利用待测组分在2 种互不相容的溶液中溶解度不同,将待测组分提取出来的前处理方法。液-液萃取法效果受溶剂的选择、萃取时间、搅拌方式等多种因素的影响。传统的液-液萃取法操作复杂,溶剂消耗量大,且易发生乳化现象。盐析辅助液-液萃取可促进相分离,盐析作用提高待测组分在水和水溶性有机溶剂之间的萃取效率。Francisco等[41]采用盐析辅助液-液萃取对肉制品进行前处理后,测定肉制品中β-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺等生物胺。
3.1.3 固相萃取法
固相萃取法是利用高效、高选择性的固体吸附剂将液体中的待测组分进行吸附,从而使待测组分与样品中的杂质分离,然后再利用洗脱液洗脱或加热等方法使待测组分与固相吸附剂分离,从而达到分离和富集待测组分的目的。固相萃取法具有不需要挑选互不相溶的溶剂、处理过程中不会产生乳化现象、提取高效等特点,常用来代替液-液萃取等除杂手段,是测定肉制品中生物胺类成分应用较为广泛的前处理方法。Chang Qingyun等[42]通过将功能化的共价有机骨架用作固相萃取吸附剂,成功萃取了肉类样品中色胺、正丁胺、苯乙胺、尸胺、腐胺、酪胺、精胺和亚精胺8 种生物胺。Molognoni等[43]采用固相萃取法处理包括生物胺类物质在内的17 种待测组分。近年来,随着新型材料的研发,肉制品中生物胺的测定可选择具有高度专一性、高度选择性的纳米聚合物作为萃取填料,能够选择性浓缩痕量待测组分,相比传统的固相萃取技术可大幅提高分离效率和分析准确性[44]。另外,固相萃取溶剂虽然提取效率较高,但溶剂消耗量大、耗时较长,研究者基于固相萃取技术开发出了固相微萃取技术,也被用于肉制品中生物胺类物质的前处理[45]。
3.2 液相色谱法
液相色谱法是定量分析肉制品中生物胺最为广泛的检测方法,具有检测灵敏度高、分析速度快、定量准确等优点,在检测器的选择方面,最常用的是紫外检测器和荧光检测器,但由于多数生物胺本身没有足够的紫外可见吸收,也没有明显的荧光效应,样品未经衍生化,采用紫外检测器或荧光检测器直接进行液相色谱检测较为困难。因此,为了提高检测灵敏度,在检测前通常先要对生物胺进行衍生化处理。根据衍生方式不同,衍生方法可分为柱前衍生和柱后衍生。常用的衍生剂包括邻苯二醛、苯甲酰氯、丹磺酰氯、二硝基苯甲酰氯、6-氨基喹啉基-N-羟基琥珀酰亚胺基氨基甲酸酯和1,2-萘醌-4-磺酸盐等,丹酰酰氯和苯甲酰氯多作为柱前衍生剂,邻苯二醛多作为柱后衍生剂[46-48]。液相色谱-荧光检测联用技术是较早用于检测生物胺的方法,随着二极管阵列检测器的使用,实现了对多种生物胺的同时检测。Papavergou等[49]采用高效液相色谱法测定希腊零售市场上出售的50 种发酵香肠中生物胺的含量,样品经苯甲酰氯柱前衍生化后,通过紫外检测器检测到腐胺、尸胺、色胺、苯乙胺和亚精胺,经过邻苯二甲酸二醛柱上衍生后,通过荧光检测器检测到酪胺和组胺。张殿伟等[50]以5 g/100 mL三氯乙酸作为提取溶剂,以丹磺酰氯作为衍生试剂,建立发酵肉制品中色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺和精胺等8 种常见生物胺的高效液相色谱检测方法。衍生化处理结合液相色谱测定肉制品中生物胺可同时处理大量样品,但操作繁琐、耗时较长,衍生产物不稳定,易造成方法重现性相对较差。液相色谱-质谱联用技术的出现实现了比液相色谱-荧光联用技术和液相色谱-紫外联用技术更灵敏、更准确、更快速的检测,采用液相色谱-质谱联用技术对一些相对简单样品中的生物胺进行检测时,通常不需要进行衍生即可进行准确的定性和定量分析。同时采用选择离子监测模式或多反应监测模式可以更灵敏、更快速地实现样品中生物胺的检测[51-52]。Molognoni等[43]采用液相色谱-串联质谱法在10 min内完成了对包括生物胺在内的17 种待测组分的分析,并在生、熟、干发酵等89 个不同类型肉制品中验证了方法的适用性。在液相色谱方面,超高效液相色谱技术及亚二微米全多孔颗粒色谱柱的应用进一步提升了液相色谱技术对肉制品中生物胺的快速检测。Caroline等[40]采用超高效液相色谱法与荧光检测器联用建立了食品中10 种生物胺的检测方法,此方法可用于检测烤肉中色胺、亚精胺、精胺、腐胺等生物胺的含量。
3.3 毛细管电泳色谱法
目前毛细管电泳色谱法常用的分离方法有毛细管区带电泳、毛细管凝胶电泳、毛细管等速电泳、毛细管等电聚焦电泳和胶束电动毛细管色谱。与高效液相色谱法相比,毛细管电泳色谱法具有分析时间短、分离速度快、有机溶剂用量小、成本低等优点,但对低含量的生物胺不敏感,检出限较高,迁移时间的重现性低于高效液相色谱法。随着研究的深入,这些缺点在一定程度上得到了克服。通过衍生化、间接光度滞留或毛细管衍生化等方法可以提高紫外检测的灵敏度,同时,在线样品预浓缩和在线结合毛细管区带电泳和毛细管等速电泳可以提高检测灵敏度。在进行毛细管电泳色谱分析之前,应首先对样品进行预处理,通过离子交换柱在流动注射系统中进行净化和预浓缩,该方法在肉制品等食品中生物胺的测定方面可能具有广阔的应用前景[35]。Jessica等[53]采用毛细管区带电泳法分离尸胺、组胺、腐胺、色胺和酪胺,所有标准曲线的相关系数均高于0.99,检测限为7~50 μg/L。
3.4 生物传感器法
生物传感器法是目前生物胺检测技术的一个热点研究方向,主要采用抗原、抗体、酶等物质作为生物探针,利用其与生物胺发生的特异反应,通过换能器将反应结果输出为可检测的信号,通过信号分析待测物质,实现对生物胺的分析,具有特异性高、操作简单、检测速度快等优点。Jin等[54]利用硝化聚噻吩和生物胺之间形成电荷转移络合物,颜色明显变暗,吸收响应率与生物胺的饱和蒸气压呈显著相关性的特性,制备了可测定腐胺和尸胺的生物传感器。Enisa等[55]以腐胺氧化酶、二胺氧化酶为催化剂,基于4-氨基丁醛的酶氧化反应制备生物传感器,该生物传感器可用于肉类样品中腐胺含量的测定。有研究者采用微悬臂[56]、纳米纤维[57]建立可测定生物胺的生物传感器。还有研究[38,58]采用纳米金为比色探针,研发出可快速筛查禽肉样品中组胺,并可用于监测生肉和腌制肉变质情况的生物传感器。生物传感器具有特异性较强、操作快捷简便等特点,但由于酶来源、酶活性的不稳定性以及生物传感器较高的成本,在实际应用过程中常受到限制。
4 肉制品中生物胺的控制
生物胺不易挥发,稳定性强,一旦形成很难破坏,生物胺的过量积累会造成许多不良影响,随着人们对食品安全的要求不断提高,控制生物胺的研究就显得尤为重要。肉制品中生物胺可从原料肉、生产工艺、天然保鲜剂、降解生物胺等多途径进行控制。
4.1 原料肉
原料肉的卫生情况与肉制品中生物胺的含量关系密切,原料肉受到肠杆菌、肠球菌等产胺腐败菌的污染会导致肉制品中生物胺的积累,控制好原料肉的卫生状况是保证肉制品质量安全的必要措施。低温环境可抑制产胺微生物的生长,降低氨基酸脱羧酶的活性,从而有效降低原料中生物胺的含量。研究显示,将野猪肉贮藏21 d,在0 ℃条件下处理的原料肉中生物胺含量明显低于7 ℃和15 ℃条件下处理的原料肉,随着贮藏时间的延长,不同温度下贮藏的原料肉中生物胺含量均有增加[59]。因此,为了保证肉制品的质量安全,生产时应选用新鲜的或低温条件下贮藏时间较短的原料肉。
4.2 生产工艺
在肉制品生产过程中通过降低水分活度、适当提高pH值、采用低温工艺等可降低氨基酸脱羧酶的活性,减少肉制品中生物胺的形成。对于生物胺含量通常较高的发酵肉制品来说,在工艺参数设计中选择合适的具有氨基酸氧化酶活性的发酵剂是控制肉制品生物胺含量最有效的措施。研究发现,复配发酵剂对肉制品中生物胺具有较好的抑制作用。Xie Chong[60]、李秀明[61]等筛选出的木糖葡萄球菌和植物乳杆菌组成的复配发酵剂可降低发酵香肠中生物胺含量。Lu Shiling等[62]发现,费氏乳杆菌与腐生葡萄球菌组成的复配发酵剂对发酵香肠中组胺、腐胺、尸胺和酪胺的生长具有明显抑制作用。王德宝等[63]选择清酒乳杆菌与木糖葡萄球菌复配作为羊肉香肠发酵剂,添加复配发酵剂的羊肉香肠中腐胺含量增加速率缓慢,9~37 d的发酵过程中酪胺含量下降速率显著加快,说明复配发酵剂可有效降低羊肉香肠中生物胺的含量。有的发酵剂虽然本身不具备氨基酸脱羧酶活性,但可以与氨基酸脱羧酶形成竞争,也可实现抑制氨基酸脱羧酶活性的作用。赵冰等[64]的研究证明,乳酸菌组产品中形成的乳酸菌优势菌群能够抑制其他微生物的生长,有效控制生物胺的生成,降低生物胺含量。
4.3 天然保鲜剂
天然保鲜剂通常含有酚类物质和β-羟基酮结构等,这些物质能够清除生物体中的羟自由基、超氧自由基,减少脂质过氧化物,具有一定的抑菌作用,对生物胺的形成具有较好的抑制效果。常用的天然保鲜剂有乳酸链球菌素、壳聚糖、蒜辣素、桂皮挥发油、丁香油酚及茶多酚等。Tang Hui等[65]的研究指出,姜辣素、乳酸链球菌素对骆驼肉中的尸胺、腐胺、精胺、色胺等生物胺的形成具有抑制作用。姜皓等[66]认为,茶多酚、VC、VE、迷迭香组成的复合天然抗氧化剂和茶多酚、VE组成的复合天然抗氧化剂可显著降低产品中生物胺的含量。孙钦秀等[67]研究发现,哈尔滨风干肠中添加含有肉桂、丁香和八角的复合香辛料提取物,由于香辛料中含有挥发油,可抑制腐败微生物的生长,从而降低哈尔滨风干肠中生物胺的含量。党晓燕等[68]的研究结果表明,壳聚糖、丁香精油、肉桂精油和大蒜精油可通过抑制微生物的生长减少猪肉中组胺、腐胺、酪胺和尸胺的生成。陈援援等[69]发现,复合抗氧化剂和复合香辛料混合添加到风干香肠中,可较好抑制组胺和酪胺的形成。Fabio等[70]评估在干发酵香肠加工过程中添加葡萄酒对生物胺积累等方面的影响,实验结果显示,葡萄酒的添加可降低pH值,对肠杆菌属细菌等产生物胺菌种的生长有抑制作用,含有葡萄酒的样品中腐胺含量明显降低。Wang Xinhui等[71]发现,葡萄籽提取物通过抑制肠杆菌的生长繁殖可降低腊肉中组胺和苯乙胺含量,尸胺和腐胺含量的增长速率明显低于未添加葡萄籽提取物的处理组。
4.4 降解生物胺
一些从发酵食品中分离出来的菌株被证明可以通过产生胺氧化酶来降解生物胺。Almudena等[72]从葡萄酒和其他相关来源分离得到的菌株中,25%的菌株能降解组胺,18%的菌株能降解酪胺和腐胺,9 株乳酸菌和球菌表现出较强的生物胺降解能力。Capozzi等[73]筛选出2 株具有降解腐胺和酪胺能力的植物乳杆菌,体外评估实验结果显示,2 株植物乳杆菌具有协同降解生物胺的作用。Li Yuxin等[74]从香肠、熏肉等中分离出的戊糖片球菌MSZ22、戊糖片球菌MSZ12、戊糖片球菌MGC2和木糖葡萄球菌YCC3可降解生物胺。
5 肉制品中生物胺的风险评估
风险评估是系统采用一切科学技术及信息,在特定条件下,对动植物或环境暴露于某危害因素产生或将产生不良效应的可能性和严重性的科学评价[75]。《中华人民共和国食品安全法》中明确,食品安全风险评估的结果是制定和修订食品安全标准和实施食品安全监管工作的科学依据,风险评估能够帮助明确食品安全监管的重点,同时可促进食品安全检测技术的发展[76]。对于肉制品同样适用,通过对肉制品中生物胺进行风险评估,可进一步保障人民的身体健康和生命安全。欧盟对发酵食物中生物胺的食用风险非常重视,2011年欧洲食品安全局在收集了大量欧洲人群生物胺暴露风险数据的基础上,对发酵食物中生物胺的形成进行风险评估,结果表明,对正常人来说,通常每人每餐25~50 mg的组胺暴露量、不超过600 mg的酪胺暴露量不会对人体带来健康风险,但对于患有某些疾病的人群或饮食中常有发酵香肠、啤酒、芝士、发酵鱼肉等多种生物胺含量较高的发酵食品人群来说,酪胺的摄入安全风险就会增加[8]。Wüst等[77]通过对2010—2015年奥地利的543 个食物样本以及2008年的食物消费数据进行分析,认为对于奥地利消费者而言,饮食中色胺的摄入不会对健康个体造成不利的健康影响,但该评估没有考虑到同时摄入的生物胺的综合作用,以及由于单胺氧化酶活性降低而增加的对色胺的敏感性。Torović等[78]经过风险评估分析得出,食用干发酵香肠可导致健康人群对组胺和酪胺的摄入量增加,分别为阈值剂量的11.9%和3.4%。由于生物胺种类多样,影响因素众多,不同国家、不同种族的人对生物胺的敏感性不同,健康状态也影响人体对生物胺的敏感性,原料肉的卫生状况、不同肉制品种类、生产各环节工艺参数可造成肉制品中生物胺含量的差异巨大,不同生物胺之间相互作用、其他食物中生物胺的摄入等也可影响肉制品中生物胺风险评估结果[79],所以科学、准确评价肉制品中生物胺的风险需要大量、全方位、持续性的数据支撑,科研部门和政府部门应统筹协作,以科研部门建立的科学评估模型等新型研究方法为基础,由政府部门规划、协调肉制品产业链、普查人群等规模性事物,形成网格化、系统性的研究体系,为获得我国肉制品中生物胺等食品风险物质的风险评估结果,有效控制食用风险做好保障。目前对于肉制品中生物胺的风险评估分析较少,风险评估作为国际公认的食品安全评估方法,是制定肉制品中生物胺相关食品安全标准和进行风险管理的重要依据。因此,开展肉制品中生物胺的风险评估研究,对我国市场监督管理部门针对性、高效实施肉制品风险管理措施、降低我国居民肉制品中生物胺摄入风险,推动肉制品行业发展等方面都具有重要意义。
6 结 语
适量的生物胺有利于人体的正常生理活动,但是生物胺的过量积累会导致人体产生一系列不良反应。肉制品是人们食物结构中的必要组成部分,随着人民生活水平的提高,人们对于肉制品安全性的要求会不断提升。肉制品中含有丰富的蛋白质,具备形成生物胺所需的适宜条件,因此,生物胺是肉制品中必然存在的一类风险物质,严格控制肉制品中生物胺的含量对于保障人体健康具有重要意义。深入研究肉制品中生物胺的形成,针对性地对影响生物胺形成的各种因素进行调节,为将来对生物胺进行靶向调控奠定坚实的基础。肉制品是一种复杂的基质,进一步改进前处理方法和检测技术,减少处理步骤、提高处理效果,消除基质干扰,增强检测专属性,使操作简单快速、分析灵敏度提高、准确性更强,是当前食品安全检测的研究方向和诉求,质谱技术的革新可实现对肉制品中痕量生物胺的快速、准确、多成分检测,生物传感器因其操作简单、检测结果可视化,在对肉制品中生物胺的快速检测方面将有巨大的发展空间。基于对生物胺形成机制的深入认识和检测技术的不断提高,生物胺的控制方法将更加精准。目前很多研究显示,天然保鲜剂可有效抑制肉制品中产生物胺微生物的繁殖,降低肉制品中生物胺的积累量,我国是资源大国,植物自然资源丰富,研究者们可以进一步筛选对肉制品中生物胺具有高效、特效抑制作用的植物提取物,制备安全、有效的肉制品保鲜剂,进而改进肉制品的保鲜工艺。同时,风险评估作为一种科学识别、确认、评价对人体健康造成不良影响的危害因子的方法,应充分运用这一工具来科学评估肉制品中生物胺的风险,从而使我国肉制品中生物胺的风险评估体系更加完善,肉制品的食用安全得到保障。
[1] PAPAGEORGIOU M, LAMBROPOULOU D, MORRISON C,et al. Literature update of analytical methods for biogenic amines determination in food and beverages[J]. Trends in Analytical Chemistry, 2018, 98: 128-142. DOI:10.1016/j.trac.2017.11.001.
[2] FAHAD D A, ALAA E M, MOHAMED A H, et al. Biogenic amines and aflatoxins in some imported meat products: incidence, occurrence,and public health impacts[J]. Journal of Food Quality, 2020, 3: 1-7.DOI:10.1155/2020/871879.
[3] 王德宝, 赵丽华, 袁倩, 等. 发酵肉制品中生物胺种类及其影响因素分析研究[J]. 食品工业, 2014, 35(8): 228-232.
[4] GAURI J, PRADEEP K S, RANDHIR S D, et al. Biogenic amines in meat and meat products and its public health significance: a review[J].Journal of Food Science and Technology, 2015, 52: 6835-6846.DOI:10.1007/s13197-015-1860-x.
[5] 唐小曼, 唐垚, 张其圣, 等. 传统发酵蔬菜中生物胺的研究进展[J].食品工业科技, 2019, 40(15): 345-348; 355. DOI:10.13386/j.issn1002-0306.2019.15.057.
[6] KLAVS M S, VIOLETTA A, BEKZOD K, et al. Biogenic amines:a key freshness parameter of animal protein products in the coming circular economy[J]. Food Science, 2018, 22: 167-173. DOI:10.1016/j.cofs.2018.05.014.
[7] ARCHANA J, KRISHNA K V. Strategies in liquid chromatographic methods for the analysis of biogenic amines without and with derivatization[J]. TrAC Trends in Analytical Chemistry, 2018, 109:62-82. DOI:10.1016/j.trac.2018.10.001.
[8] JOHN D C, BIRGIT N, HERBERT B, et al. Scientific opinion on risk based control of biogenic amine formation in fermented foods[J].EFSA Journal, 2011, 9: 2393-2486. DOI:10.2903/j.efsa.2011.2393.
[9] MARTUSCELLI M, ARFELLI G, MANETTA A C, et al. Biogenic amines content as a measure of the quality of wines of Abruzzo(Italy)[J]. Food Chemistry, 2013, 140: 590-597. DOI:10.1016/j.foodchem.2013.01.008.
[10] LJERKA P. Seafood allergy, toxicity, and intolerance: a review[J].Journal of the American College of Nutrition, 2016, 35: 271-283. DOI:10.1080/07315724.2015.1014120.
[11] BEATRIZ D R, BEGONA R, DANIEL M L, et al. The dietary biogenic amines tyramine and histamine show synergistic toxicity towards intestinal cells in culture[J]. Food Chemistry, 2017, 218:249-255. DOI:10.1016/j.foodchem.2016.09.046.
[12] ELENA P, JUANA F, BEATRIZ S, et al. Impact of fermentation conditions and refrigerated storage on microbial quality and biogenic amine content of sauerkraut[J]. Food Chemistry, 2010, 123: 143-150.DOI:10.1016/j.foodchem.2010.04.021.
[13] 冯婷婷, 方芳, 杨娟, 等. 食品生物制造过程中生物胺的形成与消除[J].食品科学, 2013, 34(19): 360-366. DOI:10.7506/spkx1002-6630-201319074.
[14] BABURA R, LAXMI A. Investigation of biogenic amines content in fermented idli batter during storage[J]. Journal of Food Science and Technology, 2019, 56(4): 1775-1784. DOI:10.1007/s13197-019-03609-9.
[15] LU Yongmei, LU Xin, CHEN Xiaohong, et al. A survey of biogenic amines in Chinese rice wines[J]. Food Chemistry, 2007, 100(4): 1424-1428. DOI:10.1016/j.foodchem.2005.11.035.
[16] U. S. Food and Drug Administration. CPG Sec.540.525 Decomposition of histamines raw, frozen tuna and mahi-mahi, canned tuna, and related species. Revised compliance policy guide[EB/OL]. (2005-11-29)[2020-10-04]. https://www.fda.gov/regulatory-information/search-fdaguidance-documents/cpg-sec-540525-decomposition-and-histamineraw-frozen-tuna-and-mahi-mahi-canned-tuna-and-related.
[17] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准鲜、冻动物性水产品: GB 2733—2015[S]. 北京: 中国标准出版社,2016: 1.
[18] 于长青, 姚笛, 满永刚, 等. 发酵肉制品中生物胺的危害及控制[J]. 肉类研究, 2010, 24(1): 41-45. DOI:10.3969/j.issn.1001-8123.2010.01.013.
[19] 杨春婷, 赵晓娟, 白卫东. 肉类中的生物胺形成及其在肉类新鲜度评价中的应用研究进展[J]. 肉类研究, 2017, 31(1): 55-59.DOI:10.7506/rlyj1001-8123-201701010.
[20] FRAQUEZA M J, ALFAIA C M, BARRETO A S. Biogenic amine formation in turkey meat under modified atmosphere packaging with extended shelf life: index of freshness[J]. Poultry Science, 2012, 91(6):1465-1472. DOI:10.3382/ps.2011-01577.
[21] MEHDI T, ANA M H, FRANCISCO J C, et al. Quality assessment of fresh meat from several species based on free amino acid and biogenic amine contents during chilled storage[J]. Foods, 2018, 7(9): 132.DOI:10.3390/foods7090132.
[22] 王新新, 刘芳, 王道营, 等. 冷藏兔肉中嗜冷菌的分离鉴定及其产生物胺特性分析[J]. 食品科学, 2014, 35(19): 128-132. DOI:10.7506/spkx1002-6630-201419027.
[23] LU Shiling, XU Xinglian, SHU Ruihua, et al. Characterization of biogenic amines and factors influencing their formation in traditional Chinese sausage[J]. Journal of Food Science 2010, 75(6): 366-372.DOI:10.1111/ j. 1750-3841.2010.01677.x.
[24] 姜皓, 陈援援, 杨璐, 等. 原料肉脂肪比例对培根加工过程中安全性的影响[J]. 食品科学, 2020, 40(20): 300-306. DOI:10.7506/spkx1002-6630-20190605-048.
[25] GARDINI F, ÖZOGUL Y, SUZZI G, et al. Technological factors affecting biogenic amine content in foods: a review[J]. Frontiers in Microbiology, 2016, 7: 1218. DOI:10.3389/fmicb.2016.01218.
[26] BRANKO S, TATIANA T, VLADO T, et al. Biogenic amine content during the production and ripening of Sremski kulen, Serbian traditional dry fermented sausage[J]. Animal Science Journal, 2020,91(1): 13466. DOI:10.1111/asj.13466.
[27] ANDEREGG J, FISCHER M, DURIG J, et al. Detection of biogenic amines and tyramine-producing bacteria in fermented sausages from Switzerland[J]. Journal of Food Protection, 2020, 83(9): 1512-1519.DOI:10.4315/JFP-19-468.
[28] FAVARO G, PASTORE P, SACCANI G, et al. Determination of biogenic amines in fresh and processed meat by ion chromatography and integrated pulsed amperometric detection on Au electrode[J].Food Chemistry, 2007, 105(4): 1652-1658. DOI:10.1016/j.foodchem.2007.04.071.
[29] ROKAITYTE A, ZABORSKIENE G, MACIONIENE I, et al.Combined effect of lactic acid, bioactive components and modified atmosphere packaging on the quality of minced meat[J]. Food Technology and Economy, Engineering and Physical Properties, 2016,34(1): 52-60. DOI:10.17221/291/2015-CJFS.
[30] 王真真, 李苗云, 赵改名, 等. 真空包装冷却猪肉生物胺与腐败指标的相关性[J]. 食品科学, 2013, 34(14): 335-339. DOI:10.7506/spkx1002-6630-201314070.
[31] NGAPO T M, VACHON L. Biogenic amine concentrations and evolution in “chilled” Canadian pork for the Japanese market[J]. Food Chemistry, 2017, 233: 500-506. DOI:10.1016/j.foodchem.2017.04.120.
[32] SUN Xueying, DU Bao, ZHAO Lihua, et al. The effect of different starter cultures on biogenic amines and quality of fermented mutton sausages stored at 4 and 20 ℃ temperatures[J]. Food Science and Nutrition, 2020: 1-12. DOI:10.1002/fsn3.1748.
[33] RABIE M A, PERES C, MALCATA F X. Evolution of amino acids and biogenic amines throughout storage in sausages made of horse, beef and turkey meats[J]. Meat Science, 2014, 96: 82-87.DOI:10.1016/j.meatsci.2013.05.042.
[34] HUTAŘOVÁ Z, VEČEREK V, MARŠÁLEK P, et al. Changes in biogenic amine concentrations in meat of eviscerated pheasants(Phasianus colchicus) during storage at 7 ℃[J]. Acta Veterinanria Brno, 2013, 82: 169-174. DOI:10.2754/avb201382020169.
[35] AN Dong, CHEN Zhuqiu, ZHENG Jiachun, et al. Determination of biogenic amines in oysters by capillary electrophoresis coupled with electrochemiluminescence[J]. Food Chemistry, 2015, 168: 1-6.DOI:10.1016/j.foodchem.2014.07.019.
[36] TANJA B, SANDRA P, MIA B, et al. Biogenic amines in selected foods of animal origin obtained from the Croatian retail market[J].Food Additives and Contaminants, 2020, 37(5): 815-830.DOI:10.1007/s12161-020-01830-3.
[37] PLAKIDI E S, MARAGOU N C, DASENAKI M E, et al. Liquid chromatographic determination of biogenic amines in fish based on pyrene sulfonyl chloride pre-column derivatization[J]. Foods, 2020,9(5): 609. DOI:10.3390/foods9050609.
[38] EL-NOUR K M A, SALAM E T A, SOLIMAN H M, et al. Gold nanoparticles as a direct and rapid sensor for sensitive analytical detection of biogenic amines[J]. Nanoscale Research Letters, 2017, 12:231. DOI:10.1186/s11671-017-2014-z.
[39] ZHANG Yujia, ZHANG Yuan, ZHOU Yu, et al. A review of pretreatment and analytical methods of biogenic amines in food and biological samples since 2010[J]. Journal of Chromatography A, 2019,1605: 360-361. DOI:10.1016/j.chroma.2019.07.015.
[40] CAROLINE D, SOUMAYA B, FRANCOIS B, et al. Development of an analytical method for the simultaneous measurement of 10 biogenic amines in meat: application to beninese grilled pork samples[J]. Food Analytical Methods, 2019, 12: 2392-2400. DOI:10.1007/s12161-019-01587-4.
[41] FRANCISCO K C A, BRANDO P F, RAMOS R M, et al. Saltingout assisted liquid-liquid extraction with dansyl chloride for the determination of biogenic amines in food[J]. International Journal of Food Science and Technology, 2020, 55: 248-258. DOI:10.1111/ijfs.14300.
[42] CHANG Qingyun, ZANG Xiaohuan, WU Tong, et al. Use of functionalized covalent organic framework as sorbent for the solidphase extraction of biogenic amines from meat samples followed by high-performance liquid chromatography[J]. Food Analytical Methods,2019, 12: 1-11. DOI:10.1007/s12161-018-1324-9.
[43] MOLOGNONI L, DAGUER H, LEANDRO A D S P, et al. A multipurpose tool for food inspection: simultaneous determination of various classes of preservatives and biogenic amines in meat and fish products by LC-MS[J]. Talanta, 2018, 178: 1053-1066. DOI:10.1016/j.talanta.2017.08.081.
[44] MA Ning, FENG Cheng, QU Ping, et al. Determination of tetracyclines in chicken by dispersive solid phase microextraction based on metalorganic frameworks/molecularly imprinted nano-polymer and ultra performance liquid chromatography[J]. Food Analytical Methods,2020, 13: 1211-1219. DOI:10.1007/s12161-020-01744-0.
[45] PANG Yuehong, SUN Miao, SHEN Xiaofang, et al. Determination of benzo[a]pyrene in roast meat by in situ growth of covalent organic framework on titanium wire for solid-phase microextraction coupled with GC-FID[J]. Food Analytical Methods, 2020, 13: 1938-1946.DOI:10.1007/s12161-020-01812-5.
[46] IRENA B, JOANNA P. Simultaneous determination of biogenic amines and methylxanthines in food stuff-sample preparation with HPLC-DAD-FL analysis[J]. Food Analytical Methods, 2015, 8:963-972. DOI:10.1007/s12161-014-9972-x.
[47] SONIA S, OSCAR N, JAVIER S. Recent advances in the determination of biogenic amines in food samples by (U)HPLC[J].Journal of Agricultural and Food Chemistry, 2016, 64: 7667-7678.DOI:10.1021/acs.jafc.6b02789.
[48] RAMOS R M, VALENTE I M, RODRIGUES J A. Analysis of biogenic amines in wines by salting-out assisted liquid-liquid extraction and high-performance liquid chromatography with fluorimetric detection[J]. Talanta, 2014, 124: 146-151. DOI:10.1016/j.talanta.2014.02.026.
[49] PAPAVERGOU E J, SAWAIDIS I N, AMBROSIADIS I A. Levels of biogenic amines in retail market fermented meat products[J].Food Chemistry, 2012, 135(4): 2750-2755. DOI:10.1016/j.foodchem.2012.07.049.
[50] 张殿伟, 高月宇, 王金菊, 等. 高效液相色谱法分析发酵肉制品中生物胺[J]. 食品与发酵工业, 2019, 45(9): 256-261. DOI:10.3995/j.cnki.11-1802 /ts. 019788.
[51] JAIN A, VERMA K K. Strategies in liquid chromatographic methods for the analysis of biogenic amines without and with derivatization[J].Trends in Analytical Chemistry, 2018, 109: 62-82. DOI:10.1016/j.trac.2018.10.001.
[52] SIROCCHI V, CAPRIOLI G, RICCIUTELLI M, et al. Simultaneous determination of ten underivatized biogenic amines in meat by liquid chromatography-tandem mass spectrometry (HPLC-MS/MS)[J].Journal of Mass Spectrometry, 2014, 49(9): 819-825. DOI:10.1002/jms.3418.
[53] JESSICA O F M, LUIS M G, ELISABETE A P. Dansyl chloride as a derivatizing agent for the analysis of biogenic amines by CZE-UV[J].Chromatographia, 2020, 83: 767-778. DOI:10.1007/s10337-020-03896-x.
[54] JIN Y J, GISEOP K. Detection of biogenic amines using a nitrated conjugated polymer[J]. Sensors and Actuators B: Chemical, 2018, 271:183-188. DOI:10.1016/j.snb.2018.05.091.
[55] ENISA O M, SANDRO V. Development of new chemiluminescence biosensors for determination of biogenic amines in meat[J]. Food Chemistry, 2017, 235: 98-103. DOI:10.1016/j.foodchem.2017.05.031.
[56] WANG Ying, COSTA C A B, SOBOLEWSKA E K, et al. Microcantilevers for optical sensing of biogenic amines[J]. Microsystem Technologies, 2018, 24: 363-369. DOI:10.1007/s00542-016-3257-9.
[57] YUROVA N S, DANCHUK A, MOBAREZL S N, et al. Functional electrospun nanofibers for multimodal sensitive detection of biogenic amines in food via a simple dipstick assay[J]. Analytical and Bioanalytical Chemistry, 2018, 410: 1111-1121. DOI:10.1007/s00216-017-0696-9.
[58] CHOW C F. Biogenic amines- and sulfides-responsive gold nanoparticles for real-time visual detection of raw meat, fish,crustaceans, and preserved meat[J]. Food Chemistry, 2020, 311:125908. DOI:10.1016/j.foodchem.2019.125908.
[59] ZDEŇKA H, GABRIELA B, IRENA S, et al. Effect of storage conditions on the biogenic amine content in wild boar meat[J]. Acta Veterinanria Brno, 2014, 83: 61-65. DOI:10.2754/avb201483010061.
[60] XIE Chong, WANG Huhu, NIE Xiaokai, et al. Reduction of biogenic amine concentration in fermented sausage by selected starter cultures[J]. CyTA-Journal of Food, 2015, 13(4): 491-497. DOI:10.108 0/19476337.2015.1005027.
[61] 李秀明, 周伟, 鲍佳彤, 等. 不同乳酸菌发酵剂对发酵红肠品质的影响[J]. 肉类研究, 2019, 33(7): 7-13. DOI:10.7506/rlyj1001-8123-20190520-110.
[62] LU Shiling, XU Xinglian, ZHOU Guanghong, et al. Effect of starter cultures on microbial ecosystem and biogenic amines in fermented sausage[J]. Food Control, 2010, 21: 444-449. DOI:10.1016/j.foodcont.2009.07.008.
[63] 王德宝, 王晓冬, 康连和, 等. 不同发酵剂对发酵羊肉香肠有害生物胺控制及游离脂肪酸释放的影响[J]. 食品与发酵工业, 2018, 44(9):71-77. DOI:10.13995/j.cnki.11-1802/ts.016881.
[64] 赵冰, 李素, 成晓瑜, 等. 乳酸菌对羊肉风干香肠的影响[J]. 食品科学, 2015, 36(5): 109-114. DOI:10.7506/spkx1002-6630-201505021.
[65] TANG Hui, DARWISH W S, EL-GHAREEB W R, et al. Microbial quality and formation of biogenic amines in the meat and edible offal of camelus dromedaries with a protection trial using gingerol and nisin[J]. Food Science and Nutrition, 2020, 8(1): 1-8. DOI:10.1002/fsn3.1503.
[66] 姜皓, 陈援援, 杨璐, 等. 复合天然抗氧化剂对西式培根品质和安全性的影响[J]. 肉类研究, 2020, 34(7): 33-39. DOI:10.7506/rlyj1001-8123-20200220-049.
[67] 孙钦秀, 杜洪振, 李芳菲, 等. 复合香辛料提取物对哈尔滨风干肠中生物胺形成的抑制作用[J]. 食品科学, 2018, 39(1): 22-28.DOI:10.7506/spkx1002-6630-201801003.
[68] 党晓燕, 王凯丽, 王玮, 等. 天然保鲜液对猪肉微冻贮藏中生物胺含量的影响[J]. 食品科学, 2017, 38(7): 253-259. DOI:10.7506/spkx 1002-6630-201707040.
[69] 陈援援, 马凯华, 李璐, 等. 外源抑制物对风干肠风干过程中理化性质及安全品质的影响[J]. 肉类研究, 2020, 34(6): 14-20.DOI:10.7506/rlyj1001-8123-20200214-036.
[70] FABIO C, GIULIA T, CRISTIANA C, et al. Effect of wine addition on microbiological characteristics, volatile molecule profiles and biogenic amine contents in fermented sausages[J]. Meat Science, 2014, 96:1395-1402. DOI:10.1016/j.meatsci.2013.11.027.
[71] WANG Xinhui, ZHANG Yalin, REN Hongyang. Effects of grape seed extract on lipid oxidation, biogenic amine formation and microbiological quality in Chinese traditional smoke-cured bacon during storage[J].Journal of Food Safety, 2018: 12426. DOI:10.1111/jfs.12426.
[72] ALMUDENA G R, EVA M G R, BEGONA B, et al. Potential of wine-associated lactic acid bacteria to degrade biogenic amines[J].International Journal of Food Microbiology, 2011, 148(2): 115-120.DOI:10.1016/j.ijfoodmicro.2011.05.009.
[73] CAPOZZI V, RUSSO P, LADERO V, et al. Biogenic amines degradation by Lactobacillus plantarum: toward a potential application in wine[J]. Frontiers in Microbiology, 2012, 3: 122. DOI:10.3389/fmicb.2012.00122.
[74] LI Yuxin, YU Zhihui, ZHU Yingchun, et al. Selection of nitritedegrading and biogenic amine-degrading strains and its involved genes[J]. Food Quality and Safety, 2020. DOI:10.1093/fqsafe/fyaa027
[75] 刘景, 任婧, 孙克杰. 食品中生物胺的安全性研究进展[J]. 食品科学,2013, 34(5): 322-326.
[76] 陈君石. 风险评估在食品安全监管中的作用[J]. 农业质量标准,2009(3): 4-6. DOI:10.3969/j.issn.1674-8255.2009.03.002.
[77] WÜST N, RAUSCHER-GABERNIG E, STEINWIDER J, et al.Risk assessment of dietary exposure to tryptamine for the Austrian population[J]. Food Additives and Contaminants, 2017, 34(3): 404-420. DOI:10.1080/19440049.2016.1269207.
[78] TOROVIĆ L, VERA G, KVRGIĆ S L. Biogenic amine and microbiological profile of Serbian dry fermented sausages of artisanal and industrial origin and associated health risk[J]. Food Additives and Contaminants, 2019, 13: 1-8. DOI:10.1080/19393210.2019.1697380.
[79] 江荣花, 汪雯, 蔡铮, 等. 肉制品加工过程中食源性致病菌交叉污染及风险评估的研究进展[J]. 食品科学, 2018, 9(7): 305-311.DOI:10.7506/spkx1002-6630-201807045.