肌球蛋白为盐溶性蛋白,是肌原纤维蛋白的重要组成部分。肌球蛋白参与肉凝胶的形成过程,对肉制品的保水性具有重要影响[1]。肌球蛋白分子由2 条重链(myosin heavy chain,MHC)和4 条轻链(myosin light chain,MLC)组成,2 条MHC缠绕形成了杆状尾部和2 个球状头部,形如“Y”状[2]。肌球蛋白S1头部上存在大量的疏水性氨基酸,每个S1片段上都存在1 个ATPase活性中心,MLC与S1头部连接,可调节ATPase活性[3]。
肌红蛋白(myoglobin,Mb)是由1 条多肽链的珠蛋白和1 个血红素辅基构成,为肉品的主要呈色物质[4]。血红素辅基是1 个具有卟啉环平面结构的小分子,环中心为1 个亚铁离子或铁离子[5]。血红素辅基具有亲合性,铁卟啉上的2 个丙酸侧链以非共价相互作用与珠蛋白肽链中的2 个碱性氨基酸侧链相连,卟啉铁与珠蛋白肽链上氨基酸形成配位键,使血红素辅基结合在Mb的疏水性空腔中,这些结合力能够稳定Mb结构[6-9]。但是pH值、温度、盐、酶类等诸多因素会影响血红辅基与珠蛋白结合力的稳定性,引起Mb构象改变,从而导致血红素辅基有可能暴露甚至从Mb中脱落[10-13]。
血红素辅基是肉品中重要的促氧因子,能显著促进蛋白氧化的发生[14]。这是由于血红素辅基能够与蛋白中特有的肽链结合,同时血红素辅基中心可以与蛋白疏水空腔中的氨基酸形成配位作用和氢键。目前,对血红素辅基功能特性的研究大都集中在血红素辅基与脂质氧化的密切关系。近年来,研究发现适度氧化也对肉品保水性具有重要影响[15]。肌球蛋白是肌肉中的重要蛋白成分,对肉制品的质构特性和保水性影响显著,因此,研究血红素辅基与肌球蛋白的相互作用将为控制肉品氧化、改善肉品保水性提供参考。
1 材料与方法
1.1 材料与试剂
三黄鸡 江苏立华牧业股份有限公司;三黄鸡购买后暂养过夜,次日宰杀,快速取胸大肌,用于肌球蛋白提取。
血红素辅基 美国Sigma公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、溴酚蓝(bromophenol blue,BPB)(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
FE20/FG2 pH计、AL电子天平 瑞士梅特勒-托利多公司;T-25型数显匀浆机 德国IKA公司;多功能酶标仪 美国BioTek仪器有限公司;Mini-PROTEAN Tetra Cell垂直电泳系统 美国Bio-Rad公司;JS-680C全自动凝胶成像分析仪 上海培清科技有限公司;UniCenMR台式冷冻离心机 德国Herolab公司;Centrifuge 5424R小型冷冻离心机 德国Eppendorf公司;1500圆二色谱仪日本Jasco公司;LS-55荧光分光光度计 美国Perkin Elmer公司;SCIENTZ-D超声波细胞破碎仪 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 肌球蛋白的提取
参考Hayakawa等[16]的方法并略作改动。将现杀现取的鸡胸肉冰浴降温,去除筋膜和脂肪后切碎,与3 倍体积预冷提取液A(0.5 mol/L KCl、0.1 mol/L KH2PO4、50 mmol/L K2HPO4、5 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)-2Na、4 mmol/L焦磷酸钠,pH 6.5)混合,将混合物在5 000×g下冰浴匀浆5 s。将匀浆液冰浴超声10 min(超声功率200 W、工作时间1 s、间隔时间3 s),超声后搅拌20 min,离心(4 ℃、5 000×g、10 min),取上清液用3 层纱布过滤。滤液用10 倍体积预冷超纯水稀释,4 ℃混匀静置4 h,虹吸去除上清液,取沉降物离心(4 ℃、8 000×g、10 min),收集沉淀。沉淀加3 倍体积提取液B(0.3 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.0),搅拌20 min混匀,离心(4 ℃、10 000×g、20 min),取上清液加10 倍体积预冷超纯水混匀,4 ℃静置过夜,虹吸去除上清液,取沉降物,离心(4 ℃、8 000×g、10 min),收集沉淀,即为粗肌球蛋白。粗肌球蛋白用3 倍体积透析液(0.6 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)溶解并于透析袋(重均分子质量10 000 Da)中透析16 h,得到的溶液在10 000×g下离心20 min,上清液即为肌球蛋白溶液。用双缩脲法测定溶液蛋白质量浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定提取肌球蛋白纯度。
1.3.2 血红素辅基溶液的制备
准确称取血红素辅基粉末0.163 g,用30 mmol/L NaOH溶液配制成浓度为10 mmol/L储备液,避光保存。用磷酸盐缓冲液(phosphate buffered saline,PBS)(0.6 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)将储备液稀释成浓度为0.0、0.4、1.0、2.0、3.0 mmol/L的血红素辅基溶液,冷藏避光保存备用。
1.3.3 肌球蛋白的氧化
向10 mg/mL肌球蛋白溶液中分别等体积血红素辅基溶液,血红素辅基终浓度分别为0.0、0.2、0.5、1.0、1.5 mmol/L,在4 ℃避光条件下孵育16 h,得到不同氧化程度的肌球蛋白溶液样品。
1.3.4 蛋白羰基含量的测定
参考Mesquita等[17]的方法略作修改。将0.1 mL 5 mg/mL不同氧化程度的肌球蛋白溶液与0.4 mL 10 mmol/L DNPH溶液(含0.5 mol/L H3PO4)混合。与等量0.5 mol/L H3PO4溶液混合作为对照组。将混合溶液于25 ℃下暗处反应10 min。反应完成后,向混合溶液中加入0.2 mL 6 mol/L NaOH溶液,并在25 ℃继续反应10 min,在450 nm波长处测定混合溶液吸光度。按式(1)计算羰基含量。
式中:A为450 nm波长处溶液吸光度;n为稀释倍数;ρ为蛋白质量浓度/(mg/mL);ε为摩尔消光系数22 000 L/(mol·cm)。
1.3.5 巯基含量的测定
采用文献[18]方法并略作修改。
总巯基含量:将0.5 mL 5 mg/mL不同氧化程度的肌球蛋白溶液与4.5 mL 0.02 mol/L的Tris-HCl缓冲液(含10 mmol/L EDTA-2Na、2% SDS、8 mol/L尿素,pH 7.5)混合,然后加入0.5 mL Ellman试剂(0.1% DTNB、0.2 mol/L Tris-HCl,pH 7.5)混匀,在40 ℃下孵育25 min后,于412 nm波长处测定混合溶液吸光度。
活性巯基含量:将0.5 mL 5 mg/mL不同氧化程度的肌球蛋白溶液与4.5 mL 0.02 mol/L的Tris-HCl缓冲液(含10 mmol/L EDTA-2Na、2% SDS,pH 7.5)混合,然后加入0.5 mL Ellman试剂在4 ℃下孵育1 h,于412 nm波长处测定混合物溶液吸光度。
总巯基、活性巯基含量按式(2)计算。

式中:A为412 nm波长处溶液吸光度;n为稀释倍数;ρ为蛋白质量浓度/(mg/mL);ε为摩尔消光系数13 600 L/(mol·cm)。
1.3.6 表面疏水性的测定
参考Zhang Dong等[19]的方法,将1 mL 5 mg/mL不同氧化程度的肌球蛋白溶液与200 μL 1 mg/mL的BPB溶液混合。将1 mL PBS与相应浓度的血红素辅基溶液和200 μL BPB溶液混合,作为对照组。将所有样品在25 ℃下振荡10 min,离心(8 000×g、10 min、4 ℃)。取上清液用PBS稀释10 倍,在595 nm波长处测定上清液吸光度。用BPB结合量表示肌球蛋白的表面疏水性,按式(3)计算。
1.3.7 溶解度的测定
参考Liu Ru等[20]的方法略作修改,将2 mL 5 mg/mL不同氧化程度的肌球蛋白溶液在4 ℃下离心10 min。考马斯亮蓝法测定离心前后肌球蛋白质量浓度,按式(4)计算肌球蛋白溶解度。
1.3.8 Ca2+/K+-ATPase活力的测定
用pH 7.5、20 mmol/L Tris-HCl缓冲液配制肌球蛋白及血红素辅基溶液,按照试剂盒说明书步骤测定Ca2+/K+-ATPase活力。
1.3.9 SDS-PAGE分析
采用SDS-PAGE分别在还原和非还原条件下分析氧化修饰的肌球蛋白交联和聚集。参考Xiong YoulingL.等[21]的方法略作修改。200 μL 2 mg/mL不同氧化程度的肌球蛋白溶液与50 μL含体积分数5% β-巯基乙醇的样品缓冲液(250 mmol/L Tris-HCl,10% SDS、50%甘油、0.5%溴酚蓝)混合,以不含β-巯基乙醇的样品缓冲液作为对照。将样品溶液于95 ℃下加热5 min后,12 000×g离心5 min。电泳条件:12%分离胶,4%浓缩胶,电极缓冲液为Tris-Gly缓冲液(含0.1% SDS),上样量5 μL。恒定120 V下电泳90 min,染色脱色后记录。
1.3.10 内源性荧光光谱分析
采用荧光光谱仪分析血红素辅基氧化修饰后肌球蛋白荧光光谱的变化。肌球蛋白溶液质量浓度0.2 mg/mL,设置激发波长280 nm,发射波长范围290~420 nm,狭缝宽度均为5 nm,扫描速率300 nm/min[22]。
1.3.11 圆二色性光谱分析
采用圆二色性光谱仪分析血红素辅基氧化修饰后肌球蛋白二级结构的变化。用30 mmol/L PBS将肌球蛋白溶液稀释至质量浓度为0.15 mg/mL。仪器参数设置:扫描速率200 nm/min,带宽1 nm,检测波长190~250 nm[23],室温下记录光谱数据。
1.3.12 分子动力学模拟
采用YASARA软件[24]进行肌球蛋白与血红素辅基复合物体系的分子动力学模拟,主要步骤包括:优化体系内部氢键网络[25],以提高体系的稳定性;设置环境pH 7.4,自动预测氨基酸残基的质子化状态;在盒子中填充水分子,共添加96 959 个水分子。为保持模拟体系的电荷平衡,在模拟盒子中添加0.9 mg/100 mL NaCl,体系总原子数331 749 个。在分子动力学模拟开始前,采用最陡下降法和模拟退火方法进行模拟体系优化,以消除原子间过近的接触,然后对复合物体系进行分子动力学模拟,时间50 ns,模拟过程中肌球蛋白采用AMBER14力场[26],血红素辅基采用GAFF2力场[27]和RESP电荷[28],水分子采用TIP3P模型。分子间范德华相互作用的截断值为10 Å,长程相互作用采用PME方法[29],截断值为1.0 nm。分子模拟过程中对成键相互作用采用步长时间1.25 fs,对非键相互作用采用步长时间2.5 fs,模拟温度25 ℃,压力为标准大气压。
1.4 数据处理
所得数据结果表示为平均值±标准差。采用软件IBM SPSS Statistics 25.0进行数据分析;运用ANOVATurkey法对数据进行单因素检验分析,P<0.05,表示2组数据间具有显著性差异;采用Origin 8.1软件作图。
2 结果与分析
2.1 血红素辅基对肌球蛋白羰基含量的影响
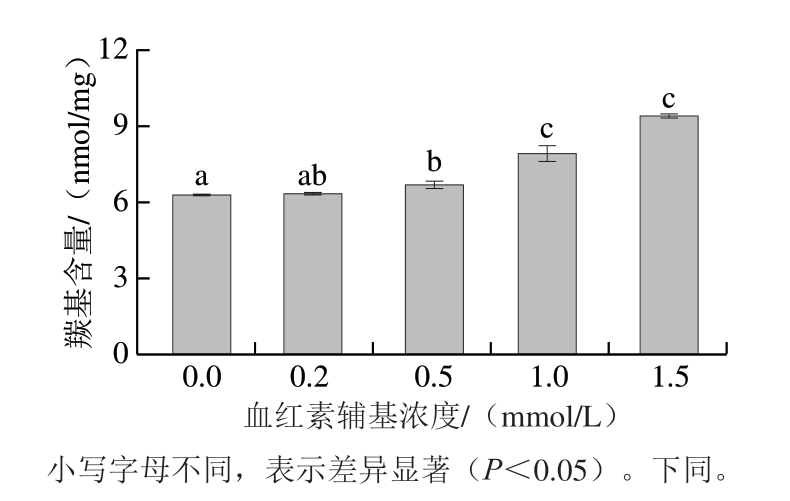
图 1 不同浓度血红素辅基对肌球蛋白羰基含量的影响
Fig. 1 Effect of hemin prosthetic group concentration on the carbonyl content of myosin
肌球蛋白侧链中脯氨酸、组氨酸、赖氨酸和精氨酸等氨基酸残基含有-NH2或-NH基团,这些基团极易氧化,氧化后与这些基团相连的碳原子易形成羰基[30],因此羰基含量是评价肌球蛋白氧化损伤的敏感指标。由图1可知,添加血红素辅基后肌球蛋白羰基含量增加,且随着血红素辅基浓度的增大,肌球蛋白羰基含量呈上升趋势(P<0.05)。血红素辅基浓度0.2~0.5 mmol/L时,肌球蛋白羰基含量上升趋势较为平缓,说明肌球蛋白氧化程度较低,而血红素辅基浓度1.0~1.5 mmol/L时,肌球蛋白羰基含量显著增加(P<0.05)。表明血红素辅基促使肌球蛋白敏感性氨基酸侧链形成了羰基及其衍生物,甚至引起了肽键的断裂[31]。
2.2 血红素辅基对肌球蛋白巯基含量的影响
蛋白质氧化会造成巯基含量减少,因此巯基含量可作为检测蛋白质氧化程度的指标[32]。肌球蛋白约含42 个巯基,氧化会使一些敏感性含硫氨基酸的活性巯基发生氧化形成二硫键,也可能进一步氧化成磺酸类或其他氧化产物,从而导致肌球蛋白结构表面巯基含量下降[33]。由图2可知,添加血红素辅基后,肌球蛋白总巯基和活性巯基含量均随血红素辅基浓度的增加呈逐渐降低的趋势。这一结果表明血红素辅基氧化修饰导致肌球蛋白结构伸展,肌球蛋白头部S1亚基内部巯基暴露,同时活性巯基氧化交联形成分子间二硫键。

图 2 不同浓度血红素辅基对肌球蛋白总巯基(A)和活性巯基含量(B)的影响
Fig. 2 Effects of hemin prosthetic group concentration on the total thiol (A) and reactive thiol contents (B) of myosin
2.3 血红素辅基对肌球蛋白表面疏水性的影响
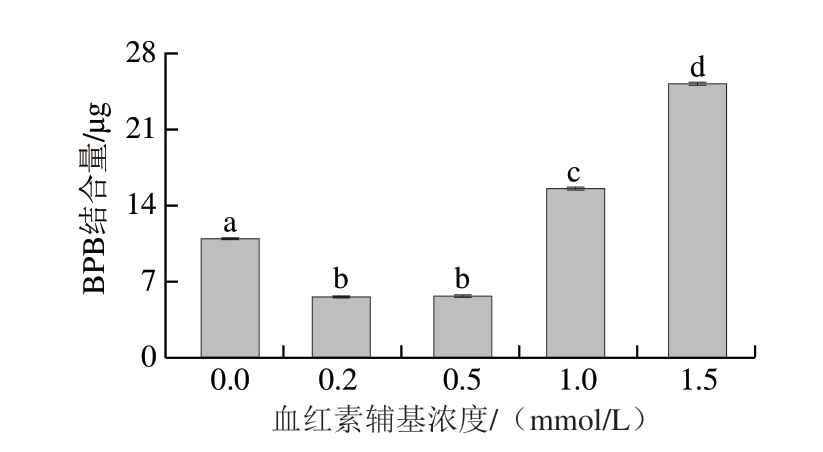
图 3 不同浓度血红素辅基对肌球蛋白表面疏水性的影响
Fig. 3 Effect of hemin prosthetic group concentration on surface hydrophobicity of myosin
由图3可知,在0.2~0.5 mmol/L血红素辅基浓度下,肌球蛋白表面疏水性降低。推测存在2 种原因:其一是氧化使肌球蛋白展开和聚集同时发生,低浓度下,血红素辅基氧化使肌球蛋白疏水基团暴露,疏水基团相互作用形成聚集体,导致肌球蛋白表面疏水性氨基酸残基的掩埋,同时由于疏水残基的共价修饰,以及由于氧化造成表面疏水性氨基酸残基结构变化部分形成亲水基团,从而造成肌球蛋白表面疏水性的降低[34];其二是血红素辅基与肌球蛋白相互作用,发生了疏水性结合[35]。当血红素辅基浓度增加到1.0~1.5 mmol/L时,肌球蛋白表面疏水性显著升高(P<0.05),表明肌球蛋白在氧化过程中结构展开,大量疏水性氨基酸残基暴露,导致表面疏水性的提高。
2.4 血红素辅基对肌球蛋白溶解度的影响
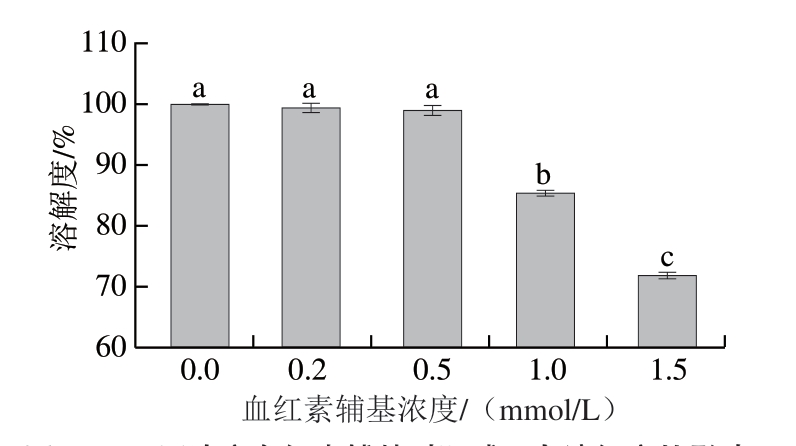
图 4 不同浓度血红素辅基对肌球蛋白溶解度的影响
Fig. 4 Effect of hemin prosthetic group concentration on solubility of myosin
蛋白氧化会引起蛋白质间的交联、聚集,形成肉眼可见的聚集体[32]。由图4可知,随着血红素辅基浓度的增加,肌球蛋白溶解度整体呈下降趋势,低浓度血红素辅基(0.2~0.5 mmol/L)处理下,肌球蛋白溶解度变化不明显,说明肌球蛋白氧化程度较小;当血红素辅基浓度为1.0 mmol/L时,肌球蛋白溶解度较未氧化时降低了14.55%;当血红素辅基浓度增加到1.5 mmol/L时,溶解度降低了28.13%。这一结果表明,在氧化攻击下肌球蛋白之间形成交联,导致蛋白大量聚集,同时蛋白结构伸展,使疏水基团外露,引起蛋白疏水相互作用增强,从而降低了蛋白质的溶解性。此外,从热力学角度分析,蛋白溶解性的降低是化学平衡移动的结果,蛋白氧化促进了蛋白分子间的相互作用,使蛋白质有序的三级结构受到破坏,从而减弱了水分子和蛋白的相互作用[36]。
2.5 血红素辅基对肌球蛋白Ca2+/K+-ATPase活力的影响
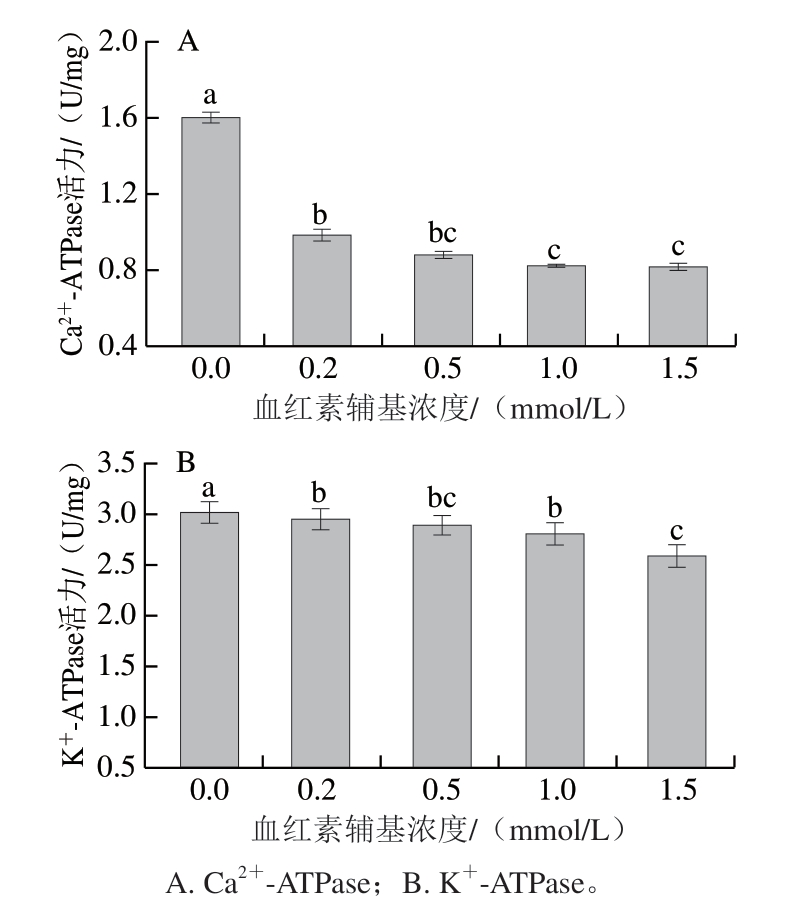
图 5 不同浓度血红素辅基对肌球蛋白ATPase活性的影响
Fig. 5 Effects of hemin prosthetic group concentration on ATPase activity of myosin
ATPase活力可以反映肌球蛋白的完整性,肌球蛋白头部S1区存在2 种活性巯基(-SH1和-SH2)。-SH1影响Ca2+-ATPase活性,而-SH1和-SH2同时影响K+-ATPase活性[37]。由图5可知:添加血红素辅基后,肌球蛋白Ca2+-ATPase活力显著降低,说明血红素辅基的氧化修饰对肌球蛋白头部S1区-SH1影响较大;K+-ATPase活力没有显著变化,说明血红素辅基对肌球蛋白-SH2影响较小。以上结果表明,血红素辅基主要通过影响肌球蛋白头部S1区活性巯基-SH1影响肌球蛋白结构。
2.6 SDS-PAGE分析结果

图 6 血红素辅基氧化修饰后肌球蛋白的SDS-PAGE图谱
Fig. 6 SDS-PAGE pattern of myosin with oxidative modification of hemin prosthetic group
由图6可知:经血红素辅基氧化修饰后,在非还原条件下(不添加β-巯基乙醇),上方区域存在少量高分子化合物,且有部分堆积在进样口未进入浓缩胶,随着血红素辅基浓度的增加,高分子化合物的条带逐渐变宽,表明肌球蛋白经氧化修饰会发生交联聚集,形成聚集体;而在还原条件下(添加β-巯基乙醇),低浓度血红素辅基作用后,上方区域条带基本消失,MHC条带(分子质量220 kDa处)灰度降低不明显,高浓度血红素辅基处理的肌球蛋白MHC条带随着血红素辅基浓度的增加明显变窄,且MHC条带上方区域还存在未完全分解的化合物,表明氧化引起MHC断裂。聚集现象表明血红素辅基处理导致肌球蛋白巯基氧化交联形成了二硫键,高浓度血红素辅基氧化条件下,除二硫键以外还存在其他作用力。
2.7 血红素辅基对肌球蛋白构象的影响
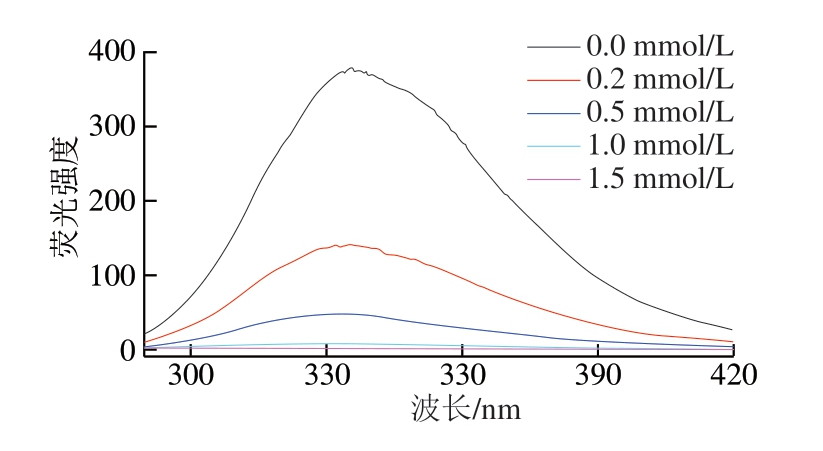
图 7 不同浓度血红素辅基对肌球蛋白内源荧光强度的影响
Fig. 7 Effect of hemin prosthetic group concentration on endogenous fluorescence of myosin
肌球蛋白中色氨酸、苯丙氨酸等氨基酸能够发射荧光,因此肌球蛋白内源荧光强度变化及峰值的偏移可以反映出其结构变化[33]。由图7可知,肌球蛋白内源荧光强度随着血红素辅基浓度的增加呈下降趋势,表明在血红素辅基作用下肌球蛋白结构展开,色氨酸残基被转移到更加疏水的非极性环境中,血红素辅基与肌球蛋白之间的相互作用导致肌球蛋白构象改变。同时,荧光最高峰值位置从336.0 nm蓝移至327.5 nm,表明肌球蛋白被血红素辅基氧化,蛋白间发生聚集,氨基酸残基被包埋,暴露程度降低。
2.8 血红素辅基对肌球蛋白二级结构的影响

图 8 不同浓度血红素辅基对肌球蛋白二级结构的影响
Fig. 8 Effect of hemin prosthetic group concentration on secondary structure content of myosin
通过圆二色性光谱测定血红素辅基氧化前后肌球蛋白的二级结构变化。由图8可知,不同氧化程度的肌球蛋白在208 nm和222 nm附近均出现2 个负吸收峰,表明二级结构主要为螺旋结构[38]。肌球蛋白杆状尾部主要是由α-螺旋构成,因此α-螺旋含量的变化反映了其杆状尾部的变化。β-折叠通常由肽链之间的氢键稳定。随着血红素辅基浓度的增加,肌球蛋白中α-螺旋相对含量逐渐减少,说明肌球蛋白氧化导致分子内氢键减少,α-螺旋结构失去稳定;当血红素辅基浓度为0.2~0.5 mmol/L时,β-折叠相对含量降低,无规卷曲与β-转角相对含量增加,说明巯基氧化生成分子内二硫键,肽链结构发生回折[39];当血红素辅基浓度为1 mmol/L时,β-折叠相对含量增加,表明肌球蛋白受氧化攻击后,部分结构展开,相邻肽链之间形成分子间氢键。这一结果表明,肌球蛋白经过氧化后,α-螺旋逐渐解旋,且部分转化为更为松散的β-折叠和无规卷曲结构,包埋在分子内部的疏水性残基暴露,导致表面疏水性上升,肌球蛋白分子间的疏水相互作用增强,发生聚合[18]。由此可知,肌球蛋白氧化可改变氨基酸与肽链间的相互作用,特别是氧化过程中氨基酸侧链间氢键的减少,会极大地影响蛋白质的二级结构[40]。
2.9 血红素辅基与肌球蛋白的分子动力学模拟
为进一步研究血红素辅基对肌球蛋白的氧化修饰,通过分子动力学模拟氧化过程中二者的相互作用,并对肌球蛋白二级结构的变化进行分析。由图9可知,在分子模拟氧化修饰过程中,血红素辅基与肌球蛋白间的疏水相互作用是二者结合的主要驱动力,平均数量约为24,而氢键和π-π堆积作用仅为1~2。

图 9 血红素辅基与肌球蛋白间的相互作用随模拟时间的变化
Fig. 9 Changes in interaction between hemin prosthetic group and myosin with simulation time
图10显示了分子模拟血红素辅基氧化修饰对肌球蛋白周围氨基酸的影响。模拟50 ns后,血红素辅基中心Fe离子分别与Asp 436和His 494的侧链形成配位键。分子模拟结果证实,在低浓度条件下,血红素辅基与肌球蛋白发生结合,且疏水相互作用是二者结合的关键作用力,从而影响了肌球蛋白的结构,但高浓度血红素辅基处理后,肌球蛋白高度氧化,发生变性,导致其结构不稳定,构象发生变化。这些原因使肌球蛋白内部荧光生色基团附近的环境发生细微变化,进而导致肌球蛋白荧光猝灭,二级结构也发生改变。
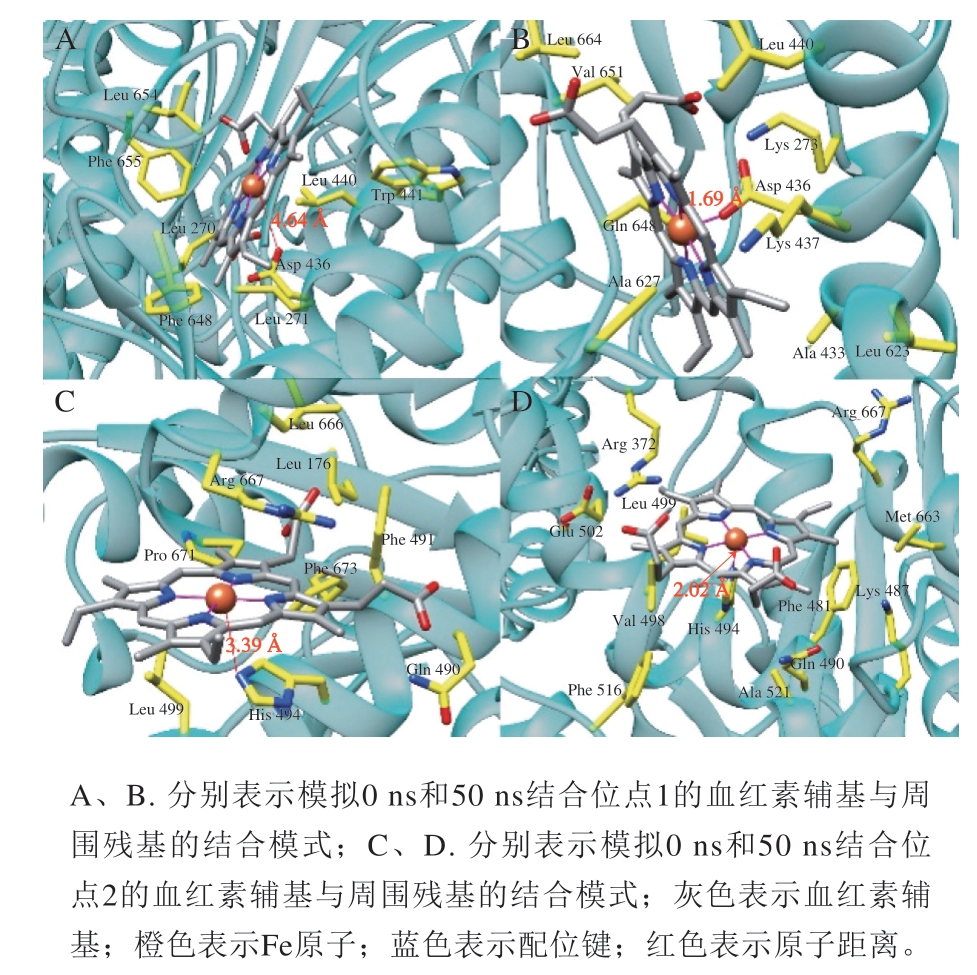
图 10 血红素辅基与肌球蛋白氨基酸残基的结合模式图
Fig. 10 Binding pattern f hemin prosthetic group to amino acid residues of myosin
3 结 论
本研究结果表明,随着血红素辅基浓度的增加,肌球蛋白羰基含量呈增加趋势;血红素辅基氧化会造成肌球蛋白结构展开,巯基及疏水氨基酸暴露,导致二硫键含量、表面疏水性的增加;肌球蛋白溶解度、巯基含量、Ca2+/K+-ATPase活性均呈现不同程度的降低,但Ca2+-ATPase活性降低更明显,这是由于血红素辅基主要引起肌球蛋白头部活性巯基-SH1发生变化;SDS-PAGE结果表明,血红素辅基氧化修饰会造成肌球蛋白二硫键的形成,蛋白发生聚集;血红素辅基的氧化修饰导致肌球蛋白内源荧光强度降低,峰值位置蓝移;α-螺旋相对含量的降低,表明血红素辅基氧化修饰会促进肌球蛋白尾部解螺旋,蛋白构象发生变化;分子动力学模拟结果证实,低浓度血红素辅基处理下,肌球蛋白可以保持活性并与之发生结合,蛋白结构发生一定程度改变,高浓度血红素辅基处理会导致肌球蛋白高度氧化变性,导致蛋白结构显著变化。
[1] 潘腾, 陈星, 沈清武, 等. 不同Ca2+浓度下猪肉肌球蛋白的热聚集体机制研究[J]. 农业机械学报, 2020, 51(9): 329-336. DOI:10.6041/j.issn.1000-1298.2020.09.037.
[2] 薛思雯, 钱畅, 王梦瑶, 等. 肌球蛋白高压凝胶机理的研究进展[J]. 肉类研究, 2016, 30(10): 40-44. DOI:10.15922/j.cnki.rlyj.2016.10.008.
[3] KOBAYASHI M, RAMIREZ B E, WARREN C M. Interplay of actin,ADP and Mg2+ interactions with striated muscle myosin: Implications of their roles in ATPase[J]. Archives of Biochemistry and Biophysics,2019, 662: 101-110. DOI:10.1016/j.abb.2018.12.004.
[4] TANDON L, THAKUR P, SINGH K, et al. Photophysical behavior of heme group: unfolding of hemoglobin and myoglobin in the presence of Gemini surfactants of different molecular architectures[J].International Journal of Biological Macromolecules, 2020, 156: 576-584. DOI:10.1016/j.ijbiomac.2020.04.008.
[5] 朱宏星, 孙冲, 王道营, 等. 肌红蛋白理化性质及肉色劣变影响因素研究进展[J]. 肉类研究, 2019, 33(6): 55-63. DOI:10.7506/rlyj1001-8123-20190415-080.
[6] 朱宏星, 王道营, 徐为民, 等. 肌红蛋白血红素辅基与珠蛋白相互作用机制[J]. 肉类研究, 2020, 34(7): 7-12. DOI:10.7506/rlyj1001-8123-20200427-107.
[7] BADEN N, TERAZIMA M. Intermolecular Interaction of myoglobin with water molecules along the pH denaturation curve[J]. The Journal of Physical Chemistry B, 2006, 110(31): 15548-15555. DOI:10.1021/jp0602171.
[8] MEERSMAN F, SMELLER L, HEREMANS K. Comparative fourier transform infrared spectroscopy study of cold-, pressure-, and heatinduced unfolding and aggregation of myoglobin[J]. Biophysical Journal,2002, 82(5): 2635-2644. DOI:10.1016/S0006-3495(02)75605-1.
[9] 刘越, 孙冲, 李鹏鹏, 等. 高效液相色谱分析不同理化因素对血红素辅基稳定性的影响[J]. 江苏农业科学, 2018, 46(16): 145-149.DOI:10.15889/j.issn.1002-1302.2018.16.037.
[10] BIKADI Z, DEMKO L, HAZAI E. Functional and structural characterization of a protein based on analysis of its hydrogen bonding network by hydrogen bonding plot[J]. Archives of Biochemistry and Biophysics, 2007, 461(2): 225-234. DOI:10.1016/j.abb.2007.02.020.
[11] ZHOU Ruhong, HUANG Xuhui, MARGULIS C J, et al. Hydrophobic collapse in multidomain protein folding[J]. Science, 2004, 305: 1605-1609. DOI:10.1126/science.1101176.
[12] PACE C N, FU H, FRYAR K L, et al. Contribution of hydrophobic interactions to protein stability[J]. Journal of Molecular Biology, 2011,408(3): 514-528. DOI:10.1016/j.jmb.2011.02.053.
[13] DROGHETTI E, SUMITHRAN S, SONO M, et al. Effects of urea and acetic acid on the heme axial ligation structure of ferric myoglobin at very acidic pH[J]. Archives of Biochemistry and Biophysics, 2009,489(1/2): 68-75. DOI:10.1016/j.abb.2009.07.008.
[14] PAL C, KUNDU M K, BANDYOPADHYAY U, et al. Synthesis of novel heme-interacting acridone derivatives to prevent free heme-mediated protein oxidation and degradation[J]. Bioorganic &Medicinal Chemistry Letters, 2011, 21(12): 3563-3567. DOI:10.1016/j.bmcl.2011.04.127.
[15] LIU G, XIONG YoulingL., BUTTERFIELD D A. Chemical, physical and gel-forming properties of oxidized myofibrils and whey- and soyprotein isolates[J]. Food Chemistry and Toxicology, 2000, 65(5): 811-818. DOI:10.1111/j.1365-2621.2000.tb13592.x.
[16] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin is solubilized in a neutral and low ionic strength solution containing l-histidine[J]. Meat Science, 2009, 82(2): 151-154. DOI:10.1016/j.meatsci.2009.01.002.
[17] MESQUITA C S, OLIVEIRA R, BENTO F, et al. Simplified 2,4-dinitrophenylhydrazine spectrophotometric assay for quantification of carbonyls in oxidized proteins[J]. Analytical Biochemistry, 2014,458: 69-71. DOI:10.1016/j.ab.2014.04.034.
[18] 蒋祎人, 李涛, 刘友明, 等. 丙二醛氧化修饰对白鲢肌原纤维蛋白结构性质的影响[J]. 食品科学, 2020, 41(6): 1-7. DOI:10.7506/spkx1002-6630-20190411-143.
[19] ZHANG Dong, LI Hongjun, EMARA A M, et al. Effect of in vitro oxidation on the water retention mechanism of myofibrillar proteins gel from pork muscles[J]. Food Chemistry, 2020, 315: 126226.DOI:10.1016/j.foodchem.2020.126226.
[20] LIU Ru, LIU Qing, XIONG Shanbai, et al. Effects of high intensity ultrasound on structural and physicochemical properties of myosin from silver carp[J]. Ultrasonics Sonochemistry, 2017, 37: 150-157.DOI:10.1016/j.ultsonch.2016.12.039.
[21] XIONG YoulingL., BLANCHARD S P, OOIZUMI T, et al. Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J]. Journal of Food Science, 2010, 75(2):C215-C221. DOI:10.1111j.1750-3841.2009.01511.x.
[22] 杨曦, 程群, 刘江, 等. 脂质自由基诱导氧化对花生蛋白功能特性的影响[J]. 食品与发酵工业, 2020, 46(10): 87-91. DOI:10.13995/j.cnki.11-1802/ts.023609.
[23] 黄渊, 岳世阳, 熊善柏, 等. 2 种天然抗氧化剂与鲢鱼肌球蛋白的相互作用[J]. 食品科学, 2019, 40(4): 14-20. DOI:10.7506/spkx1002-6630-20171221-263.
[24] KRIEGER E, DUNBRACK R L, HOOFT R W W, et al. Assignment of protonation states in proteins and ligands: combining pKa prediction with hydrogen bonding network optimization[J]. Methods in Molecular Biology, 2012, 819: 405-421. DOI:10.1007/978-1-61779-465-0_25.
[25] KRIEGER E, VRIEND G. YASARA. View-molecular graphics for all devices-from smartphones to workstations[J]. Bioinformatics, 2014,30(20): 2981-2982. DOI:10.1093/bioinformatics/btu426.
[26] MAIER J A, MARTINEZ C, KASAVAJHALA K, et al. ff14SB:Improving the accuracy of protein side chain and backbone parameters from ff99SB[J]. Journal of Chemical Theory and Computation, 2015,11(8): 3696-3713. DOI:10.1021/acs.jctc.5b00255.
[27] WANG J, WOLF R M, CALDWELL J W, et al. Development and testing of a general amber force field[J]. Journal of Computational Chemistry, 2004, 25(9): 1157-1174. DOI:10.1002/jcc.20035.
[28] WANG J, CIEPLAK P, KOLLMAN P A. How well does a restrained electrostatic potential (RESP) model perform in calculating conformational energies of organic and biological molecules?[J]. Journal of Computational Chemistry, 2000, 21(12):1049-1074. DOI:10.1002/1096-987X(200009)21:12<1049::AIDJCC3>3.0.CO;2-F.
[29] ESSMAN U, PERERA L, BERKOWITZ M L, et al. A smooth particle mesh Ewald method[J]. Journal of Physical Chemistry B, 1995, 103:8577-8593. DOI:10.1063/1.470117.
[30] 刘颖, 付湘晋. 肉制品中活泼羰基化合物累积规律及促蛋白质氧化研究进展[J]. 食品科技, 2017, 42(05): 102-105. DOI:10.13684/j.cnki.spkj.2017.05.021.
[31] IAN M M, ADELINA R W, RAO R S P. Protein carbonylation and metal-catalyzed protein oxidation in a cellular perspective[J].Journal of Proteomics, 2011, 74(11): 2228-2242. DOI:10.1016/j.jprot.2011.05.004.
[32] 袁凯, 张龙, 谷东陈, 等. 肉品中的蛋白质氧化机制及其影响因素[J].食品科学, 2018, 39(5): 329-335. DOI:10.7506/spkx1002-6630-201805048.
[33] 田元勇, 王伟, 宋扬, 等. 低离子强度下调节pH值对鲤肌球蛋白空间构象的影响[J]. 中国食品学报, 2019, 19(3): 86-92. DOI:10.16429/j.1009-7848.2019.03.010.
[34] LI Shugang, LI Zhihao, CHU Shang, et al. Effect of AAPH oxidation on digestion characteristics of seed watermelon (Citrullus lanatus Var)kernels protein isolates[J]. Food Science and Human Wellness, 2020.DOI:10.1016/j.fshw.2020.06.006.
[35] YUKSEL Z, AVCI E, ERDEM Y K. Characterization of binding interactions between green tea flavonoids and milk proteins[J].Food Chemistry, 2009, 121(2): 450-456. DOI:10.1016/j.foodchem.2009.12.064.
[36] 陈洪生, 孔保华, 刁静静, 等. 氧化引起的肌肉蛋白质功能性变化及其控制技术的研究进展[J]. 食品科学, 2015, 36(11): 215-220.DOI:10.7506/spkx1002-6630-201511041.
[37] LI Chunqiang, XIONG YoulingL., CHEN Jie. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry, 2012, 60(32): 8020. DOI:10.1021/jf302150h.
[38] LI Chunqiang, XIONG YoulingL.. Disruption of secondary structure by oxidative stress alters the cross-linking pattern of myosin by microbial transglutaminase[J]. Meat Science, 2015, 108: 97-105.DOI:10.1016/j.meatsci.2015.05.024.
[39] 丁安子, 朱萌, 乔宇, 等. 自由基氧化对猪肌球蛋白-醛类化合物吸附特性的影响[J]. 食品科学, 2019, 40(4): 75-80. DOI:10.7506/spkx1002-6630-20170918-250.
[40] ZHANG Zhongli, XIONG Zhouyi, LU Sufang, et al. Effects of oxidative modification on the functional, conformational and gelling properties of myofibrillar proteins from Culter alburnus[J].International Journal of Biological Macromolecules, 2020, 162:1442-1452. DOI:10.1016/j.ijbiomac.2020.08.052.