斑点叉尾鮰(Ietalurus punetaus)又称沟鲶、钳鱼,属鲶形目、鮰科,是原产于北美洲的一种大型淡水鱼类,也是我国重要的出口淡水大型经济鱼类之一。速冻鮰鱼片是目前斑点叉尾鮰主要的加工产品之一,鱼肉经速冻后在冷冻条件下贮藏流通,保障其卫生品质[1]。鱼肉中水分冻结会导致持水性下降,汁液流失,蛋白质冷冻变性,脂肪发生过氧化反应,导致鱼肉品质劣变[2-3]。
冷冻食品加工行业中应用最为广泛的是普通冷库冻结和隧道式冻结等,其中隧道式冻结主要为液氨速冻,液氨速冻存在冻结时间长、干耗大、安全隐患等问题[4-5]。隧道式液氮喷淋冻结是一种新型速冻方式,通过控制液氮喷淋蒸发量进而控制床层内空气温度,从而实现食品部分玻璃化冻结,减少结晶对细胞的损伤[6]。液氮具有冻结速率快、冻结时间短、干耗小、冻结质量好、安全性高等优点,是食品冷冻技术重要的发展方向[7]。
目前,国内外研究主要集中在不同冻结方式和冻结温度对水产品品质的影响,新型冻结方式如高压、超声波、射频、电磁辅助冻结等也应用于水产品保鲜贮藏中,改变了冷冻动力学,产生的冰晶更加细小和规则,减少冰晶损伤并保持肌肉品质[8-11]。大量研究集中在实验室范围内并主要采用浸入式冻结,而工业化隧道式液氮、液氨速冻鲜有报道。本研究以新鲜斑点叉尾鮰鱼肉为原料,采用隧道式液氮(-90 ℃、35 min)和液氨(-35 ℃、90 min)2 种方式速冻,速冻完成后于-18 ℃冷冻贮藏90 d,分析比较鱼肉解冻失水率、蒸煮损失率、加压失水率、剪切力、pH值、K值、挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBA)值、三甲胺(trimethylamine,TMA)含量、组织微观结构,为斑点叉尾鮰冷冻加工提供理论依据和技术参考,推动冷冻水产品加工发展。
1 材料与方法
1.1 材料与试剂
斑点叉尾鮰采购于武汉白沙洲大市场,养殖场地为湖北宜昌地区。在16 ℃条件下鱼体背部剖杀,按照出口鮰鱼片相关企业标准分割鱼片,清洗沥干后用聚氯乙烯袋真空包装,称质量,记录并编号。
磷酸二氢钾、磷酸氢二钾、氢氧化钠、硼酸、氧化镁、盐酸、三氯乙酸、硫代巴比妥酸、冰醋酸、甲基红、亚甲基蓝、高氯酸、腺苷三磷酸、腺苷二磷酸、腺苷酸、肌苷酸、次黄嘌呤核苷、次黄嘌呤(均为分析纯) 国药集团化学试剂有限公司;苏木素染液、伊红染液 武汉谷歌生物有限公司。
1.2 仪器与设备
箱式液氮速冻机 科威嘉尼(北京)科技有限公司;SL-257616双螺旋速冻装置 南通四方冷链装备股份有限公司;FG2便携式pH计、AL104分析天平、PL602-L分析天平 梅特勒-托利多仪器有限公司;YYW-2应变控制式无侧限压力仪 南京土壤仪器厂有限公司;CR-400色差仪 柯尼卡美能达(中国)投资有限公司;TA-XT Plus质构仪 英国Stable Micro System公司;GL-25MS高速冷冻离心机 上海卢湘仪离心机仪器有限公司;LC-20AT高效液相色谱仪 日本岛津公司;7890A-5975C气相色谱-质谱联用仪 美国Agilent公司;JJ-12J脱水机、JB-P5包埋机 武汉俊杰电子有限公司;RM2016病理切片机 上海徕卡仪器有限公司;Eclipse Ti-SR倒置荧光显微镜、DS-U3成像系统 日本尼康公司。
1.3 方法
1.3.1 速冻处理
样品置于含冰盒的保温箱中,在洪湖宏业水产食品有限公司分别进行隧道式液氮(-90 ℃、35 min)、液氨速冻(-35 ℃、90 min),速冻完成后于-18 ℃冻藏90 d,分别在0、30、60、90 d取样,在4 ℃解冻后,分析测定鱼肉各项品质指标。以新鲜鱼肉作为对照组。
1.3.1 解冻损失率测定
分别于不同冻藏时间取液氮、液氨速冻鱼片样品,称质量;将样品置于4 ℃条件下解冻,待解冻完全后用吸水纸吸干表面水分,称质量。按式(1)计算解冻损失率。
1.3.2 蒸煮损失率测定
顺鱼肉肌纤维方向切取5.00 g样品,记为蒸煮前质量,装入自封袋于80 ℃恒温水浴加热10 min,取出用吸水纸吸干表面水分,自然冷却至室温,记为蒸煮后质量。按式(2)计算蒸煮损失率。
1.3.3 加压失水率测定
采用Falouk等[12]的加压滤纸法,称取10.00 g鱼肉样品,用双层纱布包裹样品,并在样品上下各垫18 层滤纸,然后置于钢环允许膨胀仪平台上,加压45 kg,保持压力5 min,撤去压力,称量加压后样品质量。按式(3)计算加压失水率。

1.3.4 剪切力测定
顺鱼肉肌纤维方向切取样品,分割成长×宽×高=1 cm×1 cm×1 cm的块状,用质构仪测定剪切力,穿刺探头为MORS剪切刀。
1.3.5 pH值测定
取液氮速冻、液氨速冻样品4 ℃解冻,均质,分别取1.00 g加9 mL水,均质混匀,静置10 min,插入笔式pH酸度计,读取pH值。
1.3.6 K值测定
参照SC/T 3048—2014《鱼类鲜度指标K值的测定 高效液相色谱法》[13]进行。
1.3.7 TVB-N含量测定参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[14]进行。
1.3.8 TMA含量测定参照GB 5009.179—2016《食品安全国家标准 食品中三甲胺的测定》[15]进行。
1.3.9 TBARs值测定
参照路昊等[16]的方法,鱼肉解冻后绞碎,称取10.00 g样品于凯氏蒸馏瓶中,加20 mL蒸馏水混合均匀,加入2 mL体积分数50%盐酸溶液,水蒸气蒸馏,收集50 mL蒸馏液,取5 mL蒸馏液与5 mL TBA-醋酸溶液(0.2883 g TBA溶解于100 mL体积分数90%冰醋酸中)于25 mL比色管中混合,100 ℃水浴加热35 min后冷却10 min,在535 nm波长处测定吸光度,以蒸馏水取代蒸馏液为空白样。TBARs值按式(4)计算。
式中:A样品、A空白分别表示样品蒸馏液与蒸馏水在535 nm波长处的吸光度;7.8为换算系数(mg/100 g)。
1.3.10 鱼肉组织微观结构观察
将鱼肉分割成0.5 cm×0.5 cm×0.5 cm规格的样品,加入4 g/100 mL多聚甲醛溶液(磷酸盐缓冲液配制)固定24 h以上后,依次采用梯度体积分数乙醇、苯醇、二甲苯、石蜡进行脱水固定;将固定好的鱼肉组织于包埋机内包埋,置于石蜡切片机上切片,厚度4 μm,置于载玻片上,60 ℃烤片;切片放入苏木素染液中染色5 min,再放入伊红染液中染色3 min,梯度体积分数乙醇、二甲苯脱水后用中性树胶封片;通过荧光显微镜、成像系统观察鱼肉组织微观结构。
1.4 数据处理
每组实验重复5 次,数据以平均值±标准差表示。使用Excel、Origin 8.0软件进行数据处理和制图,采用SAS分析软件检验组间差异显著性(P<0.05)。
2 结果与分析
2.1 速冻方式对冻藏期间斑点叉尾鮰鱼肉理化性质的影响
表1 冻藏期间不同速冻方式鱼肉理化性质的变化
Table 1 Changes in physicochemical properties of fish with different quick-freezing methods during frozen storage
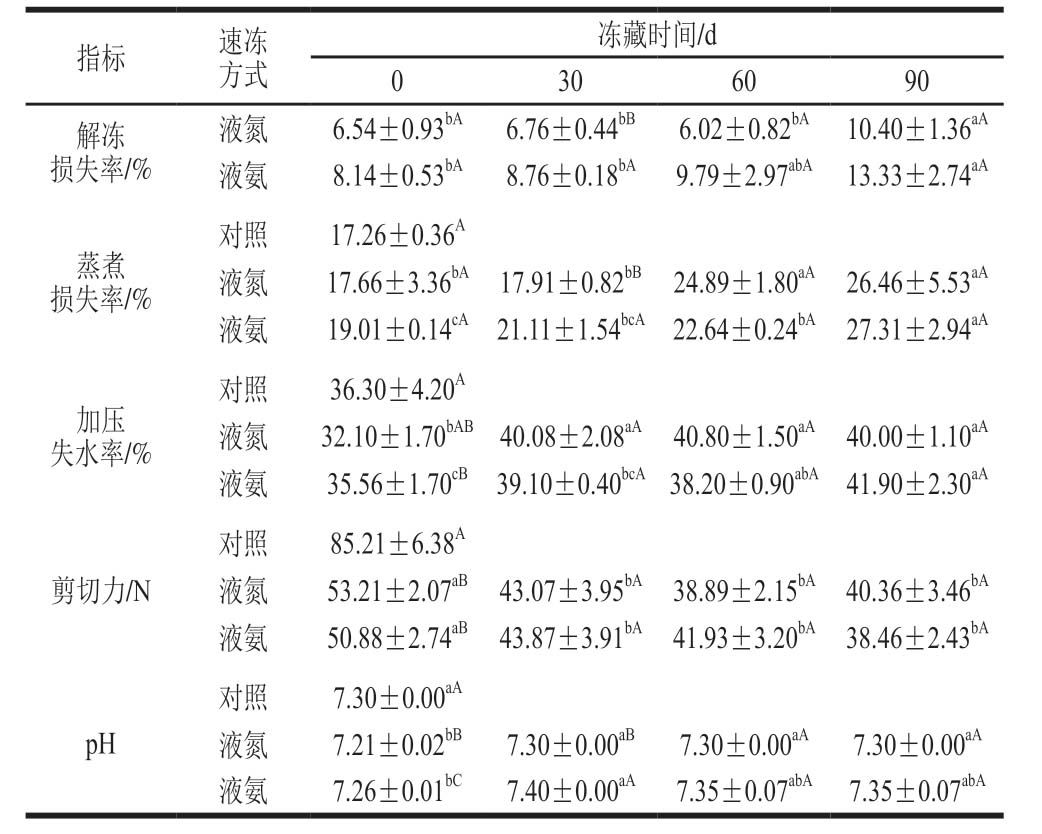
注:同行小写字母不同,表示差异显著(P<0.05);同列大写字母不同,表示同一指标相同贮藏时间组间差异显著(P<0.05)。
指标 速冻方式冻藏时间/d 030 60 90解冻损失率/%液氮 6.54±0.93bA 6.76±0.44bB 6.02±0.82bA 10.40±1.36aA液氨 8.14±0.53bA 8.76±0.18bA 9.79±2.97abA 13.33±2.74aA蒸煮损失率/%对照 17.26±0.36A液氮 17.66±3.36bA 17.91±0.82bB 24.89±1.80aA 26.46±5.53aA液氨 19.01±0.14cA 21.11±1.54bcA 22.64±0.24bA 27.31±2.94aA加压失水率/%对照 36.30±4.20A液氮 32.10±1.70bAB 40.08±2.08aA 40.80±1.50aA 40.00±1.10aA液氨 35.56±1.70cB 39.10±0.40bcA 38.20±0.90abA 41.90±2.30aA剪切力/N对照 85.21±6.38A液氮 53.21±2.07aB 43.07±3.95bA 38.89±2.15bA 40.36±3.46bA液氨 50.88±2.74aB 43.87±3.91bA 41.93±3.20bA 38.46±2.43bA pH对照 7.30±0.00aA液氮 7.21±0.02bB 7.30±0.00aB 7.30±0.00aA 7.30±0.00aA液氨 7.26±0.01bC 7.40±0.00aA 7.35±0.07abA 7.35±0.07abA
由表1可知,冻藏期间液氮、液氨速冻鱼肉解冻损失率均呈上升趋势(除冻藏60 d液氮速冻鱼肉),冻藏0~60 d,解冻损失率变化不显著,至冻藏90 d时,解冻损失率显著增加(P<0.05),但液氮速冻鱼肉解冻损失率始终低于液氨速冻鱼肉。液氮速冻相比液氨速冻具有更低的冻结终温,提高了鱼肉冻结速率,使肌肉细胞内形成微小冰晶,减少冰晶对细胞挤压以及对细胞溶质损伤,较低的冻结终温有利于保持肌肉持水性[17]。
与新鲜(对照)鱼肉相比,液氮、液氨速冻(冻藏0 d)鱼肉蒸煮损失率增大,但差异不显著。冻藏(30~90 d)期间,液氮、液氨速冻鱼肉蒸煮损失率均呈增大趋势,液氮、液氨速冻鱼肉的蒸煮损失率分别在冻藏60、90 d时显著增大(P<0.05)。液氮速冻鱼肉蒸煮损失率始终低于液氨速冻。蒸煮损失率反映了鱼肉加热前后持水性的变化,蒸煮损失率增大表明鱼肉持水性下降。此外,蒸煮损失率影响鱼肉制品的成品得率,蒸煮损失率增大会导致成品得率降低。
与新鲜(对照)鱼肉相比,液氮鱼肉(冻藏0 d)加压失水率显著降低(P<0.05),液氨速冻(冻藏0 d)鱼肉加压失水率略有下降,但差异不显著。2 组速冻鱼肉加压失水率均在冻藏30 d时显著上升(P<0.05),30~90 d没有显著变化,冻藏期间液氮、液氨速冻鱼肉加压失水率差异不显著。加压失水率反映鱼肉加压前后持水性的变化,加压失水率上升表明鱼肉持水性降低。
鱼肉经液氮液氨速冻后(即冻藏0 d)较新鲜(对照)鱼肉剪切力显著降低(P<0.05)。冻藏(30~90 d)期间,2 组速冻鱼肉剪切力均在冻藏30 d显著下降(P<0.05),液氮、液氨速冻鱼肉间剪切力差异不显著。剪切力反映鱼肉质构特性,剪切力下降是鱼肉冻藏过程中质构劣变的主要体现之一。鱼肉冻结形成的冰晶会破坏肌肉组织,使鱼肉剪切力下降,另外内源酶与微生物降解肌肉蛋白,也会导致剪切力降低[18]。
新鲜(对照)鱼肉pH值7.30,鱼肉经液氮、液氨速冻后(即冻藏0 d)pH值显著下降(P<0.05)。冻藏期间,液氮、液氨速冻鱼肉pH值变化均不明显。鱼体宰杀后肌肉中糖原发生降解产生乳酸,导致pH值降低,另外肌肉中蛋白质在组织蛋白酶和细菌分解作用下产生氨基酸和碱性物质,使pH值上升[19]。鱼肉经液氮、液氨速冻后冻藏,pH值略有上升,说明速冻冻藏可以有效抑制蛋白酶与细菌作用,使鱼肉产生较少的碱性氨和胺类化合物,保持鱼肉pH值稳定。
2.2 速冻方式对冻藏期间斑点叉尾鮰鱼肉K值的影响

图1 冻藏期间不同速冻方式鱼肉K值变化
Fig. 1 Changes in K value of fish with different quick-freezing methods during frozen storage
由图1可知,新鲜(对照)鱼肉K值为12.93%,经液氮、液氨速冻后(即冻藏0 d)鱼肉K值显著高于对照组(P<0.05),分别为21.92%、30.08%。随着冻藏时间延长,2 组速冻鱼肉K值均呈增加趋势,冻藏0~60 d,鱼肉K值上升相对平缓,冻藏60~90 d,鱼肉K值迅速增加,冻藏90 d时液氮、液氨速冻鱼肉K值分别为36.99%、44.23%。研究表明,新鲜鱼肉K值低于20%,二级鲜度鱼肉K值20%~40%,而K值在60%以上被认定为腐败初期[20]。冻藏期间,液氮速冻鱼肉K值始终显著低于液氨速冻鱼肉(P<0.05),表明液氮速冻可以较好地保持鱼肉新鲜度,冻藏90 d时液氮速冻鱼肉仍处于二级鲜度水平。Hong Hui等[21]研究不同冻结方式对鳙鱼鱼头品质影响,发现鱼头经-40 ℃速冻12 h较-18 ℃冻藏品质好。Cui Luyun等[22]研究结果表明,-55 ℃速冻24 h后再于-18 ℃贮藏,鱼肉新鲜度优于单一的-18 ℃与-55 ℃冻藏。
2.3 速冻方式对冻藏期间斑点叉尾鮰鱼肉TVB-N含量的影响
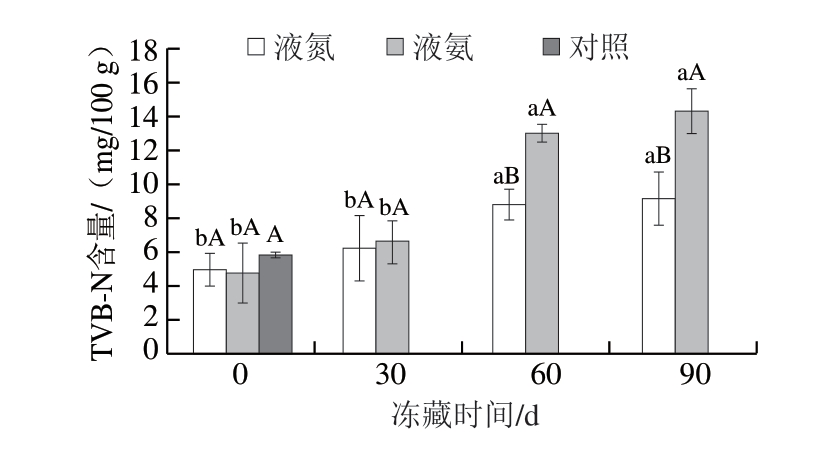
图2 冻藏期间不同速冻方式鱼肉TVB-N含量变化
Fig. 2 Changes in TVB-N content of fish with different quick-freezing methods during frozen storage
由图2可知,新鲜(对照)鱼肉TVB-N含量为5.65 mg/100 g,冻藏期间液氮、液氨速冻鱼肉TVB-N含量均低于15 mg/100 g,符合GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》中规定淡水鱼虾TVB-N含量≤20 mg/100 g的要求。冻藏初期(0~30 d),液氮、液氨速冻鱼肉TVB-N含量差异不显著,冻藏60~90 d,液氮速冻鱼肉TVB-N含量显著低于液氨速冻鱼肉(P<0.05)。在90 d冻藏期间,液氮速冻鱼肉TVB-N含量的上升速率明显低于液氨速冻鱼肉,由此可以推断,液氮速冻具有较低的冻结终温与较高的冷冻速率,可以有效抑制鱼肉中内源酶与微生物的作用,从而减少挥发性氨物质产生,保持鱼肉新鲜度[23]。
2.4 速冻方式对冻藏期间斑点叉尾鮰鱼肉TMA含量的影响
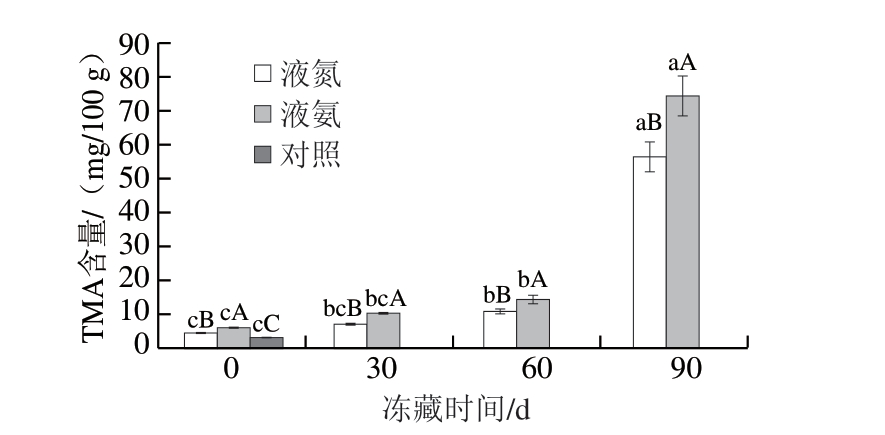
图3 冻藏期间不同速冻方式鱼肉TMA含量变化
Fig. 3 Changes in TMA content of fish with different quick-freezing methods during frozen storage
由图3可知,液氮、液氨速冻后(即冻藏0 d)鱼肉TMA含量与新鲜(对照)鱼肉(2.80 mg/100 g)相比有所上升(P<0.05),分别为4.36 mg/100 g和5.74 mg/100 g。冻藏0~60 d,2 组速冻鱼肉TMA含量均增加缓慢,冻藏60~90 d期间急剧增加,至冻藏90 d时液氮、液氨速冻鱼肉TMA含量分别达到56.30、74.18 mg/100 g。冻藏期间,液氮速冻鱼肉TMA含量始终低于液氨速冻鱼肉。TMA是一种挥发性碱性氨,由细菌分解肌肉蛋白产生,TMA含量增加表明鱼肉新鲜度下降[24]。以上结果表明,速冻可以有效抑制TMA产生,但在冻藏期间,嗜冷菌仍参与蛋白的分解,使TMA含量不断增加,尤其在冻藏60 d后TMA含量急剧增加,表明鱼肉新鲜度明显降低。
2.5 速冻方式对冻藏期间斑点叉尾鮰鱼肉TBARs值的影响
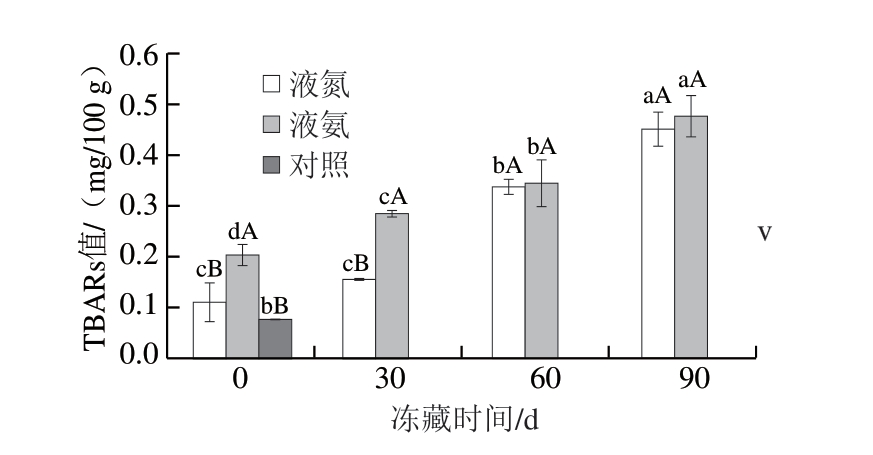
图4 冻藏期间不同速冻方式鱼肉TBARs值变化
Fig. 4 Changes in TBARs value of fish with different quick-freezing methods during frozen storage
由图4可知,新鲜(对照)鱼肉TBARs值为0.078 mg/100 g,冻藏0 d的液氮、液氨速冻鱼肉TBARs值均高于对照组,分别为0.112、0.205 mg/100 g。冻藏初期(0~30 d),液氮速冻鱼肉TBARs值显著低于液氨速冻鱼肉,冻藏60~90 d,液氮速冻鱼肉TBARs值迅速增加,略低于液氨速冻鱼肉,至冻藏90 d时,液氮、液氨速冻鱼肉TBARs值分别为0.452、0.476 mg/100 g。Tolstorebrov等[25]研究超低温冷冻对鱼肉品质的影响发现,对于脂肪含量高的鱼类,阻止氧气向肌肉组织内渗透非常必要,-86 ℃几乎可以完全抑制鱼肉冻藏期间品质劣变。脂肪氧化程度是影响鱼肉品质的重要指标,不饱和脂肪酸氧化导致鱼肉发黄,产生“哈败味”。鱼肉在冻藏过程中,不饱和脂肪酸在冰晶压力作用下由内部向表层迁移,与氧气反应产生过氧化产物(如醛、酮、羧酸类物质),促使TBARs值不断增加[26-27]。
2.6 速冻方式对冻藏期间斑点叉尾鮰鱼肉组织微观结构的影响
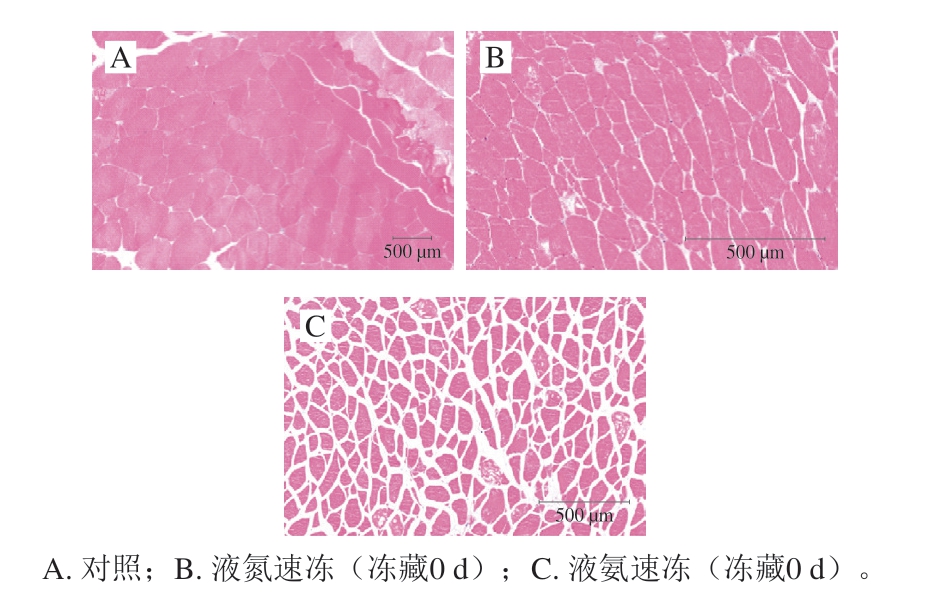
图5 不同速冻方式鱼肉组织横向切片微观结构
Fig. 5 Cross-sectional microstructure of fresh and frozen fish tissue
由图5可知,随着冻结终温升高,鱼肉组织细胞面积减小,细胞间隙增大,冰晶尺寸增大。冰晶生成及生长对细胞结构具有挤压破坏效应,使肌内膜分离、肌肉膜扩张,表现为细胞面积(细胞内区域)萎缩和细胞间隙(细胞外空间)增大,使细胞外液(自由水)与部分细胞内液(结合水)向外析出,从而解释液氮、液氨速冻后导致鱼肉持水性下降的原因[28-29]。Kono等[30]发现冷冻速率对三文鱼片细胞内冰晶大小影响明显,提高冷冻速率,细胞内形成的冰晶以微小冰晶为主,从而有效改善鱼片表观特征。
3 结 论
鱼肉经液氮、液氨速冻,其蒸煮损失率增加,加压失水率、剪切力、pH值下降;冻藏0 d时液氮速冻鱼肉解冻损失率、蒸煮损失率、加压失水率低于液氨速冻,但差异不显著;随着冻藏时间延长,2 组速冻鱼肉的解冻损失率、蒸煮损失率、加压失水率均呈增加趋势,剪切力持续降低,pH值趋于稳定。鱼肉经速冻(冻藏0 d)后K值、TMA含量、TBARs值增加,冻藏30~60 d期间各新鲜度指标均不断增加,其中液氮速冻鱼肉始终低于液氨速冻,由此可以推断,与液氨速冻比较,液氮速冻可以有效抑制鱼肉中蛋白质降解与脂肪氧化,保持鱼肉新鲜度。综合分析速冻鱼肉在冻藏期理化性质与新鲜度指标变化趋势可以得到,液氮速冻后冻藏30 d,鱼肉品质较好。鱼肉组织微观结构的观察结果表明,鱼肉速冻后,肌肉细胞面积减小,细胞间隙增大,冰晶尺寸增大,液氨速冻鱼肉相比液氮速冻,平均细胞面积减小,细胞间隙急剧增大。因此,液氮速冻可以保持肌肉组织完整性,有效减轻冻结冰晶对肌肉细胞破坏效应。
[1]刘小莉, 彭欢欢, 李莹, 等. 冻藏温度对斑点叉尾鮰鱼片蛋白质特性和感官品质的影响[J]. 中国食品学报, 2019, 19(1): 141-147.DOI:10.16429/j.1009-7848.2019.01.019.
[2]ROSENVOLD K. Refrigeration and freezing technology freezing and product quality[M]//Encyclopedia of Meat Sciences. 2nd ed. Elsevier Inc., 2014: 191-195. DOI:10.1016/B978-0-12-384731-7.00126-4.
[3]JIANG Qingqing, JIA Ru, NAHO N, et al. Changes in protein properties and tissue histology of tuna meat as affected by salting and subsequent freezing[J]. Food Chemistry, 2019, 271: 550-560.DOI:10.1016/j.foodchem.2018.07.219.
[4]OJHA K S, KERRY J P, TIWARI B K, et al. Freezing for Food Preservation[M]//Reference module in food science. Elsevier Inc.,2016: 18-25. DOI:10.1016/B978-0-08-100596-5.03108-5.
[5]ALESSANDRO B, LORENZO C, ENRICO F, et al. Case studies in food freezing at very low temperature[J]. Energy Procedia, 2016, 101:305-312. DOI:10.1016/j.egypro.2016.11.039.
[6]江杨阳, 杨水兵, 余海, 等. 不同冻结方式对红虾肌肉品质的影响[J]. 现代食品科技, 2017, 33(10): 142-148. DOI:10.13982/j.mfst.1673-9078.2017.10.021.
[7]鲁珺, 余海霞, 杨水兵, 等. 液氮深冷速冻对三疣梭子蟹品质和微观组织结构的影响[J]. 中国食品学报, 2016, 16(9): 87-94.DOI:10.16429/j.1009-7848.2016.09.012.
[8]AUBOURG S P, TORRES J A, SARAIVA J A, et al. Effect of highpressure treatments applied before freezing and frozen storage on the functional and sensory properties of Atlantic mackerel (Scomber scombrus)[J]. LWT-Food Science and Technology, 2013, 53(1): 100-106. DOI:10.1016/j.lwt.2013.01.028.
[9]SUN Qinxiu, SUN Fangda, XIA Xiufang, et al. The comparison of ultrasound-assisted immersion freezing, air freezing and immersion freezing on the muscle quality and physicochemical properties of common carp (Cyprinus carpio) during freezing storage[J].Ultrasonics Sonochemistry, 2019, 51: 281-291. DOI:10.1016/j.ultsonch.2018.10.006.
[10] HAFEZPARAST-MOADAB N, HAMDAMI N, DALVI-ISFAHAN M,et al. Effects of radiofrequency-assisted freezing on microstructure and quality of rainbow trout (Oncorhynchus mykiss) fillet[J].Innovative Food Science & Emerging Technologies, 2018, 47: 81-87.DOI:10.1016/j.ifset.2017.12.012.
[11] OTERO L, PÉREZ-MATEOS M, RODRÍGUEZ A C, et al.Electromagnetic freezing: effects of weak oscillating magnetic fields on crab sticks[J]. Journal of Food Engineering, 2017, 200: 87-94.DOI:10.1016/j.jfoodeng.2016.12.018.
[12]FALOUK M M, WIELICZKO K J, MERTS I. Ultra-fast freezing and low storage temperatures are not necessary to maintain the functional properties of manufacturing beef[J]. Meat Science, 2004, 66(1): 171-179. DOI:10.1016/S0309-1740(03)00081-0.
[13]福建省水产研究所, 南海水产研究所, 农业部渔业产品质量监督检测测试中心(厦门), 等. 鱼类鲜度指标K值的测定 高效液相色谱法:SC/T 3048—2014[S]. 北京: 中国标准出版社, 2014.
[14]中华人民共和国卫生和计划生育委员会. 食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 中国标准出版社, 2016.
[15]中华人民共和国卫生和计划生育委员会. 食品安全国家标准 食品中三甲胺的测定: GB 5009.179—2016[S]. 北京: 中国标准出版社,2016.
[16]路昊, 包建国. 在不同冻藏温度下黄鳍金枪鱼腹部肌肉的脂质氧化和肌红蛋白氧化的动力学研究[J]. 食品科学, 2007, 28(11): 63-65.
[17]KAALE L D, EIKEVIK T M, RUSTAD T, et al. Changes in water holding capacity and drip loss of Atlantic salmon (Salmo salar) muscle during superchilled storage[J]. LWT-Food Science and Technology,2014, 55(2): 528-535. DOI:10.1016/j.lwt.2013.10.021.
[18] LUAN Lanlan, WANG Liping, WU Tiantian, et al. A study of ice crystal development in hairtail samples during different freezing processes by cryosectioning versus cryosubstitution method[J].International Journal of Refrigeration, 2018, 87: 39-46. DOI:10.1016/j.ijrefrig.2017.10.014.
[19] ROMOTOWSKA P E, GUDJÓNSDÓTTIR M, KRISTINSDÓTTIR T B, et al. Effect of brining and frozen storage on physicochemical properties of well-fed Atlantic mackerel (Scomber scombrus) intended for hot smoking and canning[J]. LWT-Food Science and Technology,2016, 72(1): 199-205. DOI:10.1016/j.lwt.2016.04.055.
[20]ELMASRY G, NAGAI H, MORIA K, et al. Freshness estimation of intact frozen fish using fluorescence spectroscopy and chemometrics of excitation-emission matrix[J]. Talanta, 2015, 143: 145-156.DOI:10.1016/j.talanta.2015.05.031.
[21]HONG Hui, LUO Yongkang, ZHOU Zhongyun, et al. Effects of different freezing treatments on the biogenic amine and quality changes of bighead carp (Aristichthys nobilis) heads during ice storage[J]. Food Chemistry, 138(2/3): 1476-1482. DOI:10.1016/j.foodchem.2012.11.031.
[22]CAI Luyun, WU Xiaosa, LI Xiuxia, et al. Effects of different freezing treatments on physicochemical responses and microbial characteristics of Japanese sea bass (Lateolabrax japonicas) fillets during refrigerated storage[J]. LWT-Food Science and Technology, 2014, 59(1): 122-129.DOI:10.1016/j.lwt.2014.04.062.
[23] MULOT V, BENKHELIFA H, PATHIER D, et al. Measurement of food dehydration during freezing in mechanical and cryogenic freezing conditions[J]. International Journal of Refrigeration, 2019, 103: 329-338. DOI:10.1016/j.ijrefrig.2019.02.032.
[24]崔旭海, 毕海丹, 卞雪莲, 等. 乳清分离蛋白水解物对冷藏鱼糜的保鲜作用[J]. 现代食品科技, 2017, 33(4): 201-206. DOI:10.13982/j.mfst.1673-9078.2017.4.030.
[25] TOLSTOREBROV I, EIKEVIK T M, INDERGÅRD E. The influence of long-term storage, temperature and type of packaging materials on the lipid oxidation and flesh color of frozen Atlantic herring fillets(Clupea harengus)[J]. International Journal of Refrigeration, 2014, 40:122-130. DOI:10.1016/j.ijrefrig.2013.11.014.
[26] TOLSTOREBROV I, EIKEVIK T M, BANTLE M. Effect of low and ultra-low temperature applications during freezing and frozen storage on quality parameters for fish[J]. International Journal of Refrigeration,2016, 63: 37-47. DOI:10.1016/j.ijrefrig.2015.11.003.
[27] ESPINOZA RODEZNO L A, SUNDARARAJAN S, MIS SOLVAL K,et al. Cryogenic and air blast freezing techniques and their effect on the quality of catfish fillets[J]. LWT-Food Science and Technology,2013, 54(2): 377-382. DOI:10.1016/j.lwt.2013.07.005.
[28]TINACCI L, ARMANI A, GUIDI A, et al. Histological discrimination of fresh and frozen/thawed fish meat: European hake (Merluccius merluccius) as a possible model for white meat fish species[J]. Food Control, 2018, 92: 154-161. DOI:10.1016/j.foodcont.2018.04.056.
[29]LI Dongmei, ZHU Zhiwei, SUN Dawen. Effects of freezing on cell structure of fresh cellular food materials: a review[J]. Trends in Food Science & Technology, 2018, 75: 46-55. DOI:10.1016/j.tifs.2018.02.019.
[30]KONO S, KON M, ARAKI T, et al. Effects of relationships among freezing rate, ice crystal size and color on surface color of frozen salmon fillet[J]. Journal of Food Engineering, 2017, 214: 158-165.DOI:10.1016/j.jfoodeng.2017.06.023.