乙氧酰胺苯甲酯(ethopabate,ETP),又名4-乙酰胺基-2-乙氧基苯甲酸甲酯(结构式见图1),分子式为C12H15O4N,是一种广谱抗球虫增效剂[1-2],常被添加在家禽饲料中,与其他抗球虫药物配伍使用,可以降低抗药性,提高药效[3-5],因此,被广泛用于预防和治疗球虫病[6]。ETP在养殖行业长期大量使用后易在动物肌肉、肝、肾和蛋中残留[7-8],对消费者健康构成潜在威胁[9-10],我国现行标准GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》[11]规定,ETP在鸡肉中最大残留限量(maximum residue limit,MRL)为500 μg/kg,在鸡肝和鸡肾中MRL为1500 μg/kg,但并未规定ETP在其他禽肉组织中的MRL。因此,探讨并建立禽肉组织中ETP残留量的检测方法有利于加强养殖行业的监管机制。
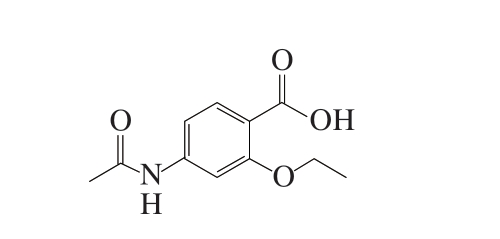
图1 ETP结构式
Fig. 1 Structure of ETP
目前,我国现实施标准GB 31660.9—2019《食品安全国家标准 家禽可食性组织中乙氧酰胺苯甲酯残留量的测定 高效液相色谱法》[12]规定了家禽可食性组织中ETP残留量的检测方法,但该方法前处理繁琐,耗时费力,不适合样品高通量分析。国内外文献报道检测禽肉组织中ETP残留量的方法主要有高效液相色谱-紫外检测法[13-15]、液相色谱-质谱法[16-21]和荧光分光光度法[22-23]等。高效液相色谱-紫外检测法重现性好、准确度高,但前处理需要使用固相萃取柱净化[24-25],成本较高,灵敏度较低,且仪器分析时间较长;液相色谱-质谱法因其灵敏度高、选择性强被广泛应用于兽药残留分析[26-28],但该法前处理繁琐、耗时且仪器成本较高,更适用于多残留测定;荧光分光光度法灵敏度高,但选择性较差。
本研究以已报道文献[18,24-25]为基础,优化前处理条件,采用乙腈进行提取,利用荧光检测器的强选择性和高灵敏度特点,对鸡、鸭、鹅肌肉组织中ETP残留量进行分析,建立禽肉组织中ETP残留量测定的超高效液相色谱-荧光检测法,国内外鲜见相关报道,为禽肉组织中ETP残留量的准确测定和安全控制提供参考。
1 材料与方法
1.1 材料与试剂
样品为市售鸡、鸭、鹅肌肉组织。
无水硫酸钠(分析纯)、丙酮(色谱纯) 国药集团化学试剂有限公司;甲醇(色谱纯)、乙腈(色谱纯) 德国默克股份两合公司;正己烷(色谱纯)永华化学科技(江苏)有限公司;水均为超纯水;ETP(纯度≥98.83%) 德国Dr.Ehrenstorfer公司。
1.2 仪器与设备
1290InfinityⅡ超高效液相色谱仪、1260荧光检测器、1290 InfinityⅡ FS二极管阵列检测器 美国Agilent公司;PL2002电子天平 美国梅特勒-托利多仪器公司;SB-4200DTS超声波双频清洗机 宁波新芝生物科技股份有限公司;Avanti JXN-26离心机 美国Beckman Coulter公司;R-205旋转蒸发仪 瑞士Buchi Manschette公司;硅酸镁固相萃取柱(1 g/6 mL) 美国Supelco公司。
1.3 方法
1.3.1 标准溶液的配制
标准储备液:准确称取适量ETP标准品于10 mL容量瓶中,用甲醇溶解并定容,配制成质量浓度为1.0 mg/mL的标准储备液。
标准工作液:吸取不同体积的标准储备液,用甲醇逐级稀释成质量浓度分别为5、10、20、50、100、200、500 ng/mL的标准工作液。
1.3.2 样品前处理
准确称取新鲜或解冻后的绞碎匀浆试样5.0 g于50 mL具塞塑料离心管中,加入15 mL乙腈和5 g无水硫酸钠,涡旋混匀1 min,振荡5 min,4000 r/min低温离心5 min,收集提取液于离心管,残渣用10 mL乙腈按照上述步骤重复提取1 次,合并2 次提取液,加入10 mL乙腈饱和的正己烷,振荡混匀后离心分层,取乙腈层60 ℃旋蒸至干,加入2.5 mL甲醇溶解(样品中目标物含量较高时,可用甲醇稀释样液),经0.22 μm滤膜过滤后作为待测液供超高效液相色谱仪分析。
1.3.3 色谱条件
色谱柱:Agilent Eclipse Plus C18柱(2.1 mm×100 mm,1.8 μm);流动相:乙腈、水体积比30∶70;流速0.3 mL/min;柱温30 ℃;进样量5.0 μL;荧光检测器;激发波长272 nm;发射波长394 nm。
1.3.4 结果计算
样品中目标物含量按下式计算。
式中:X为样品中目标物含量/(μg/kg);ρ为测试溶液中目标物质量浓度/(ng/mL)(由仪器工作站软件直接计算得出);V为试样实际稀释液总体积(2.5 mL);m为样品质量/g。
1.4 数据处理
超高效液相色谱图采用Agilent OpenLAB CDSAcquisition软件进行采集,使用Agilent OpenLab Analysis软件对实验数据进行统计分析,采用Origin 8.0软件绘图。
2 结果与分析
2.1 前处理方法参数选择
2.1.1 前处理方式的选择
采用高效液相色谱法测定ETP含量时多采用硅酸镁固相萃取柱。固相萃取的选择性吸附和洗脱可以对样品进行富集、分离及净化,采用固相萃取柱能有效去除干扰杂质,因此,常应用于实验室的样品前处理步骤。以鸡肌肉组织为空白基质,添加50 μg/kg ETP标准品,以乙腈为提取试剂,按照1.3.2节进行样品前处理。与采用硅酸镁固相萃取柱的样品前处理方法进行对比分析,比较2 种前处理方式对ETP回收率的影响。由图2可知,2 种前处理方式均能有效分离目标物,无明显杂峰干扰,但选用本研究方法处理,目标物峰面积较大,回收率更高。因此,选用本研究中前处理方法不仅简便、快速、节约成本,且回收率高、无明显杂峰干扰。
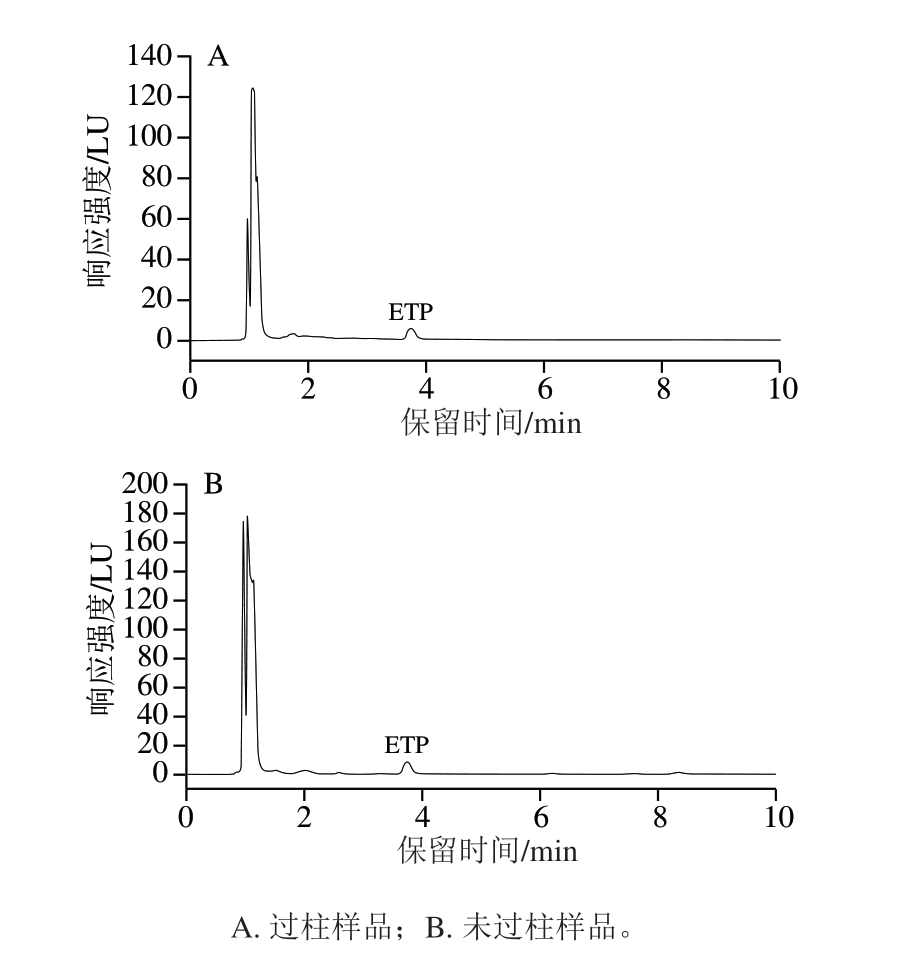
图2 不同前处理样品色谱图
Fig. 2 Chromatograms of sample with different pretreatments
2.1.2 旋蒸温度的选择
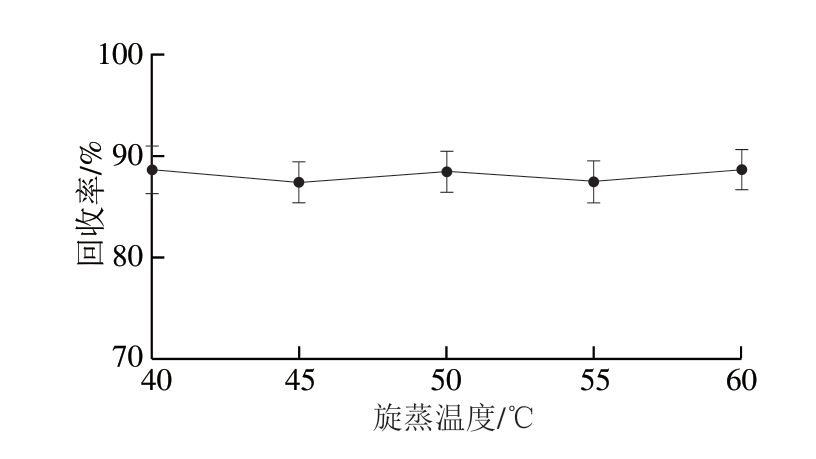
图3 旋蒸温度对ETP回收率的影响
Fig. 3 Influence of rotary evaporation temperature on the recovery of ETP
以鸡肌肉组织为空白基质,添加100 μg/kg ETP标准品,以乙腈为提取试剂,对比分析不同旋蒸温度对ETP测定结果的影响。由图3可知,旋蒸温度分别为40、45、50、55、60 ℃时,旋蒸温度对ETP回收率几乎没有影响,因此,选择60 ℃为本方法的最佳旋蒸温度,不仅可以缩短前处理时间,还可以提高检测效率。
2.2 色谱条件的选择
2.2.1 检测器的选择
目前,现有液相色谱法测定ETP残留量的检测器有紫外检测器和荧光检测器,紫外检测器适用性广,但灵敏度低,杂质峰干扰多且基线不平稳,而荧光检测器的高灵敏度和强选择性弥补了紫外检测器的不足。由图4可知,在激发波长272 nm、发射波长349 nm条件下,采用荧光检测器测定ETP残留量的响应强度是紫外检测器的近10 倍,因此,本研究选用荧光检测器测定禽肉组织中ETP残留量。

图4 ETP标准品(100 ng/mL)色谱图
Fig. 4 Chromatograms of ETP standard (100 ng/mL)
2.2.2 检测波长的选择

图5 ETP标准品(100 ng/mL)荧光光谱图
Fig. 5 Fluorescence spectra of ETP standard (100 ng/mL)
激发波长和发射波长是荧光检测的必要参数,通过仪器软件参数设置,获取目标物的最优激发波长和发射波长,可以很大程度地提高检测灵敏度。由图5可知,本方法的最佳荧光检测条件为激发波长272 nm,发射波长349 nm。
2.3 线性方程、方法检出限和定量限
采用外标法对ETP进行定量分析,按1.3.3节色谱条件,以标准品质量浓度为横坐标,峰面积为纵坐标计算回归方程和相关系数,得到回归方程为y=0.1095x+0.0913(R2=0.9997),该方法在质量浓度5~500 ng/mL范围内线性良好,满足定量分析要求。
在最优实验条件下,向空白基质样品中添加ETP标准溶液,按1.3节实验方法测定,以测定结果的3 倍信噪比(RS/N≥3)为检出限(limit of detection,LOD),10 倍信噪比(RS/N≥10)为定量限(limit of quantification,LOQ),计算可得,方法LOD为2 μg/kg,LOQ为5 μg/kg。我国现行标准GB 31660.9—2019《食品安全国家标准 家禽可食性组织中乙氧酰胺苯甲酯残留量的测定 高效液相色谱法》[12]中规定,禽肌肉组织中ETP的LOD为20 μg/kg,LOQ为50 μg/kg,均大于本研究测定值,因此,本方法具备更灵敏的定量检测能力,满足禽肉组织中ETP残留量的分析要求。
2.4 方法准确度和精密度
为考察本方法的准确度和精密度,选择不同基质样品(鸡肉、鸭肉、鹅肉),以5、50、500 μg/kg(方法LOQ、选一合适点、国标最高残留限量)3 个水平将ETP添加到阴性基质样品中,每组6 个平行。
表1 方法回收率和精密度(n=6)
Table 1 Recovery and precision of the proposed method (n= 6)

基质 加标量/(μg/kg)测定平均值/(μg/kg) 回收率/% 相对标准偏差/%鸡肉54.22 84.4 1.750 43.70 87.4 1.6500 457.40 91.5 2.9鸭肉54.18 83.6 2.150 43.30 86.6 2.2500 451.00 90.2 1.8鹅肉54.15 83.0 2.450 43.60 87.2 2.0500 452.20 90.4 2.1
由表1可知,各基质样品中ETP平均回收率为83.0%~91.5%,相对标准偏差为1.6%~2.9%,表明该法准确度高、精密度好,能满足兽药残留[29]定量分析要求和实验室质控[30]要求。
3 结 论
建立超高效液相色谱-荧光检测法测定肉类食品中ETP残留量。综合现有分析方法,简化了前处理步骤,优化了仪器参数,确立了LOD和LOQ,提高了方法灵敏度和准确度。实验结果表明,该法具有前处理操作简单、成本低、重复性好、灵敏度和准确度高、基线平稳、杂峰干扰小等特点,解决了现有文献报道中前处理繁琐耗时、成本高、分析时间长等问题。本研究方法的建立有利于样品的通量分析,提高了实验室检测效率,为测定肉类食品中ETP残留量提供了可靠、准确的分析方法。
[1]李兆周, 李智丽, 陈秀金, 等. 氧化还原引发制备乙氧酰胺苯甲酯分子印迹微球及其表征[J]. 分析测试学报, 2015, 34(7): 768-774.DOI:10.3969/j.issn.1004-4957.2015.07.003.
[2]BASHA M A, ABD EL-RAHMAN M K, BEBAWY L I, et al.Validated TLC stability indicating methods for the quantitative determination of some veterinary drugs[J]. Microchemical Journal,2019, 146: 157-163. DOI:10.1016/j.microc.2018.12.057.
[3]田永民. 养鸡生产中常用的抗球虫药及其使用注意事项[J]. 当代畜牧, 2019(9): 64-65.
[4]余永鹏. 常用抗球虫药及使用[J]. 广东饲料, 2016, 25(10): 45-47.DOI:10.3969/j.issn.1005-8613.2016.10.013.
[5]丁佳雯, 翁亚彪, 朱建荣. 乙氧酰胺苯甲酯等药物防治鸡盲肠球虫病的疗效试验[J]. 养禽与禽病防治, 2004(10): 2-3.
[6]张腊梅, 李道敏, 李兆周, 等. 乙氧酰胺苯甲酯表面分子印迹聚合物的制备与吸附特性[J]. 食品科学, 2016, 37(4): 226-232.DOI:10.7506/spkx1002-6630-201604041.
[7]陆臻. 抗球虫药物在治疗鸭病中的合理选用研究[J]. 当代畜牧,2014(20): 61-63.
[8]PIATKOWSKA M, JEDZINIAK P, ZMUDZKI J. Multiresidue method for the simultaneous determination of veterinary medicinal products, feed additives and illegal dyes in eggs using liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2016,197: 571-580. DOI:10.1016/j.foodchem.2015.10.076.
[9]苏立强, 张慧洁, 姜国强, 等. RAFT沉淀聚合法制备乙氧酰胺苯甲酯分子印迹材料及其应用[J]. 分析试验室, 2018, 37(8): 927-931.DOI:10.13595/j.cnki.issn1000-0720.2018.0179.
[10]NASR J J, SHALAN S, BELAL F. Determination of ethopabate residues in chicken muscles, liver, and eggs after aqueous SDS extraction by micellar liquid chromatography with fluorescence detection with application to baby food[J]. Food Analytical Methods,2013, 6(6): 1522-1528. DOI:10.1007/s12161-013-9564-1.
[11] 中华人民共和国农业农村部, 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准 食品中兽药最大残留限量: GB 31650—2019[S]. 北京: 中国标准出版社, 2019.
[12] 中华人民共和国农业农业部, 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准 家禽可食性组织中乙氧酰胺苯甲酯残留量的测定 高效液相色谱法: GB 31660.9—2019[S].北京: 中国标准出版社, 2019.
[13] 杨林, 薄永恒, 高迎春, 等. 高效液相色谱法检测鸭、鹅可食组织中乙氧酰胺苯甲酯残留量[J]. 江苏农业科学, 2015, 43(3): 265-267.DOI:10.15889/j.issn.1002-1302.2015.03.087.
[14]徐士新, 仲锋, 郭文林. 乙氧酰胺苯甲酯在鸡组织中残留的检测及消除规律的研究[J]. 中国兽药杂志, 1999, 33(3): 6-11.
[15] GRANJA R H M M, NINO A M M, ZUCCHETTI R A M, et al.Validation of a high-performance liquid chromatographic method with UV detection for the determination of ethopabate residues in poultry liver[J]. Journal of AOAC International, 2008, 91(6): 1483-1487.DOI:10.1134/S1061934808110191.
[16]李银生, 王秀红. 液相色谱串联质谱法同时测定鸡肉或鸡蛋中常见抗球虫类药物残留[J]. 上海交通大学学报(农业科学版), 2011,29(6): 16-23. DOI:10.3969/J.ISSN.1671-9964.2011.06.004.
[17]李丹, 孙雷, 毕言锋, 等. 超高效液相色谱-串联质谱法测定鸡肉和牛肉中五种常用抗球虫药[J]. 中国兽药杂志, 2013, 47(4): 38-41.
[18] 岳振峰, 康海宁, 陈小霞, 等. 液相色谱串联质谱法测定鸡肉中20 种抗球虫药物多残留[J]. 分析化学, 2012, 40(8): 1262-1266.DOI:10.3724/SP.J.1096.2012.10752.
[19] DASENAKI M E, THOMAIDIS N S. Multi-residue methodology for the determination of 16 coccidiostats in animal tissues and eggs by hydrophilic interaction liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2019, 275: 668-680. DOI:10.1016/j.foodchem.2018.09.138.
[20] YOSHIKAWA S, NAGANO C, KANDA M, et al. Simultaneous determination of multi-class veterinary drugs in chicken processed foods and muscle using solid-supported liquid extraction clean-up[J].Journal of Chromatography B, 2017, 1057: 15-23. DOI:10.1016/j.jchromb.2017.04.041.
[21]SHAO Bing, WU Xiaoyan, ZHANG Jing, et al. Development of a rapid LC-MS-MS method for multi-class determination of 14 coccidiostat residues in eggs and chicken[J]. Chromatographia, 2009,69(9/10): 1083-1088. DOI:10.1365/s10337-009-1009-z.
[22]NASR J J, SHALAN S. Spectrofluorimetric analysis of ethopabate in veterinary formulations with application to residue determination in chicken muscles and liver[J]. Luminescence, 2014, 29(8): 1188-1193.DOI:10.1002/bio.2683.
[23] EL-KOSASY A M, HUSSEIN L A, MAGDY N, et al. Sensitive spectrofluorimetric methods for determination of ethopabate and amprolium hydrochloride in chicken plasma and their residues in food samples[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 150: 430-439. DOI:10.1016/j.saa.2015.05.082.
[24]李丹, 沈昕, 张玉洁, 等. 高效液相色谱法测定鸡肉中5 种磺胺类药物及乙氧酰胺苯甲酯增效剂残留量[J]. 食品安全质量检测学报, 2020, 11(1): 202-208. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.01.038.
[25]农业部畜牧兽医局. 动物源食品中乙氧酰胺苯甲酯残留检测方法:高效液相色谱法[J]. 中国兽药杂志, 2002, 36(10): 7-8. DOI:10.3969/j.issn.1002-1280.2002.10.004.
[26] MOLONEY M, CLARKE L, O’MAHONY J, et al. Determination of 20 coccidiostats in egg and avian muscle tissue using ultra high performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2012, 1253: 94-104. DOI:10.1016/j.chroma.2012.07.001.
[27] CHANG S H, LAI Y H, HUANG C N, et al. Multi-residue analysis using liquid chromatography tandem mass spectrometry for detection of 20 coccidiostats in poultry, livestock, and aquatic tissues[J]. Journal of Food and Drug Analysis, 2019, 27(3): 703-716. DOI:10.1016/j.jfda.2019.02.004.
[28]徐伟, 耿士伟, 刘路, 等. 高效液相色谱-串联质谱法同时检测猪肉中125 种兽药残留[J]. 天津农业科学, 2020, 26(2): 50-57. DOI:10.3969/j.issn.1006-6500.2020.02.012.
[29]中国兽医药品监察所, 华南农业大学, 中国农业大学, 等. 兽药残留实验室质量控制规范: NY/T 1896—2010[S]. 北京: 中国标准出版社, 2010.
[30]中华人民共和国浙江出入境检验检疫局, 中国合格评定国家认可中心. 实验室质量控制规范 食品理化检测: GB/T 27404—2008[S].北京: 中国标准出版社, 2008.