甲氧氯普胺又名灭吐灵、胃复安,为多巴胺D2受体拮抗剂,兽药原料药,主要抑制延髓催吐化学感受区,有较强的止吐作用,促进胃肠蠕动和胃功能恢复正常[1-3],临床上主要用于镇吐,副作用是会引起患者昏睡、烦燥不安、疲怠无力等。由于甲氧氯普胺价格低廉,经常违规使用,引发多种不良反应[4-7]。《中华人民共和国农业部公告第560号》指出,人用胃肠道药品用于动物源性食品缺乏残留检测实验数据,会增加动物源性食品中药物残留危害,因此明确规定动物源性食品中甲氧氯普胺为禁用兽药。SN/T 2227—2008《进出口动物源性食品中甲氧氯普胺残留量检测方法》适用于猪肉、猪肝、鱼、虾、鸡蛋中甲氧氯普胺的检测,说明甲氧氯普胺在动物源性食品中均可能有残留。日本规定了鳗鱼、鸡肉、鱼片、去壳软体动物、甲壳类(螃蟹)、猪肉、冻虾仁、牛肉、蜂蜜等动物源性食品中甲氧氯普胺的残留限量,其中水生动物、鸡肉、鸭肉、鹅肉、蜂蜜中甲氧氯普胺的残留限量为0.005 μg/mL,牛肝脏中甲氧氯普胺的残留限量为0.03 μg/mL[8]。
近年来,国内外文献报道多集中于测定甲氧氯普胺血药浓度以及测定盐酸甲氧氯普胺注射液中甲氧氯普胺的含量等,检测方法有高效液相色谱(high pressure liquid chromatography,HPLC)[9-11]、液相色谱-质谱[12-16]、毛细管电泳[17-18]、化学发光法[19-21]、紫外-可见分光光度法[22]、气相色谱法[23]等。超高压液相色谱法(ultra-high pressure liquid chromatography,UPLC)借助HPLC的理论及原理,增加了分析通量、灵敏度及色谱峰容量,广泛应用于生命科学、医药化学及食品卫生等方面。多位学者相继报道了利用UPLC进行药物分析及食品检测的研究工作[24-26],但是UPLC测定肉类食品中甲氧氯普胺的研究少有报道。本研究从肉类食品中提取甲氧氯普胺所需提取溶剂、酸碱试剂对提取的影响、净化小柱的选择、流动相的选择方面进行优化,建立UPLC测定肉类食品中甲氧氯普胺类兽药的检测方法,可为肉类食品分析检测工作提供一定参考。
1 材料与方法
1.1 材料与试剂
鱼肉、猪肉、牛肉当天购于海口市金鹿菜市场,鸡肉当天购于海口市东门菜市场。抽检样品(用于检测样品中甲氧氯普胺残留含量)信息如表1所示。
甲氧氯普胺标准品(纯度99.8%) 中国食品药品检定研究院;甲醇、乙腈、甲酸(均为色谱纯) 德国Merck公司;Oasis HLB柱(3 mL,60 mg)、酸性氧化铝柱(3 mL,500 mg) 美国Waters公司。
表1 抽检样品信息
Table 1 Information about samples tested in this study
注:抽检时散装样品抽检日期设定为抽检批号。
样品 批号 抽检市县 抽检市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190506/20190505 海口 海口市琼山区凤翔市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190506/20190506/20190505 三亚 三亚丹州小区市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190505/20190505 五指山 五指山鸿鑫农贸市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190505/20190505 儋州 儋州那大红旗市场鱼肉/猪肉/牛肉/鸡肉 20190507/20190505/20190506/20190505 琼海 琼海嘉积农贸市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190505/20190505 昌江 昌江石南市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190505/20190505 保亭 保亭三道市场鱼肉/猪肉/牛肉/鸡肉 20190506/20190505/20190505/20190505 东方 东方市第三市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190507/20190505/20190507 白沙 白沙邦溪市场鱼肉/猪肉/牛肉/鸡肉 20190507/20190506/20190506/20190506 琼中 琼中乌石农贸市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190508/20190508/20190505 屯昌 屯昌屯城水口市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190505/20190505 临高 临高江南市场鱼肉/猪肉/牛肉/鸡肉 20190509/20190505/20190505/20190505 澄迈 澄迈福山农贸市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190506/20190505/20190505 文昌 文昌文城农贸市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190505/20190505 乐东 乐东乐城农贸市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190506/20190505/20190505 万宁 万宁万城市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190507/20190507 陵水 陵水椰林架场田农贸市场鱼肉/猪肉/牛肉/鸡肉 20190505/20190505/20190505/20190505 定安 定安定城农贸市场
1.2 仪器与设备
ACQUITY H UPLC® CLASS超高效液相色谱仪(配备二极管阵列检测器) 美国Waters公司;Turbo Vap LV氮吹仪 力德生物科技(上海)有限公司;XS205十万分之一分析天平 瑞士Mettler-Toledo公司。
1.3 方法
1.3.1 试剂配制
准确称取10.0 mg甲氧氯普胺标准品于10 mL容量瓶中,加入0.1 mol/L盐酸溶液2 mL溶解,用甲醇定容,配制成1 000 mg/L甲氧氯普胺标准储备液;将1 000 mg/L甲氧氯普胺标准储备液用甲醇稀释为100 mg/L甲氧氯普胺标准液,取适量100 mg/L甲氧氯普胺标准液配制成1、5、10、20、50、100 mg/L系列甲氧氯普胺标准工作液。
1.3.2 样品前处理
精确称取2 g样品至50 mL离心管中,加入2.0 g无水Na2SO4,再加入5 mL乙腈,涡旋振荡10 min,10 000 r/min离心3 min,残渣再加入5 mL乙腈重复提取1 次,合并上清液,待净化。
取Oasis HLB柱,用3 mL乙腈淋洗活化小柱,取样品上清液过柱,再用5 mL乙腈淋洗小柱1 次,置于50 mL氮吹管中,于45 ℃条件下氮吹至干,残留物加入1.0 mL甲醇-水溶液(80∶20,V/V)复溶,复溶液经0.22 μm滤膜过滤后,作为待测液。
1.3.3 色谱条件
ACQUITY BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相:乙腈-0.1%甲酸水溶液(20∶80,V/V);流速0.3 mL/min;检测波长275 nm;柱温35℃;进样量3.0 μL。以保留时间定性,峰面积定量。在上述色谱条件下,甲氧氯普胺保留时间为1.711 min。
1.3.4 结果计算
式中:C为试样中甲氧氯普胺残留量/(mg/kg);ρ为仪器检测得出的试样中甲氧氯普胺残留质量浓度/(mg/L);V为试样最终定容体积/mL;m为试样质量/g。
2 结果与分析
2.1 流动相的选择
选择合适的流动相能使目标物较好地分离。按照1.3.2节的色谱条件,比较甲醇-水(30∶70,V/V)、甲醇-0.1%甲酸水溶液(30∶70,V/V)、乙腈-0.1%甲酸水溶液(20∶80,V/V)3 种不同的流动相对目标物色谱峰的影响,标准品进样质量浓度为10.0 mg/L。
图1 流动相为甲醇-水时甲氧氯普胺标准品色谱图
Fig.1 Chromatogram of standard metoclopramide using mobile phase consisting of methanol and water
图2 流动相为甲醇-0.1%甲酸水溶液时甲氧氯普胺标准品色谱图
Fig.2 Chromatogram of standard metoclopramide using mobile phase consisting of methanol and 0.1% formic acid in water
图3 流动相为乙腈-0.1%甲酸水溶液时甲氧氯普胺标准品色谱图
Fig.3 Chromatogram of standard metoclopramide using mobile phase consisting of acetonitrile and 0.1% formic acid in water
由图1~2可知,在流动相的水相中加入一定量的酸能使甲氧氯普胺的峰形更加尖锐,检测灵敏度也得到提高,本研究选择在流动相的水相中加入0.1%甲酸控制溶液pH值,得到较好的分离效果。甲醇-0.1%甲酸水溶液作为流动相会使色谱峰分叉,由图3可知,将有机相甲醇换成乙腈后,峰形尖锐不分叉,且目标物保留时间依然保持在1.7 min左右。因此,本研究选择乙腈-0.1%甲酸水溶液(20∶80,V/V)作为流动相。
普通HPLC法所用流动相配制复杂,进样量大,目标物保留时间较长。例如:刘翔[27]采用普通HPLC法测定盐酸甲氧氯普胺注射液中甲氧氯普胺的含量,流动相为甲醇-乙腈-醋酸盐缓冲液(10∶15∶75,V/V,含0.1%三乙胺,pH 4),进样体积20 μL,目标物保留时间为7 min左右;石杰等[11]也采用普通HPLC法测定盐酸甲氧氯普胺注射液中甲氧氯普胺的含量,所用流动相为乙腈-0.025 mol/L乙酸铵(20∶80,V/V,含0.2%三乙胺,冰醋酸调pH值至5.7),进样体积20 μL,目标物保留时间为7 min左右;范先鹏[28]、王静文[29]等采用普通HPLC法分别测定甲氧氯普胺鼻腔喷雾剂及鱼腥草注射液中甲氧氯普胺含量,目标物保留时间均为9 min左右。相比普通HPLC,本研究流动相配制更简单、进样量更少、目标物保留时间更短,大大提高了检测效率,更适合批量检测肉类食品中甲氧氯普胺的含量。
2.2 提取溶剂的选择
以阴性猪肉为基质,在基质中添加一定量的甲氧氯普胺标准品,比较乙腈和甲醇作为提取溶剂的提取效果,回收率测定参考万译文[30]、张秀清[31]等的方法。
表2 不同溶剂的提取效果
Table 2 Extraction efficiencies of different solvents

提取溶剂 甲氧氯普胺标准品加入量/(mg/kg)测定结果/(mg/kg) 回收率/%乙腈 25.0 26.4 105.6甲醇 25.0 23.4 93.6
由表2可知,乙腈作为提取溶剂时回收率更高,故本研究选择乙腈作为提取溶剂。SN/T 2227—2008及曹慧等[16]用液相色谱-串联质谱法检测,前处理步骤均采用乙腈作为提取溶剂,回收率为63.3%~119.5%。普通HPLC法检测注射液中的甲氧氯普胺含量时多采用流动相或甲醇进行提取,可能是由于甲氧氯普胺药物注射液成分较简单,而动物源性食品的基质成分复杂,乙腈能较好地从肉类基质中提取出甲氧氯普胺。
2.3 酸碱试剂的影响
以阴性猪肉为基质,在基质中添加一定量的甲氧氯普胺标准品,以乙腈作为提取溶剂,在甲氧氯普胺提取过程中加入0.1 mL 0.1 mol/L氢氧化钠、0.1 mL 0.1 mol/L盐酸,与空白对照组进行比较,确定酸碱试剂对甲氧氯普胺提取及测定结果的影响。
表3 提取过程中加入酸碱试剂对提取效果的影响
Table 3 Effects of acid versus alkali addition on extraction efficiency
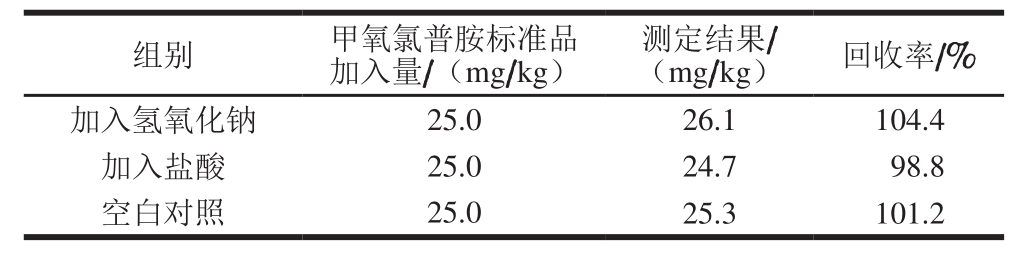
组别 甲氧氯普胺标准品加入量/(mg/kg)测定结果/(mg/kg) 回收率/%加入氢氧化钠 25.0 26.1 104.4加入盐酸 25.0 24.7 98.8空白对照 25.0 25.3 101.2
由表3可知,在提取过程中加入酸碱试剂对甲氧氯普胺提取效果无明显影响,说明甲氧氯普胺在一定pH值范围内比较稳定,方法专属性较强。范先鹏等[28]采用HPLC法测定甲氧氯普胺鼻腔喷雾剂中甲氧氯普胺的含量和有关物质时,进行了一项强制破坏实验,对甲氧氯普胺供试品分别进行碱(1 mol/L氢氧化钠溶液)、酸(1 mol/L盐酸溶液)、氧化(质量分数3%的过氧化氢溶液)、光照((4 500±500) lx光照5 d)等破坏处理后进样分析,结果表明,几种处理对测定均无干扰,但在破坏溶液的色谱图中均有不同程度的降解产物产生,各降解产物均与主峰有良好的分离度,同样表明甲氧氯普胺在一定pH值范围内比较稳定。
2.4 净化小柱的选择
已有文献报道中,采用液相色谱-质谱法检测甲氧氯普胺含量时多采用酸性氧化铝柱。本研究以阴性猪肉为基质,在基质中添加一定量的甲氧氯普胺标准品,以乙腈作为提取溶剂,比较Oasis HLB柱(3 mL,60 mg)、酸性氧化铝柱(3 mL,500 mg)2 种不同的固相萃取柱对甲氧氯普胺的净化效果。
表4 不同净化小柱的净化效果
Table 4 Purification efficiencies of different columns
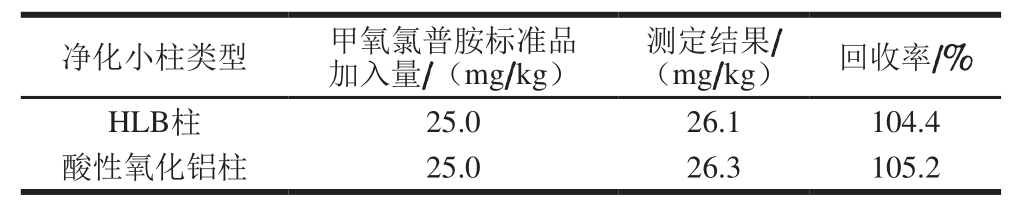
净化小柱类型 甲氧氯普胺标准品加入量/(mg/kg)测定结果/(mg/kg) 回收率/%HLB柱 25.0 26.1 104.4酸性氧化铝柱 25.0 26.3 105.2
由表4可知,HLB柱和酸性氧化铝柱净化效果均较好。HLB柱具有适合小分子和治疗性多肽分析、灵敏度更高、基质效应更低的优点,且适用于酸性、碱性和中性分析物。由于本研究样品为肉类食品,基质成分复杂,所需净化小柱的pH值应有较大的范围,以适应不同基质样品的提取净化,综合考虑,本研究选择Waters Oasis HLB柱(3 mL,60 mg)作为净化柱。
2.5 线性范围和灵敏度
分别吸取1、5、10、20、50、100 mg/L系列甲氧氯普胺标准工作液,根据其所得峰面积(y)与对应标准溶液的质量浓度(x)绘制标准曲线,得到甲氧氯普胺质量浓度1~100 mg/L范围内呈线性关系,其标准曲线方程为y=2.26×104x+1.63×104(R2=0.999 5),线性关系良好,可满足定量分析的要求。
在方法规定的取样质量条件下,在阴性猪肉样品中添加甲氧氯普胺标准储备液(添加水平为0.25 mg/kg),经测定信噪比(RS/N)均大于3,表明目标物的检测限为0.25 mg/kg。在阴性猪肉样品中添加甲氧氯普胺标准储备液(添加水平为0.5 mg/kg),经测定RS/N均大于10,表明其定量限为0.5 mg/kg。
阴性猪肉样品及甲氧氯普胺添加量0.5 mg/kg的阴性猪肉样品色谱图如图4所示。

图4 阴性样品(A)与甲氧氯普胺添加量0.5 mg/kg阴性样品(B)色谱图
Fig.4 Chromatograms of negative sample (A) and spiked sample at 0.5 mg/kg (B)
2.6 回收率和精密度
表5 回收率和精密度测定结果(n=12)
Table 5 Recoveries and precision of the method (n= 12)
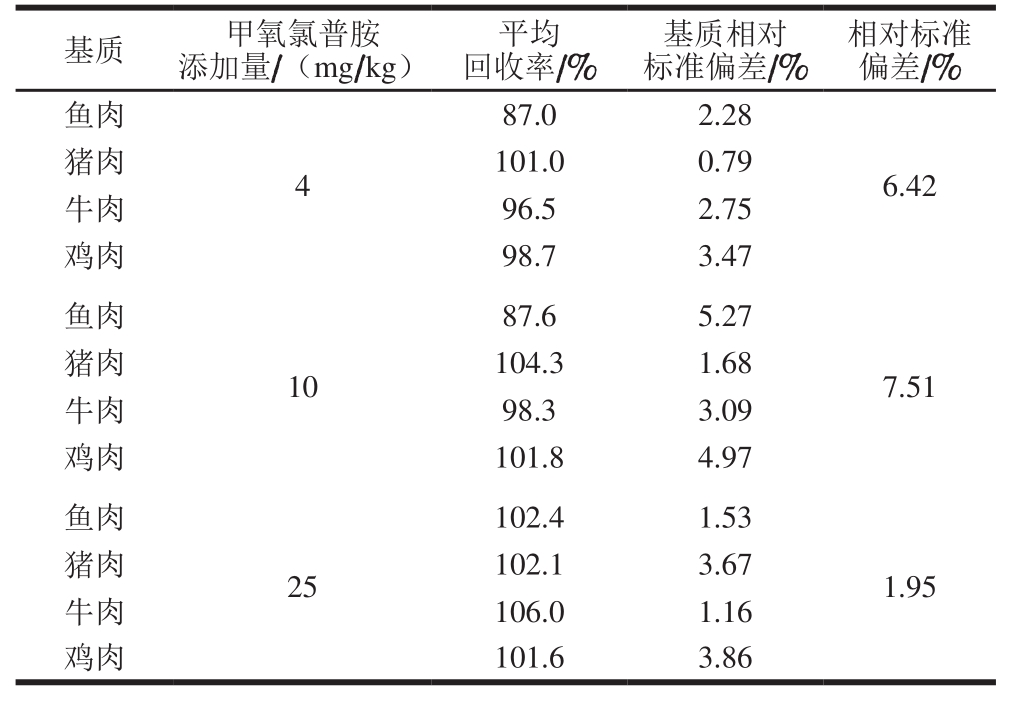
基质 甲氧氯普胺添加量/(mg/kg)平均回收率/%基质相对标准偏差/%相对标准偏差/%鱼肉4 87.0 2.28 6.42猪肉 101.0 0.79牛肉 96.5 2.75鸡肉 98.7 3.47鱼肉10 87.6 5.27 7.51猪肉 104.3 1.68牛肉 98.3 3.09鸡肉 101.8 4.97鱼肉25 102.4 1.53 1.95猪肉 102.1 3.67牛肉 106.0 1.16鸡肉 101.6 3.86
在不同的基质(鱼肉、猪肉、牛肉、鸡肉)中分别添加4、10、25 mg/kg 3 个水平的甲氧氯普胺标准品,每个添加水平设12 个平行,进行加标回收率实验。由表5可知,平均回收率为87.0%~106.0%,相对标准偏差为0.79%~5.27%,说明方法精密度较好,且具有较好的重复性,适用于肉类食品中甲氧氯普胺的检测。
2.7 样品测定
通过本研究建立的UPLC法对海南省各市县菜市场抽检的鱼肉、猪肉、牛肉和鸡肉4 类样品中甲氧氯普胺的残留量进行测定,每个样品平行测定2 次。
测定18 个市县抽检的各肉类样品共72 个,均未检出甲氧氯普胺类兽药。虽然目前在海南省各市县抽检的部分鱼肉、猪肉、牛肉和鸡肉中未检出甲氧氯普胺类兽药,但仍需加强兽药残留检测的必要性,把控动物源性食品的安全风险。
3 结 论
建立UPLC法测定肉类食品中甲氧氯普胺含量的检测方法。样品用乙腈提取,经HLB小柱净化后,采用C18色谱柱(2.1 mm×100 mm,1.7 μm),乙腈-0.1%甲酸水溶液(20∶80,V/V)为流动相,流速0.3 mL/min,检测波长275 nm,柱温35 ℃,进样量3.0 μL。结果表明:甲氧氯普胺在1~100 mg/L范围内呈良好的线性关系,R2=0.999 5,检出限为0.25 mg/kg,定量限为0.5 mg/kg,相对标准偏差为0.79%~5.27%(n=12),平均回收率达87.0%~106.0%。所建立的检测方法符合国内外有关标准和法规的要求,相比普通HPLC法,本方法的流动相配制更简单、进样量更少、目标物保留时间更短,且干扰性小、线性范围广,大大提高了检测效率,更适合批量检测肉类食品中甲氧氯普胺的含量。
[1]赵振,李玲.针刺联合盐酸甲氧氯普胺注射液治疗急性胃肠炎所致呕吐的临床疗效观察[J].甘肃科技,2018,34(16): 116; 119-120.DOI:10.3969/j.issn.1000-0952.2018.16.041.
[2]黄榕彬,刘文辉,谷铁波,等.含铂化疗相关性呃逆的不良反应临床分析[J].实用药物与临床,2019(11): 85-88.DOI:10.14053/j.cnki.ppcr.201911019.
[3]陈飞,程祺,杨雅雯.托烷司琼针、甲氧氯普胺针独用及合用对肿瘤化疗恶心、呕吐的预防效果评价[J].中国医药科学,2015,5(24):48-50.
[4]张瑞平.甲氧氯普胺中毒1 例[J].医学美学美容旬刊,2015(5): 766.
[5]陆雯.早孕妇女妊娠剧吐28 例的临床治疗分析[J].世界最新医学信息文摘,2019,19(89): 103; 107.DOI:10.19613/j.cnki.1671-3141.2019.89.064.
[6]GOOL A R V,DOORDUIJN J K,SEYNAEVE C.Severe akathisia as a side effect of metoclopramide[J].Pharmacy World and Science,2010,32(6): 704-706.DOI:10.1007/s11096-010-9444-3.
[7]国家药品不良反应监测中心.药品不良反应信息通报: 警惕甲氧氯普胺引起的锥体外系反应[J].中国药物警戒,2016,2(13): 123.DOI:10.19803/j.1672-8629.2016.02.018.
[8]农药甲氧氯普胺的基本信息[EB/OL].(2019-05-11) [2019-09-24].http://db.foodmate.net/pesticide/show_3315.html.
[9]SEVGI T U.High performance liquid chromatography for the determination of metoclopramide in pharmaceutical preparations using pre-column derivatization with fluorescamine[J].Chinese Journal of Chemistry,2012,30(3): 634-638.DOI:10.1002/cjoc.201280001.
[10]SANNA V.A new sensitive reversed-phase high-performance liquid chromatography method for the quantitative determination of metoclopramide in canine plasma[J].Analytical Letters,2008,41(5):767-778.DOI:10.1080/00032710801934601.
[11]石杰,王兴辉,闻京伟,等.RP-HPLC法测定盐酸甲氧氯普胺注射液含量及有关物质[J].药物分析杂志,2010,30(1): 117-119.DOI:10.16155/j.0254-1793.2010.01.045.
[12]BAYRAK Z,KURBANOGLU S,SAVASER A,et al.LC-MS method for the sensitive determination of metoclopramide: application to rabbit plasma,gel formulations and pharmaceuticals[J].Chromatographia,2014,77(1/2): 99-107.DOI:10.1007/s10337-013-2568-6.
[13]INAMADUGU J K,DAMARAMADUGU R,MULLANGI R,et al.Sensitive and selective liquid chromatography-tandem mass spectrometry method for the determination of metoclopramide in human plasma: application to a bioequivalence study[J].Biomedical Chromatography,2010,24(9): 1006-1014.DOI:10.1002/bmc.1401.
[14]HAMAMOTO K,MIZUNO Y,KATO M,et al.Simple and sensitive method for measurement of metoclopramide in cattle plasma by LC-MS/MS using a multimode chromatography[J].Journal of Veterinary Medical Science,2013,75(4): 509-513.DOI:10.1292/jvms.12-0220.
[15]中华人民共和国海南出入境检验检疫局.进出口动物源性食品中甲氧氯普胺残留量检测方法 液相色谱-质谱/质谱法: SN/T 2227—2008[S].北京: 中国标准出版社,2009.
[16]曹慧,施元旭,王璐璐.UPLC-MS/MS技术测定猪肉中甲氧氯普胺不确定度评价[J].食品工业科技,2017,38(9): 267-270.DOI:10.13386/j.issn1002-0306.2017.09.042.
[17]SULTAN M A,MAHER H M,ALZOMAN N Z,et al.Capillary electrophoretic determination of antimigraine formulations containing caffeine,ergotamine,paracetamol and domperidone or metoclopramide[J].Journal of Chromatographic Science,2013,51(6):502-510.DOI:10.1093/chromsci/bms175.
[18]周考文,顾雪梅,崔晓超,等.毛细管电泳电致化学发光法测定家犬体内甲氧氯普胺的血药浓度[J].化学学报,2011,69(2): 221-225.
[19]熊海涛,唐志华,聂峰,等.流动注射化学发光分析法测定片剂甲氧氯普胺[J].分析测试学报,2013,32(2): 244-248.DOI:10.3969/j.issn.1004-4957.2013.02.018.
[20]刘伟,孙丽,章竹君.测定甲氧氯普胺的化学发光新体系[J].陕西师范大学学报(自然科学版),2006,34(3): 59-61.DOI:10.3321/j.issn:1672-4291.2006.03.015.
[21]HUN Xu,ZHANG Zhujun.Electrogenerated chemiluminescence sensor for metoclopramide determination based on Ru(bpy)3 2+ -doped silica nanoparticles dispersed in Nafion on glassy carbon electrode[J].Journal of Pharmaceutical and Biomedical Analysis,2008,47(4/5):670-676.DOI:10.1016/j.talanta.2004.11.020.
[22]苗爱东,王本富,彭燕.紫外分光光度法测定甲氧氯普胺片含量的不确定度评价[J].解放军医药杂志,2010,22(增刊1): 33-34.DOI:10.3969/j.issn.2095-140X.2010.z1.031.
[23]赵磊,于丹,赵宾,等.甲氧氯普胺片的气相色谱分析方法[J].中国合理用药探索,2017,14(9): 75-77.DOI:10.3969/j.issn.2096-3327.2017.09.008.
[24]刘洋.超高效液相色谱及其于药物分析领域的应用[J].轻工科技,2015(3): 108-109.
[25]杨乔森.超高效液相色谱的特点分析及在药物领域的应用[J].中国石油和化工标准与质量,2012,33(9): 230.DOI:10.3969/j.issn.1673-4076.2012.10.201.
[26]钟慈平.固相萃取-超高效液相色谱检测食品中直接红染料方法的研究[D].重庆: 西南大学,2014.
[27]刘翔.HPLC法测定盐酸甲氧氯普胺注射液中甲氧氯普胺的含量[J].安徽医药,2010,14(7): 779-781.DOI:10.3969/j.issn.1009-6469.2010.07.017.
[28]范先鹏,孙建绪,肖军海,等.HPLC法测定甲氧氯普胺鼻腔喷雾剂的含量和有关物质[J].军事医学,2015(2): 133-135.DOI:10.7644/j.issn.1674-9960.2015.02.013.
[29]王静文,范强,龚旭昊,等.鱼腥草注射液中非法添加甲氧氯普胺的HPLC-PDA检测方法的建立[J].中国兽药杂志,2016,50(3): 45-48.
[30]万译文,黄向荣,索纹纹,等.固相萃取-高效液相色谱法测定水产品中喹乙醇代谢物的含量[J].湖南饲料,2014(4): 16-18.DOI:10.3969/j.issn.1673-7539.2014.04.010.
[31]张秀清,陈俊秀,李文廷,等.超高效液相色谱-串联质谱法测定酸奶中的喹乙醇及其代谢物[J].中国卫生检验杂志,2019,29(6): 651-653.