肉类食品鲜香味美、营养丰富,一直以来在百姓餐桌上占据重要位置[1-4]。但在国内及国际贸易中,在牛、羊肉中搀杂价格便宜的鸭肉、以次充好的欺骗行为屡见不鲜[5-6]。目前,肉类来源的鉴别方法主要有:1)显微镜观察法,通过鉴定肉制品的味道、颜色和肉类纹理等进行判别,但是这种方法费时、费力,对工作人员的技术要求高[7-9];2)基因方法,如核酸探针杂交、DNA指纹分析、聚合酶链式反应(polymerase chain reaction,PCR)-限制性片段长度多态性和PCR特异扩增[9-12],这类方法鉴定结果比较准确,但是成本较高,而且由于DNA没有组织特异性,对同一物种的肌肉、脂肪、血液等无法区分[13-15];3)免疫学检测方法,如免疫印迹、琼脂扩散、酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)[16-18],ELISA方法操作简单快速,应用最为广泛[19-20]。
在加工过程中,肉类通常要经过加热、高压、辐射等处理,DNA和蛋白质损失较大,随着热稳定蛋白及其抗体的研究,这一问题得到解决[21-22]。肌钙蛋白(troponin,Tn)为横纹肌结构蛋白,是肌肉收缩系统的主要调节蛋白,由TnC、TnT、TnI 3 个亚基组成[23-24]。Chen等[25-26]研究证实,猪TnI为热稳定标志蛋白,并建立ELISA测定动物饲料中动物肌肉的方法。Rencova等[27]用不同动物肌肉组织的热提取物作为抗原,制备兔多克隆抗体,并建立间接竞争ELISA方法,成功鉴别热加工的鸡、马、袋鼠和老鼠的肌肉组织。Kim等[28]用肠道平滑肌的加热提取物制备单抗,可以用于动物饲料中肉骨粉的免疫学检测。本研究将羊骨骼肌经煮沸提取、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)得到TnT条带,制备特异性单抗,并对抗体特性进行评价,为羊肉免疫学鉴定方法的建立和产品检测提供参考。
1 材料与方法
1.1 材料与试剂
HAT培养基(HAT media supplement(50×),Hybri-MaxTM)、HT培养基(HT media supplement(50×),Hybri-MaxTM)、福氏完全佐剂、福氏不完全佐剂、免疫球蛋白亚型试剂盒 美国Sigma公司;细胞培养板、培养瓶、DMEM培养基、胎牛血清 美国Gibco公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG)北京中杉金桥生物科技有限公司;其他试剂均为国产分析纯。
BALB/c小鼠 河北医科大学实验动物中心。
1.2 仪器与设备
90-2磁力搅拌器 上海浦江分析仪器厂;MCO-15AC二氧化碳培养箱 日本Sanyo公司;SW-CJ-2FD超净工作台 苏州净化设备有限公司;CKX41SF倒置显微镜 日本Olympus公司;1510酶标仪、ND2000超微量核酸蛋白测定仪 德国Thermo公司;VORTEX 1漩涡混合器 上海医科大学仪器厂;D37520台式冷冻离心机、移液器 德国Eppendorf公司;FluorChem® HD2化学发光凝胶成像系统 美国Alpha公司。
1.3 方法
1.3.1 抗原的提取
取羊骨骼肌去除脂肪和结缔组织,研磨混匀,称取20 g,加入0.15 mol/L NaCl溶液(1∶2,m/V);涡旋混匀后,超声提取5 min(100 W),煮沸20 min后,5 000×g离心20 min;去除沉淀,取上清过滤后作为检测原;采用相同方法提取,经离心后,取上清于121 ℃高压处理30 min,5 000×g离心30 min,上清用Whatman 1号滤纸过滤,滤液加入90%乙醇(1∶3.74,V/V),静置2 h;混合液7 000×g离心20 min,取沉淀烘干,为免疫原提取物,经SDS-PAGE后切胶用于免疫[20]。
1.3.2 SDS-PAGE鉴定
选择12%分离胶、5%浓缩胶,对检测原、免疫原提取物进行SDS-PAGE鉴定。
1.3.3 动物免疫
BALB/c小鼠颈背部注射免疫原,每隔2 周加强免疫1 次,3 免后7~10 d断尾取血,间接ELISA方法检测血清抗体效价,选取免疫效果最佳的小鼠进行细胞融合。
1.3.4 单克隆抗体的制备
采用聚乙二醇法进行融合,融合7 d后,出现肉眼可见细胞集落时换用HT培养基;上清液用间接ELISA方法检测,筛选阳性杂交瘤细胞;检测结果为阳性的孔,挑选吸光度较高的单个克隆,通过有限稀释法进行亚克隆,直至得到稳定分泌抗体的杂交瘤细胞株;小鼠体内诱生腹水,采用辛酸-硫酸铵沉淀的方法纯化[30]。
1.3.5 单克隆抗体特性鉴定
1.3.5.1 单克隆抗体效价测定
参考刘青涛[17]的方法,并稍作修改。采用间接ELISA法进行抗血清效价测定,具体步骤如下:检测原质量浓度为5 μg/mL,96孔酶标板每孔100 μL,4 ℃包被过夜;以含体积分数0.1%吐温-20的0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)作为洗液,洗涤3 次,每次用量300 mL,拍干(下同);每孔加入含体积分数10%胎牛血清的洗液封闭,37 ℃孵育2 h;洗涤、拍干;将待测血清稀释1 000 倍,每孔加入100 μL,并且设置空白对照孔(PBS)和阴性对照孔(阴性血清),37 ℃孵育45 min;洗涤、拍干;每孔加入100 μL稀释10 000 倍的HRP标记山羊抗小鼠IgG,37 ℃孵育30 min;洗涤、拍干;每孔加入底物显色液100 μL,37 ℃避光反应15 min;每孔加入50 μL终止液,终止反应;450 nm波长处测定吸光度(A),阴性对照孔吸光度为A1,阳性对照孔为A2,以A2/A1≥2.1为阳性结果。
1.3.5.2 单克隆抗体亚型测定
按免疫球蛋白亚型试剂盒说明书步骤进行测定。
1.3.5.3 单克隆抗体特异性测定
用间接ELISA法测定单克隆抗体与牛、羊、鸡、鸭、鱼骨骼肌提取物的效价,提取方法同1.3.1节。
1.3.5.4 免疫印迹
参考康洁[30]的方法。SDS-PAGE后转膜,转膜后经封闭、洗膜,加入稀释的辛酸-硫酸铵纯化抗体,洗膜后加入稀释的HRP标记山羊抗小鼠IgG,洗膜后加入显色液,采用化学发光凝胶成像系统进行拍照。
1.3.5.5 单克隆抗体亲和力测定
参照文献[29]的方法,采用间接ELISA法测定亲和常数(Ka)。
1.4 数据处理
采用Gradpad作图软件、Excel软件进行数据处理。
2 结果与分析
2.1 抗原的提取及测定
对羊骨骼肌进行提取后,得到固体物质115 mg,得率为0.57%。经考马斯亮蓝G-250法测定,免疫原提取物蛋白含量为48.7%;用超微量核酸蛋白测定仪测得检测原质量浓度为10.2 mg/mL。
2.2 SDS-PAGE结果
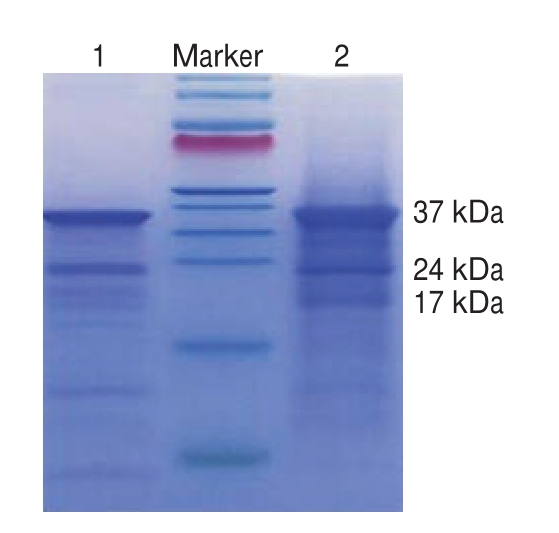
图1 提取物的SDS-PAGE鉴定结果
Fig.1 SDS-PAGE identification of extracts
泳道1.检测原;泳道2.免疫原提取物。
由图1可知,带形清晰、颜色较深的条带有3 条,对应的分子质量约为37、24、17 kDa,与文献[30]报道的骨骼肌的TnT、TnI、TnC亚基分子质量相符。与检测原相比,免疫原提取物杂带较少,颜色较深,证明经过进一步处理的抗原纯度更高。取37 kDa条带研磨后用于免疫。
2.3 杂交瘤细胞株的筛选
融合后出现肉眼可见细胞集落时,取上清进行间接ELISA检测阳性克隆,阳性孔继续进行亚克隆,直至全阳性。经过3~4 次亚克隆,筛选出羊骨骼肌肌钙蛋白T(skeletal muscle troponin T,sTnT)单克隆抗体细胞株3 株,分泌的单克隆抗体分别命名为2E11、3D3、4C2。
2.4 单克隆抗体效价测定结果
表1 单克隆抗体部分特性测定结果
Table 1 Selected characteristics of monoclonal antibody

单克隆抗体 单抗质量浓度/(mg/mL) 单抗效价2E11 26.8 1∶1.00×106 3D3 5.0 1∶2.56×105 4C2 10.9 1∶5.12×105
小鼠腹水经辛酸-硫酸铵沉淀法纯化后即为单抗,用超微量核酸蛋白测定仪测定其蛋白质量浓度,间接ELISA测定效价。由表1可知,3 株单克隆抗体细胞株分泌的抗体效价均在105以上。
2.5 单克隆抗体亚型测定结果
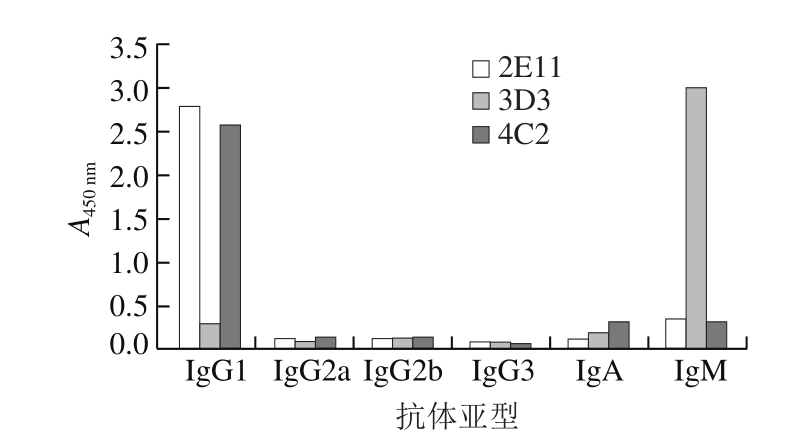
图2 单克隆抗体亚型测定结果
Fig.2 Determination of monoclonal antibody subtype
采用间接ELISA方法测定3 种单克隆抗体的亚型。由图2可知,不同杂交瘤细胞分泌的单克隆抗体与不同亚型的抗体显色有明显差异,其中2E11与抗体IgG1反应的A450 nm最高,与抗体IgM反应的A450 nm较低,而与抗体IgG2a、IgG2b、IgG3和IgA反应的A450 nm均低于0.2;4C2与抗体IgG1反应的A450 nm最高,与抗体IgA、IgM反应的A450 nm较低,而与抗体IgG2a、IgG2b、IgG3反应的A450 nm均低于0.2;因此2E11、4C2分泌的抗体类型以IgG1为主。3D3与抗体IgM反应的A450 nm最高,与抗体IgG1反应的A450 nm较低,与抗体IgG2a、IgG2b、IgG3和IgA反应的A450 nm均低于0.2,因此3D3分泌的抗体类型以IgM为主。
2.6 单克隆抗体特异性测定
由图3可知:2E11与牛、羊、鸡、鸭骨骼肌提取物反应效价分别为1∶1.0×106、1∶2.0×106、1∶1.0×106、1∶5.1×105,与鱼骨骼肌提取物也有明显反应;3D3与牛、羊骨骼肌提取物的反应效价均为1∶2.5×105,与鸡、鸭、鱼骨骼肌提取物的反应效价低于1∶5.1×103;4C2与羊骨骼肌提取物反应效价为1∶2.0×106,与牛骨骼肌提取物反应效价为1∶1.0×106,与鸡、鸭、鱼骨骼肌提取物的效价低于1∶2.5×105。2E11与鸡、鸭、鱼的交叉反应较高,3D3的特异性较好,但效价相对较低,综合评价得出,4C2效价较高、特异性较好,用于下一步实验。
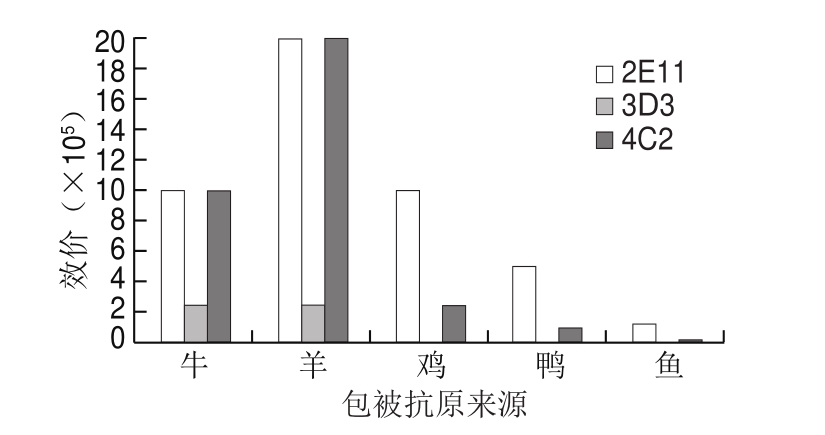
图3 单抗交叉反应结果
Fig.3 Cross-reactivity of monoclonal antibody
2.7 单克隆抗体免疫印迹
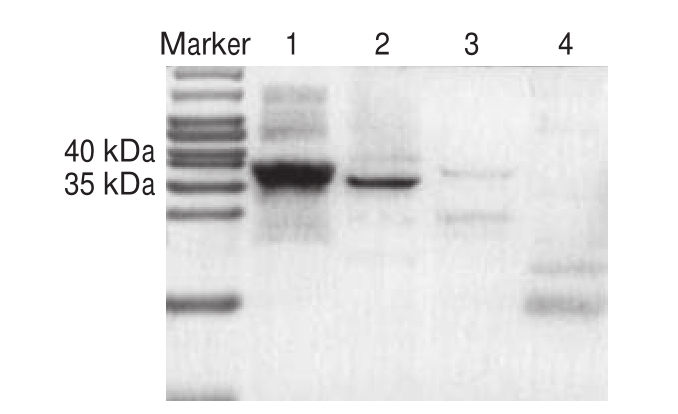
图4 4C2与骨骼肌提取物特异反应的免疫印迹图谱
Fig.4 Immunoblot analysis of specific response of 4C2 to skeletal muscle extracts
泳道1.羊骨骼肌提取物;泳道2.牛骨骼肌提取物;泳道3.鸭骨骼肌提取物;泳道4.鸡骨骼肌提取物。
由图4可知,4C2分别与转印有牛、羊、鸡、鸭骨骼肌提取物的聚偏二氟乙烯膜反应,显色后仅在牛、羊骨骼肌提取物的37 kDa位置出现单一条带,而鸡、鸭骨骼肌提取物无明显条带,初步证实4C2能结合牛、羊骨骼肌提取物,主要结合骨骼肌TnT亚基,不与鸡、鸭骨骼肌提取物结合。
2.8 单克隆抗体Ka
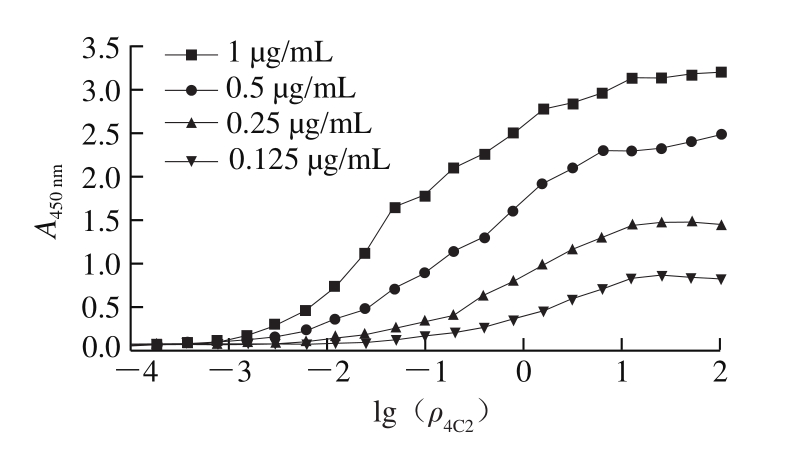
图5 4C2的亲和力测定结果
Fig.5 Determination of affinity of 4C2
采用间接ELISA法测定4C2的Ka,以抗体质量浓度的对数为横坐标,以A450 nm为纵坐标,绘制S型曲线,经计算,Ka为1.1×109 L/mol,表明4C2的亲和力较高。
3 结 论
将羊骨骼肌经过粗提,免疫小鼠后进行融合,筛选高效价、高特异性的单克隆抗体,最后获得3 株稳定分泌抗羊骨骼肌肌钙蛋白单克隆抗体的细胞株。通过小鼠体内诱生腹水,用辛酸-硫酸铵沉淀方法进行纯化,得到单克隆抗体。经过鉴定,4C2特异性较好,与羊骨骼肌提取物的反应效价为1∶2.0×106,与牛骨骼肌提取物的反应效价为1∶1.0×106,与鸡、鸭骨骼肌提取物的反应效价低于1∶2.5×105,特异性较好。4C2的类型以IgG1为主,Ka为1.1×109 L/mol。免疫印迹结果显示,4C2能够用于区分牛、羊和鸡、鸭的骨骼肌提取物,在37 kDa条带显色,证明4C2是骨骼肌TnT的抗体,且可以用于区分反刍动物和禽类的骨骼肌组织。本研究为食品中羊肉源性成分免疫学鉴别方法的建立提供了参考。
[1]高敬,魏迪,张癸荣,等.常见肉类鉴别技术研究进展[J].食品科学,2014,35(11): 356-360.DOI:10.7506/spkx1002-6630-201411068.
[2]范丽丽.实时荧光PCR检测食品肉类种源方法研究[D].苏州: 苏州大学,2013: 1-5.
[3]侯东军,杨红菊,于雷,等.环介导恒温扩增法鉴定牛羊肉中的搀杂肉[J].食品工业科技,2012,33(22): 60-62.DOI:10.13386/j.issn1002-0306.2012.22.037.
[4]尚柯,段庆梓,张玉,等.多重PCR法用于畜肉源性鉴定的研究[J].食品工业科技,2013,34(8): 83-85.DOI:10.13386/j.issn1002-0306.2013.08.004.
[5]骆训国,栗绍文,周蕾蕾,等.夹心ELISA方法检测生肉混合物中的猪肉成分的研究[J].动物医学进展,2010,31(增刊1): 19-22.DOI:10.16437/j.cnki.1007-5038.2010.s1.004.
[6]李家鹏,乔晓玲,田寒友,等.食品和饲料中动物源性成分检测技术研究进展[J].食品科学,2011,32(9): 340-347.
[7]熊蕊,郭凤柳,刘晓慧,等.牛羊肉中掺杂猪肉的PCR方法的建立和初步应用[J].食品工业,2014,35(8): 199-202.
[8]任君安,黄文胜,葛毅强,等.肉制品真伪鉴别技术研究进展[J].食品科学,2016,37(1): 247-257.DOI:10.7506/spkx1002-6630-201601043.
[9]李林,刘青涛,邹艳丽,等.饲料中动物源性成分的检测技术研究进展[J].饲料工业,2006(13): 34-36.
[10]张全芳,马德源,刘艳艳,等.利用多重PCR技术检测羊肉中掺杂狐狸肉的方法研究[J].山东农业科学,2014,46(12): 4-6; 10.DOI:10.14083/j.issn.1001-4942.2014.12.002.
[11]王建昌,王金凤,陈瑞春,等.鸭肉冒充牛羊肉的分子生物学检测[J].肉类研究,2012,26(6): 20-23.
[12]于丽娟,张艳花,徐新明,等.利用PCR技术鉴定常见肉类来源[J].中国草食动物科学,2016,36(5): 7-10.
[13]北京维德维康生物技术有限公司.荧光定量PCR技术用于食品肉类种源掺假鉴定[J].食品安全导刊,2017(10): 26-27.DOI:10.16043/j.cnki.cfs.2017.10.015.
[14]LIU Lihua,CHEN F C,DORSEY J L,et al.Sensitive monoclonal antibody based sandwich elisa for the detection of porcine skeletal muscle in meat and feed products[J].Food Microbiology and Safety,2006,71(1): M1-M6.DOI:10.1111/j.1365-2621.2006.tb12393.x.
[15]MOMCILOVIC D,RASOOLY A.Detection and analysis of animal materials in food and feed[J].Journal of Food Protection,2000,63(11): 1602-1609.DOI:10.4315/0362-028X-63.11.1602.
[16]马伊萨兰,吕明星,唐俊妮,等.用Cytb基因序列分析鉴定肉制品掺假[J].中国食品卫生杂志,2016,28(1): 48-51.DOI:10.13590/j.cjfh.2016.01.011.
[17]刘青涛.牛羊肉骨粉夹心ELISA检测方法的建立[D].扬州: 扬州大学,2006: 9-10.
[18]周蕾蕾.猪骨骼肌肌钙蛋白Ⅰ基因的表达及其单克隆抗体的制备[D].武汉: 华中农业大学,2009: 5-6.
[19]彩鸿翔,鲁晓翠,侯玉泽,等.酶联免疫吸附技术在食品安全检测中的应用研究进展[J].河北农业科学,2007(6): 67-69.DOI:10.16318/j.cnki.hbnykx.2007.06.006.
[20]CHEN F C,HSIEH Y H P,BRIDGMAN R C.Monoclonal antibodies to porcine thermal-stable muscle protein for detection of pork in raw and cooked meats[J].Journal of Food Science,1998,63(2): 201-205.DOI:10.1111/j.1365-2621.1998.tb15709.x.
[21]LI Chunsheng,LI Yujing,ZHANG Yan,et al.Preparation of an antiformoterol monoclonal antibody for indirect competitive ELISA detection of formoterol in urine and pork samples[J].Analytical Methods,2018(5): 548-553.DOI:10.1039/C7AY02562A.
[22]马永征,马冬,白娣斯,等.免疫学检测肉类制品掺假研究进展[J].肉类研究,2012,26(9): 26-29.
[23]KATUS H A,LOOSER S,HALLERMAYER K,et al.Development and in vitro characterization of a new immunoassay of cardiac troponin T[J].Clinical Chemistry,1992,38(3): 386-393.
[24]张镭,孙俊红,李永强,等.骨骼肌肌钙蛋白I的研究进展及法医学应用展望[J].中国法医学杂志,2013,28(4): 300-302.DOI:10.13618/j.issn.1001-5728.2013.04.012.
[25]CHEN F C,HSIEH Y H P.Porcine troponin I: a thermostable species marker protein[J].Meat Science,2002,61(1): 55-60.DOI:10.1016/S0309-1740(01)00162-0.
[26]CHEN F C,HSIEH Y H P,BRIDGMAN R C.Monoclonal antibodies against troponin I for the detection of rendered muscle tissues in animal feedstuffs[J].Meat Science,2002,62(4): 405-412.DOI:10.1016/S0309-1740(02)00029-3.
[27]RENCOVA E,SVOBODA I,NECIDOVA I.Identifification by ELISA of poultry,horse,kangaroo,and rat muscle specifificproteins in heat processed products[J].Veterinarni Medicina,2000,45(12): 353-356.
[28]KIM S H,HUANG T S,SEYMOUR T A,et al.Identification of a biomarker for the detection of prohibited meat and bone meal residues in animal feed[J].Journal of Food Science,2006,69(9): C739-C745.DOI:10.1111/j.1365-2621.2004.tb09926.x.
[29]李春生,刘静静,杜顺丰,等.呋喃唑酮代谢物单克隆抗体和胶体金免疫层析试纸条的研制[J].现代食品科技,2017,33(6): 326-331.DOI:10.13982/j.mfst.1673-9078.2017.6.048.
[30]康洁.牛心肌肌钙蛋白T的分离纯化和单克隆抗体的制备[D].北京:北京结核病胸部肿瘤研究所,2001: 3.