传统发酵香肠中使用的发酵剂主要为乳酸菌、葡萄球菌、微球菌、酵母菌及霉菌[1]。发酵剂能够提高食品的营养价值和风味,保证食品的安全性并延长食品保质期[2-3],部分发酵剂还能通过自身的益生特性提升产品的功能价值[4]。为筛选得到具有优良发酵特性的微生物,国内外学者进行了大量研究,主要集中在改善风味和提升营养价值方面。刘英丽等[5]筛选得到5 株乳酸菌,将它们与酵母菌复配接种于香肠发酵,结果表明,香肠中醇类挥发性物质含量增多,并产生特有的四甲基吡嗪。Song等[6]将健康韩国婴儿粪便样品中分离的益生菌Bifidobacterium longum KACC 91563用作发酵香肠的功能性发酵剂,结果表明,益生菌组的脂质氧化水平较低,总不饱和脂肪酸含量和ω-6/ω-3不饱和脂肪酸含量高。
当前,含有乳酸菌和双歧杆菌等益生菌的功能性食品开发受到越来越多的关注,但将益生菌应用于发酵肉制品中是一个巨大的挑战,因为食品加工和贮藏过程中的恶劣环境会影响其存活率[7]。因此,筛选具有良好抗逆性的益生菌菌株,将其应用于发酵香肠,对于香肠营养价值和感官特性的提升均有重要意义。
凝结芽孢杆菌(Bacillus coagulans)是一类革兰氏阳性、兼性厌氧、产乳酸的芽孢菌[8]。凝结芽孢杆菌不仅具有乳酸菌的特性,而且具备芽孢菌酶系丰富、抗逆性强、耐高温、易贮存的特性[9],对发酵环境具有更强的耐受性,在发酵食品中有潜在的应用价值。凝结芽孢杆菌具有蛋白水解和脂肪水解活性。Keller等[10]采用体外模型研究凝结芽孢杆菌GBI-30,6086对植物蛋白的消化作用,证明其可释放肽酶,促进机体对蛋白质的消化吸收。Gowthami等[11]通过统计优化得到橄榄(0.5%)、吐温-80(0.6%)和FeSO4(0.05%)的最优添加量,使凝结芽孢杆菌VKL1在培养基中的脂肪酶产量增加3.2 倍。此外,凝结芽孢杆菌与部分乳酸菌和双歧杆菌一样具备益生特性,相比营养体形式,凝结芽孢杆菌的孢子对胃酸和消化酶的耐受性更强[12],能够促进营养物质的吸收[13]、调节肠道菌群平衡[14]、提高机体免疫力[15]并改善肠道功能紊乱[16]。因此,凝结芽孢杆菌是一种潜在的功能性发酵剂。
本研究旨在筛选具有优良发酵特性的凝结芽孢杆菌,探究其发酵特性。通过筛选得到产酸快、耐盐、抑菌特性优良且发酵酶系丰富的凝结芽孢杆菌,并通过模拟发酵香肠模型评价其在发酵香肠中的应用价值。
1 材料与方法
1.1 材料与试剂
实验菌株由中国农业大学应用微生物实验室提供;MRS培养基、MSA培养基、蛋白胨、牛肉浸粉 北京奥博星生物技术有限责任公司;氯化钠、亚硝酸钠、碳酸钙、葡萄糖(均为分析纯) 国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒、2×Taq聚合酶链式反应(polymerase chain reaction,PCR)MasterMix天根生化科技有限公司;API ZYM酶活性试剂条 梅里埃诊断产品(上海)有限公司;戊糖片球菌、木糖葡萄球菌冻干菌粉 上海昊岳食品科技有限公司。
1.2 仪器与设备
AOC-5000自动固相萃取仪、QP2010 plus气相色谱-质谱联用仪 日本岛津公司;UV-1800紫外分光光度计上海美谱达仪器有限公司;SW-CJ-2D2G2F2FD超净工作台 上海苏净实业有限公司;DNP-9162恒温培养箱上海精宏实验设备有限公司。
1.3 方法
1.3.1 凝结芽孢杆菌的初筛
取实验室前期从食品中分离保藏的41 株产酸芽孢菌进行初筛,对菌株分别进行接触酶、发酵葡萄糖产酸产气、产黏、产H2S、精氨酸产氨、氨基酸脱羧实验以及蛋白酶、脂肪酶检测实验,筛选符合发酵特性的菌株进行进一步筛选。
1.3.2 凝结芽孢杆菌的复筛
1.3.2.1 菌株产酸能力测定
菌株以2%(体积分数,下同)的接种量接种于MRS培养基中,37 ℃培养24 h后测定培养液pH值。
1.3.2.2 菌株耐盐性及耐亚硝酸盐性测定
菌株活化后以2%的接种量接种于分别添加5 g/100 mL NaCl、150 mg/kg NaNO2的MRS肉汤培养基中,37 ℃培养24 h,用紫外分光光度计测定其在600 nm波长处的吸光度,与空白MRS肉汤培养基对照,确定其生长情况。
1.3.2.3 菌株抑菌特性测定
采用牛津杯琼脂扩散法筛选抑菌性能较好的菌株。预先在无菌平皿中加入适量1.5 g/100 mL的素琼脂,凝固后,放入牛津杯(直径8 mm);向15 mL半固体培养基(含0.6 g/100 mL琼脂)中加入10 μL指示菌(单增李斯特菌、大肠杆菌、金黄色葡萄球菌和蜡样芽孢杆菌),倒入含有琼脂的平皿中,凝固后,取出牛津杯,每孔分别加入200 μL的细菌发酵液和空白MRS培养基(对照),在最适温度(37 ℃)条件下培养24 h后观察抑菌效果。
1.3.2.4 菌株发酵酶系鉴定
利用API ZYM酶活性试剂条鉴定发酵酶系,通过颜色强度(0~5)确定酶的活性,0表示无酶活性,1~5分别对应5、10、20、30、40 nmol水解底物[17]。
1.3.3 凝结芽孢杆菌的鉴定
1.3.3.1 形态学观察
筛选后的菌株在MRS固体平板上划线,37 ℃培养24 h,观察菌落的大小、边缘、表面、透明度等形态特征。对菌株进行革兰氏染色,在显微镜下观察菌体的细胞形态。
1.3.3.2 生理生化鉴定
参照《伯杰细菌鉴定手册》[18]和《常见细菌系统鉴定手册》[19]对菌株的生理生化特征进行鉴定。
1.3.3.3 16S rDNA分子生物学鉴定
利用细菌基因组D N A提取试剂盒提取菌株的D N A。以提取的D N A为模板,利用正向引物27F和反向引物1492R进行PCR扩增,PCR扩增反应体系(20 μL):2×Mix 20 μL、引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)2 μL、引物1492R(5’-GGTTACCTTGTTACGACTT-3’)2 μL、模板DNA 2 μL、ddH2O 14 μL。PCR反应条件:95 ℃、10 min,95 ℃、40 s,50 ℃、40 s,72 ℃、90 s,30 个循环后72 ℃延伸10 min。用1.5%琼脂糖凝胶电泳对扩增后的PCR产物进行分析,之后由北京博迈德基因技术有限公司进行测序,测序结果与Genbank(http://www.ncbi.nlm.nih.gov)中的数据进行Blast对比分析,下载近源物种菌株的16S rDNA序列,利用MEGA 6.0软件绘制系统发育树。
1.3.4 凝结芽孢杆菌L-H7的生长特性和产酸能力测定
将凝结芽孢杆菌L-H7以2%的接种量接种于MRS培养基,37 ℃静置培养,每4 h取样测定菌液pH值,并用紫外分光光度计测定其在600 nm波长处的吸光度。
1.3.5 凝结芽孢杆菌L-H7在模拟发酵香肠中的应用
1.3.5.1 发酵香肠模型的制备
参照Almeida等[20]的方法,制备烧杯香肠模型(Beaker sausage models,BS),略有改动。选用猪背脊肉,将质量比7∶3的瘦肉和肥肉斩拌后加入3%盐、0.35%葡萄糖混匀后接种发酵剂,以戊糖片球菌和木糖葡萄球菌为对照,通过接种不同组合发酵剂制备5 组发酵香肠模型:BS-1:接种戊糖片球菌(7 (lg(CFU/g)))+木糖葡萄球菌(7 (lg(CFU/g)));BS-2:接种凝结芽孢杆菌(7 (lg(CFU/g)));BS-3:接种戊糖片球菌(7 (lg(CFU/g)));BS-4:接种凝结芽孢杆菌(7 (lg(CFU/g)))+木糖葡萄球菌(7 (lg(CFU/g)));BS-5:接种凝结芽孢杆菌(7 (lg(CFU/g)))+戊糖片球菌(7 (lg(CFU/g)))+木糖葡萄球菌(7 (lg(CFU/g)))。将肉糜灌入无菌离心管中,封口膜封口后于恒温培养箱中25 ℃发酵2 d,然后将温度调至15 ℃发酵5 d。
1.3.5.2 发酵期微生物指标及pH值测定
微生物指标测定:在无菌条件下去除香肠肠衣,取10 g香肠于无菌均质袋中,加入90 mL无菌生理盐水,充分拍打均质后取适量样液进行梯度稀释后,选择适宜的梯度倾注平板,并在适宜温度下培养48 h后计数。乳酸菌和凝结芽孢杆菌的总菌落数测定选用MRS培养基,葡萄球菌总菌落数测定选用MSA培养基。
pH值测定:称取香肠样品10 g于90 mL无菌生理盐水中,充分拍打均质后,用pH计测定滤液的pH值。
1.3.5.3 挥发性风味化合物分析
取发酵后的香肠样品5 g置于20 mL顶空瓶内,参照Sidira等[21]的方法,略有改动,采用顶空固相微萃取法提取挥发性化合物,再通过气相色谱-质谱联用法(gas chromatograph-mass spectrum,GC-MS)对化合物进行分离并分析。
固相微萃取条件:采用65 μm PDMS/DVB萃取头,将样品置于50 ℃条件下平衡20 min后,将萃取头插入顶空瓶中萃取40 min,最后将萃取头拔出并置于200 ℃的进样口中解吸2 min。
GC条件:DB-WAX色谱柱(30 m×0.25 mm,0.25 μm),柱温箱初始温度40 ℃,进样口温度200 ℃,不分流进样,载气流速1 mL/min,柱温箱升温程序为40 ℃保持3 min,5 ℃/min升至120 ℃,10 ℃/min升至200 ℃,保持5 min。
MS条件:离子源温度200 ℃,传输线温度250 ℃,采用全扫描模式采集信号,扫描范围m/z 35~500。
使用NIST 11数据库对未知挥发性化合物谱图进行比对,并采用面积归一化法进行定量。
1.4 数据处理
所有实验重复3 次,使用Microsoft Office Excel软件进行数据分析处理和作图,并用SPSS 23软件进行方差分析,P<0.05表示差异显著,结果有统计学意义。
2 结果与分析
2.1 凝结芽孢杆菌的初筛结果
表1 菌株初筛结果
Table 1 Results of preliminary screening

注:+.阳性反应;-.阴性反应。表2~4同。
菌株 接触酶 葡萄糖产酸/产气产黏精氨酸产氨氨基酸脱羧酶产H2S蛋白酶/脂肪酶L-H3 + +/- - - - - +/+L-H7 + +/- - - - - +/+L-H8 + +/- - - - - +/+L-H12 + +/- - - - - +/+L-D2 + +/- - - - - +/+L-D6 + +/- - - - - +/+L-S1 + +/- - - - - +/+L-S8 + +/- - - - - +/+L-S9 + +/- - - - - +/+L-Y3 + +/- - - - - +/+L-Y9 + +/- - - - - +/+L-Y14 + +/- - - - - +/+L-M4 + +/- - - - - +/+
取41 株实验室前期分离保藏的具有产酸能力的芽孢菌进行初筛,由表1可知,筛选出13 株接触酶阳性、发酵葡萄糖产酸不产气、不产黏、精氨酸不产氨、氨基酸脱羧酶阴性、不产H2S、产蛋白酶和脂肪酶的菌株。
2.2 凝结芽孢杆菌的复筛结果
2.2.1 菌株产酸能力、耐盐性、耐亚硝酸盐性及抑菌性
由表2可知,产酸能力实验结果显示,13 株菌株在MRS培养基中培养24 h后,除L-H3、L-D2、L-D6、L-Y9、L-Y14、L-M4外,其余菌株培养液pH值均可降至4.5以下。
表2 菌株复筛结果
Table 2 Results of secondary screening

菌株 pH24 h<4.5 5 g/100 mL NaCl 150 mg/kg NaNO2抑菌特性(抑菌圈直径>8 mm)大肠杆菌 金黄色葡萄球菌 蜡样芽孢杆菌 单增李斯特菌L-H3 - + + - + - -L-H7 + + + + + + +L-H8 + + + + + - +L-H12 + - + - - + +L-D2 - - + - - + -L-D6 - + + + - + -L-S1 + - + - - + -L-S8 + - + - - - +L-S9 + + + + + + +L-Y3 + - + + - - +L-Y9 - + + - - + +L-Y14 - - + + - + -L-M4 - + + - + - +
发酵香肠中的盐含量较高,在成熟结束时,NaCl含量达到3.0%~5.0%[22],因此筛选的菌株必须耐受5 g/100 mL NaCl和150 mg/kg NaNO2,且具备抑制食源性病原菌的能力。13 株菌株对150 mg/kg NaNO2均有很好的耐受性,但部分菌株无法耐受5 g/100 mL NaCl。对致病菌的抑菌结果显示,菌株L-H7、L-H8、L-S9的抑菌特性较好。综合以上结果,选择菌株L-H7、L-H8、L-S9作为优良发酵剂的候选菌株。
2.2.2 菌株发酵酶系的鉴定结果
发酵香肠成熟过程中的代谢是内源酶与细菌代谢之间复杂相互作用的结果,因此分析发酵微生物的酶谱对于控制发酵香肠的品质具有重要意义。采用API ZYM试剂条检测参与碳水化合物、蛋白质、脂质和磷酸盐代谢的几种酶活性。
表3 API ZYM酶活性试剂条鉴定结果
Table 3 Results of identification using API ZYM strip
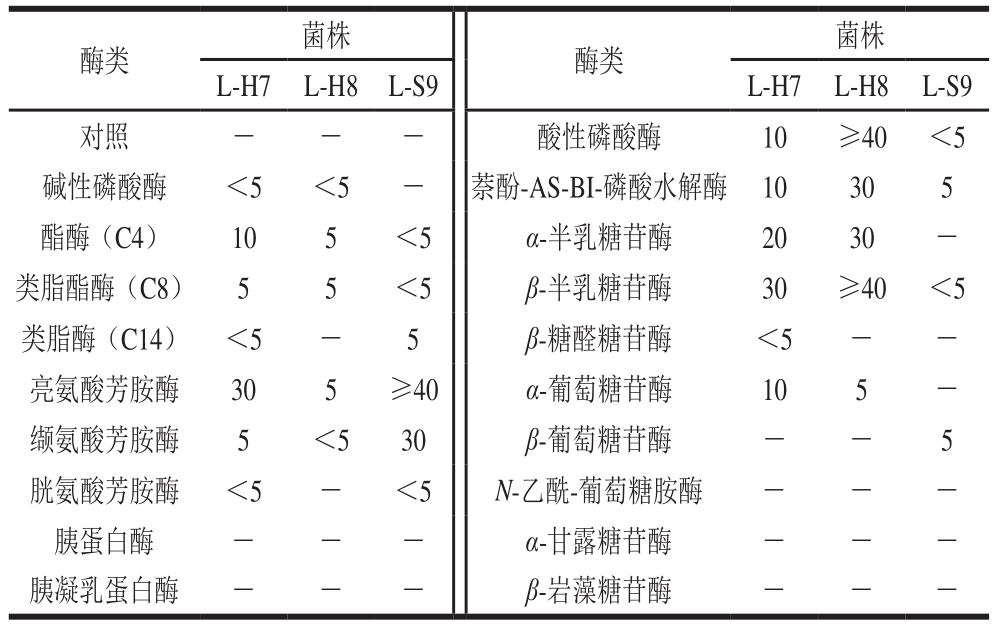
酶类 菌株 酶类 菌株L-H7 L-H8 L-S9 L-H7 L-H8 L-S9对照 - - - 酸性磷酸酶 10 ≥40 <5碱性磷酸酶 <5 <5 - 萘酚-AS-BI-磷酸水解酶 10 30 5酯酶(C4) 10 5 <5 α-半乳糖苷酶 20 30 -类脂酯酶(C8) 5 5 <5 β-半乳糖苷酶 30 ≥40 <5类脂酶(C14) <5 - 5 β-糖醛糖苷酶 <5 - -亮氨酸芳胺酶 30 5 ≥40 α-葡萄糖苷酶 10 5 -缬氨酸芳胺酶 5 <5 30 β-葡萄糖苷酶 - - 5胱氨酸芳胺酶 <5 - <5 N-乙酰-葡萄糖胺酶 - - -胰蛋白酶 - - - α-甘露糖苷酶 - - -胰凝乳蛋白酶 - - - β-岩藻糖苷酶 - - -
由表3可知,菌株L-H7、L-S9表现出较强的肽酶活性(亮氨酸芳胺酶、缬氨酸芳胺酶、胱氨酸芳胺酶),Papamanoli等[23]在从希腊自然发酵香肠中分离出的菌株清酒乳杆菌、副干酪乳杆菌和植物乳杆菌中同样检测到这些蛋白酶具有很强的活性。菌株L-H7和L-H8表现出较好的酯酶活性,酯酶的作用主要是促进酯类风味物质的形成,有利于促进发酵香肠的风味形成。同样,相比于菌株L-S9,菌株L-H7和L-H8表现出较高的磷酸水解酶活性,对有机磷化合物的降解有重要作用[17]。与其他2 株对照菌相比,菌株L-H7的糖苷酶种类最多,且活性最强。糖苷酶主要参与碳水化合物代谢,香肠中酸的产生取决于添加到肉混合物中糖的类型和浓度、干香肠的直径和发酵微生物群[24],因此微生物分泌的糖苷酶类型和活性对于香肠发酵过程中快速产酸具有重要意义。综合以上实验结果,选择酶系丰富的菌株L-H7作为候选菌株进行鉴定。
2.3 凝结芽孢杆菌的鉴定结果
2.3.1 形态学观察结果
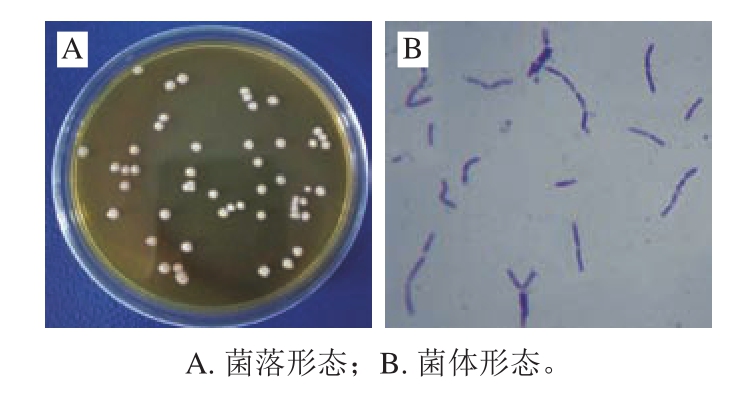
图1 菌株L-H7的形态特征
Fig 1 Morphological characteristics of strain L-H7
由图1可知,菌株L-H7在MRS培养基上生长情况良好,37 ℃培养48 h后可形成直径2~3 mm的圆形菌落,菌落表面光滑、不透明,边缘较规则,中心凸起(图1A)。油镜观察菌体细胞形态,菌株为革兰氏阳性菌,呈长杆状,成对或链状排列(图1B)。
2.3.2 生理生化鉴定结果
表4 菌株L-H7的生理生化特征
Table 4 Physiological and biochemical characteristics of strain L-H7

特征 鉴定结果 特征 鉴定结果运动性 + 明胶液化 -产孢子 + 溶血 -厌氧生长 + 15 ℃生长 +V-P实验 + 37 ℃生长 +淀粉水解 + 55 ℃生长 +吲哚产生 - 60 ℃生长 -
由表4可知,菌株L-H7的生理生化鉴定结果与《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》中芽孢杆菌属的乳酸细菌特性基本相符,且菌株L-H7的吲哚实验和溶血实验结果均为阴性,可用作安全的微生物发酵剂。
2.3.3 16S rDNA分子生物学鉴定结果
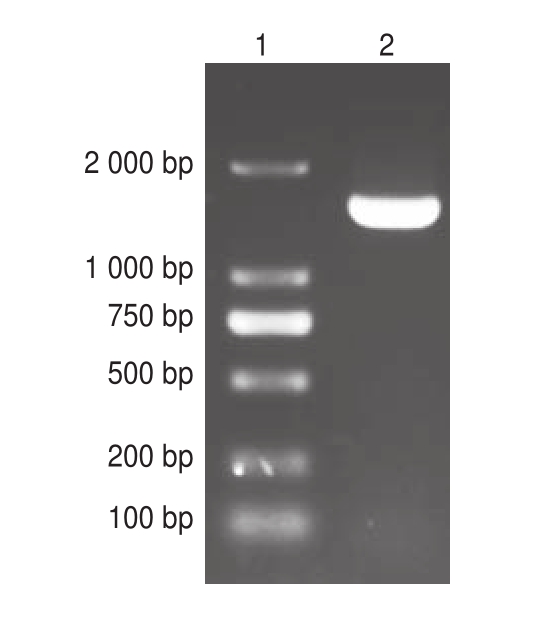
图2 菌株L-H7 16S rDNA的PCR扩增电泳图
Fig 2 Electrophoretogram of PCR amplification products of 16S rDNA gene from strain L-H7
泳道1.DL 2000 DNA Marker;泳道2.菌株L-H7。
利用通用引物对菌株L-H7的16S rDNA进行PCR扩增。由图2可知,扩增后的产物长度约为1 500 bp,与预期相符。
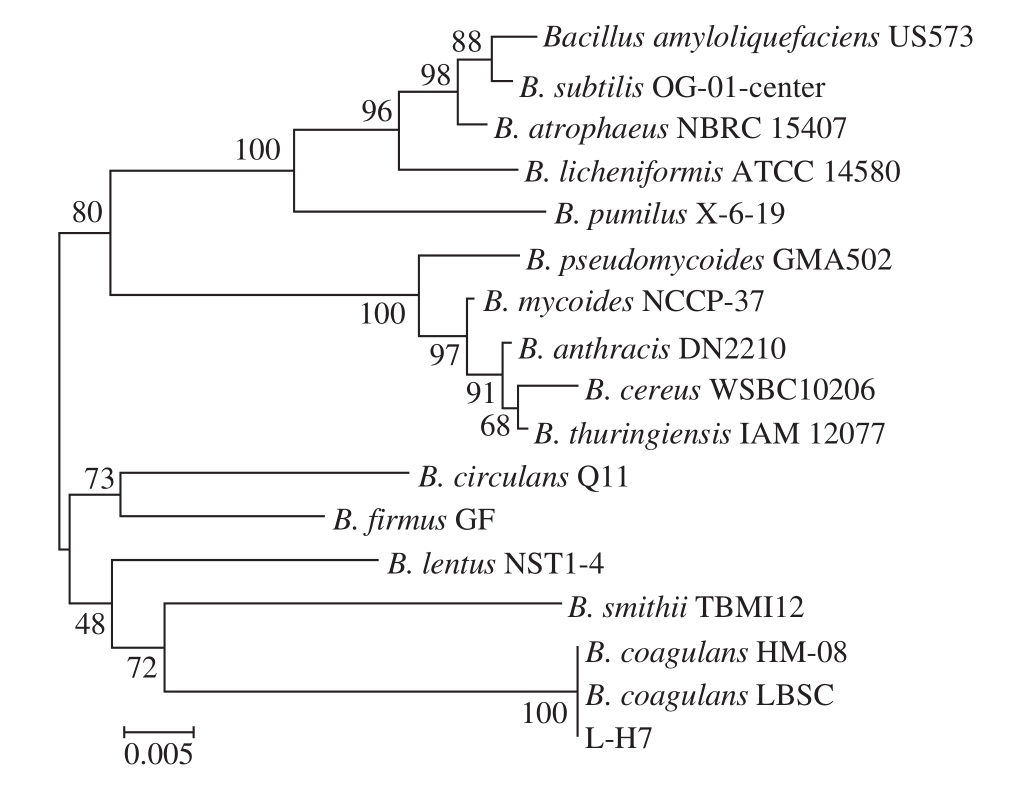
图3 菌株L-H7的系统发育树
Fig.3 Neighbour-joining tree of L-H7
由图3可知,通过Blast与Genbank中已知种属的1 6 S r D N A序列进行对比分析,绘制系统发育树,发现菌株L-H7与Bacillus coagulans HM-08、Bacillus coagulans LBSC的同源性达到99%以上。综合菌株L-H7的形态特征、生理生化特征和16S rDNA同源性分析结果,确定其为凝结芽孢杆菌。
2.4 凝结芽孢杆菌L-H7的生长特性和产酸能力
由图4可知,凝结芽孢杆菌L-H7在MRS培养基中能够快速生长,20 h时进入稳定生长期,随后由于营养物质的消耗和代谢产物的积累,菌株生长速率减缓并逐渐进入衰亡期。凝结芽孢杆菌L-H7在24 h生长期内产酸较快,且产酸速率稳定,随后由于菌株生长速率减缓、代谢活性降低,其产酸速率减缓,pH值保持平稳。

图4 凝结芽孢杆菌L-H7的生长曲线及产酸能力
Fig.4 Growth curve and acid production capacity of Bacillus coagulans L-H7
2.5 凝结芽孢杆菌L-H7在模拟发酵香肠中的应用
2.5.1 模拟发酵香肠发酵期间的微生物指标和pH值
表5 香肠发酵期间乳酸菌和凝结芽孢杆菌菌落数
Table 5 Total number of lactic acid bacteria and Bacillus coagulans colonies during fermentation
lg(CFU/g)
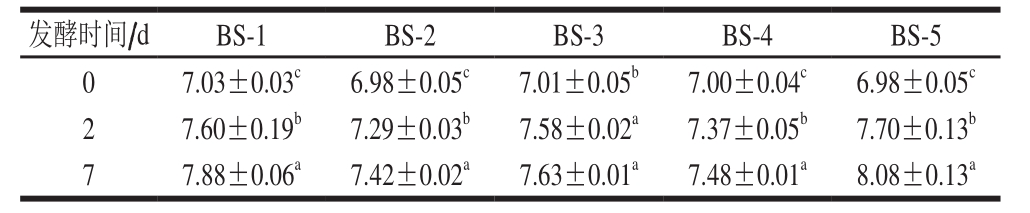
注:同列小写字母不同,表示差异显著(P<0.05)。表6~7同。
发酵时间/d BS-1 BS-2 BS-3 BS-4 BS-5 0 7.03±0.03c 6.98±0.05c 7.01±0.05b 7.00±0.04c 6.98±0.05c 2 7.60±0.19b 7.29±0.03b 7.58±0.02a 7.37±0.05b 7.70±0.13b 7 7.88±0.06a 7.42±0.02a 7.63±0.01a 7.48±0.01a 8.08±0.13a
表6 香肠发酵期间的葡萄球菌菌落数
Table 6 Number of Staphylococcus colonies during fermentation lg(CFU/g)

注:-.未检出。表8同。
发酵时间/d BS-1 BS-2 BS-3 BS-4 BS-5 0 7.12±0.02a 3.36±0.06a 3.40±0.10a 7.16±0.02a 7.09±0.02a 2 6.08±0.06c - - 6.13±0.03c 6.19±0.01c 7 6.37±0.01b - - 6.40±0.04b 6.29±0.01b
表7 香肠发酵期间的pH值
Table 7 Changes in pH value during fermentation

发酵时间/d BS-1 BS-2 BS-3 BS-4 BS-5 0 5.74±0.02a5.75±0.04a5.74±0.02a5.72±0.03a5.73±0.05a 2 5.12±0.02b5.41±0.02b4.96±0.02b5.38±0.01b5.05±0.01b 7 5.07±0.02c5.30±0.04c4.95±0.05b5.31±0.06b4.92±0.04c
由表5~7可知:经25 ℃发酵2 d后,各组发酵香肠的乳酸菌和凝结芽孢杆菌菌落数均显著升高(P<0.05),但葡萄球菌菌落数均显著下降(P<0.05),可能是由于发酵期间产酸菌的快速生长抑制了葡萄球菌的生长;15 ℃继续发酵5 d后,葡萄球菌菌落数开始有所上升;经25 ℃发酵2 d后,接种戊糖片球菌的BS-1、BS-3、BS-5组发酵香肠pH值显著降低(P<0.05),分别达到5.12、4.96和5.05,而未接种戊糖片球菌的BS-2、BS-4组发酵香肠pH值偏高,说明凝结芽孢杆菌在肉类体系中的产酸速率低于戊糖片球菌。
2.5.2 模拟发酵香肠的挥发性风味化合物分析
对BS-1、BS-5组发酵香肠进行挥发性化合物测定,分析不同发酵剂组合产生的挥发性物质差异。
表8 发酵香肠挥发性化合物组成
Table 8 List of volatile compounds identified in fermented meat
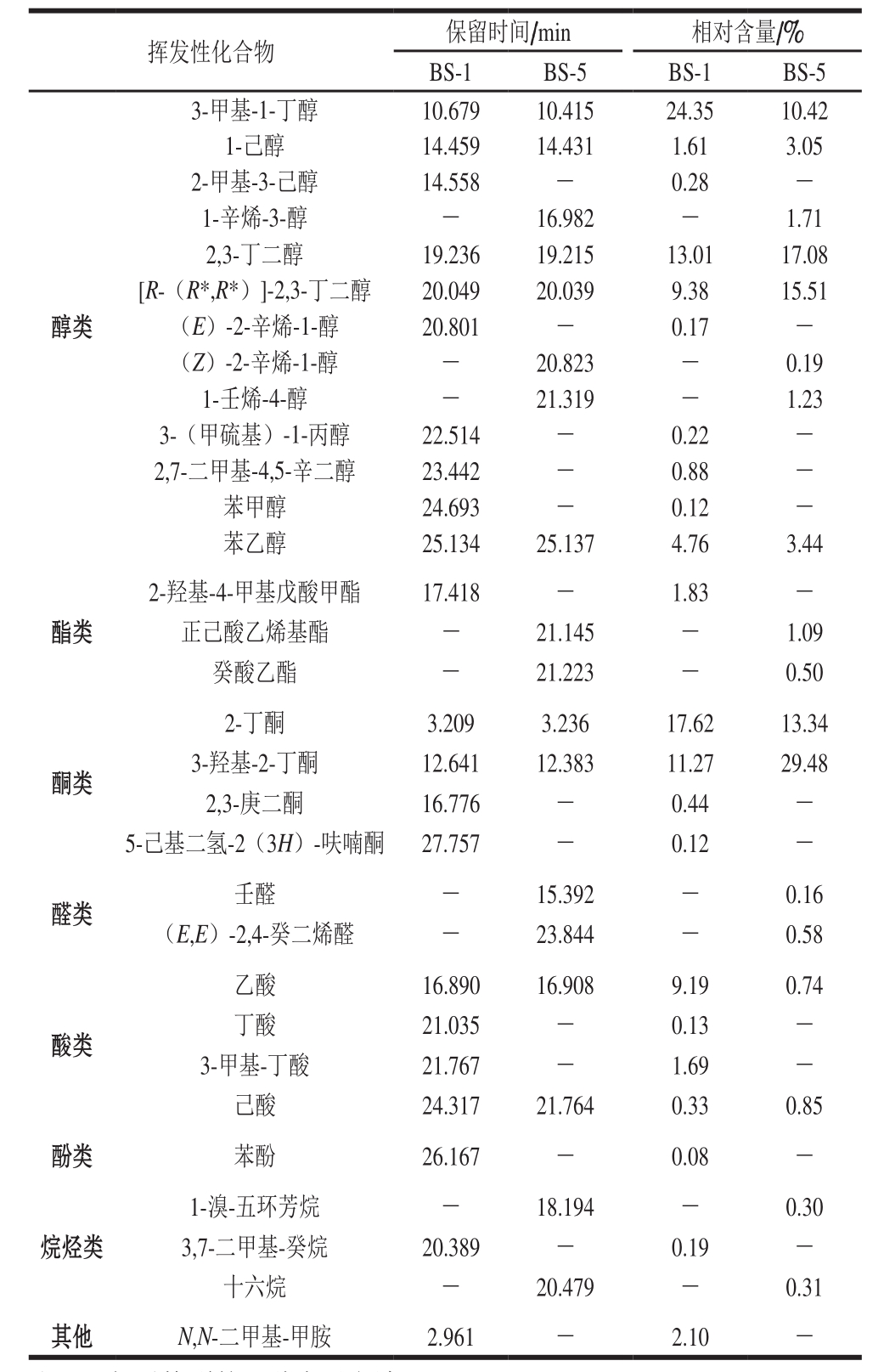
注:*.相对构型的一种表示方法。
挥发性化合物 保留时间/min 相对含量/%BS-1 BS-5 BS-1 BS-5醇类3-甲基-1-丁醇 10.679 10.415 24.35 10.42 1-己醇 14.459 14.431 1.61 3.05 2-甲基-3-己醇 14.558 - 0.28 -1-辛烯-3-醇 - 16.982 - 1.71 2,3-丁二醇 19.236 19.215 13.01 17.08[R-(R*,R*)]-2,3-丁二醇 20.049 20.039 9.38 15.51(E)-2-辛烯-1-醇 20.801 - 0.17 -(Z)-2-辛烯-1-醇 - 20.823 - 0.19 1-壬烯-4-醇 - 21.319 - 1.23 3-(甲硫基)-1-丙醇 22.514 - 0.22 -2,7-二甲基-4,5-辛二醇 23.442 - 0.88 -苯甲醇 24.693 - 0.12 -苯乙醇 25.134 25.137 4.76 3.44酯类2-羟基-4-甲基戊酸甲酯 17.418 - 1.83 -正己酸乙烯基酯 - 21.145 - 1.09癸酸乙酯 - 21.223 - 0.50酮类2-丁酮 3.209 3.236 17.62 13.34 3-羟基-2-丁酮 12.641 12.383 11.27 29.48 2,3-庚二酮 16.776 - 0.44 -5-己基二氢-2(3H)-呋喃酮 27.757 - 0.12 -醛类 壬醛 - 15.392 - 0.16(E,E)-2,4-癸二烯醛 - 23.844 - 0.58酸类乙酸 16.890 16.908 9.19 0.74丁酸 21.035 - 0.13 -3-甲基-丁酸 21.767 - 1.69 -己酸 24.317 21.764 0.33 0.85酚类 苯酚 26.167 - 0.08 -烷烃类1-溴-五环芳烷 - 18.194 - 0.30 3,7-二甲基-癸烷 20.389 - 0.19 -十六烷 - 20.479 - 0.31其他 N,N-二甲基-甲胺 2.961 - 2.10 -
由表8可知,BS-1和BS-5组发酵香肠模型中的挥发性化合物主要为醇类、酯类、酮类、醛类、酸类和酚类。醇类物质中主要化合物为3-甲基-1-丁醇、2,3-丁二醇和[R-(R*,R*)]-2,3-丁二醇。3-甲基-1-丁醇和2,3-丁二醇是发酵香肠中重要的香气来源。3-甲基-1-丁醇可能来自乳酸菌介导的亮氨酸转化[25]。2,3-丁二醇主要由戊糖片球菌通过氨基酸分解代谢产生[26-27]。BS-5组发酵香肠特有的1-辛烯-3-醇来源于脂质氧化,具有蘑菇味和发酵香,气味阈值极低,也被检测证实为发酵香肠中的有效气味[28],说明凝结芽孢杆菌有助于形成发酵香肠特定风味。
酮类物质中2-丁酮、3-羟基-2-丁酮的相对含量均较高,这2 种酮来自丙酮酸代谢。3-羟基-2-丁酮是乳酸菌通过碳水化合物分解代谢产生的,有助于产生果味[29],对发酵肉的香气有重要贡献。BS-5组发酵香肠3-羟基-2-丁酮相对含量更高,证明凝结芽孢杆菌的碳水化合物代谢率较高。
碳链长度为1~10的酸生成的酯类通常会产生果香味[30],2 组发酵香肠均有酯类物质产生,BS-5组发酵香肠所含的酯类物质种类更多,其中癸酸乙酯具有典型的果香,对肉制品香味有重要贡献。
醛类物质是BS-5组发酵香肠特有的挥发性风味物质,其感官阈值较低,对发酵香肠的风味有很大贡献。醛类物质由脂质氧化产生,其中壬醛是ω-9多不饱和脂肪酸氧化的产物[31],具有脂香味、甜橙味,(E,E)-2,4-癸二烯醛具有油炸味。
BS-1组发酵过程中出现了胺类物质,具有不愉快气味,而BS-5组并未产生该类物质,说明凝结芽孢杆菌可抑制不良风味物质的产生。
3 结 论
通过初筛及复筛得到L-H7、L-H8、L-S9 3 株能耐受5 g/100 mL NaCl和150 mg/kg NaNO2,且对大肠杆菌、单增李斯特菌、假单胞菌和蜡样芽孢杆菌有良好抑制作用的菌株,并最终筛选鉴定得到酶系更为丰富的凝结芽孢杆菌L-H7。发酵香肠模型实验结果显示,凝结芽孢杆菌L-H7与戊糖片球菌、木糖葡萄球菌复配后添加至发酵香肠,能够产生1-辛烯-3-醇等特有香气物质,证明凝结芽孢杆菌L-H7复配戊糖片球菌和木糖葡萄球菌能促进发酵香肠特征风味的形成。以上研究结果表明,凝结芽孢杆菌L-H7对于提升发酵香肠的营养价值和品质特性均有重要意义,未来具有开发成为发酵肉制品优良发酵剂的潜力。该菌株在发酵香肠中的作用机制及应用效果还需要更进一步的研究。
[1]FRANCIOSA I,ALESSANDRIA V,DOLCI P,et al.Sausage fermentation and starter cultures in the era of molecular biology methods[J].International Journal of Food Microbiology,2018,279:26-32.DOI:10.1016/j.ijfoodmicro.2018.04.038.
[2]CRUXEN C E D S,FUNCK G D,DANNENBERG G D S,et al.Characterization of Staphylococcus xylosus LQ3 and its application in dried cured sausage[J].LWT-Food Science and Technology,2017,86:538-543.DOI:10.1016/j.lwt.2017.08.045.
[3]ESSID I,BEN ISMAIL H,AHMED S B H,et al.Characterization and technological properties of Staphylococcus xylosus strains isolated from a Tunisian traditional salted meat[J].Meat Science,2007,77(2):204-212.DOI:10.1016/j.meatsci.2007.03.003.
[4]RAHMAN U U,KHAN M I,SOHAIB M,et al.Exploiting microorganisms to develop improved functional meat sausages:a review[J].Food Reviews International,2017,33(2): 195-215.DOI:10.1080/87559129.2016.1175012.
[5]刘英丽,毛慧佳,李文采,等.乳酸菌的筛选及其与酵母菌互作对干发酵香肠品质的影响[J].中国食品学报,2018,18(9): 96-108.DOI:10.16429/j.1009-7848.2018.09.013.
[6]SONG M Y,VAN-BA H,PARK W S,et al.Quality characteristics of functional fermented sausages added with encapsulated probiotic Bifidobacterium longum KACC 91563[J].Korean Journal for Food Science of Animal Resources,2018,38(5): 981-994.DOI:10.5851/kosfa.2018.e30.
[7]BOSNEA L A,KOURKOUTAS Y,ALBANTAKI N,et al.Functionality of freeze-dried L.casei cells immobilized on wheat grains[J].LWT-Food Science and Technology,2009,42(10): 1696-1702.DOI:10.1016/j.lwt.2009.05.011.
[8]NAFARY A,SEYEDJAFARI E,SALIMI A.Electrospun poly-L-lactic acid coated with silicate bioceramic nanoparticles enhance osteogenic differentiation of adipose tissue derived mesenchymal stem cells[J].Journal of Biomaterials and Tissue Engineering,2017,7(2): 91-100.DOI:10.1166/jbt.2017.1544.
[9]KONURAY G,ERGINKAYA Z.Potential use of Bacillus coagulans in the food industry[J].Foods,2018,7(6): 92.DOI:10.3390/foods7060092.
[10]KELLER D,VAN DINTER R,CASH H,et al. Bacillus coagulans GBI-30,6086 increases plant protein digestion in a dynamic,computer-controlled in vitro model of the small intestine (TIM-1)[J].Beneficial Microbes,2017,8(3): 491-496.DOI:10.3920/BM2016.0196.
[11]GOWTHAMI P,MUTHUKUMAR K,VELAN M.Utilization of coconut oil cake for the production of lipase using Bacillus coagulans VKL1[J].Biocontrol Science,2015,20(2): 125-133.DOI:10.4265/bio.20.125.
[12]SHINDE T,VEMURI R,SHASTRI M D,et al.Probiotic Bacillus coagulans MTCC 5856 spores exhibit excellent in vitro functional efficacy in simulated gastric survival,mucosal adhesion and immunomodulation[J].Journal of Functional Foods,2019,52: 100-108.DOI:10.1016/j.jff.2018.10.031.
[13]JAGER R,PURPURA M,FARMER S,et al.Probiotic Bacillus coagulans GBI-30,6086 improves protein absorption and utilization[J].Probiotics and Antimicrobial Proteins,2018,10(4): 611-615.DOI:10.1007/s12602-017-9354-y.
[14]LEE S,LEE J,JIN Y,et al.Probiotic characteristics of Bacillus strains isolated from Korean traditional soy sauce[J].LWT-Food Science and Technology,2017,79: 518-524.DOI:10.1016/j.lwt.2016.08.040.
[15]BOMKO T V,NOSALSKAYA T N,KABLUCHKO T V,et al.Immunotropic aspect of the Bacillus coagulans probiotic action[J].Journal of Pharmacy and Pharmacology,2017,69(8): 1033-1040.DOI:10.1111/jphp.12726.
[16]MAITY C,GUPTA A K.A prospective,interventional,randomized,double-blind,placebo-controlled clinical study to evaluate the efficacy and safety of Bacillus coagulans LBSC in the treatment of acute diarrhea with abdominal discomfort[J].European Journal of Clinical Pharmacology,2019,75(1): 21-31.DOI:10.1007/s00228-018-2562-x.
[17]OLIVEIRA R C D,OLIVEIRA R R D,BORDON C D M,et al.Enzymatic characterization of Corynespora cassiicola isolates using the API-ZYM system[J].Journal of Phytopathology,2013,161(3):210-212.DOI:10.1111/jph.12043.
[18]布坎南 R E.伯杰细菌鉴定手册[M].北京: 科学出版社,1984: 199-206.
[19]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京: 科学出版社,2002: 246-299.
[20]ALMEIDA M A D,SALDANA E,PINTO J S D S,et al.A peptidomic approach of meat protein degradation in a low-sodium fermented sausage model using autochthonous starter cultures[J].Food Research International,2018,109: 368-379.DOI:10.1016/j.foodres.2018.04.042.
[21]SIDIRA M,KANDYLIS P,KANELLAKI M,et al.Effect of immobilized Lactobacillus casei on volatile compounds of heat treated probiotic dry-fermented sausages[J].Food Chemistry,2015,178:201-207.DOI:10.1016/j.foodchem.2015.01.068.
[22]CORRAL S,SALVADOR A,BELLOCH C,et al.Effect of fat and salt reduction on the sensory quality of slow fermented sausages inoculated with Debaryomyces hansenii yeast[J].Food Control,2014,45: 1-7.DOI:10.1016/j.foodcont.2014.04.013.
[23]PAPAMANOLI E,TZANETAKIS N,LITOPOULOU-TZANETAKI E,et al.Characterization of lactic acid bacteria isolated from a Greek dryfermented sausage in respect of their technological and probiotic properties[J].Meat Science,2003,65(2): 859-867.DOI:10.1016/S0309-1740(02)00292-9.
[24]RUBIO R,JOFRE A,MARTIN B,et al.Characterization of lactic acid bacteria isolated from infant faeces as potential probiotic starter cultures for fermented sausages[J].Food Microbiology,2014,38:303-311.DOI:10.1016/j.fm.2013.07.015.
[25]MARCO A,NAVARRO J L,FLORES M.Volatile compounds of dryfermented sausages as affected by solid-phase microextraction (SPME)[J].Food Chemistry,2004,84(4): 633-641.DOI:10.1016/S0308-8146(03)00288-7.
[26]CHEN Qing,KONG Baohua,SUN Qinxiu,et al.Antioxidant potential of a unique LAB culture isolated from Harbin dry sausage:in vitro and in a sausage model[J].Meat Science,2015,110: 180-188.DOI:10.1016/j.meatsci.2015.07.021.
[27]CHEN Qing,LIU Qian,SUN Qinxiu,et al.Flavour formation from hydrolysis of pork sarcoplasmic protein extract by a unique LAB culture isolated from Harbin dry sausage[J].Meat Science,2015,100:110-117.DOI:10.1016/j.meatsci.2015.07.021.
[28]OLIVARES A,LUIS NAVARRO J,FLORES M.Effect of fat content on aroma generation during processing of dry fermented sausages[J].Meat Science,2011,87(3): 264-273.DOI:10.1016/j.meatsci.2010.10.021.
[29]MARCO A,NAVARRO J L,FLORES M.Quantitation of selected odor-active constituents in dry fermented sausages prepared with different curing salts[J].Journal of Agricultural and Food Chemistry,2007,55(8): 3058-3065.DOI:10.1021/jf0631880.
[30]李林,吴倩,林静,等.老腊肉腌制烟熏加工过程中主体特征风味及变化规律[J].食品科学,2015,36(16): 175-179.DOI:10.7506/spkx1002-6630-201516032.
[31]LEROY F,VERLUYTEN J,DE VUYST L.Functional meat starter cultures for improved sausage fermentation[J].International Journal of Food Microbiology,2006,106(3): 270-285.DOI:10.1016/j.ijfoodmicro.2005.06.027.