发酵肉制品是指在自然和人工控制条件下利用微生物发酵作用,产生具有特殊风味、色泽和质地且具有较长保存期的肉制品[1]。作为一种古老的肉制品加工贮藏方法,发酵使肉制品具有独特的风味和良好的咀嚼性,发酵肉制品深受广大消费者喜爱[2]。发酵肉制品在生产过程中接种的微生物(如乳酸菌、微球菌等)能够发酵糖类物质形成乳酸[3-5],从而赋予肉制品特殊的风味,同时,通过产生乳酸降低pH值提高肉制品的安全性、稳定性及货架期[6-8]。此外,发酵剂的使用对降低肉制品中亚硝酸盐含量也有一定作用[9]。Nie Xiaohua等[10]研究表明,复合发酵剂能够加快蛋白质降解,增加风味氨基酸的含量。赵丽华等[11]研究戊糖片球菌(Pediococcus pentosaceus)与混合发酵剂(植物乳杆菌和产香葡萄球菌(Staphylococcus carnosus))对羊肉干发酵香肠品质的影响,结果表明,戊糖片球菌能使香肠pH值和水分活度下降。另外,发酵肉制品通过微生物发酵而创造的低pH值环境有利于提高产品稳定性,保存产品的营养价值和品质特性[12]。总之,国内外研究表明,添加发酵剂可以有效改善香肠的品质及贮藏性,提高其食用安全性,且无毒无害,口味适中,迎合了消费者需求,体现了以人为本的生产理念,具有实用价值[13]。随着对于发酵肉制品研究的不断深入,发酵肉制品成熟过程微生物菌群变化与其品质的关系有待进一步明晰。
发酵肉成熟过程中微生物菌群和理化性质的变化不尽相同。本研究以同一批次的新鲜优质猪里脊肉为原料,研究添加戊糖片球菌、木糖葡萄球菌(Staphylococcus xylosus)的发酵肉与自然发酵肉成熟过程中的微生物菌群、理化性质及质构品质变化,为提高发酵肉制品安全提供理论指导和数据支持。
1 材料与方法
1.1 材料与试剂
新鲜优质猪里脊肉 伟鸿食品股份有限公司;52°高度白酒、食盐、味精、白糖 长沙嘉而惠超市。
戊糖片球菌 中国科学科院微生物保藏中心;木糖葡萄球菌 传统湘西腊肉中分离获取。
MRS培养基、平板计数培养基、MSA培养基、马丁孟加拉红-链霉菌琼脂培养基、结晶紫中性胆碱盐培养基广东环凯微生物科技有限公司;三氯乙酸、盐酸、氢氧化钠、硼酸、硫酸、硫酸钾、硫酸铜、对氨基苯磺酸、盐酸萘乙二胺、亚硝酸钠、乙酸锌、氨水、醋酸铅、硫酸钠、氯化钠、酚酞、铬酸钾、硝酸银(均为分析纯)天津市化学试剂一厂。
1.2 仪器与设备
K9860全自动凯式定氮仪、SH220F石墨消解仪山东海能科学仪器有限公司;CP114分析天平 奥豪斯仪器有限公司;Testo 250 pH计、LabTech分光光度计北京莱伯泰科仪器有限公司;D2S2-LJ080高压灭菌锅山东新医疗器械股份有限公司;GZ-250-HSII恒温恒湿箱广智科技设备有限公司;101-3HB干燥箱 天津泰斯特仪器有限公司;TG16-WS离心机 长沙湘仪离心机仪器有限公司;SKY-2102C摇床 上海浦东生物光学仪器厂;SW-CJ-IFD超净工作台 苏州净化设备有限公司;GZ-250-HSII电热恒温水浴锅 广东省韶关市广智科技设备有限公司;GJB1-25均质机 江苏省金坛市荣华仪器设备有限公司。
1.3 方法
1.3.1 实验设计
实验分为2 组,其中1 组添加戊糖片球菌、木糖葡萄球菌(按照体积比1∶1将已活化好菌株浓度为108 CFU/g的发酵剂菌液添加到原料肉中,并与其他辅料充分混合)的发酵剂生产发酵肉,另1 组自然发酵,作为对照组。分别于生肉,腌制1、2 d以及成熟过程中每隔5 d取样,分别检测样品菌落总数、肠杆菌、乳酸菌、酵母菌、葡萄球菌数量的变化,并对其pH值、水分含量、亚硝酸盐残留量、食盐含量等理化指标和质构指标进行测定。各取样点样本的微生物指标直接测定,其余样本真空包装。
1.3.2 发酵剂的制备
取适量已活化的戊糖片球菌和木糖葡萄球菌菌种,分别接种于MRS肉汤培养基和MSA液体培养基,37 ℃摇床培养24 h后,将已活化好的菌株浓度为108 CFU/g的发酵剂菌液按照肉质量的1%添加到原料肉中并与其他辅料充分混合,进行腌制。
1.3.3 发酵肉的制作
发酵肉制作过程中腌制辅料包括食盐3%、白糖0.7%、味精0.3%、高度白酒2%、亚硝酸钠0.008%。发酵肉制作工艺流程如图1所示。
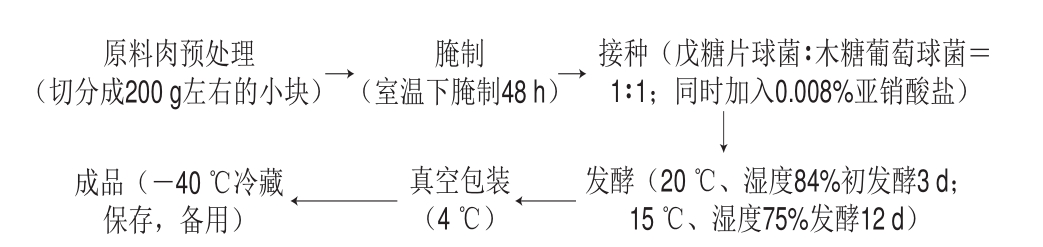
图1 发酵肉的制作工艺流程
Fig.1 Flow chart of production of fermented meat
1.3.4 微生物指标测定
取不同阶段的发酵肉,在无菌超净台中用刀切碎,取25 g置于含有225 mL无菌生理盐水的锥形瓶中,封口后于摇床中振荡40 min,取1 mL上清液于含有9 mL无菌生理盐水的试管中,进行加倍递增稀释,分别稀释至10-3、10-4、10-5,每个稀释度做3 个平行,用培养基培养。
菌落总数测定:采用PCA平板,37 ℃培养48 h;葡萄球菌菌数测定:采用MSA培养基,37 ℃培养72 h;乳酸菌菌数测定:采用MRS(加入100 mg/L放线菌酮)培养基,37 ℃培养48 h;肠杆菌菌数测定:采用结晶紫中性胆碱盐培养基,37 ℃培养24 h;酵母菌菌数测定:采用马丁孟加拉红-链霉菌琼脂培养基,28 ℃培养72 h。
1.3.5 理化指标测定
1.3.5.1 pH值
参考GB/T 10468—1989《食品安全国家标准 食品中pH的测定》中的玻璃电极法。
1.3.5.2 水分含量
参考GB 5009.3—2010《食品安全国家标准 食品中水分的测定》,采用直接干燥法进行测定。将称量瓶置于105 ℃的烘箱中烘至恒质量(前后2 次质量差不超过2 mg即为恒质量);称取4 g搅碎的试样,干燥3 h后取出,放入干燥器中冷却0.5 h后称质量;重复以上操作至样品恒质量,每个样品做3 次平行。
1.3.5.3 亚硝酸盐残留量
参考GB 5009.33—2010《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》中的盐酸萘乙二胺法。
1.3.5.4 食盐含量
参考GB/T 12457—2008《食品中氯化钠的测定》中的间接滴定法。
1.3.6 质构测定
切取厚度约为1 cm左右的肉片,放在质构分析仪探头下测定。测定参数:感应元量程450 N;测试高度15 mm;形变量50%;测试速率60 mm/min;起始力5 N;触发类型:自动;探头类型P50。
1.4 数据处理
每个样本测定进行3 次重复实验,并使用SPSS 24.0软件进行t检验,P<0.05表示差异显著,然后使用Excel软件绘图。
2 结果与分析
2.1 发酵肉成熟过程中的微生物指标变化
2.1.1 发酵肉成熟过程中菌落总数的变化
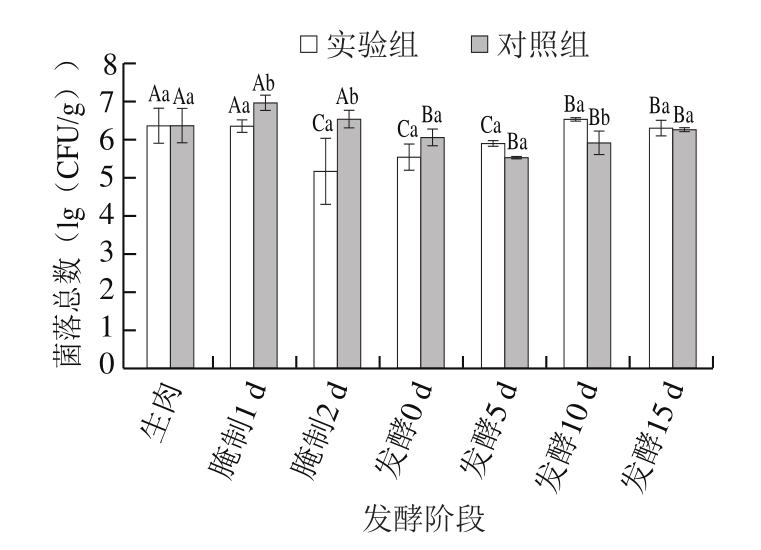
图2 发酵肉成熟过程中菌落总数变化
Fig.2 Change in total bacterial number during meat fermentation
小写字母不同,表示同一发酵阶段组间差异显著(P<0.05);大写字母不同,表示同组不同发酵阶段差异显著(P<0.05)。图3~8同。
由图2可知,2 组发酵肉菌落总数匀呈现先降低后升高的趋势,且在发酵前期,实验组发酵肉菌落总数明显较对照组下降快,在腌制第2天就已经达到最低值5.69 (lg(CFU/g)),而对照组发酵肉在发酵第5天才达到最低值5.48 (lg(CFU/g))。这是由于在腌制过程中加入发酵剂能够有效抑制杂菌的生长,并加速发酵进程[14]。

图3 发酵肉成熟过程中葡萄球菌数量变化
Fig.3 Changes in Staphylococcus count during meat fermentation
2.1.2 发酵肉成熟过程中葡萄球菌数量的变化由图3可知,2 组发酵肉的葡萄球菌数量呈现波动趋势,即先下降再上升后又有所下降,且2 组存在显著差异(P<0.05)。这是由于在腌制1 d时加入发酵剂使葡萄球菌数量突升,随着发酵的进行,葡萄球菌数量因乳酸菌产酸的影响有所下降,之后由于水分含量的降低与盐含量的增加,乳酸菌数量减少,葡萄球菌耐受性增加,导致葡萄球菌数量有所回升[15]。就对照组而言,随着发酵的进行,葡萄球菌数量一直处于上升期,由此可以得出,在发酵肉的制作过程中葡萄球菌是优势菌种。
2.1.3 发酵肉成熟过程中乳酸菌数量的变化
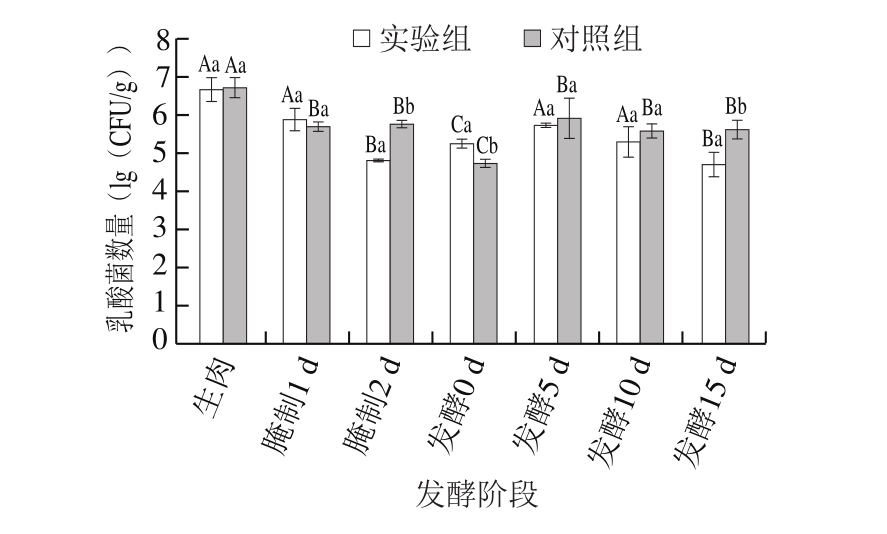
图4 发酵肉成熟过程中乳酸菌数量变化
Fig.4 Changes in lactic acid bacterial count during meat fermentation
由图4可知,乳酸菌数量在发酵时波动比较大,且在发酵0 d达到最低值。这是由于原料肉在屠宰、加工、运输过程中与空气及器皿的接触使原料肉未腌制前的乳酸菌数量最高,而在腌制过程中随着食盐、发酵剂的加入,在一定程度上抑制了乳酸菌的生长,之后随着耐受性的增强,乳酸菌数量逐渐上升,但发酵后期实验组发酵肉盐含量上升,乳酸菌数量又有下降趋势[16-18]。在整个发酵过程中,乳酸菌一直是优势菌,通过竞争作用能有效抑制有害微生物的生长,同时一些乳酸菌能产生细菌素,抑制病原微生物,显著提高产品的安全性[19-20]。
2.1.4 发酵肉成熟过程中肠杆菌数量的变化
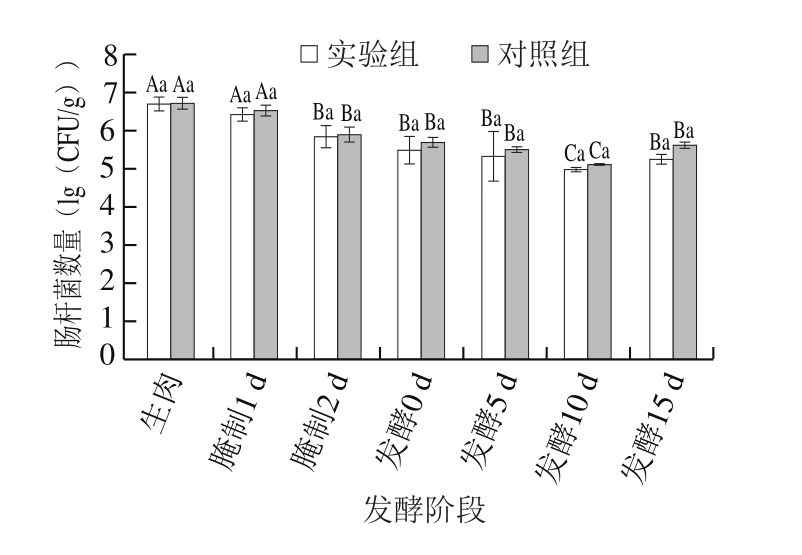
图5 发酵肉成熟过程中肠杆菌数量变化
Fig.5 Changes in Enterobacteriaceae count during meat fermentation
由图5可知,随着发酵的进行,发酵肉中肠杆菌数量逐渐下降,且实验组低于对照组,说明发酵剂对肠杆菌的抑制效果明显。但发酵结束后肠杆菌数量有上升趋势,这是由于随着发酵进程的结束,有害菌的耐受性增强,且在发酵进程中有益菌的分解产物被肠杆菌利用,因此肠杆菌数量在发酵后期有所增加。
2.1.5 发酵肉成熟过程中酵母菌数量的变化
酵母菌是兼性厌氧型菌,有氧气存在时会大量繁殖,并且能够生成蛋白酶和脂肪酶,这些对于发酵肉品质有极大影响。由于原料肉以肉块状态进行腌制,在腌制过程中,随着肉内氧气的消耗,酵母菌的生长受到限制,进行无氧呼吸,产生乳酸,限制杂菌的生长。
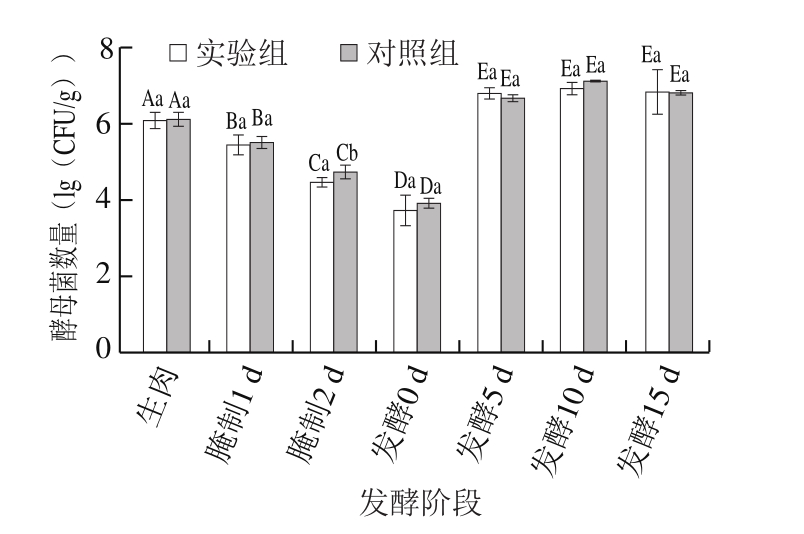
图6 发酵肉成熟过程中酵母菌数量变化
Fig.6 Changes in yeast count during meat fermentation
由图6可知,在发酵中后期,由于发酵肉中葡萄球菌数量上升,葡萄球菌中蛋白酶的水解作用使肉制品结构松散,氧气进入,酵母菌进行大量繁殖,分解产生大量小分子物质,增加了发酵肉的风味品质。
跟踪检测生肉,腌制1、2 d,发酵0、5、10、15 d样本的微生物菌落变化,通过定量分析可知,发酵肉成熟过程中,实验组与对照组的酵母菌和肠肝菌数量均无显著差异,而菌落总数、乳酸菌和葡萄球菌数量有显著差异(P<0.05)。
2.2 发酵肉成熟过程中的理化指标变化
2.2.1 发酵肉成熟过程中pH值的变化
在发酵肉成熟过程中,由于食盐的加入会杀死部分乳酸菌,使pH值有所上升,但随着发酵的进行,乳酸菌数量增加,产酸量增加,使pH值降低。
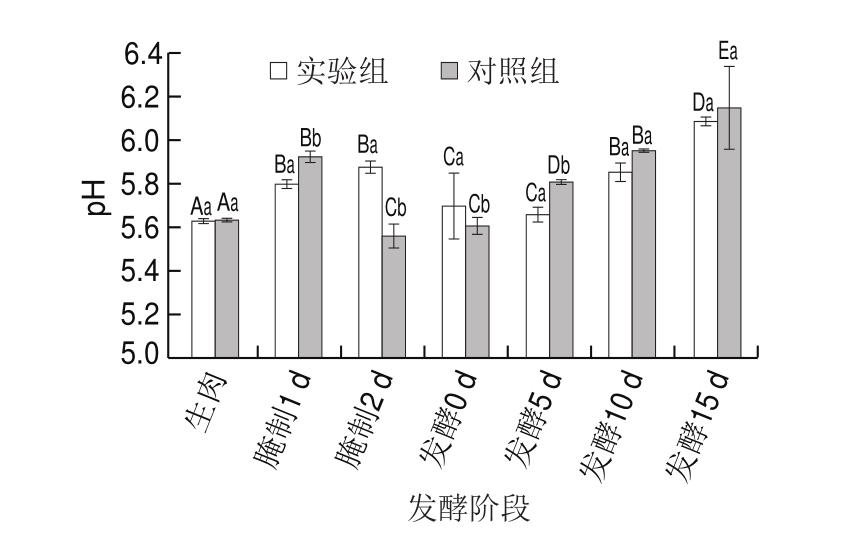
图7 发酵肉成熟过程中pH值的变化
Fig.7 Changes in pH value during meat fermentation
由图7可知,在发酵第5天时,实验组发酵肉pH值(5.66)达到最低,而对照组发酵肉pH值在开始发酵时就达到最低值。发酵后期,对照组发酵肉pH值上升较快,发酵结束时略高于实验组。2 组发酵肉pH值回升的起始时间较早,且产品的最终pH值较高(6.09左右),这可能与添加的发酵剂和发酵温度(低温发酵)有关[21]。
2.2.2 发酵肉成熟过程中水分含量和食盐含量的变化
表1 发酵肉成熟过程中水分含量及食盐含量变化
Table 1 Changes in water content,salt content and nitrite content during meat fermentation%

注:同列小写字母不同,表示相同发酵阶段组间差异显著(P<0.05);同行大写字母不同,表示不同发酵阶段差异显著(P<0.05)。
指标 组别 腌制时间/d 发酵时间/d 1 2 0 5 10 15水分 实验组 68.54±0.26aA67.23±0.54aA67.22±1.29bA50.77±6.56aB42.58±0.54bC31.61±1.60bD含量 对照组 69.47±0.38aA65.94±0.81aB68.20±1.15bA49.12±3.06bC45.07±1.52bC40.15±1.08aD食盐 实验组 3.17±0.44aA5.21±0.01aB 2.65±0.06aC4.10±0.04aB6.40±0.04aD7.20±0.08bD含量 对照组 3.17±0.44aA4.13±0.49bB 3.62±0.05bB3.71±0.04bAB4.56±0.06bB5.93±0.09aC
由表1可知,发酵初期,2 组发酵肉水分含量持续下降,发酵结束时,实验组水分含量为31.61%,对照组水分含量为40.15%,与原料肉相比水分流失高达30%以上。而实验组的水分流失量明显多于对照组,而发酵肉成品水分含量越低,对微生物的抑制能力越强,品质越好。
发酵肉的食盐含量随着水分含量的下降呈现出上升趋势。腌制过程中,随着腌制时间的增加,发酵肉水分含量发生变化,食盐含量也逐渐增加。而加入发酵剂后,食盐含量相比于腌制结束时升高,这可能是由于菌种活化时,液体培养基内残留有氯化钠。
发酵过程中,2 组发酵肉水分含量均明显降低,而食盐含量则明显上升。并且,实验组产品最终食盐含量显著高于对照组(P<0.05)。这也充分表明在初始时添加相同量食盐的情况下,加入发酵剂的发酵肉成品中食盐含量高于自然发酵肉,能够更好地抑制有害菌生长,同时产品拥有更好的风味品质,显著提高了产品的安全性[22-24]。
2.2.3 发酵肉成熟过程中亚硝酸盐含量的变化

图8 发酵肉成熟过程中亚硝酸盐含量的变化
Fig.8 Changes in nitrite content during meat fermentation
在腌制第1天时亚硝酸盐同发酵剂一同加入,加入量为80 mg/kg。由图8可知,发酵前期对于亚硝酸盐的消耗量较大,其作用为参与色泽的产生及抑制杂菌生长。而实验组加入发酵剂对于亚硝酸盐的消耗起促进作用,加速其消耗,从而使亚硝酸盐含量减少。发酵后期,发酵肉亚硝酸盐含量有所上升,且实验组发酵肉的最终亚硝酸盐含量显著低于对照组(P<0.05)。总体来说,发酵肉亚硝酸盐含量的变化与Essid等[17]的结果相一致,并且加入发酵剂能够明显抑制发酵后期亚硝酸盐的形成,减少有毒有害物质的生成,显著提高产品的安全性[25-27]。
2.4 发酵肉成熟过程中的质构变化
表2 发酵肉成熟过程中质构特性的变化
Table 2 Changes in texture quality during meat fermentation
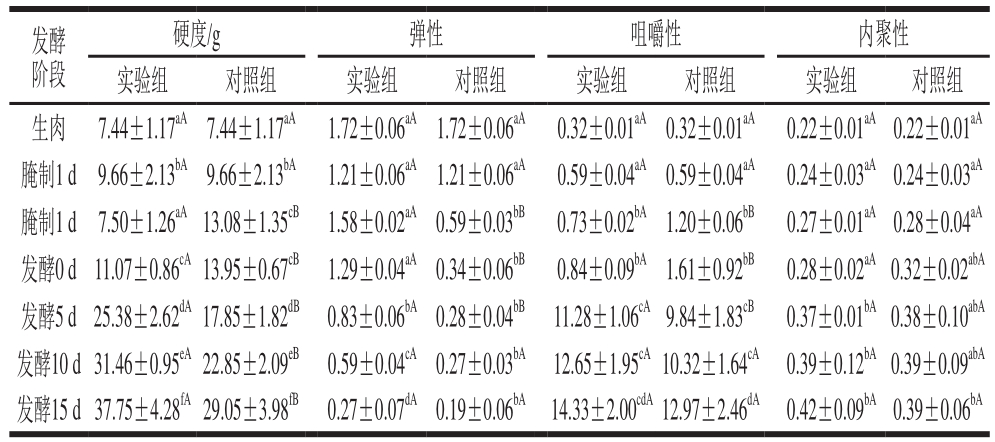
注:同列小写字母不同,表示不同发酵阶段差异显著(P<0.05);同行大写字母不同,表示相同发酵阶段组间差异显著(P<0.05)。
发酵阶段硬度/g 弹性 咀嚼性 内聚性实验组 对照组 实验组 对照组 实验组 对照组 实验组 对照组生肉 7.44±1.17aA 7.44±1.17aA 1.72±0.06aA1.72±0.06aA 0.32±0.01aA 0.32±0.01aA 0.22±0.01aA0.22±0.01aA腌制1 d 9.66±2.13bA9.66±2.13bA 1.21±0.06aA1.21±0.06aA 0.59±0.04aA 0.59±0.04aA 0.24±0.03aA0.24±0.03aA腌制1 d 7.50±1.26aA13.08±1.35cB 1.58±0.02aA0.59±0.03bB 0.73±0.02bA1.20±0.06bB 0.27±0.01aA0.28±0.04aA发酵0 d 11.07±0.86cA13.95±0.67cB 1.29±0.04aA0.34±0.06bB 0.84±0.09bA1.61±0.92bB 0.28±0.02aA0.32±0.02abA发酵5 d 25.38±2.62dA17.85±1.82dB 0.83±0.06bA0.28±0.04bB 11.28±1.06cA9.84±1.83cB 0.37±0.01bA0.38±0.10abA发酵10 d 31.46±0.95eA22.85±2.09eB 0.59±0.04cA0.27±0.03bA 12.65±1.95cA10.32±1.64cA 0.39±0.12bA0.39±0.09abA发酵15 d 37.75±4.28fA29.05±3.98fB 0.27±0.07dA0.19±0.06bA 14.33±2.00cdA12.97±2.46dA 0.42±0.09bA0.39±0.06bA
由表2可知,无论是硬度、弹性、咀嚼性还是内聚性,实验组发酵肉均明显优于对照组(P<0.05),说明在质构品质方面,相比自然发酵肉,加入发酵剂的发酵肉硬度、弹性、咀嚼性和口感更好。
3 结 论
通过研究发酵成熟过程中添加戊糖片球菌和木糖葡萄球菌复合发酵剂的发酵肉与自然发酵肉的微生物菌群、理化指标及质构品质变化,发现无论是在微生物、理化指标还是风味品质方面,加入发酵剂的发酵肉均优于自然发酵肉。并且与对照组相比,加入发酵剂能够减少最终产品的亚硝酸盐含量,同时提高食盐含量,促进风味物质的形成。因此,推测加入发酵剂可以减少发酵肉中食盐的用量,同时减少亚硝酸盐的生成,从而保证产品安全和风味品质。发酵肉通过微生物发酵,其安全性得以提高、风味品质得以改善,而如何生产出高品质、营养、健康的功能性发酵肉制品必将成为肉制品加工行业的又一新热点[28-30]。
[1]郭晓芸,张永明,张倩.发酵肉制品的营养、加工特性与研究进展[J].肉类工业,2009(5): 51-54.
[2]马菊,孙宝忠,郝永清.国内外发酵肉制品历史及发展现状比较[J].肉类研究,2006,20(9): 45-47.DOI:10.3969/j.issn.1001-8123.2006.09.019.
[3]王敏,李梦璐,葛庆丰,等.微生物外源酶对发酵肉制品品质的影响[J].食品与发酵工业,2012(10): 134-139.
[4]王亚男,马龙彪,赵晶,等.发酵肉制品的最新研究动态与前景展望[J].农产品加工(学刊),2012(8): 88-92.DOI:10.3969/j.issn.1671-9646(X).2012.08.025.
[5]CASABURI A,DI MARTINO V,FERRANTI P,et al.Technological properties and bacteriocins production by Lactobacillus curvatus 54M16 and its use as starter culture for fermented sausage manufacture[J].Food Control,2016,59: 31-45.DOI:10.1016/j.foodcont.2015.05.016.
[6]周光宏.发酵肉制品加工技术[M].北京: 中国农业出版社,2014: 35-36.
[7]杜莎.湘西腊肠理化特性及血液指标和肠道微生物研究[D].长沙:湖南农业大学,2017: 75-78.
[8]刘宗敏.发酵肉制品研究现状及发展趋势[J].山东食品发酵,2014(1): 50-52.DOI:10.3321/j.issn:1002-6630.2005.06.035.
[9]沈清武,李平兰.小片球菌在发酵香肠中的应用: 对产品色泽、质构和感官品质的影响[J].中国食品学报,2003(增刊1): 58-61.DOI:10.3969/j.issn.1009-7848.2003.z1.013.
[10]NIE Xiaohua,LIN Shengli,ZHANG Qilin.Proteolytic characterization in grass carp sausage inoculated with Lactobacillus plantarum and Pediococcus pentosaceus[J].Food Chemistry,2014,145: 840-844.DOI:10.1016/j.foodchem.2013.08.096.
[11]赵丽华,靳烨,马长伟,等.戊糖片球菌与复合发酵剂对羊肉干发酵香肠质地剖面分析(TPA)和色泽的影响[J].食品科技,2009(10):122-126.DOI:10.3969/j.issn.1009-7848.2003.z1.013.
[12]郝红涛,赵改名,柳艳霞,等.肉类制品的质构特性及其研究进展[J].食品与机械,2009,25(3): 125-128.
[13]杜莎,谭雅,谢佳琦,等.发酵肉制品品质改善途径的研究进展[J].食品工业科技,2016,37(16): 374-378.DOI:0.13386/j.issn1002-0306.2016.16.066.
[14]张杨萍,张弘,余翔,等.中式培根制作工艺及其对理化品质指标和蛋白质水解的影响[J].食品科学,2011,32(4): 15-20.
[15]张会丽,余翔,张弘,等.鲈鱼风干成熟工艺及对蛋白质水解和感官品质影响[J].食品科学,2010,31(16): 47-51.
[16]周慧敏,张顺亮,赵冰,等.木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J].食品科学,2018,39(22): 32-38.DOI:10.7506/spkx1002- 6630- 201822006.
[17]ESSID I,HASSOUNA M.Effect of inoculation of selected Staphylococcus xylosus and Lactobacillus plantarum strains on biochemical,microbiological and textural characteristics of a Tunisian dry fermented sausage[J].Food Control,2013,32(2): 707-714.DOI:10.1016/ j.foodcont.2013.02.003.
[18]潘晓倩,成晓瑜,张顺亮,等.不同发酵剂对北方风干香肠色泽和风味品质的改良作用[J].食品科学,2015,36(14): 81-86.DOI:10.7506/spkx1002-6630-201514016.
[19]SANTIAGO R M,ALBERTO M,MARIA JOSÉ B,et al.Application of Lactobacillus fermentum HL57 and Pediococcus acidilactici SP979 as potential probiotics in the manufacture of traditional Iberian dryfermented sausages[J].Food Microbiology,2011,28(5): 839-847.DOI:10.1016/j.fm.2011.01.006.
[20]扈莹莹,王妍,于晶,等.脂肪添加量对发酵香肠脂质和蛋白质氧化及挥发性化合物形成的影响[J].食品科学,2019,40(18): 8-14.DOI:10.7506/spkx1002-6630-20181022-233.
[21]ANGELIKI S D,PANAGIONTA F,STEFAAN D S,et al.Effect of temperature and pH on the community dynamics of coagulase-negative staphylococci during spontaneous meat fermentation in a model system[J].Food Microbiology,2018,76: 180-188.DOI:10.1016/j.fm.2018.05.006.
[22]蔡鲁峰,杜莎,谭雅,等.乳酸菌肉品发酵剂的发酵特性研究[J].食品工业科技,2015(17): 108-114.DOI:10.13386/j.issn1002-0306.2015.17.022.
[23]杜宝.不同发酵剂和贮藏温度对发酵羊肉香肠品质的影响[D].呼和浩特: 内蒙古农业大学,2018: 53-55.
[24]LU Shiling,XU Xinglian,ZHOU Guanghong,et al.Effect of starter cultures on microbial ecosystem and biogenic amines in fermented sausage[J].Food Control,2010,21(4): 444-449.DOI:10.1016/j.food cont2009.07.008.
[25]MORACANIN S V,STEFANOVIC S,RADICEVIC T,et al.Production of biogenic amines by lactic acid bacteria isolated from uzicka sausages[J].Procedia Food Science,2015(5): 308-311.DOI:10.1016/j.profoo.2015.09.068.
[26]扈莹莹,温荣欣,陈佳新,等.低盐对发酵肉制品品质形成影响及减盐手段研究进展[J].食品工业科技,2019,40(16): 324-335.DOI:10.13386/j.issn1002-0306.2019.16.054.
[27]朱胜华,车振明.微生物在发酵肉制品中的应用[J].食品科技,2011(10): 112-115.
[28]龙强,聂乾忠,刘成国.发酵肉制品功能性发酵剂研究现状[J].食品科学,2016,37(17): 263-269.DOI:10.7506/spkx1002-6630-201617044.
[29]谭雅,黄晴,曹熙,等.发酵肉制品中常见有益微生物及其功能研究进展[J].食品工业科技,2016,37(21): 388-392.DOI:10.13386/j.issn1002-0306.2016.21.067.
[30]张敬竟,刘姝韵,王桂瑛,等.干腌火腿的蛋白质组学研究进展[J].肉类研究,2017,31(8): 60-63.DOI:10.7506/rlyj1001-8123-201708012.