表 1 流动相梯度洗脱条件
Table 1 Gradient elution conditions of mobile phase

时间/min 水体积分数/% 乙腈体积分数/%0.0 65 35 3.0 50 50 6.0 10 90 9.0 10 90 9.1 65 35 12.0 65 35
己烯雌酚(diethylstilbestrol,DES)属激素类化合物,是一种能够缩短动物生长周期、提高养殖效率的生长促进剂,可导致机体代谢紊乱、发育异常或产生肿瘤,被德国、法国等欧盟国家在食用性动物饲养中列为禁用品[1-3]。农业部193号公告《食品动物禁用的兽药及其他化合物清单》以及农业部235号公告《动物性食品中兽药最高残留限量》,均禁止在畜禽水产养殖过程中使用DES等雌激素。目前,测定食品中DES残留的方法有液相色谱(liquid chromatography,LC)[4-6]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)[7-9]、LC-MS/MS[10-12]等方法。LC法易产生假阳性结果;GC-MS法样品需衍生化处理,步骤繁琐;LC-MS/MS技术具有高选择性和高灵敏度,且样品前处理简单。液-液分配或固相萃取等传统前处理方法耗时长、有机溶剂损耗大,不利于环保。分散固相萃取QuEChERS(Quick,Easy, Cheap, Effective, Rugged, Safe)是近年发展起来的一种快速、简便、有效、可靠、安全的样品前处理技术[13]。本研究采用QuEChERS技术进行样品前处理,建立QuEChERS-超高效液相色谱(ultra high performance liquid chromatography,UPLC)-MS/MS法检测鸡鸭肉中DES残留的方法,可较好地排除样品基质干扰,提高检测效率,节约时间,适合大批量鸡鸭肉样品的快速检测。
鸡鸭肉,来自广西区监督抽检及风险监测样品。
实验用水均为超纯水;乙腈(色谱纯) 德国Merck公司;无水乙酸钠、无水硫酸镁、中性氧化铝、氯化钠(均为分析纯) 国药集团化学试剂有限公司;N-丙基乙二胺(primary secondary amine,PSA)吸附剂德国CNW公司;DES标准品(纯度≥99.5%) 德国Dr.Ehrenstorfer GmbH公司;内标物DES-D8标准品(纯度≥98.0%) 美国CIL公司。
Shimadzu DGU-20A超高效液相色谱仪 日本岛津公司;QTRAP 4500 MS四极杆质谱仪(配备电喷雾离子源) 美国AB Sciex公司;S180H超声波发生器德国Elma公司;3-30K离心机 德国Sigma公司;N-EVAP水浴式氮吹浓缩仪 美国Organomation Associates公司;Vortex-genie涡旋混匀器 美国Scientific Industries公司。
1.3.1 溶液配制
1.3.1.1 标准工作液的配制
精密称取DES标准品,置于25 mL棕色容量瓶中,用甲醇溶解定容至刻度,配制成质量浓度为1 mg/mL的DES标准储备液,密封,于-18 ℃冰箱中保存备用,有效期3 个月。精确吸取DES标准储备液1.00 mL,配制成质量浓度为50 ng/mL的DES标准工作液,备用。
1.3.1.2 内标工作液的配制
精密称取内标物DES-D8标准品,置于100 mL棕色容量瓶中,用甲醇溶解定容至刻度,配制成质量浓度为5 μg/mL的DES-D8内标储备液,密封,于-18 ℃冰箱中保存备用。精确吸取DES-D8内标储备液1.00 mL,配制成质量浓度为100 ng/mL的DES-D8内标工作液,备用。
1.3.1.3 混合标准工作溶液的配制
精确吸取50 ng/mL的DES标准工作液0.1、0.2、0.4、1.0、2.0、4.0 mL,分别置于10 mL棕色容量瓶中,分别加入DES-D8内标工作液(100 ng/mL)1.0 mL,用甲醇稀释至刻度,摇匀,配制成DES质量浓度分别为0.5、1.0、2.0、5.0、10.0、20.0 ng/mL的混合标准工作溶液,其中DES-D8内标的质量浓度均为10 ng/mL。
1.3.1.4 基质匹配混合标准工作溶液的配制
准确称取空白基质样品5.00 g,按1.3.2节的方法进行样品前处理,上清液转移至氮吹管中,分别加入上述混合标准工作溶液各1.00 mL,氮气吹干后,加入1.00 mL体积分数50%乙腈溶液复溶,超声30 s,涡旋混匀,过0.22 μm滤膜,即得基质匹配混合标准工作溶液。
1.3.2 样品前处理
1.3.2.1 样品提取
鸡鸭肉均质后,准确称取试样5.00 g,置于带螺旋盖的50 mL聚丙烯离心管中,加入10 mL水,涡旋1 min后,准确加入10.00 mL乙腈,涡旋2 min,加入QuEChERS盐析剂(4.0 g无水硫酸镁、1.0 g氯化钠),快速摇匀,冰水浴15 min降温,4 000 r/min离心10 min,上清液转移至15 mL聚丙烯离心管中,备用。
1.3.2.2 样品净化
将QuEChERS净化粉(含500 mg无水硫酸镁、500 mg中性氧化铝及200 mg PSA)加入装有上清液的15 mL离心管中,涡旋1 min,4 000 r/min离心10 min,离心后样品分层,取上层清液至10 mL具塞刻度试管,45 ℃水浴,氮吹浓缩至近干;加入1.0 mL体积分数50%乙腈溶液复溶,超声30 s,涡旋混匀,过0.22 μm滤膜,待上机测定。
1.3.3 UPLC-MS/MS测定
1.3.3.1 色谱条件
色谱条件:XBridge Phenyl-C18色谱柱(150 mm×2.1 mm,3.5 μm);柱温40 ℃;流速0.3 mL/min;进样量10 μL;流动相A为水,流动相B为乙腈,梯度洗脱程序见表1。
表 1 流动相梯度洗脱条件
Table 1 Gradient elution conditions of mobile phase

时间/min 水体积分数/% 乙腈体积分数/%0.0 65 35 3.0 50 50 6.0 10 90 9.0 10 90 9.1 65 35 12.0 65 35
1.3.3.2 质谱条件
电喷雾电离负离子模式(electron spray ionization,ESI-),多反应监测(multiple reaction monitoring,MRM)模式,电喷雾电压-4 500 V,离子源温度650 ℃,气帘气压241 kPa,雾化气压、辅助气压均为345 kPa。MRM相关参数设定见表2。
表 2 DES和DES-D8的MRM相关参数设定
Table 2 Related parameters of DES and DES-D8 under MRM mode
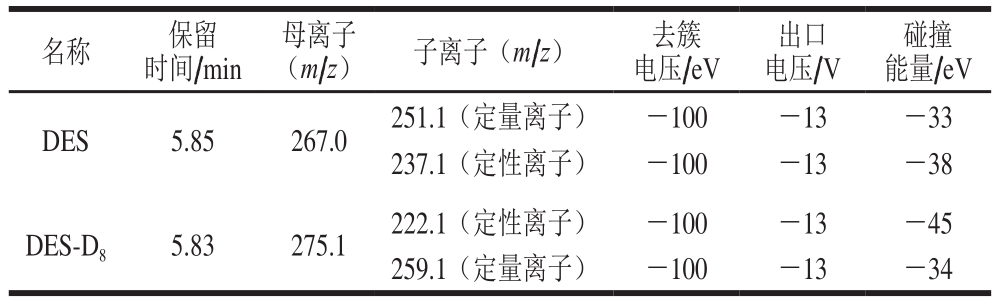
碰撞能量/eV DES 5.85 267.0 251.1(定量离子) -100 -13 -33 237.1(定性离子) -100 -13 -38 DES-D8 5.83 275.1 222.1(定性离子) -100 -13 -45 259.1(定量离子) -100 -13 -34名称 保留时间/min (m/z)子离子(m/z)去簇电压/eV母离子 出口电压/V
1.3.3.3 上机测定
在上述测定条件下,分别对样品溶液、基质匹配混合标准溶液进行测定,以基质匹配标准溶液保留时间和定性、定量离子为依据进行定性,以定量离子色谱峰面积与对应内标峰面积的比值计算样品中待测物的含量。
鸡鸭肉中的脂肪、蛋白质等组分会产生基质抑制效应[14-15],造成被测物灵敏度降低,需对样品中的目标物进行提取净化。根据DES易溶于乙醇、乙醚、氯仿等有机试剂的化学性质,比较甲醇、乙腈、甲醇水溶液、乙腈水溶液及乙酸乙酯的提取效果。结果表明:用乙酸乙酯提取的样品,后续净化困难,回收率低,与李雪等[16]报道的以乙酸乙酯提取牛乳样品中的DES后续净化较困难、回收率较低一致;甲醇、乙腈与水可以互溶,具有良好的蛋白沉淀能力,同时可将鸡鸭肉中部分水溶性蛋白提取出来,带来杂质;甲醇水溶液、乙腈水溶液、甲醇等由于沸点较高或与水互溶后沸点提高,不易蒸干,考虑到后续净化过程,本研究采用乙腈为提取溶剂。
样品经过乙腈沉淀蛋白质后,除去了大部分干扰物,但仍有少量脂肪杂质会对目标物造成一定影响。比较弗罗里硅土、中性氧化铝、C18固相萃取小柱及QuEChERS技术等净化方式。结果表明:单独使用弗罗里硅土或中性氧化铝的脂肪去除能力尚可,平均回收率在60%~72%之间,样品基线较平整,回收率较好,能够基本满足分析要求[12,14];而采用C18固相萃取小柱净化的样品,DES回收率明显较低且重复性差;采用QuEChERS技术净化的样品,DES回收率均在70%以上,重复性相对较高,故采用QuEChERS技术进行净化。
QuEChERS样品前处理技术有机溶剂用量少、耗时短,加入中性氧化铝和PSA除去样品中的杂质,加入无水硫酸镁吸收样品中的水分等[16-18],同时可分散样品,增加与萃取溶剂的接触面[19-21],提高回收率。为了获得最佳的样品提取效果和回收率,研究PSA(50~300 mg)、无水硫酸镁(500~1 000 mg)及中性氧化铝(200~1 000 mg)按不同比例组合的净化效果。结果表明,采用200 mg PSA、500 mg无水硫酸镁及500 mg中性氧化铝为净化剂组合进行分散固相萃取时,样品溶液澄清,基质干扰较小,回收率最佳,为70.4%~81.6%,满足目标物痕量分析的要求。
基质效应是客观存在且不可能消除的,主要是由于基质成分和目标化合物在电喷雾离子源进行离子化时相互竞争的结果,包括基质增强效应和基质抑制效应。在LC-MS分析中,基质效应影响仪器的灵敏度和重复性,是影响可靠定性及准确定量的重要因素,这在动物源食品及生物样本中表现尤为明显。为了补偿基质效应给分析结果带来的影响,通常采用同位素内标、稀释样品溶液、配制基质匹配标准溶液等方法。本研究采用配制基质匹配标准溶液的方法,很好地抵消了样品的基质效应,得到的方法学指标能满足残留检测的要求。
DES的化学结构中含有酚羟基,易脱去一个H+而形成离子峰[M-H]-,适合选用ESI-模式,ESI-模式下产生的母离子为[M-H]-。采用注射泵直接进样,将质量浓度为1 μg/mL的标准溶液以5 μL/min流速注入离子源中进行一级质谱分析(MS2 Scan),得到分子离子峰,再对准分子离子峰进行二级质谱分析,得到相应的碎片离子,选择3 个丰度较高的特征碎片离子,其中丰度最高的作为定量离子,其余做为定性离子,进行碰撞能量、去簇电压、喷雾电压等参数优化,最后得到DES的3 个碎片离子MRM扫描时对应的质谱参数[22-24]。
由于DES含有酚羟基结构,在ESI-模式下,流动相中加入乙酸、乙酸铵、甲酸等会抑制其响应[25-27],流动相中加入0.1%氨水则可提高灵敏度,但流动相pH值会达到10左右,超过普通硅胶基质C18柱的pH值耐受范围,需选用pH值耐受范围广的色谱柱[28-30]。在本研究优化的色谱条件下,不加0.1%氨水也能获得良好的峰形和灵敏度,故选取乙腈-水作为流动相。选用可耐受pH值范围2.0~12.0的XBridge Phenyl-C18柱(2.1 mm×150 mm,3.5 μm)作为分离柱。
流速大小影响色谱柱及系统的压力、样品组分的分离效果和出峰时间,流速太大,系统的压力太高,容易引起柱头塌陷,流速太小,出峰时间延长,通过查阅相关研究[18,20,23],流速确定为0.3 mL/min。采用优化后的条件,DES及其内标物DES-D8的MRM提取离子流如图1所示。
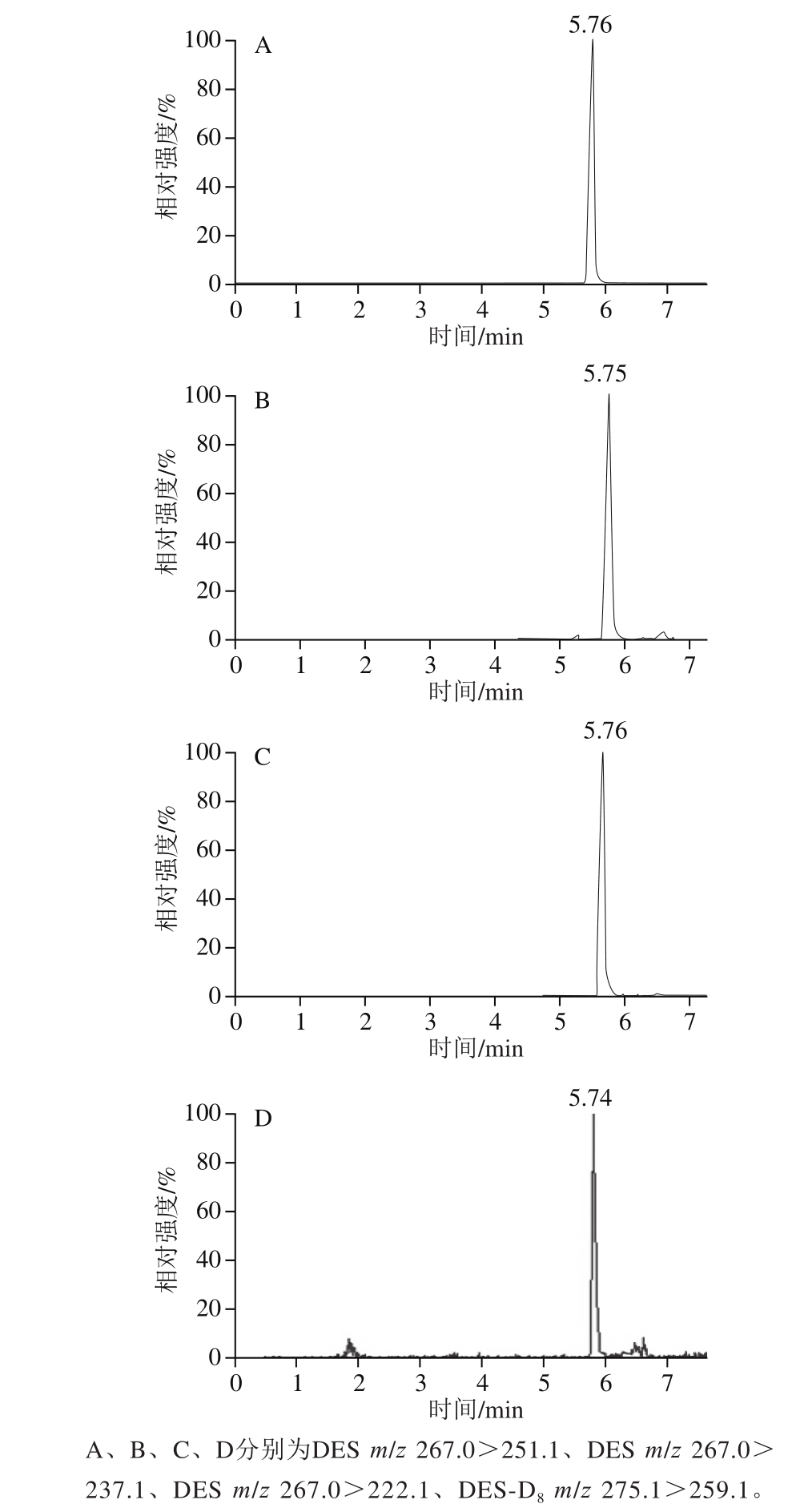
图 1 DES及DES-D8的MRM提取离子流图
Fig. 1 MRM chromatograms of DES and DES-D8
对配制好的DES标准工作溶液进行测定,以DES定量离子色谱峰面积与对应内标峰面积的比值为纵坐标(y),标准溶液质量浓度为横坐标(x,ng/mL),进行线性回归分析。结果表明:DES在质量浓度0.50~20.00 ng/mL范围内呈现良好的线性关系,线性方程为y=0.927 00x+0.004 76(r=0.999 9)。准确称取鸡鸭肉空白样品,加入一定量DES和DES-D8标准溶液,按1.3.2节的方法进行样品前处理,以3 倍信噪比(RS/N)计算得到DES的方法检出限为0.1 μg/kg,以10 倍RS/N计算得到DES的方法定量限为0.4 μg/kg。
采用内标定量法,准确称取鸡鸭肉空白样品进行加标回收实验,加标量分别为0.4、0.8、4.0 μg/kg,每个加标量设3 个平行,按1.3.2节的方法进行样品前处理,并做空白实验。
表 3 鸡鸭肉中DES的回收率与相对标准偏差
Table 3 Recoveries and precision of DES in chicken and duck meat samples
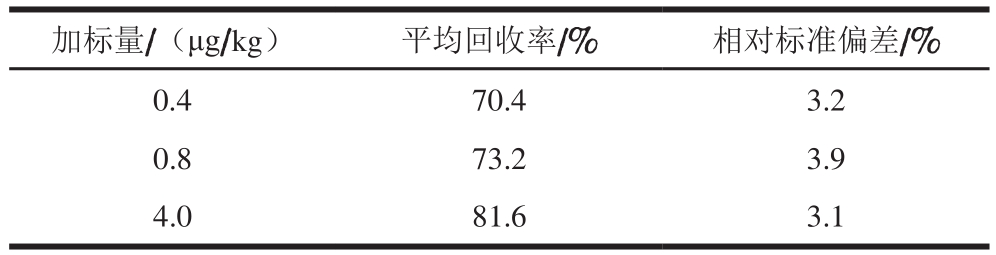
加标量/(μg/kg) 平均回收率/% 相对标准偏差/%0.4 70.4 3.2 0.8 73.2 3.9 4.0 81.6 3.1
由表3可知,鸡鸭肉中DES的加标回收率为70.4%~81.6%,相对标准偏差为3.1%~3.9%,表明方法的准确度与精密度较好,符合残留分析要求。图2为加标量0.8 μg/kg的样品总离子流图。
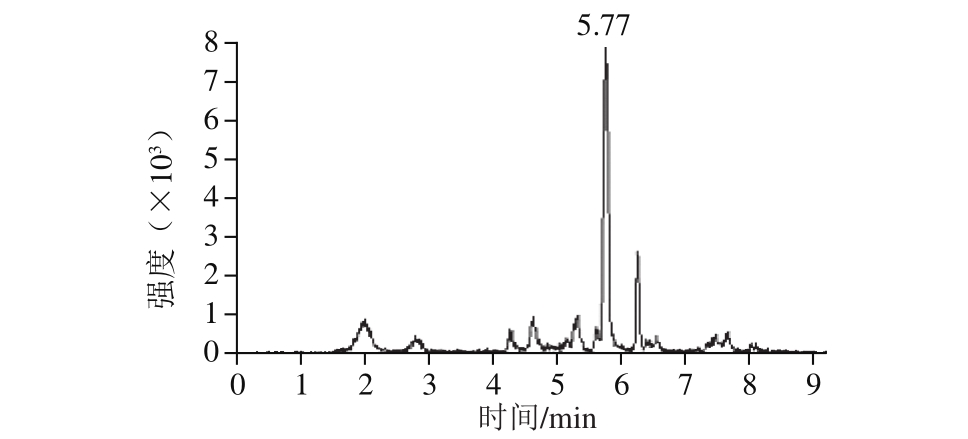
图 2 鸡鸭肉加标0.8 μg/kg DES样品的总离子流图
Fig. 2 Total ion current chromatograms for chicken and duck samples spiked with 0.8 μg/kg DES
应用建立的方法对广西区监督抽检和风险监测的103 批鸡鸭肉样品进行DES残留量测定,结果表明,样品中均未检出DES。
建立了鸡鸭肉中DES残留量的QuEChERS-UPLC-MS/MS测定方法,以中性氧化铝、无水硫酸镁和PSA为基质净化剂,用乙腈对样品进行提取,UPLC-MS/MS法检测,内标法定量。结果表明,样品加标回收率和样品间的测定重复性较好,样品前处理过程相对简单,可较好地排除样品基质的干扰,且分析时间仅6 min左右,提高了检测效率,适合大批量鸡鸭肉样品的快速检测。
在样品前处理条件和色谱条件优化中,提取溶剂和净化方式均与回收率和提取率有密切关系。合适的净化方式可以有效将基质干扰效应降低,减少杂质对目标物的影响以及对仪器的污染和损害。色谱条件则影响目标物的响应和分离效果。故选择合适的提取溶剂、净化方式及色谱条件是日常食品检测中必须考虑的因素。本研究建立的方法适合大批量鸡鸭肉中的DES检测,对于其他类型样品则需进一步研究探讨。
[1] 庞国芳. 农药残留高通量检测技术. 第2卷: 动物源产品[M]. 北京:科学出版社, 2013: 14-27.
[2] 李维红, 熊琳, 高雅琴, 等. HPLC法同时测定牛羊肉中4 种雌激素的残留量[J]. 黑龙江畜牧兽医, 2014(6): 207-209. DOI:10.13881/j.cnki.hljxmsy.2014.0447.
[3] 黄璐, 张勇民, 郑琦. SPE-HPLC法检测食品中多种痕量雌激素[J].江汉大学学报(自然科学版), 2014, 42(1): 55-58. DOI:10.16389/j.cnki.cn42-1737/n.2014.01.002.
[4] 李娴. 高效液相色谱测定牛肉中己烯雌酚残留量方法的探讨[J]. 福建分析测试, 2016, 25(4): 26-29. DOI:10.3969/j.issn.1009-8143.2016.04.05.
[5] 李亚男. 高效液相色谱法测定鸡肉中的己烯雌酚和甲睾酮残留量[J].今日药学, 2016, 26(7): 491-493.
[6] 罗慧玉, 徐鹏, 闫伟伟, 等. 改进MSPD-HPLC法快速检测猪血豆腐中镇静剂及雌激素残留[J]. 食品研究与开发, 2017, 38(4): 147-150.DOI:10.3969/j.issn.1005-6521.2017.04.032.
[7] 钱宗耀, 张维维, 刘河疆. 气相色谱-串联质谱法测定水中己烯雌酚残留[J]. 环境监测管理与技术, 2017, 29(2): 50-52. DOI:10.19501/j.cnki.1006-2009.20170322.003.
[8] 王宇, 孔祥瑞, 李成久. 气相色谱-质谱法测定水产品中己烯雌酚的不确定度分析评定[J]. 水产科学, 2016, 35(3): 284-288.DOI:10.16378/j.cnki.1003-1111.2016.03.016.
[9] 林小莉, 李宁, 霍峰, 等. 气相色谱-质谱法同时测定饲料中6 种雌激素类药物[J]. 分析测试学报, 2016, 35(3): 322-326. DOI:10.3969/j.issn.1004-4957.2016.03.011.
[10] 权伍英, 郭廓, 刘洋. 液相色谱-串联质谱法测定牛奶中的己烯雌酚残留量[J]. 河南预防医学杂志, 2018, 29(9): 663-665. DOI:10.13515/j.cnki.hnjpm.1006-8414.2018.09.008.
[11] 张天姝, 马雷, 玄兵, 等. 饲料中玉米赤霉醇、玉米赤霉酮和己烯雌酚的测定: 超高效液相色谱-串联质谱法[J]. 现代畜牧兽医, 2018(2):18-23.
[12] 赵昕, 张占恩, 张磊, 等. 基质固相分散萃取/高效液相色谱-串联质谱法测定污泥中的6 种雌激素[J]. 分析测试学报, 2015, 34(1): 56-61.DOI:10.3969/j.issn.1004-4957.2015.01.008.
[13] 罗辉泰, 黄晓兰, 吴惠勤, 等. QuEChERS/液相色谱-串联质谱法同时测定鸡鸭肉中30 种激素类及氯霉素类药物残留[J]. 分析测试学报,2011, 30(12): 1329-1337. DOI:10.3969/j.issn.1004-4957.2011.12.001.
[14] 马丽莎, 戴晓欣, 谢文平, 等. QuEChERS/GC-MS法同时测定鱼、虾中的雌二醇与己烯雌酚残留[J]. 分析测试学报, 2015, 34(1): 62-66.DOI:10.3969/j.issn.1004-4957.2015.01.009.
[15] 白志荣, 李娜林, 高娃, 等. 高效液相色谱-质谱法对水产品中孔雀石绿、隐性孔雀石绿及己烯雌酚的测定[J]. 内蒙古农业科技, 2013,43(5): 14-16. DOI:10.3969/j.issn.1007-0907.2015.05.004.
[16] 李雪, 牟光庆, 陈历俊, 等. 固相萃取-高效液相色谱串联质谱法测定原料奶中5 种环境雌激素残留量的研究[J]. 食品工业科技, 2013,34(9): 293-296. DOI:10.13386/j.issn1002-0306.2013.09.020.
[17] 罗辉泰, 黄晓兰, 吴惠勤, 等. 分散固相萃取/高效液相色谱-串联质谱快速测定饲料中87 种药物残留[J]. 分析测试学报, 2015, 34(9):14-16. DOI:10.3969/j.issn.1004-4957.2015.09.001.
[18] 罗辉泰, 谢梦婷, 黄晓兰, 等. 分散固相萃取-高效液相色谱-串联质谱法同时测定畜禽肉中63 种兽药残留[J]. 色谱, 2015, 33(4):354-362. DOI:10.3724/SP.J.1123.2014.12005.
[19] 王春辉, 蒲云霞, 徐晓枫, 等. 固相萃取-反相高效液相色谱法测定肌肉中的己烯雌酚[J]. 中国卫生检验杂志, 2013, 23(18): 3492-3494.
[20] 黄雪玲, 戚隽冤, 魏厚道, 等. 固相萃取-反相高效液相色谱法同时测定水产品中的己烯雌酚和甲基睾丸酮[J]. 江苏农业科学, 2015,43(5): 285-286. DOI:10.15889/j.issn.1002-1302.2015.05.095.
[21] 张晓璐, 丁建, 汪嘉丽. UPLC-QTOF-MS法快速测定化妆品中添加的7 种性激素[J]. 海峡药学, 2015, 27(10): 36-39.
[22] 崔向云, 张雪峰, 李照, 等. UPLC-MS/MS法测定牛乳中己烯雌酚、玉米赤霉醇和玉米赤霉酮残留[J]. 中国乳品工业, 2015, 43(10): 44-46.
[23] 韩迪, 张艳, 周建于, 等. 超高效液相色谱串联质谱法检测鸡肉中5种雌激素残留[J]. 昆明医科大学学报, 2014, 35(7): 32-36.
[24] 张秋菊, 曹林波, 翁少梅, 等. 固相微萃取-高效液相色谱法测定牛奶和肉类中己烯雌酚、丙酸睾酮和双酚A[J]. 中国卫生检验杂志,2017, 27(5): 635-638.
[25] 阳洪波, 古丽君, 林业刚. UPLC-MS/MS同时测定保健饮品中的3 种雌激素[J]. 食品工业, 2015, 36(5): 271-274.
[26] 张振霖. 高效液相色谱法检测鲈鱼中己烯雌酚含量[J]. 福建水产,2013, 35(2): 124-128. DOI:10.14012/j.cnki.fjsc.2013.02.002.
[27] 李佩佩, 郭远明, 陈雪昌, 等. 凝胶渗透色谱-固相萃取/高效液相色谱法同时测定水产品甲基睾丸酮和己烯雌酚[J]. 分析测试学报,2013, 32(2): 267-270. DOI:10.3969/j.issn.1004-4957.2013.02.023.
[28] 朱金兰, 王菁, 潘迎辉, 等. 气相色谱-串联质谱法测定水产品中己烯雌酚的含量[J]. 江苏农业科学, 2015, 43(12): 328-330.
[29] 魏斌, 陆井莲, 魏云计, 等. 气质联用法检测水产品中己烯雌酚含量并用液相色谱串联质谱验证[J]. 检验检疫学刊, 2015, 25(1): 32-35;66. DOI:10.15889/j.issn.1002-1302.2015.12.104.
[30] 隆雪明, 匡光伟, 陈福华, 等. 高效液相色谱法测定饲料中雌二醇、炔雌醇和己烯雌酚的含量[J]. 饲料研究, 2017(2): 27-29.DOI:10.13557/j.cnki.issn1002-2813.2017.02.007.
Determination of Diethylstilbestrol Residues in Chicken and Duck Meat Using QuEChERS Combined with Ultra-Performance Liquid Chromatography-Tandem Mass Spectrometry
MO Zimei, NING Xin, CHEN Ningzhou, et al. Determination of diethylstilbestrol residues in chicken and duck meat using QuEChERS combined with ultra-performance liquid chromatography-tandem mass spectrometry[J]. Meat Research, 2019,33(9): 48-52. DOI:10.7506/rlyj1001-8123-20190523-114. http://www.rlyj.net.cn