发酵时间和发酵剂种类对牛肉调味料风味的影响
吴晨燕,马俪珍*,周 伟,熊凤娇,仇泓博
(天津农学院食品科学与生物工程学院,天津 300384)
摘 要:为研究发酵剂种类和发酵时间对发酵牛肉调味基料(fermented beef flavorings,FBF)风味的影响,将发酵剂THM-17(木糖葡萄球菌+戊糖片球菌)、WBL-45(木糖葡萄球菌+肉葡萄球菌+清酒乳杆菌)、VHI-41(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)及清酒乳杆菌(Lactobacillus sake,LS)分别接种于牛骨肉酶解液中发酵12 h和16 h制作FBF,同时设置不发酵的对照组,采用电子鼻、电子舌、气相色谱-离子迁移谱和气相色谱-质谱联用分析不同组别FBF的风味差异和挥发性化合物组成。结果表明:对照组与发酵组FBF的气味和滋味均存在较大差异,其中,LS组和VHI-41组FBF风味具有特殊性;含硫化合物和醛类化合物是FBF中的关键风味化合物,醇类、酮类化合物对FBF的总体风味有重要的修饰作用,2-甲基-3-呋喃硫醇和双(2-甲基-3-呋喃基)二硫及壬醛的相对含量是引起处理组FBF风味差异的关键。
关键词:发酵牛肉调味基料;发酵时间;发酵剂种类;挥发性风味物质
如今,咸味香精在国内外食用香精技术中发展较快[1]。牛肉味热反应香精是咸味香精的一个重要分支,已被广泛应用于肉味食品的风味改善和增香[2]。传统的牛肉香精多通过酶解-美拉德反应制备而成,通过增味剂或香辛料提高制品香味[3]。发酵牛肉调味基料(fermented beef flavorings,FBF)以牛骨肉末为原料,经高压浸提、酶解、微生物发酵和美拉德反应加工而成,通过微生物发酵对FBF的风味进行改善和增强[4]。
微生物发酵能有效促进产品中醇类、酮类和酸类等物质的生成[5],形成一系列风味物质或风味前体物质[6],对肉制品风味的改善有直接贡献作用[7]。乳酸菌能够利用水解酶类促进肉中蛋白质和脂肪的分解[8],增加肉味香精的必要前体物质,即游离氨基酸含量[9-10]。樊晓盼等[4]发现,戊糖片球菌和清酒乳杆菌能降低牛肉味香精苦味,改善肉制品风味。李松耀等[11]研究发现,利用米曲霉和酵母菌发酵制取牛肉香精,成品酱香浓郁、口感醇厚、后味悠长。魏欣等[12]将干酪乳杆菌、小球菌复配接种于肉馅中,制得的猪肉味香精肉香浓郁。李平[13]以毛霉发酵大豆蛋白制备牛肉香精,其中呋喃、硫醇、噻吩化合物的相对含量达38%以上。白菊红[14]于牦牛肉灌肠中分别接种米酒乳杆菌、植物乳杆菌及戊糖片球菌进行发酵,发现不同菌种和发酵时间灌肠中的总肽含量差异显著。肽的组成和含量对美拉德反应中肉香味的形成有很大影响。
目前,微生物发酵制作肉味香精的关键风味化合物报道较少。为研究发酵剂种类和发酵时间对FBF风味的影响,本研究以THM-17(木糖葡萄球菌+戊糖片球菌)、WBL-45(木糖葡萄球菌+肉葡萄球菌+清酒乳杆菌)、VHI-41(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)及清酒乳杆菌(Lactobacillus sake,LS)为发酵剂制作FBF,每种发酵剂均分别发酵12 h和16 h,设置不经发酵的对照组(control group,CK),通过电子鼻、电子舌、气相色谱-离子迁移谱(gas chromatographyion migration spectrum,GC-IMS)及气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)检测9 组样品的气味与滋味差异,明确发酵剂种类和发酵时间对FBF风味的影响,同时了解引起差异的化合物种类和关键风味物质,为发酵牛肉调味料风味形成机制的进一步研究提供依据。
1 材料与方法
1.1 材料
牛骨肉末 顶兴食品科技发展(天津)有限公司;THM-17、WBL-45、VHI-41 意大利萨科公司;LS由萨科商业复合菌WBL-45分离纯化获得。
商业复合菌粉无菌接种于含1.5 g/100 mL葡萄糖的灭菌乳中,常温活化2 h备用;LS接种于MRS液体培养基,37 ℃连续活化3 代备用。活化时接种量为2 g/100 mL。
1.2 仪器与设备
SX-500高压蒸汽灭菌锅 日本Tomy公司;THZ-98AB恒温振荡器 上海一恒科学仪器有限公司;JM-B6002电子天平 诸暨市超泽衡器设备有限公司;Astree电子舌、Heracles Ⅱ超快速气相色谱电子鼻法国Alpha M.O.S公司;QP2010 Plus 气相色谱-质谱联用仪 日本岛津公司;FlavourSpec风味分析仪 德国Gesellschaft für analytische Sensorsysteme mbH公司。
1.3 方法
1.3.1 FBF的制备
FBF的制备工艺流程[4]:原料选择(牛骨肉末)→高压浸提→酶解→发酵(或不发酵)→美拉德反应→离心取上清液
操作要点:1)高压浸提:将牛骨肉末、水以质量比1∶4混合搅拌,密封后置于高压灭菌锅中,0.1 MPa、121 ℃浸提4 h;2)酶解:分别添加质量分数0.06%的风味蛋白酶和0.03%复合蛋白酶于冷却至室温的浸提液中,50 ℃条件下振摇酶解4.5 h,酶解结束后沸水灭酶20 min;3)发酵:酶解液冷却至室温后接种发酵剂,分别发酵12、16 h,发酵温度30 ℃,发酵结束后沸水灭菌20 min,CK组可省略此步骤;4)美拉德反应:发酵液中添加1.2 g/100 mL木糖、1.2 g/100 mL葡萄糖、0.9 g/100 mL半胱氨酸、0.45 g/100 mL甘氨酸、0.45 g/100 mL丙氨酸和1.8 g/100 mL VB1,搅拌均匀后在110 ℃条件下美拉德反应60 min。
1.3.2 实验方案设计
参照FBF的制备工艺流程,只在发酵环节设计不同实验组,其他工艺环节均相同:1)CK组:不进行发酵;2)其他8 组进行发酵,在酶解液中分别接种THM-17、WBL-45、VHI-41及LS,THM-17、WBL-45、VHI-41按商用推荐量进行添加,添加量为酶解液质量的0.02%,LS接种量为106 CFU/mL;各组发酵12、16 h,各组编号分别为THM17-12、WBL45-12、VHI41-12、LS-12、THM17-16、WBL45-16、VHI41-16、LS-16。通过电子鼻、电子舌、GC-IMS、GC-MS分析不同发酵剂及其发酵时间对FBF风味的影响。
1.3.3 指标测定
1.3.3.1 电子鼻测定
参考张鑫等[15]的方法,并作适当修改。吸取1 mL样品,密封至专用瓶中;样品在HeraclesⅡ超快速气相色谱电子鼻上进行测定分析。
进样、检测条件:进样体积300 μL,孵化温度50 ℃,捕获温度50 ℃,检测器温度250 ℃。
1.3.3.2 电子舌测定
参考李阳等[16]的方法,并作适当修改。将样品稀释30 倍,过0.45 μm水系滤膜后置于电子舌专用烧杯中待测;检测器由7 根具有特异选择性的传感器(ZZ、BA、CA、HA、GA、BB、JB)组成,通过电压值信号对不同样品的差异进行判别。
1.3.3.3 GC-IMS分析
参考王辉等[17]的方法,并作适当修改。
样品处理:取FBF 1 mL,置于20 mL顶空瓶中,每个样品取2 份平行样,放入仪器样品盘上进行自动进样分析。
自动进样条件:孵育时间20 min,温度60 ℃,孵化转速500 r/min,进样针温度85 ℃,进样体积500 μL,进样方式为顶空进样,不分流。
GC条件:FS-SE-54-CB-1石英毛细管柱(15 m×0.53 mm,1 μm),色谱柱温度60 ℃,载气为N2(纯度≥99.999%)。载气流速:初始2 mL/min,保持2 min后,8 min内线性上升至15 mL/min,10 min内线性上升至80 mL/min,5 min内线性上升至130 mL/min,总运行时间25 min。
IMS条件:IMS温度45 ℃,漂移气为N2(纯度≥99.999%),迁移气流速为恒速150 mL/min,迁移管长度98 mm,管内线性电压500 V/cm;放射源:β射线(氚,3H);离子化模式:正离子。
1.3.3.4 GC-MS分析
固相微萃取条件:75 μm碳分子筛/聚二甲基硅氧烷萃取头,萃取时间40 min,萃取温度60 ℃。
GC条件:VF-5ms柱(30 m×0.25 mm,0.25 μm);柱温:初始温度40 ℃,保持4 min后以5 ℃/min升至终温240 ℃并保持5 min;进样口温度250 ℃;分流比5;柱流速1.0 mL/min;载气He(纯度99.999%)。
MS条件:扫描范围:采集质量范围50~1 000(m/z);传输温度280 ℃;离子阱温度220 ℃。
1.4 数据处理
使用Excel 2016软件进行数据处理,用Sigma plot 10.0软件绘图;用Statistix 8.1软件中的Tukey HSD进行显著性检验(P<0.05),用Gallery Plot插件进行指纹图谱对比;采用Alphasoft V 12.46软件进行电子鼻数据处理。
2 结果与分析
2.1 FBF的电子鼻分析结果
不同处理组之间相对距离越远,说明彼此气味差异越大。由表1可知:CK组和各发酵组FBF均能很好地分开,说明发酵处理使得CK组和发酵组气味差异较大;发酵时间相同时,THM-17、WBL-45、VHI-41、LS 4组间均有不同程度的分散,其中,THM-17、WBL-45组相对距离较近,VHI-41、LS组在所有处理组中的分散程度较大,由此说明,发酵剂种类对FBF产物的挥发性气味影响较大;当发酵剂种类相同、发酵时间不同时,LS-12、LS-16组间的差异最大,相对距离为45 863.94;随着发酵时间的延长,采用不同发酵剂制得的FBF气味差异增大。综合来看,VHI-41组FBF与其他发酵组差异较大,发酵时间对LS组风味影响更大。
表 1 不同处理组FBF气味差异的相对距离
Table 1 Relative distance of flavor differences between treatment groups
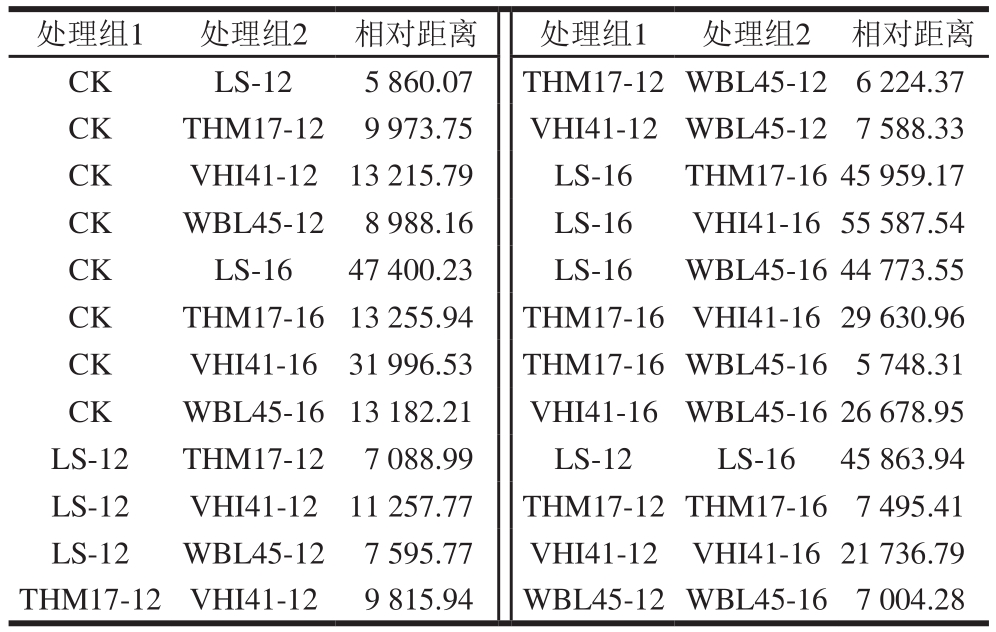
处理组1 处理组2 相对距离 处理组1 处理组2 相对距离CK LS-12 5 860.07 THM17-12WBL45-126 224.37 CK THM17-12 9 973.75 VHI41-12WBL45-127 588.33 CK VHI41-12 13 215.79 LS-16 THM17-1645 959.17 CK WBL45-12 8 988.16 LS-16 VHI41-1655 587.54 CK LS-16 47 400.23 LS-16 WBL45-1644 773.55 CK THM17-1613 255.94 THM17-16VHI41-1629 630.96 CK VHI41-16 31 996.53 THM17-16WBL45-165 748.31 CK WBL45-1613 182.21 VHI41-16WBL45-1626 678.95 LS-12 THM17-12 7 088.99 LS-12 LS-16 45 863.94 LS-12 VHI41-12 11 257.77 THM17-12THM17-167 495.41 LS-12 WBL45-12 7 595.77 VHI41-12 VHI41-1621 736.79 THM17-12VHI41-12 9 815.94 WBL45-12WBL45-167 004.28
2.2 FBF的电子舌分析结果
表 2 不同处理组FBF滋味差异的相对距离
Table 2 Relative distance of taste differences between treatment groups
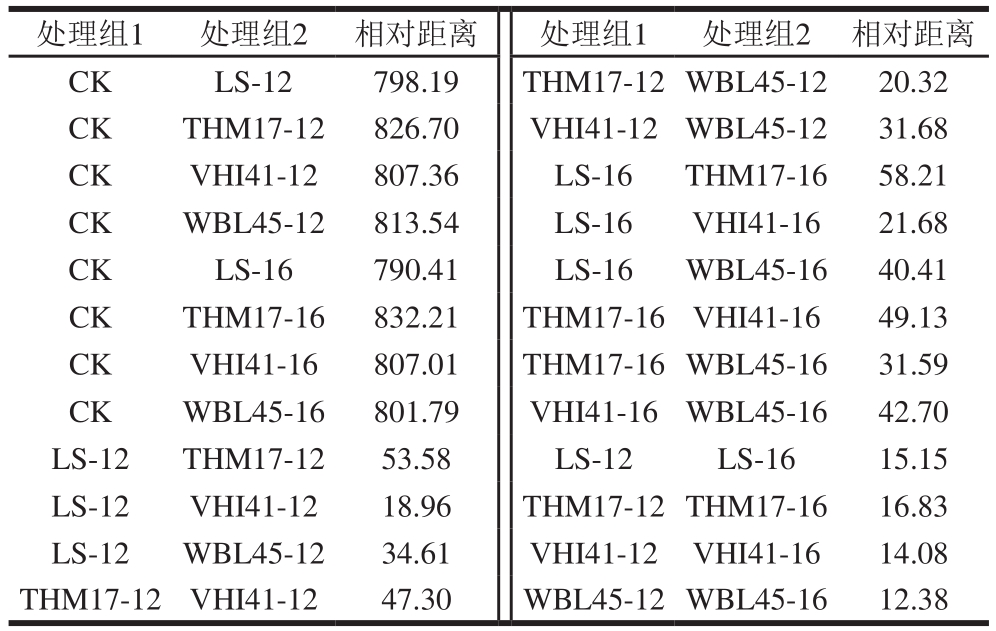
处理组1 处理组2 相对距离 处理组1 处理组2 相对距离CK LS-12 798.19 THM17-12WBL45-12 20.32 CK THM17-12 826.70 VHI41-12WBL45-12 31.68 CK VHI41-12 807.36 LS-16 THM17-16 58.21 CK WBL45-12 813.54 LS-16 VHI41-16 21.68 CK LS-16 790.41 LS-16 WBL45-16 40.41 CK THM17-16 832.21 THM17-16VHI41-16 49.13 CK VHI41-16 807.01 THM17-16WBL45-16 31.59 CK WBL45-16 801.79 VHI41-16WBL45-16 42.70 LS-12 THM17-12 53.58 LS-12 LS-16 15.15 LS-12 VHI41-12 18.96 THM17-12THM17-16 16.83 LS-12 WBL45-12 34.61 VHI41-12 VHI41-16 14.08 THM17-12VHI41-12 47.30 WBL45-12WBL45-16 12.38
由表2可知:CK组与各发酵组FBF之间的相对距离较大,说明发酵对FBF的滋味影响较大;发酵时间相同时,不同发酵剂组FBF滋味的相对距离存在差异,说明发酵剂种类会影响FBF的最终滋味,其中,THM-17和WBL-45组、VHI-41和LS组之间的差异相对较小;发酵时间同样会对FBF的非挥发性成分造成影响,且发酵时间会加大不同发酵剂组之间的差异。
2.3 FBF的GC-IMS分析结果
GC-IMS能够明确引起不同处理组风味差异的化合物,适合小分子物质的检测。GC-IMS分析结果表明,FBF发酵剂相同时,发酵12 h和16 h的风味差异较小;FBF发酵时间相同时,THM-17、WBL-45组风味较相似,LS、VHI-41组风味较特殊。GC-IMS分析除进一步验证了电子鼻、电子舌的测定结果外,还可以明确引起不同处理组间差异的小分子物质:与CK组相比,发酵处理使呋喃酮、2-甲基丁酸、3-甲基丁酸、戊醛等组分含量升高,壬醛、正辛醛、2-戊酮、2-壬酮、3-戊酮、2-正戊基呋喃等组分含量降低,CK组和发酵组FBF的总体风味存在较大差异;经LS发酵后,3-辛酮、正己醇、3-辛醇、正辛醇等物质含量明显变大,LS组FBF风味独特。
2.4 FBF的GC-MS分析结果
结合计算机质谱数据库检索,采用峰面积归一化法测得各挥发性组分的相对含量[18]。各处理组鉴定出的挥发性化合物占FBF中挥发性化合物总量的比例均达到99%以上,说明各处理组挥发性化合物均被得到较好地分离、鉴定。
表 3 不同处理组FBF的挥发性风味物质分析
Table 3 Analysis of volatile flavor compounds in FBF made with different starter cultures
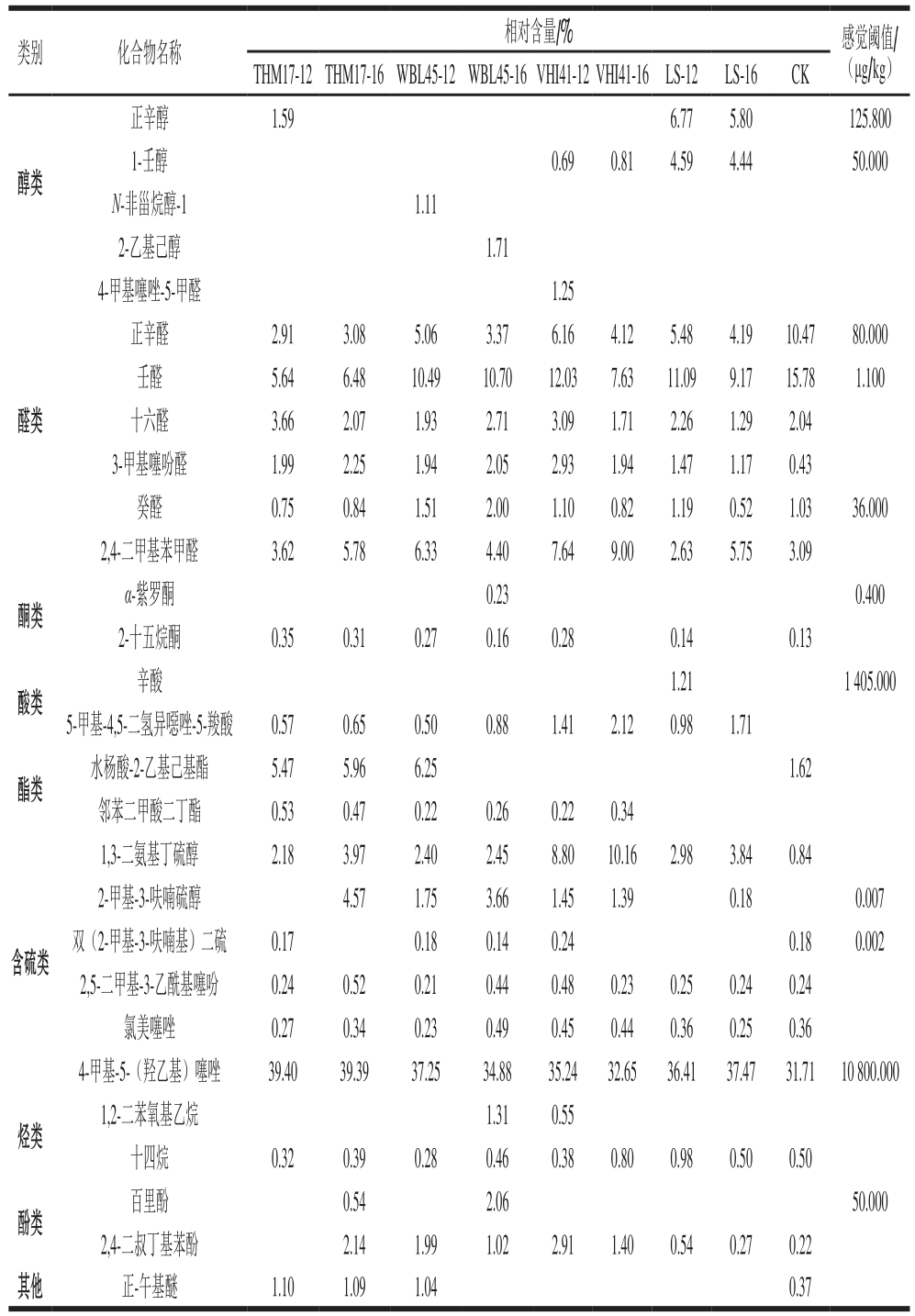
类别 化合物名称相对含量/% 感觉阈值/(μg/kg)THM17-12THM17-16WBL45-12WBL45-16VHI41-12VHI41-16LS-12 LS-16 CK醇类正辛醇 1.59 6.77 5.80 125.800 1-壬醇 0.69 0.81 4.59 4.44 50.000 N-非甾烷醇-1 1.11 2-乙基己醇 1.71醛类4-甲基噻唑-5-甲醛 1.25正辛醛 2.91 3.08 5.06 3.37 6.16 4.12 5.48 4.19 10.47 80.000壬醛 5.64 6.48 10.49 10.70 12.03 7.63 11.09 9.17 15.78 1.100十六醛 3.66 2.07 1.93 2.71 3.09 1.71 2.26 1.29 2.04 3-甲基噻吩醛 1.99 2.25 1.94 2.05 2.93 1.94 1.47 1.17 0.43癸醛 0.75 0.84 1.51 2.00 1.10 0.82 1.19 0.52 1.03 36.000 2,4-二甲基苯甲醛 3.62 5.78 6.33 4.40 7.64 9.00 2.63 5.75 3.09酮类α-紫罗酮 0.23 0.400 2-十五烷酮 0.35 0.31 0.27 0.16 0.28 0.14 0.13 1.21 1 405.000 5-甲基-4,5-二氢异噁唑-5-羧酸 0.57 0.65 0.50 0.88 1.41 2.12 0.98 1.71辛酸酸类酯类水杨酸-2-乙基己基酯 5.47 5.96 6.25 1.62邻苯二甲酸二丁酯 0.53 0.47 0.22 0.26 0.22 0.34含硫类1,3-二氨基丁硫醇 2.18 3.97 2.40 2.45 8.80 10.16 2.98 3.84 0.84 2-甲基-3-呋喃硫醇 4.57 1.75 3.66 1.45 1.39 0.18 0.007双(2-甲基-3-呋喃基)二硫 0.17 0.18 0.14 0.24 0.18 0.002 2,5-二甲基-3-乙酰基噻吩 0.24 0.52 0.21 0.44 0.48 0.23 0.25 0.24 0.24氯美噻唑 0.27 0.34 0.23 0.49 0.45 0.44 0.36 0.25 0.36 4-甲基-5-(羟乙基)噻唑 39.40 39.39 37.25 34.88 35.24 32.65 36.41 37.47 31.71 10 800.000烃类1,2-二苯氧基乙烷 1.31 0.55十四烷 0.32 0.39 0.28 0.46 0.38 0.80 0.98 0.50 0.50百里酚 0.54 2.06 50.000 2,4-二叔丁基苯酚 2.14 1.99 1.02 2.91 1.40 0.54 0.27 0.22其他 正-午基醚 1.10 1.09 1.04 0.37酚类
由表3可知:各处理组FBF挥发性化合物中含硫化合物占较大比例,其次是醛类、醇类、烃类、酯类、酸类、酮类、酚类及其他。根据食品风味研究的一般方法可以确定,含硫化合物是FBF中的关键风味化合物。
9 组样品中共有9 种主要风味化合物(相对含量>1%)(正辛醛、壬醛、十六醛、3-甲基噻吩醛、癸醛、2,4-二甲基苯甲醛、1,3-二氨基丁硫醇、4-甲基-5-(羟乙基)噻唑和2,4-二叔丁基苯酚),其中包含6 种醛类物质、2 种含硫化合物、1 种酚类物质,进一步表明醛类化合物和含硫化合物是FBF中重要的挥发性风味物质。
2.4.1 含硫化合物
在牛肉香味构成中,含硫化合物是肉味香精中基本肉香味的主要来源。FBF中共检测出6 种含硫化合物,共有的含硫化合物中,4-甲基-5-(羟乙基)噻唑相对含量达30%以上,其呈味特征为肉香、烤香、坚果香[1]、强烈乳香[19],但因其感觉阈值较高,对FBF风味影响较小;1,3-二氨基丁硫醇在CK组和发酵组中的相对含量差异较大,与CK组相比,发酵组FBF中1,3-二氨基丁硫醇相对含量增加,其中,VHI-41组相对含量与其他发酵处理组差异较大,说明1,3-二氨基丁硫醇可能是造成不同处理组FBF之间风味差异的化合物之一。2-甲基-3-呋喃硫醇和双(2-甲基-3-呋喃基)二硫是目前国内外公认的关键风味化合物[20-21],主要由含硫化合物提供。结合感觉阈值判断,2-甲基-3-呋喃硫醇和双(2-甲基-3-呋喃基)二硫可能是引起9 组样品风味差异的主要物质。2-甲基-3-呋喃硫醇的呈味特征为肉香、烤香、烤鸡肉香,在肉味香精中常被用作头香和体香;双(2-甲基-3-呋喃基)二硫的呈味特征为饱满的肉香、炖肉香,在肉味香精中常被用作体香。
2.4.2 醛类化合物
醛类化合物由美拉德反应过程中脂肪酸降解产生[22],醛类物质可以使肉味香料的风味更加圆润、有层次感[23],为整体风味提供脂香[24]。正辛醛、壬醛、十六醛、3-甲基噻吩醛、癸醛和2,4-二甲基苯甲醛是9 组FBF中共有且相对含量较高(>1%)的醛类化合物。其中,壬醛有水果香、柑橘香[25]。壬醛在醛类化合物中相对含量最高且阈值较低,CK组壬醛相对含量最高(15.78%),各发酵组壬醛相对含量差异较大,随着发酵时间从12 h延长至16 h,WBL-45组壬醛相对含量相对稳定,THM-17组壬醛相对含量较低,但呈上升趋势,另外2 个发酵组壬醛相对含量呈下降趋势。4-甲基噻唑-5-甲醛为VHI41-12组特有,其相对含量为1.25%。研究表明,低级醛类(C4以下)有刺激性,中级醛类(C5~C12)呈花果香味[26]。
2.4.3 醇类化合物
饱和醇类对食品总体风味起协同作用,不饱和醇类对食品风味贡献较大[27]。CK组FBF中醇类化合物种类较少,且在总挥发性化合物中所占比例较小。经发酵处理后FBF中醇类物质种类及相对含量均增加。正辛醇存在于THM-17组和LS组中,相对含量较高,能带来柑橘清香[28],但因其阈值较高,故对风味影响贡献较小。1-壬醇(玫瑰香、橙子香,并伴有油脂气息)[29]在LS组中相对含量较高,其他发酵组未检出或相对含量较小(<1%),因此认为,1-壬醇是LS组FBF的重要风味物质。此外,N-非甾烷醇-1可能是WBL45-12组中起贡献作用的风味物质,2-乙基己醇则对WBL45-16组FBF的风味起重要作用。
2.4.4 烃类、酯类、酸类、酮类、酚类及其他化合物
烃类化合物阈值一般较高,香气较弱或无香气,对风味的直接贡献作用较小。但烃类化合物是形成对肉风味有贡献作用的杂环化合物的重要中间体,对风味形成有重要的基底作用[18]。经VHI-41发酵16 h制成的FBF中烃类化合物种类和相对含量明显增加;WBL-45发酵16 h制成的FBF中,1,2-二苯氧基乙烷相对含量较高,达1.31%。
酯类化合物多具有特殊气味,能起到调味作用,从而赋予食品水果清香、花香及蜂蜜的味道[30]。邻苯二甲酸二异丁酯(马铃薯泥特征香气)[31]和水杨酸-2-乙基己基酯可能是引起不同处理组FBF风味差异的主要酯类化合物。
酸类化合物主要存在于发酵组FBF中,CK组检测出的酸类物质种类较少,且相对含量较低。5-甲基-4,5-二氢异噁唑-5-羧酸是8 组发酵处理组FBF共有的主要酸类化合物,其在VHI-41组和LS组中相对含量较高(>1%)。辛酸(清香、微弱的水果酸香气、淡酸味)[32]为LS-12组FBF特有的酸类化合物,但因其感觉阈值很高,对风味影响可能起协同作用。
酮类化合物香味持久,且具有特殊清香,但因其感觉阈值较高,对气味的贡献相对较小[18]。随着发酵时间从12 h延长至16 h,不同发酵组FBF中的酮类化合物种类及相对含量均有所降低,如WBL-45组发酵12 h和16 h时,2-十五烷酮的相对含量由0.27%降至0.16%。由此判断,酮类化合物是对CK组与发酵组FBF风味差异有贡献的化合物。
正-午基醚在THM17-12、THM17-16、WBL45-12组FBF中的相对含量分别为1.10%、1.09%、1.04%,CK组相对含量为0.37%,结合电子鼻结果分析,CK组、THM-17组、WBL-45组间相对距离较近,正-午基醚可能也是起贡献作用的化合物。
3 讨 论
美拉德反应主要产生含硫化合物,醛类化合物则是脂肪酸降解的主要产物。结合本研究所用发酵剂的组成分析,清酒乳杆菌、戊糖片球菌及植物乳杆菌在代谢过程中能产生大量乳酸,在肉制品应用中主要起抑菌作用[14];木糖葡萄球菌、肉葡萄球菌能够通过分解蛋白质和脂肪[33],延缓脂肪氧化源风味物质的生成速率[34],促进肉制品风味的形成。根据4 种发酵剂的组成可知,FBF的风味主要由美拉德反应产生,发酵剂中肉葡萄球菌和木糖葡萄球菌的存在可以延缓脂肪氧化,从而影响醛类物质的形成,LS组发酵剂为单株的清酒乳杆菌,其他3 种发酵剂均含葡萄球菌属,因此LS组FBF的关键风味化合物组成与其他处理组存在差异。VHI-41-12组FBF风味与其他处理组差异较大,且最被接受,构成该组FBF总体风味的关键化合物有3 种,其中,2-甲基-3-呋喃硫醇是贡献最大的物质,双(2-甲基-3-呋喃基)二硫、壬醛等化合物对该组FBF风味的贡献也比其他发酵组高。关键化合物种类多且风味贡献较大是VHI-41-12组FBF风味独特、更受欢迎的原因。
2-甲基-3-呋喃硫醇作为最关键的风味物质,生成后易氧化降解为二硫醚类化合物[35]。分别对比各发酵组FBF发酵12 h和16 h的关键风味化合物差异,结果表明,发酵12 h时的关键风味化合物有2-甲基-3-呋喃硫醇、双(2-甲基-3-呋喃基)二硫及壬醛;发酵16 h的关键风味化合物为2-甲基-3-呋喃硫醇及壬醛,由此可知,FBF的风味主要通过美拉德反应生成的含硫化合物提供,发酵过程通过影响和控制2-甲基-3-呋喃硫醇的氧化降解对FBF的最终风味产生影响,不同发酵剂因组成不同,对该关键风味化合物的影响存在差异。
4 结 论
针对发酵剂种类和发酵时间对FBF风味的影响展开研究。结果表明:发酵时间可以影响FBF中风味化合物的生成量,对FBF风味和滋味差异影响较小;发酵剂种类能够影响FBF中风味化合物的种类,对风味和滋味影响较大;THM-17、WBL-45组FBF风味较相似,LS、VHI-41组FBF风味特殊;通过对关键风味化合物进行分析发现,2-甲基-3-呋喃硫醇、双(2-甲基-3-呋喃基)二硫和壬醛是形成FBF香气的主体风味物质,2-甲基-3-呋喃硫醇和双(2-甲基-3-呋喃基)二硫2 种组分在处理组中的相对含量差异是引起FBF风味差异的主要原因。
参考文献:
[1] 孙宝国, 陈海涛. 食用调香术[M]. 3版. 北京: 化学工业出版社,2015: 4-7.
[2] 李迎楠, 刘文营, 成晓瑜. GC-MS结合电子鼻分析温度对肉味香精风味品质的影响[J]. 食品科学, 2016, 37(14): 104-109. DOI:10.7506/spkx1002-6630-201614018.
[3] 牛云蔚. 肉味香精的制备及其性能研究[D]. 上海: 上海海洋大学,2009: 12-35.
[4] 樊晓盼, 马俪珍, 张伯男, 等. 微生物发酵对牛肉调味基料的增香作用[J]. 食品工业科技, 2018, 39(7): 64-69. DOI:10.13386/j.issn1002-0306.2018.07.014.
[5] 潘晓倩, 成晓瑜, 张顺亮, 等. 乳酸菌发酵剂对风干肠风味品质的影响[J]. 肉类研究, 2017, 31(12): 50-55. DOI:10.7506/rlyj1001-8123-201712009.
[6] RUIZMOYANO S, MARTIN A, BENITO M J, et al. Application of Lactobacillus fermentum HL57 and Pediococcus acidilactici SP979 as potential probiotics in the manufacture of traditional Iberian dryfermented sausages[J]. Food Microbiology, 2011, 28(5): 839-847.DOI:10.1016/j.fm.2011.01.006.
[7] SIDIRA M, KANDYLIS P, KANELLAKI M, et al. Effect of immobilized Lactobacillus casei on the evolution of flavor compounds in probiotic dry-fermented sausages during ripening[J]. Meat Science,2015, 100: 41-51. DOI:10.1016/j.meatsci.2014.09.011.
[8] CHEN Qian, LIU Qian, SUN Qinxiu, et al. Flavour formation from hydrolysis of pork sarcoplasmic protein extract by a unique LAB culture isolated from Harbin dry sausage[J]. Meat Science, 2015, 100:110-117. DOI:10.1016/j.meatsci.2014.10.001.
[9] 孔保华, 夏让, 夏秀芳, 等. 直投式发酵剂制备的哈尔滨风干肠在成熟过程中的理化及微生物特性变化[J]. 食品工业科技, 2012, 33(8):168-171; 175. DOI:10.13386/j.issn1002-0306.2012.08.063.
[10] HONG J H, JUNG D W, KIM Y S, et al. Impacts of glutathione Maillard reaction products on sensory characteristics and consumer acceptability of beef soup[J]. Journal of Food Science, 2010, 75(8):427-434. DOI:10.1111/j.1750-3841.2010.01783.x.
[11] 李松耀, 郝学财, 邢海鹏, 等. 利用微生物发酵生产牛肉香精[J]. 中国调味品, 2008, 33(12): 84-87. DOI:10.3969/j.issn.1000-9973.2008.12.019.
[12] 魏欣, 徐仲伟, 宁正祥. 发酵型肉味香精的研制[J]. 食品工业科技,2007(1): 62-66. DOI:10.3969/j.issn.1000-9973.2007.01.012.
[13] 李平. 毛霉发酵大豆蛋白制备肉味香精的研究[D]. 天津: 天津科技大学, 2013: 56-60.
[14] 白菊红. 乳酸菌发酵牦牛肉灌肠过程中主要物质变化规律的研究[D]. 成都: 西南民族大学, 2017: 19-22.
[15] 张鑫, 相里加雄, 路星. Heracles Ⅱ超快速气相色谱电子鼻对白酒气味成分分析技术探讨[J]. 酿酒科技, 2014(10): 116-119.DOI:10.13746/j.njkj.2014.0238.
[16] 李阳, 陈芹芹, 胡雪芳, 等. 电子舌技术在啤酒口感评价中的应用[J].食品研究与开发, 2008, 29(11): 122-127. DOI:10.3969/j.issn.1005-6521.2008.11.035.
[17] 王辉, 田寒友, 李文采, 等. 基于顶空气相色谱-离子迁移谱技术的冷冻猪肉贮藏时间快速判别方法[J]. 食品科学, 2019, 40(2): 269-274.DOI:10.7506/spkx1002-6630-20180531-443.
[18] 黄玉坤, 田红媚, 陈芳, 等. 三种香型食用牛油的挥发性风味物质分析及鉴定[J]. 食品与发酵工业, 2019, 45(3): 196-205. DOI:10.13995/j.cnki.11-1802/ts.017118.
[19] 何磊, 周敏, 郭燏. 4-甲基-5-(β-羟乙基)-噻唑的合成工艺改进[J].山东化工, 2015, 44(11): 15-17. DOI:10.3969/j.issn.1008-021X.2015.11.006.
[20] BOLTON T A. Role of cysteine in the formation of 2-methyl-3-furanthiol in a thiamine-cysteine model system[J]. ACS National Meeting Book of Abstracts, 2016, 204: 270-278. DOI:10.1021/bk-1994-0543.ch022.
[21] XIAO Zuobing, WU Minling, NIU Yunwei, et al. Contribution of chicken base addition to aroma characteristics of Maillard reaction products based on gas chromatography-mass spectrometry, electronic nose, and statistical analysis[J]. Food Science and Biotechnology,2015, 24(2): 411-419. DOI:10.1007/s10068-015-0054-7.
[22] BREWER M S. Irradiation effects on meat flavor: a review[J]. Meat Science, 2009, 81(1): 1-14. DOI:10.1016/j.meatsci.2008.07.011.
[23] 孙红梅, 李侠, 张春晖, 等. 鸡骨素及其酶解液的美拉德反应产物挥发性风味成分比较分析[J]. 分析测试学报, 2013, 32(6): 661-667.DOI:10.3969/j.issn.1004-4957.2013.06.002.
[24] 吕玉. 美拉德反应模型体系的研究及牛肉香精的制备[D]. 北京: 北京工商大学, 2010: 40-41.
[25] 罗玉龙, 靳志敏, 刘夏炜, 等. 肉制品中香味物质形成原因研究进展[J]. 食品与发酵工业, 2015, 41(2): 254-258. DOI:10.13995/j.cnki.11-1802/ts.201502045.
[26] 陈红霞. 伊拉兔生长过程中挥发性风味物质的变化及其定量研究[D]. 重庆: 西南大学, 2014: 8-10.
[27] 田怀香, 王璋, 许时婴. 金华火腿挥发性风味物质[J]. 无锡轻工大学学报(食品与生物技术), 2005(1): 69-73; 83. DOI:10.3321/j.issn:1673-1689.2005.01.016.
[28] 蔺佳良, 繆芳芳, 蔡江佳, 等. 中华绒螯蟹不同部位挥发性物质的研究[J]. 核农学报, 2014, 28(2): 259-269. DOI:10.11869/j.issn.100-8551.2014.02.0259.
[29] 温莉娟, 马君义, 曹晖, 等. 宰后不同冷藏时间对牛胃肌肉风味特征的影响[J]. 食品与发酵工业, 2018, 44(6): 216-225. DOI:10.13995/j.cnki.11-1802/ts.015391.
[30] KHAIRY H L, SAADOON A F, ZZAMAN W, et al. Identification of flavor compounds in rambutan seed fat and its mixture with cocoa butter determined by SPME-GC-MS[J]. Journal of King Saud University-Science, 2018, 30(3): 316-323. DOI:10.1016/j.jksus.2017.03.001.
[31] 刘爽, 潘洪冬, 赵思明. 酥脆薯条的加工工艺与风味特征研究[J].食品工业科技, 2017, 38(14): 196-202. DOI:10.13386/j.issn1002-0306.2017.14.039.
[32] 牛婕, 甘伯中, 乔海军, 等. 牦牛乳软质干酪成熟期挥发性风味成分分析[J]. 食品科学, 2010, 31(18): 278-282. DOI:10.7506/spkx1002-6630-201018065.
[33] ESSID I, HASSOUNA M. Effect of inoculation of selected Staphylococcus xylosus and Lactobacillus plantarum strains on biochemical, microbiological and textural characteristics of a Tunisian dry fermented sausage[J]. Food Control, 2013, 32(2): 707-714.DOI:10.1016/j.foodcont.2013.02.003.
[34] 周慧敏, 张顺亮, 赵冰, 等. 木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J]. 食品科学, 2018, 39(22): 32-38. DOI:10.7506/spkx1002-6630-201822006.
[35] 田红玉, 孙宝国, 刘玉平, 等. 热反应香精中关键香成分硫醇类化合物的稳定性[J]. 食品科学, 2004, 25(10): 33-36. DOI:10.3321/j.issn:1002-6630.2004.10.002.
Effects of Fermentation Time and Starter Cultures on Flavor of Beef Flavorings
WU Chenyan, MA Lizhen*, ZHOU Wei, XIONG Fengjiao, QIU Hongbo
(College of Food Science and Biotechnology, Tianjin Agricultural University, Tianjin 300384, China)
Abstract: The effects of different starter cultures and fermentation times on the flavor of fermented beef flavorings (FBF)were studied. FBF were Maillard reaction products derived from an enzymatic hydolysate of bovine bones fermented for 12 or 16 h with THM-17 (Staphylococcus xylosus + Pediococcus pentosaceus), WBL-45 (Staphylococcus xylosus +Staphylococcus carnosus + Lactobacillus sakei), VHI-41 (Staphylococcus xylosus + Pediococcus pentosaceus +Lactobacillus plantarum) or Lactobacillus sakei (LS). The flavor characteristics and volatile components of FBF were analyzed by gas chromatography-ion mobility spectrometry, gas chromatography-mass spectrometry, an electronic tongue and an electronic nose. The results showed that there were significant differences in flavor and taste between FBF and the unfermented control. FBF prepared with LS or VHI-41 had distinctive flavors. Sulfur-containing compounds and aldehydes were the key flavor compounds in FBF. Alcohols and ketones played an important role in modifying the overall flavor of FBF. The flavor difference among the nine groups may be ascribed to the relative contents of 2-methyl-3-furanethiol and bis (2-methyl-3-furyl) disulfide and nonanal.
Keywords: fermented beef flavorings; fermentation time; starter culture; volatile flavor substances
收稿日期:2019-08-15
基金项目:“十三五”国家重点研发计划重点专项(2018YFD0401200)
第一作者简介:吴晨燕(1994—)(ORCID: 0000-0002-1376-139X),女,硕士研究生,研究方向为肉制品加工及质量控制。E-mail: wcy13512857969@163.com
*通信作者简介:马俪珍(1963—)(ORCID: 0000-0003-2744-7171),女,教授,博士,研究方向为肉品科学与技术。E-mail: malizhen-6329@163.com
DOI:10.7506/rlyj1001-8123-20190815-182
中图分类号:TS251.9
文献标志码:A
文章编号:1001-8123(2019)09-0042-06
引文格式:
吴晨燕, 马俪珍, 周伟, 等. 发酵时间和发酵剂种类对牛肉调味料风味的影响[J]. 肉类研究, 2019, 33(9): 42-47.DOI:10.7506/rlyj1001-8123-20190815-182. http://www.rlyj.net.cn
WU Chenyan, MA Lizhen, ZHOU Wei, et al. Effects of fermentation time and starter cultures on flavor of beef flavorings[J].Meat Research, 2019, 33(9): 42-47. DOI:10.7506/rlyj1001-8123-20190815-182. http://www.rlyj.net.cn


