颜色是评价肉品质量的重要指标之一,对消费者和零售商也有重要参考意义[1]。肉品在加工、贮藏过程中会发生一系列的物理化学变化,从而产生发色、变色、褪色等现象[2]。尤其是在预煮肉制品中容易出现彩虹色斑,体现反光质感,一般认为彩虹色斑是以绿色和红色为主的混合色[3-4]。已有研究表明,彩虹色斑主要出现在完整肌肉表面,猪肉制品中彩虹色斑的比例低于牛肉及其制品[4-6]。不同部位肌肉之间所产生的彩虹色斑也有差异,其中半腱肌中的发生率较高也较明显[3,7]。吉艳峰[7]研究表明,肉制品加工过程中的一些添加物会破坏肌肉的正常结构,使肌原纤维排列结构发生改变,从而对彩虹色斑的强度和面积造成影响。Kukowski[8]研究表明,彩虹色斑的强度和面积与动物的年龄、宰后pH值、肌肉的色泽及眼肌面积有关。
氧化是导致肉类品质下降的重要原因之一,蛋白质氧化造成蛋白质营养损失、结构变化及功能性下降。氧化后蛋白质的交联和聚集反应会影响肌肉的光反射特性和黄度值(b*),进而影响色泽。同时,蛋白质氧化导致保水性下降,使肌肉内部水分向外部迁移,影响肌肉的光反射特性、颜色及光泽[2]。煮制温度差异会影响肌肉中不同形态铁元素的含量。在煮制温度60 ℃条件下,血红素铁含量从65%降低到22%,当温度继续升高到85 ℃时,血红素铁含量无明显变化,而非血红素铁含量显著上升[9]。肌红蛋白氧化生成的血红素铁与脂质氢过氧化物反应不仅能够促进脂质氧化,而且也会破坏血红素铁的卟啉环结构,最终生成非血红素铁[10]。外源添加肌红蛋白与非血红素铁会促进牛肉、猪肉和鸡肉的脂质氧化,使肌红蛋白的促氧化能力比非血红素铁更强,表现出更高的脂质氧化水平[11]。
Berry[12]、Seyfert[13]等研究表明,增加脂肪含量、升高加热处理温度以及延长加热时间会降低牛肉馅饼的红度值(a*),牛肉馅饼的厚度与加热温度的增加速率也会影响牛肉馅饼蒸煮后的颜色。蒸煮制温度会影响肉制品的颜色,当亮度值(L*)变化不大时,a*则会显著降低,b*会升高[14]。Utrera等[15]研究发现,蛋白质与脂质有交互作用,牛肉馅饼的脂肪含量越高,其蛋白质氧化越剧烈,同时在牛肉冷冻贮藏过程中,脂质氧化和蛋白质氧化会发生交互作用。Soyer等[16]的研究也得到同样的结论,鸡肉低温贮藏过程中,脂质氧化和蛋白质氧化会同时发生并相互影响。
随着肉类安全意识的提高,越来越多的消费者更加关注肉品安全[17]。当预煮肉制品加工、贮藏期间出现彩虹色斑时,会引起消费者的恐慌而拒绝购买,这是限制预煮肉制品发展的一个突出问题。本研究以牛半腱肌为实验材料,在水浴加热及不同冷藏时间条件下,研究肌肉彩虹色斑强度、非血红素铁含量、蛋白质与脂质氧化、色泽等指标的变化,探讨水浴加热对牛半腱肌冷藏形成彩虹色斑的影响,旨在为相关研究提供参考。
新鲜牛肉半腱肌,购于新疆乌鲁木齐市新北园春农贸市场。
三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethane,Tris)、马来酸、焦磷酸钠、氯化钾、氯化镁、二硝基苯腙、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、乙醇、盐酸胍、三氯甲烷、乙酸乙酯、磷酸二氢钠、磷酸氢二钠、尿素、甘氨酸(glycine,Gly)、邻甲苯甲醛-2,4-二硝基苯肼(2,4-dinitrophenylhydrazone,DNPH)、5,5'-二硫代双-(2-硝基苯甲酸)(5,5'-dithiobis-(2-nitrobenzoic acid),DTNB)、三氯乙酸(trichloroacetic acid,TCA)、硫代巴比妥酸(thiobarbituric acid,TBA)、柠檬酸、抗坏血酸、乙酸铵(均为分析纯) 国药集团化学试剂(上海)有限公司;牛血清蛋白、啡啰嗪试剂(均为分析纯) 美国Sigam-Aldrich公司。
JZ-350便携式色差仪 苏州艾森仪器设备有限公司;FSH-2匀浆机 江苏金坛宏华仪器厂;HT-9815热电偶数字显示温度计 东莞市鑫泰仪表有限公司;SF-GL-16A高速冷冻离心机 上海菲恰尔分析仪器有限公司;UV-1800紫外-可见分光光度计 上海菁华科技仪器有限公司;JA2003电子天平 上海浦春计量仪器有限公司;HH-S4数显电热恒温水浴锅 上海博迅实业有限公司;KQ-250DE数控超声波清洗器 昆山市超声仪器有限公司;PHS-3C pH仪 上海大谱仪器有限公司。
1.3.1 样品制备
剔除牛半腱肌(约120 g)可见筋膜和脂肪,顺肌纤维方向切成4 cm×4 cm×6 cm的小块,置于500 mL烧杯中,加入300 mL蒸馏水,97 ℃恒温水浴加热;将数字温度计探头插入肉样中,实时监控中心温度,当中心温度分别达到(70±1)、(80±1)、(90±1) ℃时,立即取出肉样冷却至室温,用吸水纸吸干表面水分,切成厚度为1 cm的片状,放入自封袋,4 ℃条件下冷藏0~5 d,用于测定相关指标。
1.3.2 彩虹色斑强度测定
采用吉艳峰[7]的方法,并稍作修改。将水浴处理的肉块横切成肉片,随机组织5 名专业人员进行感官评定,并记录彩虹色斑的强度。在室内光照条件下,将彩虹色斑的颜色从弱到强分为6 个等级,即:0、1、2、3、4、5,分别表示没有、极弱、弱、中等、强及极强。
1.3.3 非血红素铁含量测定
参照李贺[17]的方法,并稍作修改。精确称取5.00 g肉样,切碎研磨并置于50 mL离心管中,加入0.1 mol/L 15 mL柠檬酸缓冲液,用高速匀浆机6 000 r/min匀浆60 s;准确吸取1.5 mL研磨液,加入0.5 mL 2 g/mL抗坏血酸(溶有0.2 mol/L HCI),室温条件下静置15 min;加入1 mL 11.3 g/100 mL TCA,混合均匀,3 000 r/min离心10 min;取上清液2 mL于比色管中,加入0.8 mL质量分数10%的乙酸铵和0.2 mL啡啰嗪试剂,充分混合,静置5 min后在562 nm波长处比色。非血红素铁含量按式(1)计算。
1.3.4 硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARs)值测定
称取5.00 g肉样,置于锥形瓶中,加入50 mL TCA溶液(含0.1 g/100 mL EDTA),在冰水浴中用高速匀浆机3 000 r/min匀浆60 s,振荡1 h,双层滤纸过滤;取5 mL滤液,加入5 mL 0.02 mol/L TBA,在沸水浴中反应50 min;取出用流水冷却,3 000 r/min离心10 min;取5 mL上清液,加入5 mL三氯甲烷并摇匀,静置;取上清液,分别在532 nm、600 nm波长处测定吸光度;空白样为0.02 mol/L TBA[18]。TBARs值按式(2)计算。
式中:m为样品质量/g。
1.3.5 蛋白质羰基含量测定
参考Amenteros[19]的方法。比色法是测定蛋白质羰基含量的典型方法,其原理是当蛋白质发生氧化后羰基含量会增加,羰基会与邻甲苯甲醛-DNPH结合形成2,4-二硝基苯腙,其为红棕色沉淀,再用盐酸胍溶解后在370 nm波长处有一定的吸光度,从而可以测得蛋白质的羰基含量。280 nm波长处测定蛋白质含量,用牛血清蛋白做标准曲线(y=0.089 3x+0.013 5,R2=0.999)计算。蛋白质羰基含量按式(3)计算。
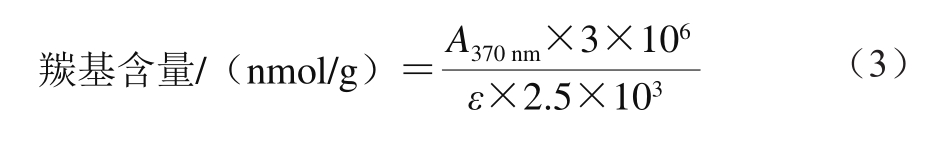
式中:ε为蛋白质的摩尔消光系数,ε=22 000 L/(mol·cm)。
1.3.6 蛋白质游离巯基含量测定
准确称取5.00 g肉样,置于100 mL离心管中,加入45 mL pH 7.4的焦磷酸缓冲液(含2.0 mmol/L焦磷酸钠、10 mmol/L Tris-马来酸、2.0 mmol/L氯化镁、100 mmol/L氯化钾和2.0 mmol/L EDTA),4 000 r/min匀浆60 s;于0.5 mL均质液中加入2.5 mL Tris-Gly缓冲液(含8 mol/L尿素和0.02 mL 4 mg/mL的DTNB),25 ℃水浴30 min,412 nm波长处测定吸光度[20]。蛋白质游离巯基含量按式(4)计算。
式中:ε为蛋白质的摩尔消光系数,ε=13.6 L/(mol·cm)。
1.3.7 色泽测定
采用色差计测定颜色参数L*、a*和b*。色差计以标准白板校正,在自然光照条件下随机选取肉样截面的3 个点进行测定,结果取平均值。
结果表示为平均值±标准差。用SPSS 18.0统计软件进行数据显著性及相关性分析,利用Origin 9.0软件绘图。
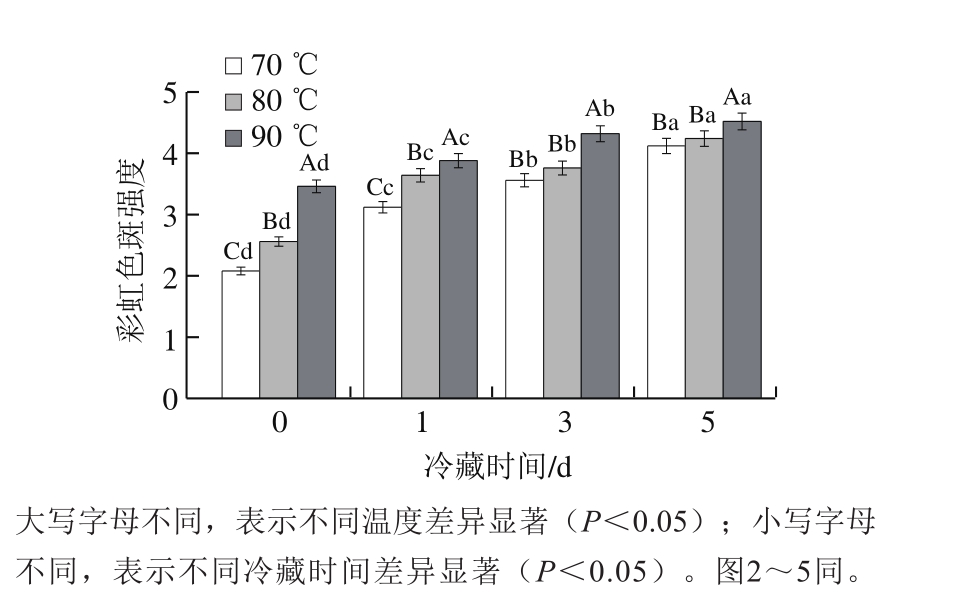
图 1 加热处理温度对牛半腱肌冷藏彩虹色斑强度的影响
Fig. 1 Effect of heating temperature on the strength of rainbow spots in bovine Semitendinosus muscle
由图1可知,随着加热温度的升高,牛半腱肌彩虹色斑强度增强,这与吉艳峰[7]的研究结果一致。在冷藏5 d内,彩虹色斑强度不断增加,终点中心温度为70、80、90 ℃水浴处理牛半腱肌的彩虹色斑强度相比冷藏0 d升高98%、65%、30%,差异显著(P<0.05)。原因可能是鲜肉直接加热过程中,肌红蛋白中的球蛋白部分发生变性,并且细胞膜结构也发生变化,失去防止血红素氧化的作用,从而引起肌红蛋白氧化、肌肉组织结构改变[21-23],产生彩虹色斑。
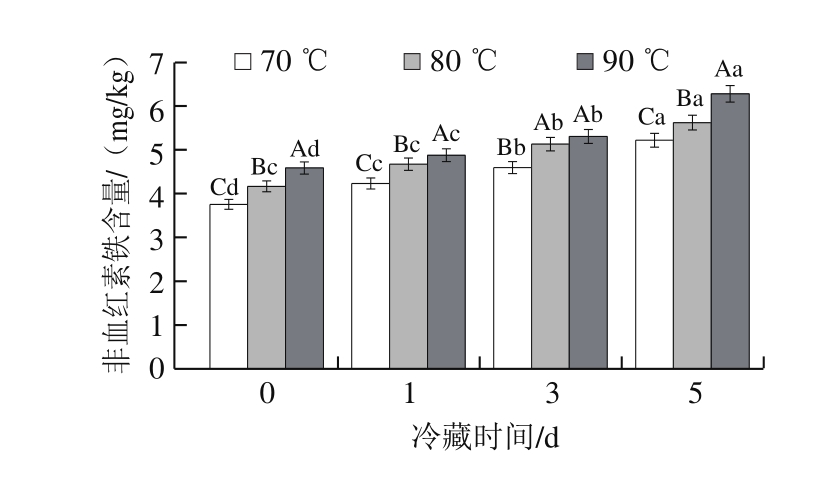
图 2 加热处理温度对牛半腱肌冷藏非血红素铁含量的影响F
ig. 2 Effect of heating temperature on non-heme iron in bovine Semitendinosus muscle
由图2可知,在冷藏0~5 d期间,终点中心温度为70、80、90 ℃水浴处理牛半腱肌的非血红素铁含量分别由3.754、4.165、4.584 mg/kg上升至5.214、5.619、6.278 mg/kg,随着冷藏时间延长,非血红素铁含量增加,这与Dai Yan等[24]的研究结果一致。牛半腱肌经过水浴加热处理,肌肉蛋白发生自动氧化,球蛋白结构被打开并破坏,血红素与球蛋白的结合减弱,不断释放出高铁血红素,高铁血红素继续参与氧化反应,形成非血红素铁,因此随着冷藏时间延长,牛半腱肌非血红素铁含量逐渐增加。
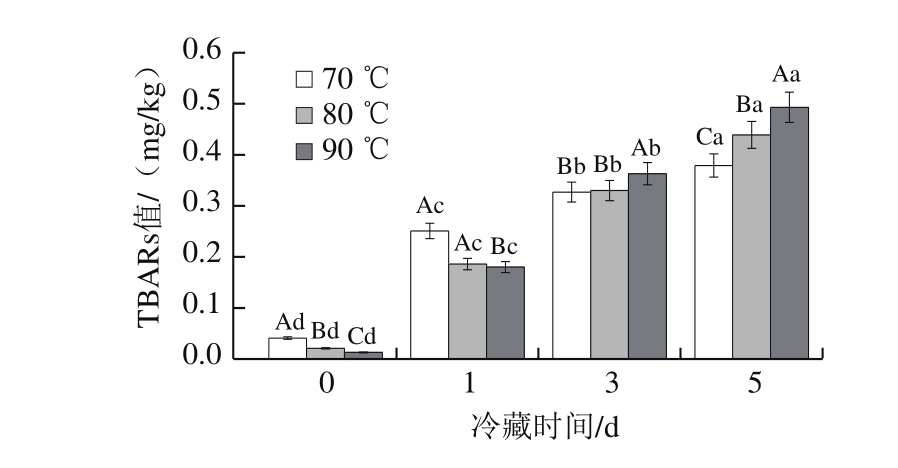
图 3 加热处理温度对牛半腱肌冷藏TBARs值的影响
Fig. 3 Effect of heating temperature on TBARs value of bovine Semitendinosus muscle
由图3可知,在终点中心温度为70、80、90 ℃水浴处理后的牛半腱肌冷藏过程中,随着处理温度的增加和冷藏时间的延长,牛半腱肌的TBARs值不断增加(P<0.05),冷藏期间分别增加9.24、21.50、37.69 倍。这是由于丙二醛作为脂肪酸氧化的中间产物,经过一段时间的积累,造成TBARs值增加。水浴温度对脂肪氧化会有一定影响,本研究发现,冷藏时终点中心温度70 ℃水浴处理的肉样TBARs值比终点中心温度80、90 ℃水浴处理的肉样更低,且存在显著差异(P<0.05),说明温度上升会促进后期脂肪的氧化,70 ℃水浴处理降低了牛半腱肌冷藏后期丙二醛的形成速率,这可能与水浴加热处理牛半腱肌中非血红素铁含量的增加有关。
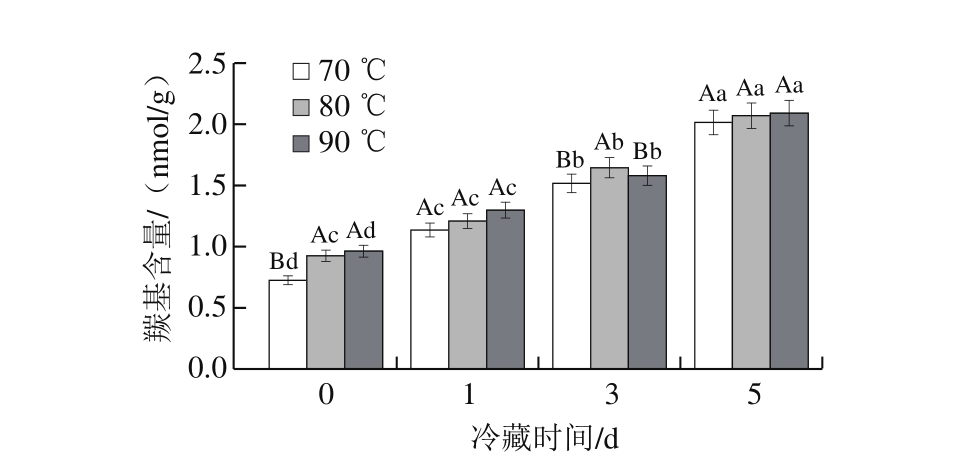
图 4 加热处理温度对牛半腱肌冷藏羰基含量的影响
Fig. 4 Effect of heating temperature on protein carbonyl content in bovineSemitendinosus muscle
由图4可知:冷藏0 d时,终点中心温度为80、90 ℃水浴处理组牛半腱肌的羰基含量较高,70 ℃水浴处理组最低,说明较高的加热温度促进蛋白质变性;随着冷藏时间延长,冷藏0 d与冷藏5 d牛半腱肌的羰基含量有显著差异(P<0.05),各组牛半腱肌的羰基含量均升高,这与彭珠妮等[25]研究结果一致。羰基含量的升高表明,冷藏期间经过水浴加热处理的牛半腱肌发生了蛋白质氧化反应。冷藏1 d后,由于肌原纤维蛋白的氧化反应,形成羰基基团,且终点温度和冷藏对蛋白质羰基含量有显著影响。冷藏后期蛋白质羰基含量的增加可能是由于水煮牛半腱肌中的脂质发生氧化,产生大量脂质二级氧化产物,促进了蛋白质的氧化。
屠宰后肌肉中的巯基总量基本保持稳定,含有巯基基团的氨基酸(半胱氨酸)易被氧化形成二硫键,因此常用游离巯基含量来反映蛋白质氧化程度[26]。
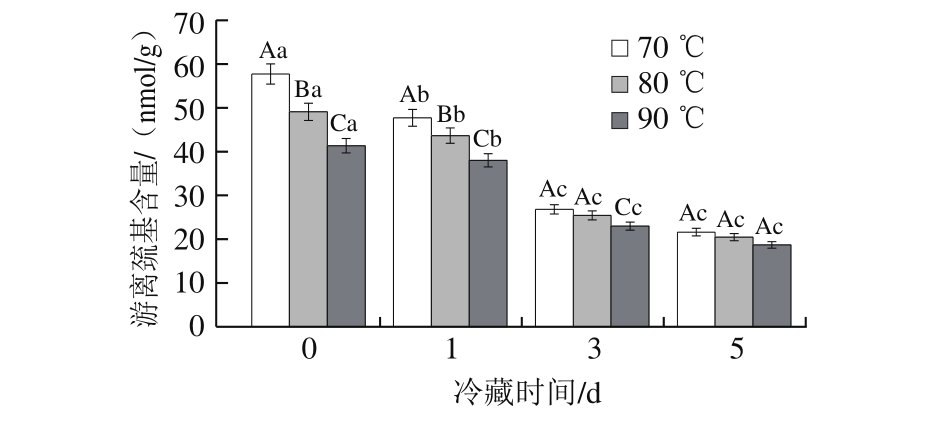
图 5 加热处理温度对牛半腱肌冷藏游离巯基含量影响
Fig. 5 Effect of heating temperature on protein sulfhydryl group content in bovineSemitendinosus muscle
由图5可知,3 组牛半腱肌的游离巯基含量随着冷藏时间的延长均呈下降趋势。冷藏1 d时,游离巯基含量降低19.08%,与冷藏0 d相比差异不显著(P>0.05),这与Dai Yan[24]、彭珠妮[25]等的研究结果一致;而在冷藏后期,牛半腱肌游离巯基含量显著下降(P<0.05),冷藏5 d时游离巯基含量仅为冷藏0 d时的44.65%,表明蛋白质氧化主要发生在冷藏后期。
表 1 加热处理温度对牛半腱肌冷藏色度的影响
Table 1 Effect of heating temperature on color parameters of bovine Semitendinosus muscle during cold storage
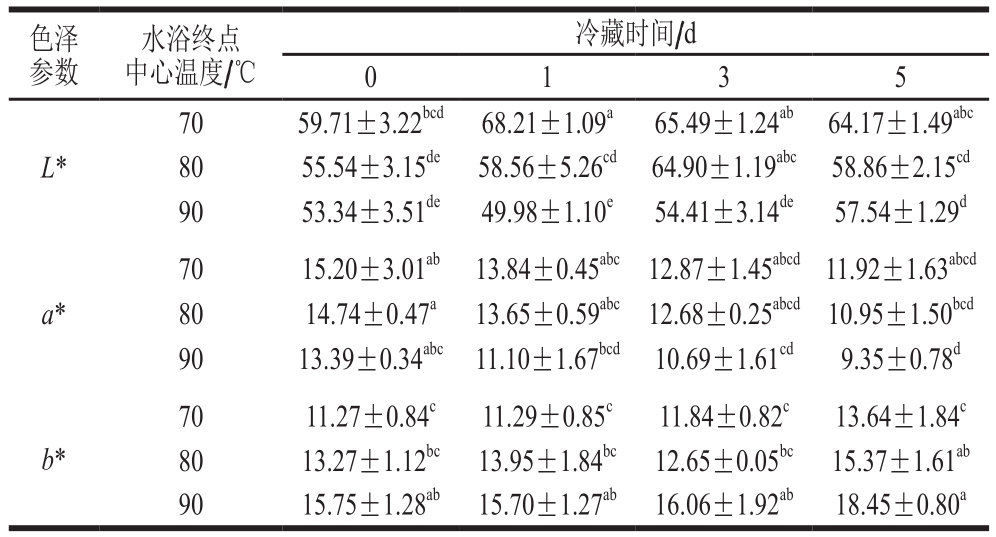
注:同行小写字母不同,表示差异显著(P<0.05)。
色泽参数水浴终点中心温度/℃冷藏时间/d 0 1 3 5 L*70 59.71±3.22bcd 68.21±1.09a 65.49±1.24ab 64.17±1.49abc 80 55.54±3.15de 58.56±5.26cd 64.90±1.19abc 58.86±2.15cd 90 53.34±3.51de 49.98±1.10e 54.41±3.14de 57.54±1.29d a*70 15.20±3.01ab 13.84±0.45abc 12.87±1.45abcd 11.92±1.63abcd 80 14.74±0.47a 13.65±0.59abc 12.68±0.25abcd 10.95±1.50bcd 90 13.39±0.34abc 11.10±1.67bcd 10.69±1.61cd 9.35±0.78d 70 11.27±0.84c 11.29±0.85c 11.84±0.82c 13.64±1.84c 80 13.27±1.12bc 13.95±1.84bc 12.65±0.05bc 15.37±1.61ab 90 15.75±1.28ab 15.70±1.27ab 16.06±1.92ab 18.45±0.80a b*
由表1可知,不同温度水浴处理和冷藏时间对牛半腱肌的色泽均有显著影响(P<0.05)。当水浴终点中心温度为70 ℃时,牛半腱肌L*、a*最大,b*最低;当水浴终点中心温度为90 ℃时,牛半腱肌L*、a*最小、b*最大,与其他温度有显著差异(P<0.05)。冷藏0 d时,终点中心温度70、80 ℃水浴处理牛半腱肌的肉色无显著差异,90 ℃与70 ℃时有显著差异(P<0.05),这表明水浴终点中心温度较高时,色素较易发生氧化或分解。此外,较高的水浴终点中心温度使得蛋白质变性更彻底,对色素物质的保护作用减弱。随着冷藏时间的延长,不同终点中心温度水浴处理牛半腱肌的L*和b*总体上略有升高,而a*总体上略有降低。
表 2 牛半腱肌彩虹色斑强度与相关指标之间的相关性分析
Table 2 Correlation analysis between rainbow stain intensity of bovine Semitendinosus muscle and related indicators
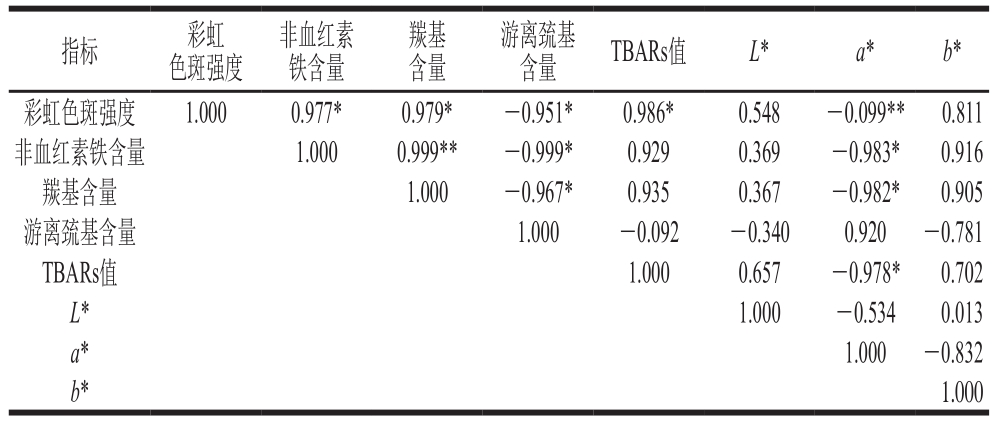
注:*. 差异显著(P<0.05);**. 差异极显著(P<0.01)。
指标 彩虹色斑强度非血红素铁含量羰基含量游离巯基含量 TBARs值 L* a* b*彩虹色斑强度 1.000 0.977* 0.979* -0.951* 0.986* 0.548 -0.099** 0.811非血红素铁含量 1.000 0.999** -0.999* 0.929 0.369 -0.983* 0.916羰基含量 1.000 -0.967* 0.935 0.367 -0.982* 0.905游离巯基含量 1.000 -0.092 -0.340 0.920 -0.781 TBARs值 1.000 0.657 -0.978* 0.702 L* 1.000 -0.534 0.013 a* 1.000 -0.832 b*1.000
由表2可知:牛半腱肌彩虹色斑强度与非血红素含量、羰基含量、TBARs值呈显著正相关(P<0.05),与游离巯基含量呈显著负相关(P<0.05),与a*呈极显著负相关(P<0.01);非血红素铁含量与羰基含量呈极显著正相关(P<0.01),与游离巯基含量、a*呈显著负相关(P<0.05);羰基含量与游离巯基含量、a*呈显著负相关(P<0.05);TBARs值与a*呈显著负相关(P<0.05)。
现有研究表明,肉品加工过程中的蛋白质氧化是不可避免的,肉品的氧化会导致色度变化,影响产品的感官特性。蛋白质氧化促进了蛋白质交联、聚集反应,不仅使蛋白质分子结构发生改变,而且对蛋白质溶解性、乳化性和凝胶性也有一定影响,尤其是在凝胶类肉制品和热加工肉制品中。同时,由于蛋白质氧化后热动力学的不稳定性,引起部分蛋白质发生变性,从而使其构象也随之改变[27-29]。
加热处理温度和后期冷藏时间的差异对牛半腱肌彩虹色斑强度、非血红素铁含量、TBARs值、羰基含量和游离巯基含量均有影响。通过牛半腱肌彩虹色斑强度与相关指标间的相关性分析得知,非血红素铁含量和羰基含量具有相关性,非血红素铁是水浴处理牛半腱肌冷藏期间蛋白质氧化的主要催化剂,它使肉品的氧化稳定性减弱,促进肉品中蛋白羰基含量的上升、游离巯基含量的下降;牛半腱肌彩虹色斑强度与羰基含量、游离巯基含量、TBARs值及a*均有相关性。因此认为,蛋白质氧化和脂肪氧化可能是造成牛半腱肌形成彩虹色斑的主要原因,蛋白质氧化通过改变蛋白质分子的变性、交联和聚集,进而影响蛋白质的结构,需要进行进一步的研究。
[1] 胡煌, 吕飞, 丁玉庭. 肉制品的呈色机理和色泽评定研究进展[J]. 肉类研究, 2016, 30(12): 48-53. DOI:10.15922/j.cnki.rlyj.2016.12.009.
[2] 孙卫青. 巴氏杀菌切片火腿冷藏期间褪色机理研究[D]. 南京: 南京农业大学, 2009: 5-10.
[3] JUAN L M. Iridescence in meat caused by surface gratings[J]. Journal of Food Science, 2013, 2(1): 499-506. DOI:10.3390/foods2040499.
[4] SWATLAND H J. Iridescence in beef caused by multilayer interference from sarcomere discs[J]. Journal of Meat Science, 2012, 90(2):398-401. DOI:10.1016/j.meatsci.2011.08.006.
[5] WANG H J. Causes and solutions of iridescence in precooked meat[D].Manhattan: Kansas State University, 1991.
[6] SWATLAND H J. Interference colors of beef fasciculi in circularly polarized light[J]. Journal of Animal Science, 1988, 66(2): 379-384.
[7] 吉艳峰. 牛肉制品彩虹色斑的控制技术研究[D]. 南京: 南京农业大学, 2007: 40-50.
[8] KUKOWSKI A C. Factors associated with surface iridescence in fresh beef[J]. Meat Science, 2004, 66(3): 889-893. DOI:10.1016/j.meatsci.2003.08.011.
[9] PURCHAS R W, RUTHERFURD S M, PEARCE P D, et al. Cooking temperature effects on the forms of iron and levels of several other compounds in beef Semitendinosus muscle[J]. Meat Science, 2004,68(2): 201-207. DOI:10.1016/j.meatsci.2004.02.018.
[10] AHN D, WOLFE F, SIM J. Three methods for determining nonheme iron in turkey meat[J]. Journal of Food Science, 1993, 58(2): 288-291.
[11] BENY B W. Factors affecting color properties of beef patties cooked on an outdoor gas grill[J]. Journal of Muscle Foods, 2000, 11(3):213-226. DOI:10.1 111/j.1745-4573.2000.tb00426.x.
[12] BERRY B W, BIGNER-GEORGE M E. Postcooking temperature changes in beef patties[J]. Jornal of Food Protection, 2001, 64(9):1405-1411.
[13] SEYFERT M, KROPF D H, HUNT M C. Final cooked temperature effects of ground pork on its ability to react with nitrite[J]. Journal of Food Science, 2004, 69(7): 506-510.
[14] UTRERA M, MORCUENDE D, ESTEVEZ M. Fat content has a significant impact on protein oxidation occurred during frozen storage of beef patties[J]. LWT-Food Science and Teclinology, 2014, 56(1):61-68. DOI:10.1016/j.lwt.2013.10.040.
[15] UTRERA M, MORCUENDE D, ESTEVEZ M. Temperature of frozen storage affects the nature and consequences of protein oxidation inbeef patties[J]. Meat Science, 2014, 96(3): 1250-1257.
[16] SOYER A, OZALP B, DALMIS U, et al. Effects of freezing temperature and duration of frozen storage on lipid and protein from frozen pork meat[J]. Food Chemistry, 2016, 196(1): 1310-1314.
[17] 李贺. 加工工艺和贮藏条件对蒸煮切片火腿颜色及色素影响研究[D]. 南京: 南京农业大学, 2012: 26-27.
[18] 李梦琪, 孙思远, 刘敏, 等. 加热温度和时间对真空低温烹饪鸡胸肉脂肪与蛋白质氧化的影响[J]. 肉类研究, 2018, 32(10): 6-11.DOI:10.7506/rlyj1001-8123-201810002.
[19] AMENTEROS M. Products by using the DNHP-method, fluorescence spectroscopy and liquid chromatography-electrospray ionisation-mass spectrometry (LC-ESI-MS)[J]. Meat Science, 2009, 83(1): 104-112.
[20] CUI Chun, ZHOU Xuesong, ZHAO Mouming, et al. Effect of thermal treatmenton the enzymatic hydrolysis of chicken proteins[J].Innovative Science and Emerging Technologies, 2009, 10(1): 37-41.DOI:10.1016/j.ifset.2008.09.003.
[21] POLIGNE I, COLLIGNAN A, TRYSTRAM G. Effects of salting,drying, cooking, and smoking operations on volatile compound formation and color patterns in pork[J]. Journal of Food Science, 2002,67(8): 2976-2986. DOI:10.1111/j.1365-2621.2002.tb08848.x.
[22] BREWER S. Irradiation effects on meat color : a review[J]. Meat Science, 2004, 68(1): 1-17. DOI:10.1016/j.meatsci.2004.02.007.
[23] GRUNWAL E W, RICARDS M P. Studies with myoglobin variants indicate that released hemin the primary promoter of lipidoxidation in washed fish muscle[J]. Journal of Agricultural and Food Chemistry,2006, 54(1): 4452-4460.
[24] DAI Yan, ZHANG Qiaona, WANG Lu, et al. Changes in shear parameters, protein degradation and ultrastucture of pork following water bath and ohmic cooking[J]. Food and Bioprocess Technology,2014, 7(5): 1393-1403. DOI:10.1007/s11947-013-1145-1.
[25] 彭珠妮, 张雅玮, 鲍英杰, 等. 水煮牛肉冷藏期间脂质和蛋白质氧化与质构特性变化[J]. 食品工业科技, 2018, 39(17): 79-83; 88.DOI:10.13386/j.issn1002-0306.2018.17.013.
[26] 薛文月. 猪浓缩饲料蛋白质氧化及不同抗氧化剂抗氧化作用的研究[D]. 南京: 南京农业大学, 2015: 24-25.
[27] 刘海梅, 夏文娟, 王静. 鲢肌球蛋白胶凝过程中化学键变化与动态流变特性的关系[J]. 食品与发酵工业, 2016, 42(5): 80-85.DOI:10.13995/j.cnki.11-1802/ts.201605014.
[28] XIONG Y L, PARK D, OOIZUMI A. Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J].Journal of Agricultural and Food Chemistry, 2009, 5(1): 153-159.
[29] 李学鹏, 周凯, 周明言, 等. 自由基氧化对大黄鱼肌原纤维蛋白交联和聚集的影响[J]. 中国食品学报, 2015, 15(4): 13-21.
Effect of Water Bath Heating on the Formation of Rainbow Stains in Frozen Bovine Semitendinosus Muscle