表1 脂肪酶活测定中各体系组成
Table 1 Composition of lipase assay systems
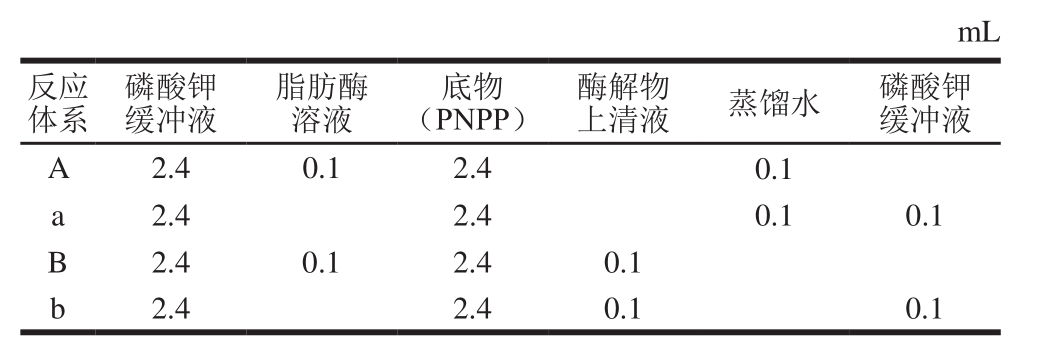
mL反应体系上清液蒸馏水磷酸钾缓冲液A 2.4 0.1 2.4 0.1 a 2.4 2.4 0.1 0.1 B 2.4 0.1 2.4 0.1 b 2.4 2.4 0.1 0.1磷酸钾缓冲液脂肪酶溶液底物(PNPP)酶解物
近年来,肥胖在我国已呈流行趋势[1],肥胖不仅是多种慢性非传染性疾病的重大危险因素[2-4],还与过早死亡风险的增加密切相关[5],由肥胖带来的疾病造成的经济负担正在成为严重的社会问题[6]。专家预期,肥胖将成为21世纪全球最大的公共卫生问题[7]。寻找和筛选具有天然减肥作用的药物或辅助减肥的功能性食品已成为研究热点。研究发现,肥胖与人体内脂肪酶的活性有着十分密切的关系,随人体进食而摄入的大部分脂肪会在脂肪酶的作用下降解和消化,合成新的脂肪,从而导致脂肪的堆积,形成肥胖。脂肪酶抑制剂能抑制脂肪酶的活性,减少食物中脂类物质的消化和吸收,达到控制和治疗肥胖的目的[8-9]。脂肪酶抑制剂的来源主要有化学合成、微生物发酵和植物提取[10]。化学合成的有机磷化合物对脂肪酶的抑制作用明显,但这类脂肪酶抑制剂主要用于研究脂肪酶的催化反应机理[11],半合成的脂肪酶抑制剂类药物奥利司他(Orlistat)已作为减肥药物广泛应用于临床,但长期服用该药会出现腹泻、胃肠胀气[12-14]、失眠、乏力、心率和血压异常[15]等副作用。微生物是脂肪酶抑制剂的重要来源,目前已报道的脂肪酶抑制剂产生菌主要集中于放线菌或真菌,许多学者强调并尝试从不同种属微生物获取脂肪酶抑制剂[16-18]。植物也是脂肪酶抑制剂的重要来源,已报道的植物来源脂肪酶抑制剂主要集中于黄酮类、皂苷类、萜类、多酚类、生物碱类和多糖类化合物等[10]。
目前,关于脂肪酶抑制肽的研究较少,刘丽媛等[19]以鲫鱼蛋白为原料,酶解制备具有胰脂肪酶抑制活性的短肽,研究不同条件对该肽稳定性的影响。而其他蛋白源脂肪酶抑制肽的研究还未见报道。本研究筛选合适的蛋白酶酶解鸡肉肌原纤维蛋白,并测定肌原纤维蛋白酶解物对脂肪酶活性的抑制作用,优化酶解条件,探究脂肪酶抑制肽的影响因素,为鸡肉减肥功能产品的研发提供一定的理论依据。
鸡腿肉购自杨凌好又多超市。
木瓜蛋白酶、胃蛋白酶、碱性蛋白酶、中性蛋白酶西安热默尔生物科技有限公司;胰蛋白酶、脂肪酶、三羟甲基氨基甲烷(tri-hydroxymethyl aminomethane,Tris)北京索莱宝科技有限公司;对硝基苯酚、对硝基苯酚棕榈酸酯(p-nitrophenyl palmitate,PNPP)、脱氧胆酸钠上海阿拉丁生化科技股份有限公司;阿拉伯树胶 天津市天力化学试剂有限公司;乙二胺四乙酸(elhylene diamine tetraacetic acid,EDTA)、氢氧化钠、盐酸、硫酸、硼酸、异丙醇均为国产分析纯。
NH-6数显恒温水浴锅 常州国华电器有限公司;JA3003电子天平 赛多利斯科学仪器(北京)有限公司;101-1AB电热鼓风干燥箱 天津市泰斯特仪器有限公司;UV-1700双光束紫外分光光度计 日本岛津公司;TGL-16G高速台式离心机 上海安亭科学仪器厂;JYL-C020E料理机 九阳股份有限公司;Q8 LOCUS电陶炉 中山市诺洁仕电器有限公司;LWY848控温式远红外消煮炉 四平电子技术研究所;半微量凯氏定氮装置 长天市旭丽玻璃仪器厂;BCD-450ZE9H冰箱 合肥美菱股份有限公司。
1.3.1 肌原纤维蛋白的制备
冷冻鸡腿肉经冰箱冷藏解冻,去皮去骨,得到纯鸡腿肉。根据闫海鹏[20]、Doerscher[21]等的方法提取肌原纤维蛋白,并略有改动。向100 g鸡腿肉中加入4 倍体积的僵直提取缓冲液(含100 mmol/L Tris、10 mmol/L EDTA,pH 8.3),匀浆,1 000×g离心20 min,将所得沉淀称质量,依次用4 倍体积的标准盐溶液(100 mmol/L KCl、20 mmol/L NaH2PO4/Na2HPO4和2 mmol/L MgCl2,pH 7.0)重复上述操作2 次,沉淀再分别用0.1 mol/L KCl溶液和0.1 mol/L NaCl溶液分散,1 500×g离心10 min,得到粗肌原纤维蛋白。将纯化的沉淀均匀涂抹于培养皿中并封口,于-60 ℃条件下冷冻24 h后,真空冷冻干燥机内冻干,得到冻干蛋白粉后立即真空密封,于-20 ℃冰箱内保存备用。
1.3.2 肌原纤维蛋白粉中蛋白质含量的测定
采用GB 5009.5ü2016《食品安全国家标准 食品中蛋白质的测定》中的凯式定氮法测定冻干蛋白粉中的蛋白质含量。
1.3.3 鸡肉蛋白源脂肪酶抑制肽的制备工艺
鸡肉肌原纤维蛋白中含有多种具有特定生物活性的肽序列,这些序列是否能够从肌原纤维蛋白中释放出来,关键在于所使用的酶和酶解条件。酶解鸡肉肌原纤维蛋白冻干粉,得到鸡肉蛋白源活性肽,根据该活性肽对脂肪酶和α-淀粉酶活性的抑制作用筛选出酶解肌原纤维蛋白效果最优的酶种类、加酶量、底物质量浓度和酶解时间,进而确定脂肪酶抑制肽的制备工艺。根据单因素试验结果,选择加酶量、底物质量浓度、酶解时间和酶解温度进行L9(34)正交试验,确定鸡肉蛋白源脂肪酶抑制肽的最佳制备工艺。
1.3.4 鸡肉蛋白源脂肪酶抑制肽影响因素
将采用最优工艺制备的脂肪酶抑制肽分别置于不同温度、pH值和金属离子存在的条件下30 min,研究不同因素对鸡肉蛋白源脂肪酶抑制肽活性的影响。
1.3.5 体外模拟胃肠液消化对鸡肉蛋白源脂肪酶抑制肽功能特性的影响
配制模拟胃肠液[22],向2.0 mL鸡肉肌原纤维蛋白酶解液中加入0.2 mL模拟胃液,37 ℃保温2 h,测定其对脂肪酶的抑制率;同时取1.0 mL酶解液,向其中加入0.1 mL模拟肠液,37 ℃温育2.5 h(模拟小肠消化),测定其对脂肪酶的抑制率;以等体积的蒸馏水代替胃肠液作为空白对照,探究胃肠液对鸡肉蛋白源脂肪酶抑制肽功能特性的影响。
1.3.6 鸡肉蛋白源脂肪酶抑制肽的脂肪酶抑制活性测定
PNPP在脂肪酶的催化作用下,释放出黄色的对硝基苯酚,该化合物在410 nm波长处具有特征吸收,可由分光光度计对其进行定量。以PNPP为底物,采用分光光度法测定脂肪酶活性[23-25]。
PNPP底物的配制:称取30 mg PNPP,溶解在10 mL异丙醇中作为溶液Ⅰ,称取200 mg脱氧胆酸钠并加入90 mL 0.1 mol/L的磷酸盐缓冲液(pH 7.2),搅拌至溶解后再加入90 mg阿拉伯胶,搅拌至完全溶解作为溶液Ⅱ;将溶液Ⅰ与溶液Ⅱ以1∶9的体积比混合均匀,至完全溶解,室温下稳定2 h。
测定脂肪酶活性时,每个反应体系由4 种溶液组成。首先将经蛋白酶处理的鸡肉肌原纤维蛋白酶解物上清液、20 mg/mL的脂肪酶溶液、蒸馏水和pH 7.2、0.1 mol/L的磷酸钾缓冲液在37 ℃恒温水浴锅中共保温1 h;再加入PNPP底物,加入后各体系在37 ℃条件下反应20 min;反应结束后在410 nm波长处测定各体系的吸光度(A410 nm),根据对硝基苯酚标准曲线计算脂肪酶活性(以A410 nm计)。每个体系做3 次平行实验。
选用对硝基苯酚质量浓度为横坐标,对硝基苯酚溶液A410 nm为纵坐标绘制标准曲线。所得曲线方程为y=0.098 9x-0.001 6(R2=1),在质量浓度为0~5 μg/mL范围内,对硝基苯酚溶液A410 nm与对硝基苯酚质量浓度有良好的线性关系,可作为标准曲线。
表1 脂肪酶活测定中各体系组成
Table 1 Composition of lipase assay systems

mL反应体系上清液蒸馏水磷酸钾缓冲液A 2.4 0.1 2.4 0.1 a 2.4 2.4 0.1 0.1 B 2.4 0.1 2.4 0.1 b 2.4 2.4 0.1 0.1磷酸钾缓冲液脂肪酶溶液底物(PNPP)酶解物
肌原纤维蛋白酶解物对脂肪酶活性的抑制率按下式计算。
式中:I为肌原纤维蛋白酶解物对脂肪酶活性的抑制率/%;A为未加酶解物体系的吸光度;a为A对照体系的吸光度(未加脂肪酶);B为加入酶解物体系的吸光度;b为B对照体系的吸光度(加入蛋白酶解物,未加脂肪酶)。
1.3.7 鸡肉蛋白源脂肪酶抑制肽的α-淀粉酶抑制活性测定
参照让一峰等[26]的方法测定鸡肉蛋白源脂肪酶抑制肽的α-淀粉酶抑制活性。
使用Origin 8.5软件绘图,用SPSS 20.0统计软件进行数据处理,P<0.05表示差异显著。用最小显著性差异法进行多重比较。
2.1.1 酶种类对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
用碱性蛋白酶、中性蛋白酶、胃蛋白酶、木瓜蛋白酶和胰蛋白酶5 种蛋白酶酶解鸡肉肌原纤维蛋白提取物,离心得到酶解液。
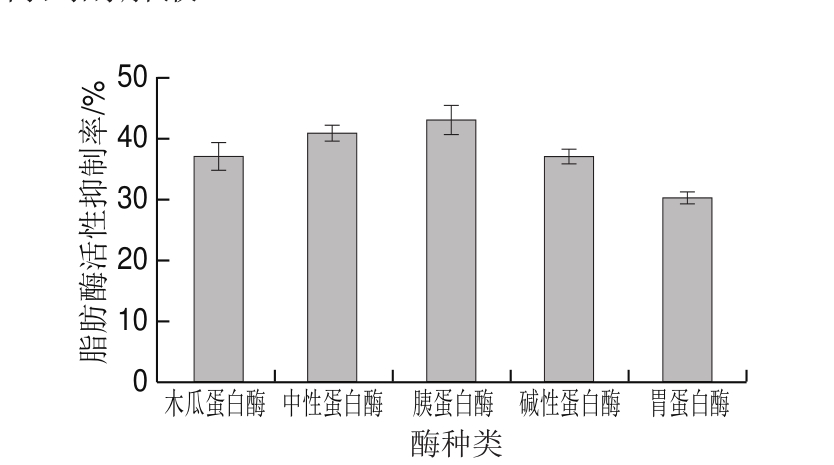
图1 酶种类对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
Fig. 1 Effect of enzyme type on lipase inhibitory activity of bioactive peptides from chicken protein hydrolysates
由图1可知,5 种蛋白酶的酶解产物对脂肪酶活性均有一定的抑制作用,其中,胃蛋白酶酶解液对脂肪酶活性的抑制率最低,胰蛋白酶酶解液对脂肪酶活性的抑制率最高。这可能是由于不同的酶作用于鸡肉肌原纤维蛋白的作用位点不同,例如,胰蛋白酶是一种肽链内切酶,它的主要作用位点是多肽链中的赖氨酸和精氨酸残基中的羧基侧[27],而胃蛋白酶则主要倾向于剪切氨基端或羧基端为芳香族氨基酸或亮氨酸的肽键[28],从而产生不同特性的多肽。因此,选择胰蛋白酶进行酶解。
2.1.2 胰蛋白酶加酶量对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
由图2可知:胰蛋白酶加酶量为1 000 U/g时,酶解液对脂肪酶活性的抑制率最高;胰蛋白酶加酶量高于1 000 U/g时,随着加酶量的增加,抑制率反而降低;胰蛋白酶加酶量为500~1 000 U/g时,加酶量相对底物的量来说较少,加酶量与水解度成正比[29],随着水解程度的增大,产生较多对脂肪酶活性具有抑制作用的活性肽,抑制率增大;胰蛋白酶加酶量为1 000~2 500 U/g时,加酶量相对底物的量较多,会产生酶相互竞争的作用,导致水解程度降低,水解产生的脂肪酶活性抑制肽较少,抑制率较低。因此,胰蛋白酶的加酶量初步确定为1 000 U/g。
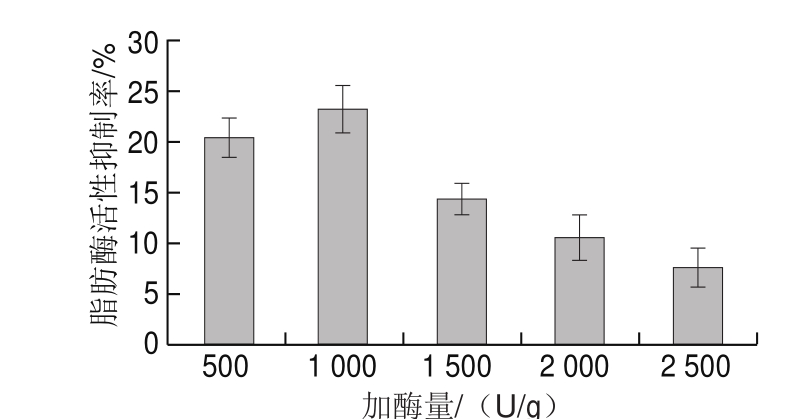
图2 胰蛋白酶加酶量对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
Fig. 2 Effect of enzyme dosage on lipase inhibitory activity of bioactive peptides from chicken protein hydrolysates
2.1.3 底物质量浓度对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
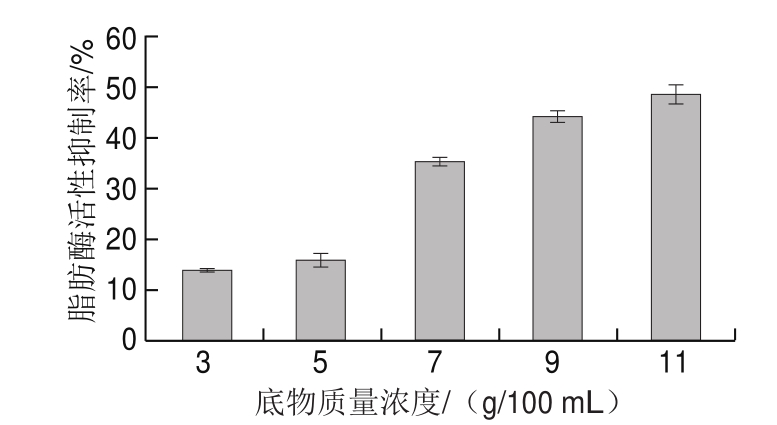
图3 底物质量浓度对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
Fig. 3 Effect of substrate concentration on lipase inhibitory activity of bioactive peptides from chicken protein hydrolysates
由图3可知,底物质量浓度为3~11 g/100 mL时,随着质量浓度的增加,酶解液对脂肪酶活性的抑制率先迅速增加,质量浓度达到9 g/100 mL后开始缓慢增加,最终趋于平稳。这是由于底物质量浓度较低时,胰蛋白酶与底物不能充分结合,随着底物质量浓度的增加,越来越多的酶分子与底物相结合,使酶解反应充分进行[30]。由于底物质量浓度为9 g/100 mL时酶解液对脂肪酶活性的抑制率接近质量浓度为11 g/100 mL时的抑制率,考虑到黏度增加带来的操作困难,初步确定底物质量浓度为9 g/100 mL。
2.1.4 酶解时间对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
由图4可知:酶解时间从1.0 h增加到3.0 h时,酶解液对脂肪酶活性的抑制率总体增加,在此期间蛋白质不断被分解为对脂肪酶活性具有抑制作用的活性肽占主导作用;酶解时间从3.0 h增加到3.5 h时,随酶解时间延长,脂肪酶抑制肽被部分分解,使得酶解液中脂肪酶抑制肽含量下降。因此,3.0 h是制备高活性脂肪酶抑制肽较适的水解时间。
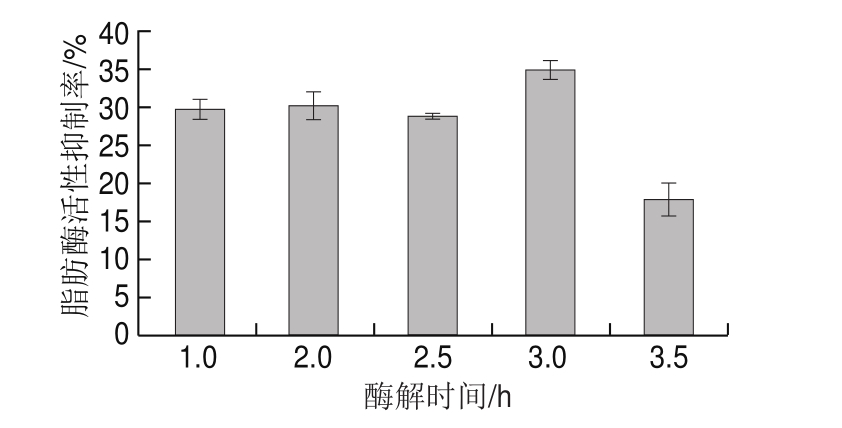
图4 酶解时间对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
Fig. 4 Effect of hydrolysis time on lipase inhibitoryactivity of bioactive peptides from chicken protein hydrolysates
选用正交试验,测定不同加酶量、底物质量浓度、酶解时间和酶解温度条件下酶解液对脂肪酶活性的抑制率,优化胰蛋白酶酶解肌原纤维蛋白提取物的酶解条件。参照相关实验规范标准对正交试验的结果进行相应的极差分析。
表2 鸡肉蛋白源脂肪酶抑制肽酶解条件的正交试验方案及结果
Table 2 Orthogonal array design with experimental results

试验号 A加酶量/(U/g)脂肪酶活性抑制率/%1 1(500) 1(8) 1(2.5) 1(35) 53.96 2 1 2(9) 2(3.0) 2(40) 67.35 3 1 3(10) 3(3.5) 3(45) 24.81 4 2(1 000) 1 2 3 33.31 5 2 2 3 1 46.71 B质量浓度/(g/100 mL)C酶解时间/h D酶解温度/℃6 37.95 7 3(1 500) 1 3 2 44.93 8 3 2 1 3 40.80 2 3 1 2 1 42.75 K1 146.13 132.20 132.72 143.42 554.47 K2 117.97 154.87 143.41 150.24 566.49 K3 128.49 105.51 116.46 98.93 449.38 k1 48.71 44.07 44.24 47.81 184.82 k2 39.32 51.62 47.80 50.08 188.83 k3 42.83 35.17 38.82 32.98 149.79 R 9.38 16.45 8.98 17.10 51.92因素主次顺序 D>B>A>C最优水平 A1 B2 C2 D2最优组合 A1B2C2D2 9 3 3 2
由表2可知,通过极差分析发现,在胰蛋白酶水解肌原纤维蛋白提取物所得酶解液对脂肪酶活性的抑制作用中,影响因素的主次顺序为D>B>A>C,即酶解温度影响最显著,为重要因素,其次是底物质量浓度,加酶量次之,酶解时间的影响最小。加酶量、底物质量浓度、酶解时间和酶解温度4 个因素的最优水平依次为A1、B2、C2、D2,最优组合为A1B2C2D2,即加酶量500 U/g、底物质量浓度9 g/100 mL、酶解时间3 h、酶解温度40 ℃。
在最优酶解条件下酶解得到的脂肪酶抑制肽对α-淀粉酶也有抑制作用,抑制率为23%。这可能是由于鸡肉蛋白源脂肪酶抑制肽与α-淀粉酶的活性位点结合,抑制了α-淀粉酶的活性[31]。
2.4.1 温度对鸡肉蛋白源脂肪酶抑制肽功能特性的影响
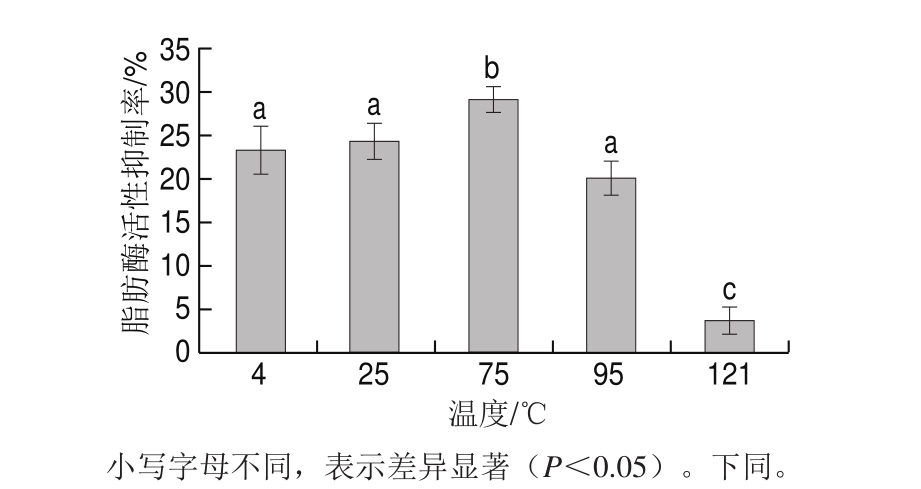
图5 温度对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
Fig. 5 Effect of temperature on lipase inhibitory activity of bioactive peptides from chicken protein hydrolysates
在不同温度条件下保温0.5 h后测定酶解液中的鸡肉蛋白源脂肪酶抑制肽对脂肪酶活性的影响。由图5可知,在4~75 ℃之间时,随着温度的升高,酶解液对脂肪酶活性的抑制率增加,并且在75 ℃达到最高值,当温度高于75 ℃时,随着温度的升高,抑制率显著降低(P<0.05)。这可能是由于温度升高到75 ℃的过程中,酶解液中的鸡肉蛋白源脂肪酶抑制肽活性增强,使得酶解液对脂肪酶活性的抑制率增加;而温度高于75 ℃时,随着温度升高,脂肪酶抑制肽的活性受到抑制,导致酶解液对脂肪酶活性的抑制率显著下降。因此,将鸡肉蛋白源脂肪酶抑制肽在75 ℃处理0.5 h,脂肪酶抑制肽对脂肪酶的抑制率较高。
2.4.2 pH值对鸡肉蛋白源脂肪酶抑制肽功能特性的影响
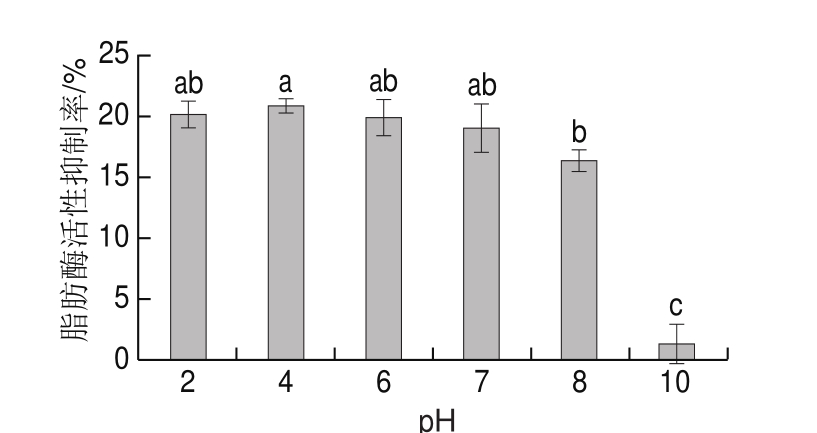
图6 pH值对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
Fig. 6 Effect of pH value on lipase inhibitory activity of bioactive peptides from chicken protein hydrolysates
在最适温度条件下保温0.5 h后,测定酶解液中的鸡肉蛋白源脂肪酶抑制肽在不同pH值条件下对脂肪酶活性的影响。由图6可知,在中、酸性条件下,酶解液对脂肪酶活性的抑制率相对稳定;而在碱性条件下,随着pH值的增加,抑制率显著降低(P<0.05);pH值为4时,抑制率最高。这可能是由于酶解液中的脂肪酶抑制肽在酸性条件下稳定性较高,在碱性条件下构象易发生改变,导致其活性受到抑制。因此,鸡肉蛋白源脂肪酶抑制肽在酸性条件下利于其活性的发挥。
2.4.3 离子种类对鸡肉蛋白源脂肪酶抑制肽功能特性的影响
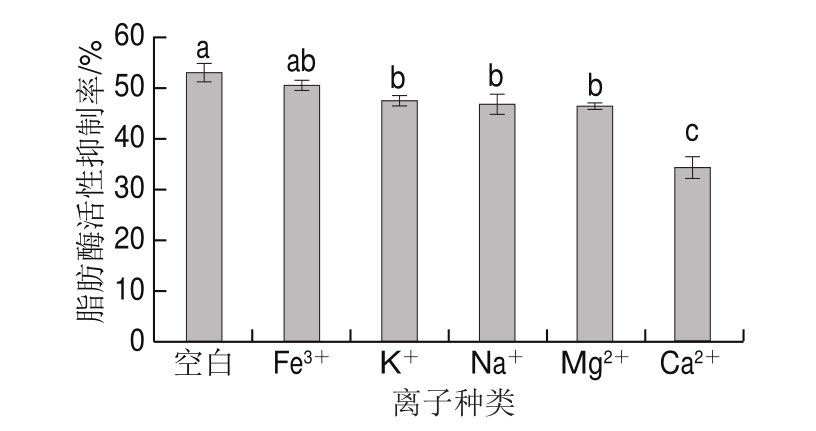
图7 离子种类对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
Fig. 7 Effect of ionic species on lipase inhibitory activity of bioactive peptides from chicken protein hydrolysates
测定酶解液中的鸡肉蛋白源脂肪酶抑制肽在不同种类离子的作用下对脂肪酶活性的影响。由图7可知,Fe3+、K+、Na+、Mg2+、Ca2+对鸡肉蛋白源脂肪酶抑制肽功能均有抑制作用,其中,Fe3+的抑制作用不显著(P>0.05),K+、Na+、Mg2+和Ca2+有显著的抑制作用(P<0.05)。刘丽媛等[19]的研究表明,Na+和Mg2+促进鲫鱼多肽对胰脂肪酶的抑制活性,Ca2+对该肽的抑制活性基本无影响,与本研究的结果不一致。可能的原因是脂肪酶抑制肽的来源及结构不一致。本研究以鸡肉蛋白为原料,与刘丽媛等[19]的研究原料鲫鱼蛋白不同。另外,酶解不同蛋白得到的肽段结构可能不同,因此离子种类对由不同蛋白得到的脂肪酶抑制肽的影响存在差异。
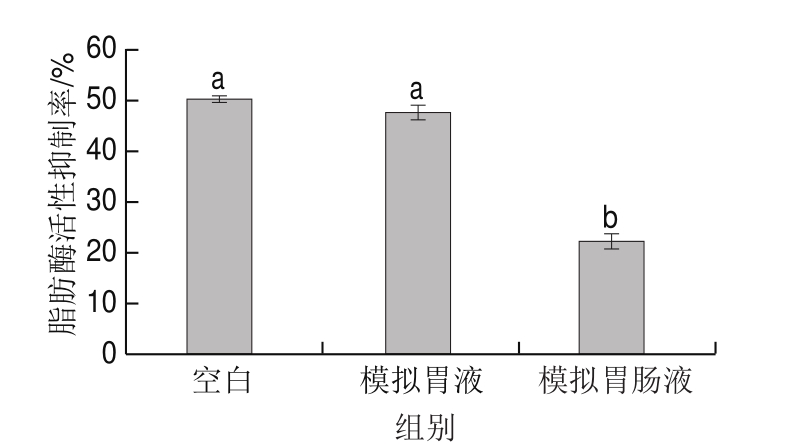
图8 模拟胃肠液对鸡肉蛋白源活性肽脂肪酶活性抑制率的影响
Fig. 8 Effect of gastrointestinal fl uid on lipase inhibitory activity of bioactive peptides from chicken protein hydrolysates
由图8可知,鸡肉蛋白源酶解液经过模拟胃液消化后,酶解液中的脂肪酶抑制肽对脂肪酶活性的抑制作用无显著变化(P>0.05),当酶解液再经模拟肠液消化后,抑制率显著降低(P<0.05)。这可能是由于肠液中的胰蛋白酶能酶解部分鸡肉蛋白源脂肪酶抑制肽,使脂肪酶抑制肽的活性部分丧失,导致脂肪酶活性抑制率显著下降。
从鸡腿肉中提取并酶解肌原纤维蛋白,研究鸡肉蛋白源脂肪酶抑制肽的制备工艺,并进行正交试验,探究脂肪酶抑制肽的最佳制备工艺。结果表明,在鸡肉肌原纤维蛋白质量浓度为9 g/100 mL的溶液中,加入500 U/g胰蛋白酶、40 ℃酶解3 h,所得脂肪酶抑制肽的活性最大,对脂肪酶活性的抑制率最高。此外,对鸡肉蛋白源脂肪酶抑制肽的影响因素进行研究,结果表明,温度为75 ℃、pH值为4、无金属离子作用时,脂肪酶抑制肽的活性最大,对脂肪酶活性的抑制率最高。体外模拟胃肠液消化实验表明,模拟胃液对鸡肉蛋白源脂肪酶抑制肽无显著影响,模拟肠液能显著降低脂肪酶抑制肽对脂肪酶活性的抑制率。本研究结果为脂肪酶抑制肽的制备、特性及应用提供了依据。
[1] 国家体育总局. 2014年国民体质监测公报[EB/OL]. (2015-11-25)[2019-05-12]. http://www.sport.gov.cn/n16/n1077/n1227/7328132.htmL.
[2] HENRY R R, CHILTON R, GARVEY W T. New options for the treatment of obesity and type 2 diabetes mellitus (narrative review)[J].Journal of Diabetes and its Complications, 2013, 27(5): 508-518.DOI:10.1016/j.jdiacomp.2013.04.011.
[3] SHEPHARD R J. Separate and combined associations of bodymass index and abdominal adiposity with cardiovascular disease:collaborative analysis of 58 prospective studies[J]. The Lancet, 2011,377: 1085-1095. DOI:10.1016/S0140-6736(11)60105-0.
[4] LAUBY-SECRETAN B, SCOCCIANTI C, LOOMIS D, et al. Body fatness and cancer: viewpoint of the IARC working group[J]. The New England Journal of Medcine, 2016, 375(8): 794-798. DOI:10.1056/NEJMsr1606602.
[5] ANGELANTONIO E D, BHUPATHIRAJU S N, WORMSER D, et al.Bodymass index and all-cause mortality: individual-participant-data meta-analysis of 239 prospective studies in four continents[J]. The Lancet, 2016, 388: 776-786. DOI:10.1016/S0140-6736(16)30175-1.
[6] TSAI A G, WILLIAMSON D F, GLICK H A. Direct medical cost of overweight and obesity in the USA: a quantitative systematic review[J]. Obesity Reviews, 2011, 12(1): 50-61. DOI:10.1111/j.1467-789X.2009.00708.x.
[7] PRENTICE A M. The emerging epidemic of obesity in developing countries[J]. International Journal of Epidemiology, 2006, 35: 93-99.DOI:10.1093/ije/dyi272.
[8] SÁNCHEZ J, PRIEGO T, PALOU M, et al. Oral supplementation with physiological doses of leptin during lactation in rats improves insulin sensitivity and affects food preferences later in life[J]. Endocrinol,2008, 149(2): 733-740. DOI:10.1210/en.2007-0630.
[9] 姜运耀, 吕国英, 李燕飞. 植物来源的胰脂肪酶抑制剂研究进展[J].中国生化药物杂志, 2012, 33(2): 199-202. DOI:10.13684/j.cnki.spkj.2013.10.007.
[10] 韩昕男, 武淑芬, 黑黾哲, 等. 不同来源脂肪酶抑制剂研究进展[J].安徽农业科学, 2017, 45(3): 138-140. DOI:10.13989/j.cnki.0517-6611.2017.03.047.
[11] GARGOURI Y, RANSAC S, VERGER R. Covalent inhibition of digestive lipases: an in vitro study[J]. Biochimica et Biophysica Acta,1997, 1344(1): 6-37. DOI:10.1016/S0005-2760(97)81102-2.
[12] SHI Y, BURN P. Lipid metabolic enzymes:emerging drug targets forthe treatment of obesity[J]. Nature Reviews Drug Discovery, 2004,3(8): 695-710. DOI:10.1038/nrd1469.
[13] KLEIN S. Long-term pharmacotherapy for obesity[J]. Obesity Society,2004(12): 163-166. DOI:10.1038/oby.2004.283.
[14] FINER N, JAMES W P, KOPELMAN P G. One-year treatment of obesity: a randomized, double-blind, placebo-controlled, multicentrestudy of orlistat, a gastrointestinal lipase inhibitor[J]. International Journal of Obesity, 2000, 24(3): 306-313. DOI:10.1038/sj.ijo.0801128.
[15] BRAY G A, TARTAGLIA L A. Medicinal strategies in the treatment of obesity[J]. Nature, 2000, 404: 672-677. DOI:10.1038/35007544.
[16] 刘兰, 周培华, 曾伟, 等. 脂肪酶抑制剂产生菌的筛选和鉴定[J]. 食品与生物技术学报, 2013, 32(2): 219-223.
[17] 孙菲, 郑榕, 杨煌建, 等. 胰脂肪酶抑制剂产生菌的筛选[J]. 生物技术进展, 2014, 4(1): 40-43. DOI:10.3969/j.issn.2095-2341.2014.01.08.
[18] 朱珺, 吴石金. 胰脂肪酶抑制剂产生菌的筛选和鉴定[J]. 发酵科技通讯, 2015, 44(4): 10-14. DOI:10.16774/j.cnki.issn.1674-2214.2015.04.005.
[19] 刘丽媛, 王艳萍, 彭晨, 等. 鲫鱼肽胰脂肪酶抑制活性稳定性的研究[J]. 食品科技, 2013, 38(10): 245-248. DOI:10.13684/j.cnki.spkj.2013.10.007.
[20] 闫海鹏, 吴菊清, 李美琳, 等. 不同种类肉肌原纤维蛋白乳化及理化特性的研究[J]. 南京农业大学学报, 2013, 36(6): 100-104.DOI:10.7685/j.issn.1000-2030.2013.06.016.
[21] DOERSCHER D R, BRIGGS J L, LONERGAN S M. Effects of pork collagen on thermal and viscoelastic properties of purified porcine myofibrillar protein gels[J]. Meat Science, 2004, 66(1): 181-188.DOI:10.1016/S0309-1740(03)00082-2.
[22] 赵玉明, 马玲, 谢海军. 模拟胃肠液环境下Mozzarella干酪提取液抗氧化活性[J]. 中国酿造, 2016, 35(10): 107-111.
[23] 雷启义, 邹凯, 周江菊, 等. 脂肪酶活力测定方法及其比较[J].凯里学院学报, 2 0 11, 2 9(6): 4 3-4 5. D O I:1 0.3 9 6 9/j.issn.1673-9329.2011.06.16.
[24] GUPTA N, RATHI P, GUPTA R. Simplif i ed para-nitrophenyl palmitate assay for lipases and esterases[J]. Analytical Biochemistry, 2002, 311:98-99. DOI:10.1016/S0003-2697(02)00379-2.
[25] ZHENG Chengdong, DUAN Yaqing, GAO Jinming, et al. Screening for anti-lipase properties of 37 traditional Chinese medicinal herbs[J].Journal of the Chinese Medical Association, 2010, 73: 319-324.DOI:10.1016/S1726-4901(10)70068-X.
[26] 让一峰, 赵伟, 杨瑞金, 等. 白芸豆α-淀粉酶抑制剂在加工和消化过程中的活性变化研究[J]. 食品工业科技, 2015, 36(17): 53-57.DOI:10.13386/j.issn1002-0306.2015.17.002.
[27] 王荣春, 孙建华, 何述栋, 等. 胰蛋白酶抑制剂的结构与功能研究进展[J]. 食品科学, 2013, 34(9): 364-368.
[28] 姜太玲, 吴红洋, 王微, 等. 响应面法优化胃蛋白酶制备花椒籽蛋白抗菌肽的研究[J]. 食品工业科技, 2014, 35(20): 226-231.DOI:10.13386/j.issn1002-0306.2014.20.041.
[29] 李勇. 生物活性肽研究现况和进展[J]. 食品与发酵工业, 2007(1):3-9. DOI:10.3321/j.issn:0253-990X.2007.01.002.
[30] 徐明, 岳喜庆. 酶解法制备鹿茸多肽的研究[J]. 食品工业科技, 2012,33(5): 205-207. DOI:10.13386/j.issn1002-0306.2012.05.099.
[31] CHIN C F, TAN S J, GAN C Y, et al. Identification of peptide based inhibitors for alpha-amylase by phage display[J]. International Journal Of Peptide Research And Therapeutics, 2015, 21(3): 237-242.DOI:10.3177/jnsv.52.149.
Preparation of Lipase Inhibitory Peptides from Chicken Myofibrillar Protein and Factors Influencing Anti-Lipase Activity
LI Ruixia, DAN Jie, LÜ Jinxiao, et al. Preparation of lipase inhibitory peptides from chicken myofibrillar protein and factors inf l uencing anti-lipase activity[J]. Meat Research, 2019, 33(8): 29-34. DOI:10.7506/rlyj1001-8123-20190513-104. http://www.rlyj.net.cn