威宁火腿中微生物的分离鉴定及其耐受特性
张诗意,唐 楠,黄 攀,周 颖,徐宝才,李沛军*
(农产品生物化工教育部工程研究中心,合肥工业大学食品与生物工程学院,安徽 合肥 230009)
摘 要:以贵州威宁火腿为研究对象,对其中的微生物开展分离鉴定及耐盐、耐亚硝酸盐和耐低温特性研究。结果表明:共分离得到10 株菌,包括4 株马胃葡萄球菌(Staphylococcus equorum)、2 株木糖葡萄球菌(Staphylococcus xylosus)、2 株乳酸片球菌(Pediococcus acidilactici)、1 株变平滑假丝酵母菌(Candida metapsilosis)和1 株近平滑假丝酵母菌(Candida parapsilosis);其中,马胃葡萄球菌WN1、变平滑假丝酵母菌WN9和近平滑假丝酵母菌WN10耐受9% NaCl、150 mg/kg亚硝酸盐和4 ℃低温条件的能力较强。
关键词:威宁火腿;分离;鉴定;耐盐;耐亚硝酸盐;耐低温
威宁火腿是贵州著名的传统发酵肉制品,至今已有600多年的历史。威宁火腿由高原瘦肉型良种“乌金猪”后腿加工而成,该猪腿部肌肉紧实,肌纤维质量高,为威宁火腿的加工提供了上乘的原料[1]。目前,威宁火腿仍延用家庭作坊式模式,于每年冬至后开始制作,采用自然发酵法生产。自然发酵中的微生物主要来源于原料肉及周围环境,火腿中微生物种类复杂且易受到有害微生物的污染,因此产品质量受环境影响较大,严重时甚至会导致发酵过程的失败,引起火腿腐败变质[2]。
在现代发酵肉制品加工工艺中,使用人工接种来控制生产过程已经成为一种趋势[3]。与自然发酵相比,人工接种发酵不仅能保持产品质量稳定、缩短发酵时间,还能保证产品安全性,统一生产标准,延长产品货架期[4-5]。因此,分离、鉴定威宁火腿中的有益微生物就显得至关重要。本研究以威宁火腿为研究对象,使用划线培养法对其中的微生物进行分离并鉴定,同时对其耐盐、耐亚硝酸盐和耐低温特性进行研究,以期揭示威宁火腿中优势微生物分布,为实现其工业化生产提供科学理论依据;同时,可扩充我国肉用益生菌菌种库。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
成熟期1 年的威宁火腿,购于威宁彝族回族苗族自治县农贸市场,样品置于放有冰袋的保温箱中低温运输至实验室。
亚硝酸钠 山东烟台佳晶食品工业有限公司;氯化钠 国药集团化学试剂(上海)有限公司;革兰氏染液 北京索莱宝(Solarbio)科技有限公司;细菌基因组DNA提取试剂盒 北京天根生化科技有限公司;Ezup柱式酵母基因组DNA抽提试剂盒 生工生物工程(上海)股份有限公司。
1.1.2 培养基
甘露醇氯化钠琼脂(mannitol salt agar,MSA)液体培养基(牛肉浸膏5.0 g、䏡蛋白胨10.0 g、D-甘露醇10.0 g、氯化钠75.0 g、酚红1.5 mL、蒸馏水1 000 mL,pH 7.4f0.2,121 ℃灭菌20 min) 自制;MRS肉汤液体培养基、麦芽汁液体培养基 广东环凯微生物科技有限公司。
向上述液体培养基中各添加15.0 g/L琼脂,得到相应的固体培养基。MSA固体培养基、MRS固体培养基、麦芽汁固体培养基分别用于葡萄球菌、乳酸菌、酵母菌的分离培养。
1.2 仪器与设备
AC2-4S1生物安全柜 新加坡艺思高科技有限公司;H1650-W微量台式高速离心机 湖南湘仪实验室仪器开发有限公司;721G可见分光光度计 上海精密科学仪器有限公司;HH系列数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂;YX280/15手提式不锈钢压力蒸汽灭菌器 上海三申医疗器械有限公司;BSD-250培养箱上海博迅实业有限公司;JY系列电子天平 上海衡平仪器仪表厂;Tanon 1600蛋白核酸检测仪 上海天能科技有限公司;DYY-6D电泳仪 北京六一生物科技有限公司;SCIENTZ 09无菌均质器 宁波新芝生物科技股份有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪 美国Bio-Rad公司;C-HGFI Nikon Intensilight荧光显微镜 日本Nikon公司。
1.3 方法
1.3.1 样品处理
在无菌条件下,用无菌刀从威宁火腿表层和内部1.0~2.0 cm处分别切取5 g样品,放入盛有25 mL无菌生理盐水的无菌袋中。将无菌袋放入无菌均质器中拍打30 s,得均质液备用。
1.3.2 菌株的分离纯化
取上述均质液加入到无菌生理盐水中适度稀释后,吸取200 μL涂布于MRS固体培养基、MSA固体培养基和麦芽汁固体培养基中,37 ℃培养。用接种环挑取单菌落,采用平板划线法进行划线培养,重复操作直至获得纯种培养物。将纯化后菌株接种于斜面培养基上,于4 ℃保存。
1.3.3 菌种鉴定
1.3.3.1 形态学观察
菌落形态特征分析:观察并记录菌落的表面形貌、色泽、透明度等特征。
个体形态特征分析:挑取细菌菌体进行革兰氏染色后镜检;酵母菌通过水浸片法观察[6],记录菌体细胞形态。
1.3.3.2 DNA序列鉴定
参照细菌、酵母基因组DNA提取试剂盒说明书,提取细菌、酵母基因组DNA,并于-20 ℃条件下保存备用。细菌16S rRNA基因采用通用引物进行扩增:上游引物27F(5’-AGTTTGATCMTGGCTCAG-3’),下游引物1492R(5’-GGTTACCTTGTTACGACTT-3’)。酵母菌内部转录间隔区(internal transcribed spacer,ITS)序列扩增通用引物为:上游引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’),下游引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)[7-8]。PCR反应体系(50 μL)为:Taq PCR Master Mix 25 μL、模板DNA 2 μL、引物各2 μL、无菌ddH2O 19 μL,混匀30 s。PCR反应条件:94 ℃预变性4 min,94 ℃变性30 s,45 ℃退火30 s,72 ℃延伸90 s,进行30 个循环,最后72 ℃延伸10 min。
PCR扩增产物经1.0%琼脂糖凝胶电泳检验后,送往生工生物工程(上海)股份有限公司测序。利用NCBI数据库,使用BLAST对基因的同源性进行分析,获取与目的基因序列同源性较高不同种序列。使用MEGA-X软件构建Neighbor-Joinging系统发育树[9-10],同时综合考虑菌株菌落特征和菌体形态,确认菌株名称。
1.3.4 微生物特性研究
1.3.4.1 耐盐特性
吸取活化3 代后的菌液200 μL,分别接种于NaCl质量分数为3%、6%和9%的选择性液体培养基中,37 ℃培养,以未接种培养基作为空白对照。细菌、酵母经10 h培养后,测定培养液在600 nm波长处的光密度(optical density,OD600 nm)[11]。
1.3.4.2 耐亚硝酸盐特性
吸取活化3 代后的菌液200 μL,接种于NaNO2添加量分别为0、150 mg/kg的选择性液体培养基中[12],37 ℃培养,其中前者为对照组。细菌、酵母经10 h培养后测定培养液的OD600 nm。耐受系数定义为实验组OD600 nm与对照组OD600 nm之比[13]。
1.3.4.3 耐低温特性
吸取活化3 代后的菌液200 μL,接种于选择性液体培养基中,于4 ℃条件下培养,37 ℃培养组设为对照组。细菌、酵母经10 h培养后测定培养液的OD600 nm。耐受系数为实验组OD600 nm与对照组OD600 nm之比。
1.4 数据处理
使用Statistix 8.1软件对数据进行显著性分析,使用Origin 2017软件作图。每个实验重复3 次,结果表示为平均值±标准差。
2 结果与分析
2.1 威宁火腿中微生物的分离与鉴定
对威宁火腿中的优势微生物进行分离纯化,共得到10 株菌,分别编号为WN1~WN10,通过形态学分析和DNA序列分析,鉴定威宁火腿中微生物的种类。
2.1.1 形态学分析
表1 威宁火腿中分离菌株的菌落特征及菌体形态
Table 1 Colony and cell morphology of the isolated strains

菌株编号 菌落特征 菌体形态WN1 微白色,菌落小,光滑圆整,边缘整齐 G+,成葡萄状排列WN2 微白色,菌落小,光滑圆整,边缘整齐 G+,成葡萄状排列WN3 微白色,菌落小,光滑圆整,边缘整齐 G+,成葡萄状排列WN4 微白色,菌落小,光滑圆整,边缘整齐 G+,成对或葡萄状排列WN5 白色,菌落小,光滑圆整,边缘整齐 G+,成对或成堆排列WN6 白色,菌落小,光滑圆整,边缘整齐 G+,成对或成堆排列WN7 白色,菌落小,光滑圆整,边缘整齐 G+,成对排列WN8 白色,菌落小,光滑圆整,边缘整齐 G+,成对排列WN9 乳白色,菌落较大,光滑圆整,边缘整齐,有酒香 菌体较大,卵圆形WN10 乳白色,菌落较大,光滑圆整,边缘整齐,有酒香 菌体较大,卵圆形
由表1可知:分离纯化得到的8 株细菌均为革兰氏阳性(G+)菌,菌落形态圆整,边缘整齐,成对、成堆或成葡萄状排列;2 株酵母菌菌落大而厚,表面光滑,呈卵圆形,均有酒香。
图1为细菌革兰氏染色镜检图像,图2为酵母菌镜检图像。
2.1.2 DNA序列鉴定
提取获得各菌株基因组DNA后进行PCR扩增。由图3可知,样品WN1~WN8扩增产物的分子质量约为1 500 bp,样品WN9、WN10扩增产物的分子质量约为500 bp,且扩增条带清晰、明亮可见。所有条带分子质量大小符合理论预期。
表2 威宁火腿中10 株分离菌株的鉴定结果
Table 2 Identification of the 10 isolated strains

菌株编号 鉴定结果WN1、WN2、WN3、WN4 马胃葡萄球菌(Staphylococcus equorum)WN5、WN6 木糖葡萄球菌(Staphylococcus xylosus)WN7、WN8 乳酸片球菌(Pediococcus acidilactici)WN9 变平滑假丝酵母菌(Candida metapsilosis)WN10 近平滑假丝酵母菌(Candida parapsilosis)
利用N C B I数据库,对分离菌株的D N A序列进行BLAST分析,确定菌种鉴定结果。由表2可知,威宁火腿的10 个分离菌株中包括4 株马胃葡萄球菌(Staphylococcus equorum)、2 株木糖葡萄球菌(Staphylococcus xylosus)、2 株乳酸片球菌(Pediococcus acidilactici)、1 株变平滑假丝酵母菌(Candida metapsilosis)和1 株近平滑假丝酵母菌(Candida parapsilosis)。
对比国内三大火腿,宣威火腿最显著的特点是表面存在大量耐盐的G+菌,其优势菌群包括葡萄球菌和微球菌[14]。黄艾祥[15]发现,云南干腌火腿中的优势细菌主要有马胃葡萄球菌、表皮葡萄球菌、肉葡萄球菌、木糖葡萄球菌、戊糖片球菌和变异微球菌等,其中葡萄球菌是云腿加工过程中的优势菌。样品中检出的酵母菌数量相对较少,经分离鉴定主要有红酵母、德巴利酵母、汉逊酵母、诞沫假丝酵母、弯假丝酵母及隐球酵母。蒋云升等[16]研究发现,在如皋火腿的自然发酵过程中,球菌、杆菌、酵母菌是优势菌群。余翔[17]研究发现,在现代化发酵技术生产的金华火腿中,细菌的优势种为乳酸菌,其次为葡萄球菌;在真菌方面,内部占优势的酵母菌主要是欧诺比假丝酵母、白色布勒掷孢酵母等。国外著名腌制火腿中,Jamon Iberico火腿发酵成熟过程中的优势菌包括葡萄球菌属和微球菌属,从Parma火腿表面样品中可以分离出乳球菌属细菌,从内部样品可以分离出耐盐菌[18-19]。Virgili等[20]从Italian火腿表面分离得到12 株酵母菌,经鉴定属于德巴利酵母属、假丝酵母属和汉森酵母属。
本研究分离鉴定得到的大多数微生物在上述国内外火腿(宣威火腿、如皋火腿、金华火腿、Jamon Iberico火腿、Parma火腿、Italian火腿)中较为常见,如马胃葡萄球菌、木糖葡萄球菌和乳酸片球菌。但也有几种微生物,如变平滑假丝酵母菌和近平滑假丝酵母菌,报道比较少,这可能是由于在不同生产环境下,不同火腿中的微生物种类存在差异。2004年,近平滑假丝酵母菌被确立为种水平上的新分类单元[21]。梁慧等[22]从传统腊鱼中分离筛选得到2 株产香酵母,其中1 株为近平滑假丝酵母菌。郭壮等[23]从生膜牛肉酱中分离到4 株变平滑假丝酵母菌,并且发现它们能使牛肉酱产膜,其在火腿中的作用有待进一步研究。
2.2 威宁火腿中分离微生物的特性研究
从分离得到的5 种菌中各选择1 株代表菌株(WN1、WN5、WN7、WN9、WN10),开展耐盐、耐亚硝酸盐和耐低温特性研究。
2.2.1 耐盐特性研究
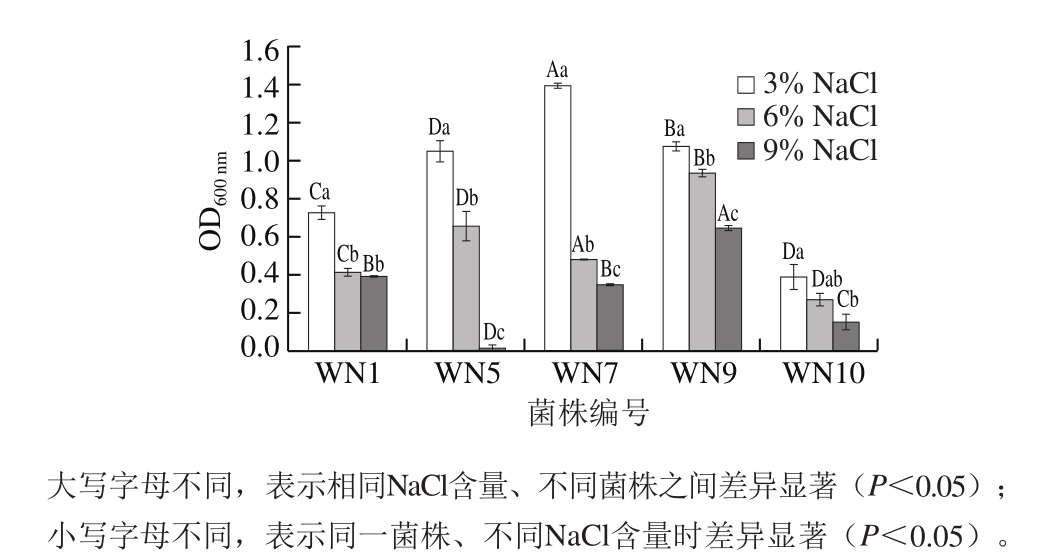
耐盐能力是选择发酵肉制品发酵剂的一个重要因素,对发酵肉制品的感官质量和生物安全性有重要影响。筛选出的菌株要求能够在至少6%的食盐含量下正常生长[24-25]。因此,研究盐含量对5 株菌生长的影响。
由图4可知,随着培养基NaCl含量的增加,各菌株的生长量均呈下降趋势。各菌株在NaCl含量为3%时生长量最大,表明高NaCl含量会抑制菌株的生长。其中,乳酸片球菌WN7在6% NaCl含量下生长量显著下降(P<0.05),降幅超过60%。当NaCl含量增加到9%时,木糖葡萄球菌WN5基本停止生长,马胃葡萄球菌WN1、变平滑假丝酵母菌WN9和近平滑假丝酵母菌WN10的生长量有所下降但仍能生长,故耐盐性较好。
潘明[26]从如皋火腿中分离、纯化得到耳式葡萄球菌、表皮葡萄球菌和木糖葡萄球菌3 种葡萄球菌,结果表明,适当浓度的NaCl能够促进3 种葡萄球菌的生长,其中耳式葡萄球菌的耐盐性最强,当NaCl含量达到8%时才对其有抑制作用,木糖葡萄球菌的耐盐性稍差,但在12% NaCl含量下依然能够生长,其耐盐特性超过马胃葡萄球菌WN1。
2.2.2 耐亚硝酸盐特性研究
肉制品生产过程中,亚硝酸钠是重要添加剂。肉类工业中,通常要求菌株在150 mg/kg的亚硝酸钠条件下可良好生长[27]。因此,研究添加亚硝酸钠对5 株菌生长的影响。
由图5可知,在亚硝酸钠含量为150 mg/kg的培养基中,5 株菌均可生长。其中,马胃葡萄球菌WN1的耐受系数接近于1.00,表明其生长几乎不受亚硝酸盐添加的影响,耐亚硝酸盐能力显著高于其他菌株(P<0.05);木糖葡萄球菌WN5、乳酸片球菌WN7和近平滑假丝酵母菌WN10在亚硝酸钠添加量为150 mg/kg时生长有所抑制,但耐受系数均能达到0.70以上,耐亚硝酸盐能力次之;而变平滑假丝酵母菌WN9的耐受系数最低(0.62),对亚硝酸盐的耐受力最差。
李欣蔚等[28]研究剑门火腿中葡萄球菌、乳酸菌在亚硝酸盐添加量为150 mg/kg时的生长量,结果表明,5 株菌均具有一定的耐亚硝酸盐特性,其中葡萄球菌(S-1、S-2和S-3)对亚硝酸盐具有较强的耐受性,而乳酸菌(L-1和L-2)的耐受性相对较弱。潘明[26]从如皋火腿分离、纯化得到的耳式葡萄球菌、表皮葡萄球菌、木糖葡萄球菌和德巴利汉逊酵母均有较好的耐亚硝酸盐特性,其中葡萄球菌耐亚硝酸盐性最好。与本研究结果一致。
2.2.3 耐低温特性研究
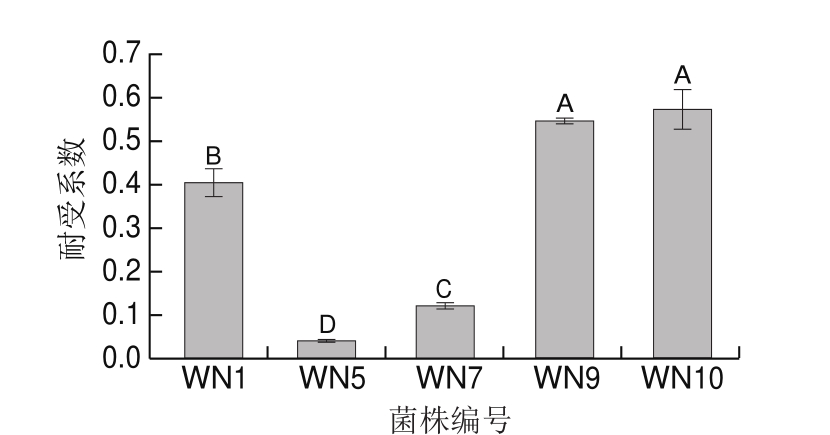
温度在发酵肉制品的生产过程中起着至关重要的作用。通常情况下,发酵肉制品的腌制温度为4 ℃,最适发酵温度为25~30 ℃[29]。此外,中式火腿制作周期较长,其腌制工序一般不少于40 d。因此,本研究探讨低温(4 ℃)对5 株菌生长的影响。
由图6可知,在培养温度降低至4 ℃时,5 个菌株均能维持一定的生长量,但不同菌株受低温的影响程度存在显著差异(P<0.05)。3 株细菌的耐受系数分别为0.40、0.04和0.12,故细菌对低温的耐受力依次为马胃葡萄球菌WN1>乳酸片球菌WN7>木糖葡萄球菌WN5,其中马胃葡萄球菌WN1的耐受系数明显高于其他细菌,耐低温性最好。在4 ℃培养温度下,变平滑假丝酵母菌WN9和近平滑假丝酵母菌WN10的耐受系数最高,分别为0.55和0.60,表明其在低温条件下依然能较好地生长。
刘晓强[30]从云南火腿中分离得到1 株变异微球菌和2 株木糖葡萄球菌,这3 株菌均能耐受6% NaCl和150 mg/kg亚硝酸盐。用MRS培养基分离得到2 株戊糖片球菌和2 株清酒乳杆菌,也均能耐受6% NaCl和150 mg/kg亚硝酸盐,但是均不耐低温。本研究筛选得到的木糖葡萄球菌WN5能耐受6% NaCl和150 mg/kg亚硝酸盐但不耐低温,与刘晓强[30]研究结果相一致;而乳酸片球菌WN7与其相比耐盐性较差。
3 结 论
从威宁火腿中分离出10 株微生物,经过菌落特征、个体形态分析以及DNA序列鉴定,最终确定为5 种菌,分别为马胃葡萄球菌、木糖葡萄球菌、乳酸片球菌、变平滑假丝酵母和近平滑假丝酵母。其中,马胃葡萄球菌WN1、变平滑假丝酵母菌WN9和近平滑假丝酵母菌WN10耐盐性较好,乳酸片球菌WN7耐盐性稍差,而木糖葡萄球菌WN5在9% NaCl含量下几乎不能生长。马胃葡萄球菌WN1对亚硝酸钠含量为150 mg/kg的培养基耐受力最好,平滑假丝酵母菌WN9的耐受力最差。在4 ℃培养温度下,变平滑假丝酵母菌WN9和近平滑假丝酵母菌WN10的耐低温能力显著高于其他菌株,细菌中马胃葡萄球菌WN1的耐受系数最高。因此,马胃葡萄球菌WN1和近平滑假丝酵母菌WN10耐盐、耐亚硝酸盐和耐低温能力较好,能够适应不同外部环境。
本研究揭示了威宁火腿中细菌和酵母的组成及特性,扩充了肉制品有益菌菌种库,为后续肉制品发酵剂的本土化研究和开发提供了理论基础。而在威宁火腿发酵过程中,微生物对火腿风味等品质的影响还有待进一步研究。
参考文献:
[1] 江萍, 欧阳旭燚. 贵州传统威宁火腿的加工工艺[J]. 食品科学, 1997,18(11): 41-43.
[2] 邵金昆, 杨芳, 杜丽娟, 等. 肉与肉制品中挥发性盐基氮测定方法的改进[J]. 肉类研究, 2009, 23(10): 58-60.
[3] 翁航萍, 宋翠英, 王盼盼. 对我国传统肉制品的探讨[J]. 肉类研究,2007, 21(12): 3-5.
[4] 黄盼盼, 蒋先芝, 田建卿. 火腿微生物研究进展[J]. 生物工程学报,2018, 34(9): 1410-1418. DOI:10.13345/j.cjb.170496.
[5] AL-AHMAD S. The effect of starter cultures on the physico-chemical,microbiological and sensory characteristics of semi-dried sausages[J].International Journal of Chemtech Research, 2015, 7(4): 2020-2028.
[6] 王传花, 周传云, 王传亮, 等. 一株低温耐酒精度苹果酒酵母菌的选育[J]. 农产品加工(学刊), 2008(3): 60-64. DOI:10.3969/j.issn.1671-9646-B.2008.03.017.
[7] FLYNN A N, LYNDON C A, CHURCH D L. Identification by 16S rRNA gene sequencing of an Actinomyces hongkongensis isolate recovered from a patient with pelvic actinomycosis[J]. Journal of Clinical Microbiology, 2013, 51(8): 2721-2723. DOI:10.1128/JCM.00509-13.
[8] CINDY D G, NELLY C, VALÉRIE B, et al. 16S rDNA analysis of bacterial communities associated with the hyper accumulator Arabidopsis halleri grown on a Zn and Cd polluted soil[J].European Journal of Soil Biology, 2014, 60: 16-23. DOI:10.1016/j.ejsobi.2013.10.006.
[9] GIAMMARIOLI M, CEGLIE L, ROSSI E, et al. Increased genetic diversity of BVDV-1: recent findings and implications thereof[J].Virus Genes, 2015, 50(1): 147-151. DOI:10.1007/s11262-014-1132-2.
[10] MAHONY TIMOTHY J, MCCARTHY FIONA M, GRAVEL JENNIFER L, et al. Genetic analysis of bovine viral diarrhoea viruses from Australia[J]. Veterinary Microbiology, 2005, 106(1/2): 1-6.DOI:10.1016/j.vetmic.2004.10.024.
[11] 徐鑫, 王茜茜, 王晓蕊, 等. 传统农家大酱中耐盐性乳酸菌的分离与鉴定[J]. 食品与发酵工业, 2014, 40(11): 33-40. DOI:10.13995/j.cnki.11-1802/ts.201411006.
[12] 王海燕. 湖南腊肉源产香葡萄球菌的筛选、鉴定及其产香机理研究[D]. 北京: 中国农业大学, 2005: 27-28.
[13] 赵莹, 朱丹, 石叶帆, 等. 发酵酱油豆豉中优势霉菌的筛选及功能分析[J]. 食品科技, 2018, 43(6): 18-22. DOI:10.13684/j.cnki.spkj.2018.06.004.
[14] 李平兰, 沈清武, 吕燕妮, 等. 宣威火腿成熟产品中主要微生物菌相构成分析[J]. 中国微生态学杂志, 2003(5): 12-13. DOI:10.3969/j.issn.1005-376X.2003.05.007.
[15] 黄艾祥. 云南干腌火腿品质特征形成与微生物作用研究[D]. 重庆:西南大学, 2006: 83-84.
[16] 蒋云升, 郭本功, 席军, 等. 如皋火腿微生物菌群分析[J].扬州大学烹饪学报, 2 0 0 4(3): 1 0-1 2. D O I:1 0.3 9 6 9/j.issn.1009-4717.2004.03.003.
[17] 余翔. 金华火腿现代化发酵工艺中微生物区系研究[D]. 重庆: 西南农业大学, 2005: 7-8.
[18] LORI D, GRISENTII M S, PAROLAIR G, et al. Microbiology of drycured ham[J]. Industria Conserve, 2005, 80: 23-32.
[19] SANZ Y, FADDA S, VIGNOLO G, et al. Hydrolytic action of Lactobacillus casei CRL 705 on pork muscle sarcoplasmic and myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry,1999, 47(8): 3441-3448. DOI:10.1021/jf981255n.
[20] VIRGILI R, SIMONCINI N, TOSCANI T, et al. Biocontrol of Penicillium nordicum growth and ochratoxin A production by native yeasts of dry cured ham[J]. Toxins, 2012, 4(2): 68-82. DOI:10. 3390/toxins4020068.
[21] TAVANTI A, DAVIDSON A D, GOW N A, et al. Candida orthopsilosis and Candida metapsilosis spp. nov. to replace Candida parapsilosis groups Ⅱ and Ⅲ[J]. Journal of Clinical Microbiology,2005, 43(1): 284-292. DOI:10.1128/JCM.43.1.284-292.2005.
[22] 梁慧, 马海霞, 李来好. 腊鱼产香酵母菌的筛选及其发酵产香特性初步研究[J]. 食品工业科技, 2011, 32(12): 213-217. DOI:10.13386/j.issn1002-0306.2011.12.075.
[23] 郭壮, 董蕴, 尚雪娇, 等. 致牛肉酱生膜菌的分离鉴定及其生膜能力验证[J]. 中国调味品, 2018, 43(11): 59-63. DOI:10.3969/j.issn.1000-9973.2018.11.011.
[24] SANTOS B A D, CAMPAGNOL P C B, FAGUNDES M B, et al.Adding blends of NaCl, KCl, and CaCl2 to low-sodium dry fermented sausages: effects on lipid oxidation on curing process and shelf life[J].Journal of Food Quality, 2017(2): 1-8. DOI:10.1155/2017/7085798.
[25] 马德功. 发酵香肠中乳酸菌的分离、筛选及其应用[D]. 济南: 山东轻工业学院, 2008: 19-24.
[26] 潘明. 如皋火腿发酵菌群与火腿品质关系研究[D]. 扬州: 扬州大学,2007: 39-42.
[27] 李凤彩, 程文新, 谢华, 等. 发酵香肠菌种筛选标准探讨[J]. 食品科技, 2002, 23(6): 78-79. DOI:10.13386/j.issn1002-0306.2002.06.032.
[28] 李欣蔚, 迟原龙, 贾冬英, 等. 剑门火腿菌相构成及主要腐败菌特性分析[J]. 中国酿造, 2012, 31(11): 132-134. DOI:10.3969/j.issn.0254-5071.2012.11.035.
[29] 马德功, 王成忠, 崔文文, 等. 发酵香肠乳酸菌发酵剂筛选标准[J].肉类研究, 2007, 21(12): 31-33.
[30] 刘晓强. 云南火腿中菌种的分离筛选及在发酵火腿中的应用[D].长春: 吉林农业大学, 2008: 22-31.
Isolation, Identification and Tolerance Characteristics of Microorganisms from Weining Ham
ZHANG Shiyi, TANG Nan, HUANG Pan, ZHOU Ying, XU Baocai, LI Peijun*
(Engineering Research Center of Bio-Process, Ministry of Education, School of Food and Biological Engineering,Hefei University of Technology, Hefei 230009, China)
Abstract: The objective of our current study was to isolate and identify microorganisms from Weining ham, as well as to illustrate their salt, nitrite and low temperature resistance. The results showed that a total of 10 strains were obtained,including 4 strains ofStaphylococcus equorum, 2 strains ofStaphylococcus xylosus, 2 strains ofPediococcus acidilactici,1Candida metapsilosisstrain and 1Candida parapsilosisstrain. Among them,S. equorum WN1,C. metapsilosis WN9 and C. parapsilosis WN10 grew well in the presence of 9% NaCl or 150 mg/kg nitrite at 4 ℃.
Keywords: Weining ham; isolation; identification; salt tolerance; nitrite tolerance; low temperature tolerance
收稿日期:2019-06-25
基金项目:国家自然科学基金青年科学基金项目(31601498);安徽省科技重大专项(18030701168)
第一作者简介:张诗意(1999—)(ORCID: 0000-0001-8912-0372),女,本科生,研究方向为肉品微生物。E-mail: zhangshiyi0207@163.com
*通信作者简介:李沛军(1986—)(ORCID: 0000-0002-8244-366X),男,副教授,博士,研究方向为肉品微生物。E-mail: lipeijun@hfut.edu.cn
DOI:10.7506/rlyj1001-8123-20190625-147
中图分类号:TS201.3
文献标志码:A
文章编号:1001-8123(2019)08-0012-06
引文格式:张诗意, 唐楠, 黄攀, 等. 威宁火腿中微生物的分离鉴定及其耐受特性[J]. 肉类研究, 2019, 33(8): 12-17. DOI:10.7506/rlyj1001-8123-20190625-147. http://www.rlyj.net.cn
ZHANG Shiyi, TANG Nan, HUANG Pan, et al. Isolation, identification and tolerance characteristics of microorganisms from Weining ham[J]. Meat Research, 2019, 33(8): 12-17. DOI:10.7506/rlyj1001-8123-20190625-147. http://www.rlyj.net.cn