表1 不同部位肌肉的蛋白质量浓度
Table 1 Protein concentration of different carcass parts
注:A. 鸡胸肉;B. 鸡腿肉;1~3. 生物重复。图1同。
样品编号 A1 A2 A3 B1 B2 B3蛋白质量浓度/(µg/µL) 24.250 17.298 24.660 23.080 16.245 21.170
白羽肉鸡别名AA鸡,具有抗病力强、肉质细嫩、饲养周期短等特点。相比于其他肉类,鸡肉具有高蛋白、低脂肪、低胆固醇和低热量等特点[1-2]。每100 g鸡肉中含有接近其总质量1/5的蛋白质[3],相比于猪肉、牛肉、羊肉等高产量肉类,鸡肉的蛋白质含量最高。研究表明,烘干基础上,机械去骨鸡肉与新鲜鸡胸肉蛋白质含量分别高达90.5%和82.2%,鸡肉的氨基酸组成比例均一,蛋白功效比和利用率均很高[4-5],具有很高的生物价值和消化率。随着白羽肉鸡胴体质量等级的增加,鸡胸肉与鸡腿肉的质量与内聚性、咀嚼性呈显著负相关,与硬度呈极显著负相关[6]。鸡胸肉是典型的白肌肌肉,鸡腿肉是典型的红肌肌肉,红肌和白肌的化学组成和功能特性均存在差异,鸡胸肉中含B族维生素较多,因此可以保护皮肤,减轻疲劳,鸡腿肉中含有较多的铁质,可以改善缺铁性贫血[7]。不同部位的鸡肉蛋白质组存在差异。鸡肉蛋白质的氨基酸组成比例均衡,且鲜味氨基酸、支链氨基酸和抗氧化性氨基酸含量较高,但组成蛋白质的各氨基酸比例存在较大差异[8]。
作为肌肉的重要组成部分,蛋白质的改变会引起肌肉品质的变化[9]。蛋白质的变化规律有其自身的特定性,通常这些特性无法通过基因组学直接反应出来[10],而蛋白质组学是有效的检测工具。随着组学技术的发展,基于质谱的蛋白质组学技术广泛应用于猪[11]、鸡[12]、牛[13]、羊[14]肉质的研究中。Lamctsch等[15]运用质谱技术发现,宰后肌肉组织中钙蛋白酶的含量与猪肉的嫩度相关。黄晓毅[16]研究发现,肉品质变化可能与热休克蛋白相关。Doherty等[17]阐述了蛋鸡胸肌蛋白质的组成,揭示了相关蛋白质在生长期集中表达的差异。这些研究表明,蛋白质组学技术是鉴定肉质蛋白差异的有利工具。本研究利用非标记蛋白质组学定量技术SWATH(sequential window acquisition of all theoretical fragment-ion spectra)和数据非依赖型采集(data independent acquisition,DIA)技术,对白羽肉鸡鸡腿肉与鸡胸肉进行蛋白质鉴定和定量分析,以期为鸡肉肉质形成的分子机制和品质快速鉴定提供参考。
样本由3 只白羽肉鸡(35 日龄)作为生物重复,分别采集3 只鸡的鸡腿肉与鸡胸肉。
蛋白裂解液、尿素、胰蛋白酶(Trypsin)、碘乙酰胺(iodoacetamide,IAA)、二硫苏糖醇(dithiothreitol,DTT)、碳酸氢铵 美国赛默飞世尔公司。
-80 ℃冰箱 美国赛默飞世尔公司;98-IIIN超声波粉碎仪 宁波新芝生物科技股份有限公司;Z323K低温离心机 德国Hermle公司;QT-901涡旋仪 海门市其林贝尔仪器制造有限公司;Eksigent Technologies液相色谱仪、TOF 5600质谱仪 美国AB Sciex公司。
1.3.1 总蛋白提取
取适量样品置于含有液氮的研钵中研磨成粉末状,将样本转移至1.5 mL离心管中,加入1 g/100 mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)裂解液,每隔1 min在涡旋仪上涡旋30 s,20 min后结束;超声破碎2 min,4 ℃、12 000 r/min离心30 min,取上清;使用BCA(Bioteke)试剂盒进行总蛋白质量浓度测定。
1.3.2 总蛋白酶解
取蛋白含量100 µg的样品,加入200 µL含8 mol/L尿素和10 mmol/L DTT的混合溶液,37 ℃变性1 h,12 000 r/min离心40 min,加入200 µL尿素,振荡、12 000 r/min离心30 min,重复2 次;加入200 µL 50 mmol/L IAA避光反应30 min,12 000 r/min离心30 min;加入100 µL 100 mmol/L碳酸氢铵,12 000 r/min离心20 min,重复3 次;加入适量Trypsin 37 ℃孵育过夜,12 000 r/min离心30 min;加入50 µL 100 mmol/L碳酸氢铵,12 000 r/min离心30 min,重复2 次;收集滤液,冻干,备用。
1.3.3 总蛋白鉴定
取100 µg冻干粉,50 µL 2%乙腈水溶液复溶,利用DIA与SWATH方法上机鉴定总蛋白与差异蛋白。离子源:DIA扫描模式:正离子模式;喷雾电压2.3 kV;离子源温度150 ℃。蛋白鉴定模式:一级扫描模式:全扫描;一级扫描范围:150~1 200m/z;质谱分辨率设为30 000;选择窗口:0.4 Da;碎裂模式:诱导碰撞解离(collision-induced dissociation,CID);碎裂能量:动态碎裂;二级扫描范围:100~1 500m/z;循环模式:动态排除扫描;动态排除时间18 s;SWATH定量模式:一级扫描模式:全扫描;一级扫描范围:150~1 200m/z;质谱分辨率设为30 000;间隔窗口25 u(如400~425(m/z)、424~449、448~473, ,1 175~1 200);碎裂模式:CID;碎裂能量:动态碎裂;二级扫描范围:100~1 500m/z;循环模式:依次均匀扫描。
1.4.1 蛋白鉴定
将液相色谱-质谱连用采集的鸡腿肉与鸡胸肉DIA数据利用Protien Pilot 4.5软件进行搜库,蛋白数据库来源于UniProt/Swiss-Prot。
保留时间校准:利用PeakView软件,对鸡腿肉和鸡胸肉的SWATH数据与DIA数据进行比对,进行保留时间校准,做定量分析。
1.4.2 差异蛋白的筛选
通过LOG2(Fold Change)与-LOG10(P value)值绘制火山图,应用Marker View软件,以P value<0.05、差异倍数(Fold Change)>2或<0.5作为阈值,选取鸡腿肉和鸡胸肉的差异蛋白。
1.4.3 基因本体论(gene ontology,GO)富集分析
GO富集分析使用DAVID Bioinformatics Resources 6.8软件的功能注释一栏对筛选出的差异蛋白按照细胞学组分、分子功能及生物学过程进行分类,使用默认设置进行。
采用BCA(Bioteke)试剂盒对总蛋白质量浓度进行测定,得到的总蛋白质量浓度标准曲线方程为y=0.012 5x+0.092 4(R2=0.991 3),说明标准曲线比较理想,可以用于样品蛋白质量浓度的计算。根据蛋白在595 nm波长处的吸光度(A595 nm)及标准曲线方程,计算不同部位肌肉样品的蛋白质量浓度,结果如表1所示。
表1 不同部位肌肉的蛋白质量浓度
Table 1 Protein concentration of different carcass parts
注:A. 鸡胸肉;B. 鸡腿肉;1~3. 生物重复。图1同。
样品编号 A1 A2 A3 B1 B2 B3蛋白质量浓度/(µg/µL) 24.250 17.298 24.660 23.080 16.245 21.170
取蛋白含量30 µg的样品进行蛋白均一化,并进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)检测。由图1可知,蛋白质提取效果较好,条带均一,说明蛋白质量浓度测定准确,可用于后期实验。
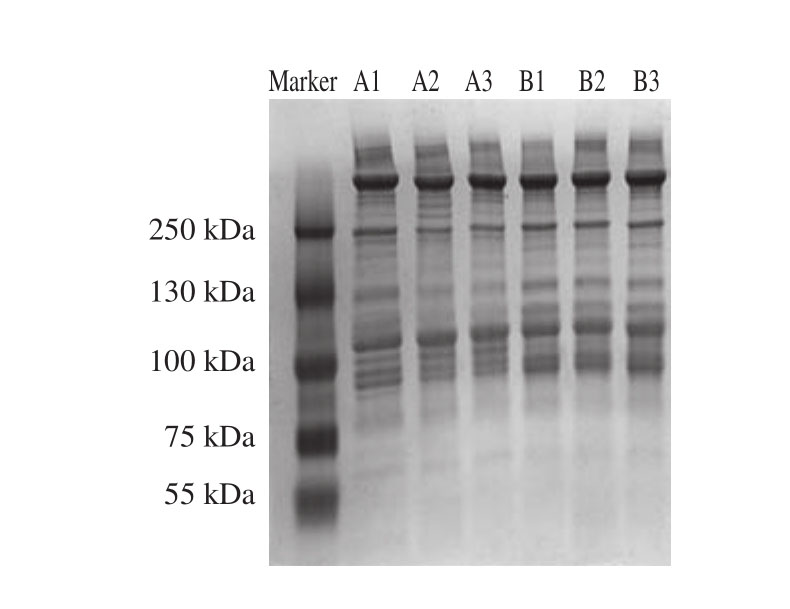
图1 总蛋白电泳图
Fig. 1 Electrophoresis of total proteins
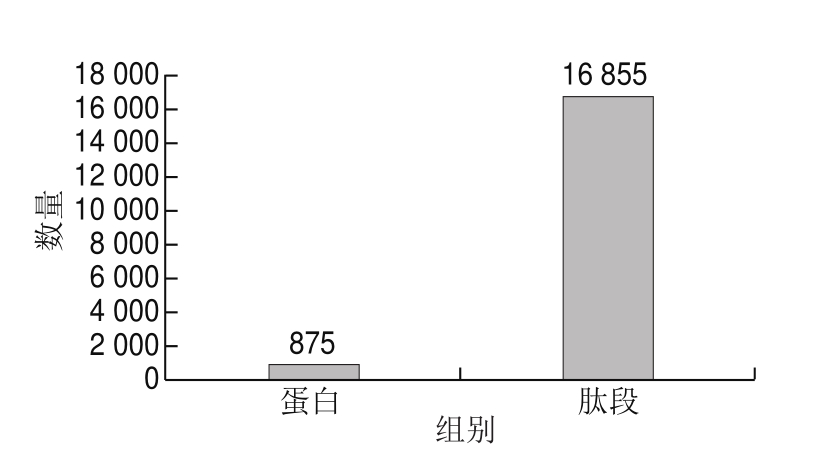
图2 1%假阳性条件下的搜库结果
Fig. 2 Results of database search under 1% FDR
以UniProt/Swiss-Prot数据库为背景,对鸡腿肉和鸡胸肉蛋白质进行鉴定,初步建立鸡腿肉和鸡胸肉的蛋白质表达谱。由图2可知,1%假阳性(false discovery rate,FDR)条件下检测到875 个蛋白质及16 855 条肽段。
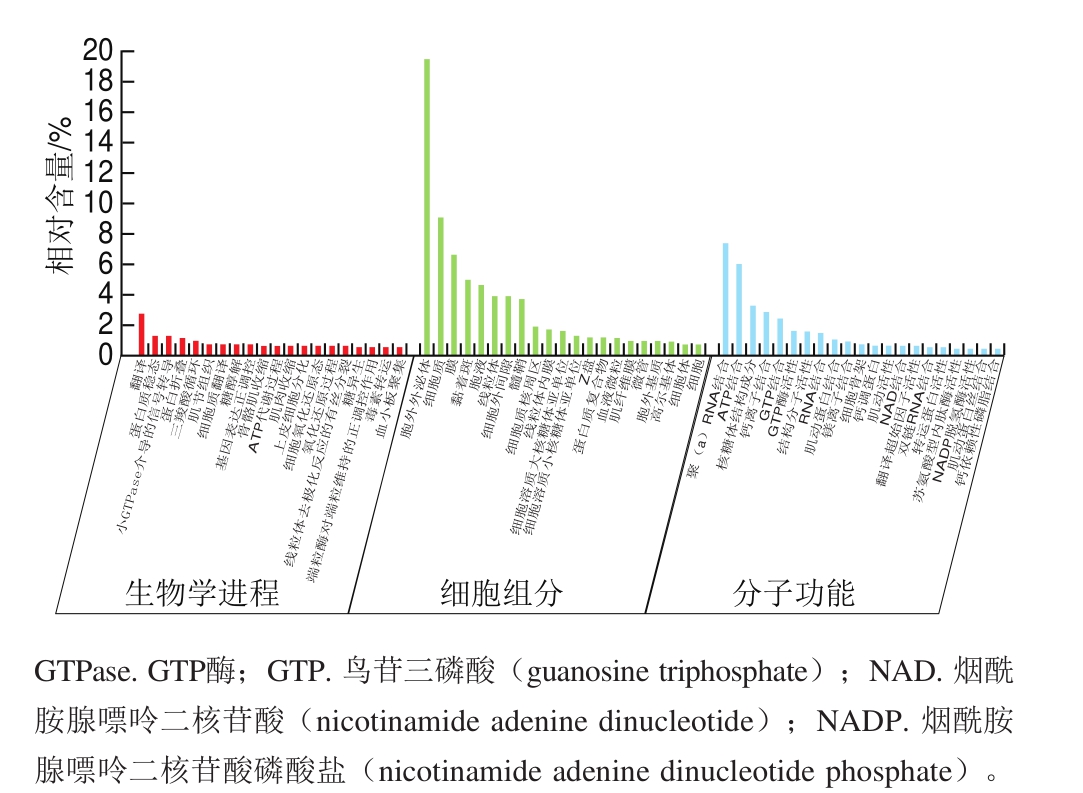
图3 GO富集分析
Fig. 3 GO enrichment analysis
对总蛋白进行GO组分富集分析,由图3可知,在生物学进程中参与生物学转化过程的蛋白质最多,其次为蛋白质稳定化功能;在细胞组分中,富集于胞外外泌体中的蛋白质最多,其次富集于细胞质内;在分子功能中,参与分子功能的多聚核糖核酸结合功能的蛋白质最多,其次为ATP结合功能。
主成分分析是基于原有变量建立两两不相关的反应差异蛋白质组数据原有信息的新变量信息[11]。通过主成分分析构建反映鸡胸肉与鸡腿肉差异蛋白质组信息的分析图,直观显示鸡腿肉和鸡胸肉的蛋白质组成差异。
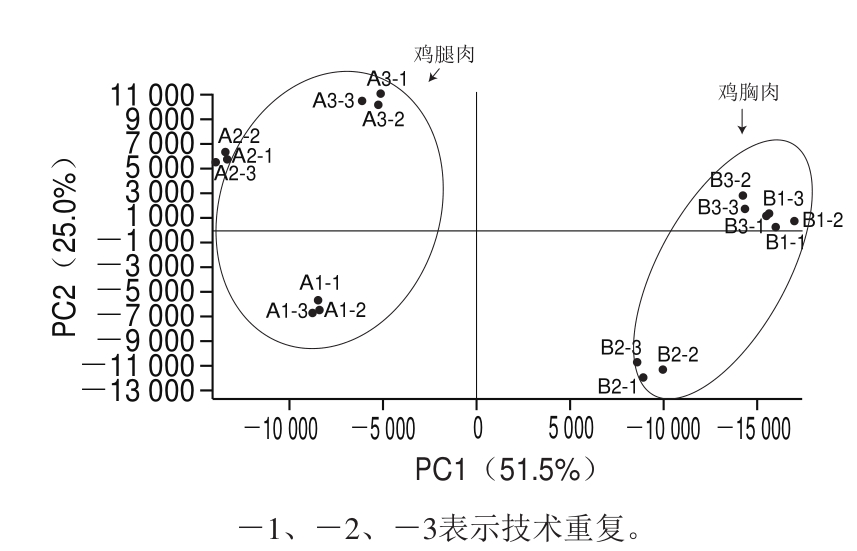
图4 鸡胸肉与鸡腿肉的主成分分析
Fig. 4 Principal component analysis of differentially expressed proteins in chicken breast and thigh meat
由图4可知,技术重复性均较好,表明仪器状态良好,数据可信,并且2 组分布在不同区间,说明鸡腿肉与鸡胸肉的蛋白质组有较大差异。

图5 鸡腿肉和鸡胸肉差异表达蛋白火山图
Fig. 5 Volcano map of differentially expressed proteins in chicken breast and thigh meat
由图5可知,以P value<0.05、Fold Change>2或<0.5作为阈值,筛选出鸡腿肉和鸡胸肉的差异蛋白98 个。其中鸡腿肉中上调蛋白71 个,鸡腿肉中下调蛋白,即鸡胸肉中上调蛋白27 个。
对鸡腿肉中的上调蛋白进行GO组分富集分析,由图6可知,这些蛋白参与酰基辅酶A脱氢酶催化的脂肪酸β-氧化、三羧酸循环及脂质体内平衡等生物学过程;在细胞组分中,主要富集于线粒体;在分子功能中,参与氧化还原酶活性功能、脂肪酰基辅酶A结合功能、NAD结合功能、肌动活动功能、电子载体活性、黄素腺嘌呤二核苷酸结合功能及催化活性等。
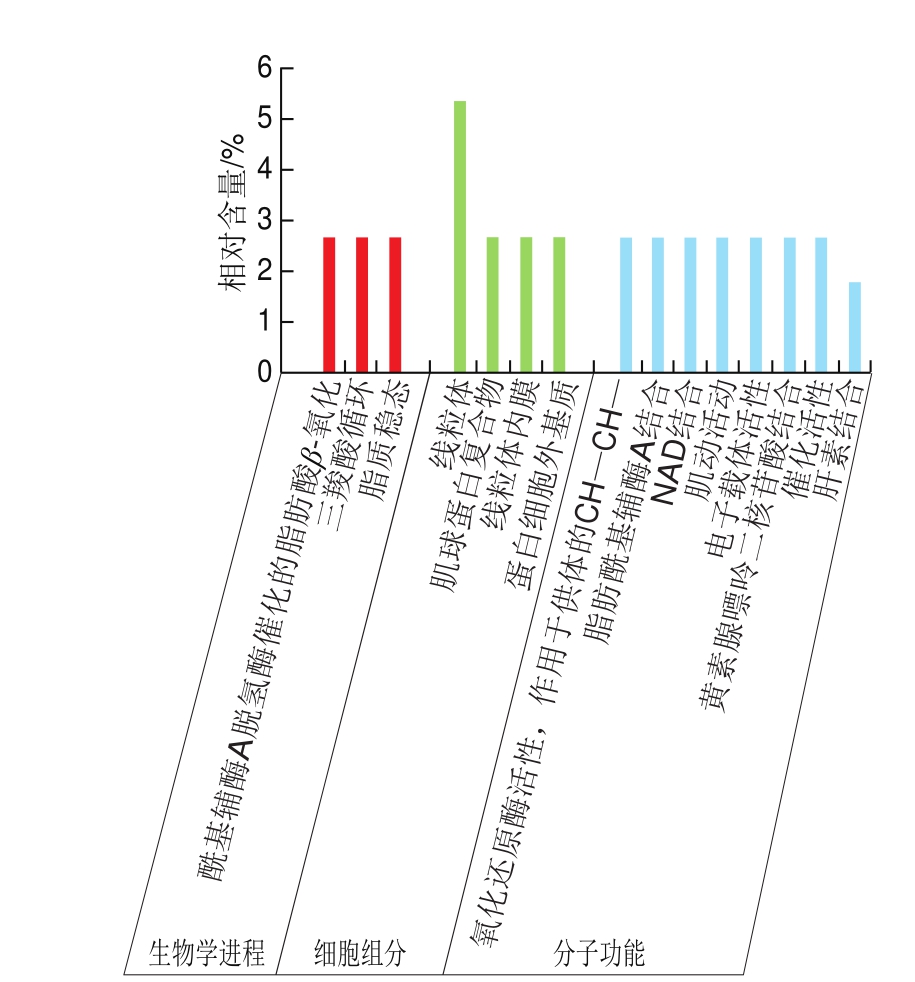
图6 鸡腿肉中上调蛋白的GO富集分析
Fig. 6 GO enrichment analysis of up-regulated proteins in chicken thigh meat

图7 鸡胸肉中上调蛋白的GO富集分析
Fig. 7 GO enrichment analysis of up-regulated proteins in chicken breast meat
对鸡胸肉中的上调蛋白进行GO组分富集分析,由图7可知,在生物学进程中,骨骼肌收缩与心肌收缩过程中富集的蛋白质最多;在细胞组分中富集于胞外外泌体中的蛋白质最多,且没有蛋白质富集于分子功能中。
蛋白质是生理功能的执行者,利用蛋白质组学方法可以从全新的角度来分析与肉质相关的问题,有望运用蛋白质组学技术对肌肉品质进行有效控制[18-20]。研究表明,蛋白质组成的变化可能引起与肌肉嫩度相关的变化[21]。目前,蛋白质组学多用于筛选多组样品之间关键的有意义差异蛋白[22-23]。本研究利用DIA技术鉴定鸡胸肉与鸡腿肉的总蛋白,再利用SWATH技术对鸡胸肉与鸡腿肉进行定量分析,筛选差异蛋白,并通过GO富集分析差异蛋白肉的功能特性,为不同类型鸡肉形成的分子机制研究提供参考。
对鸡肉进行分类发现,鸡腿肉是红肌肌肉,而鸡胸肉是白肌肌肉,红肌肌肉和白肌肌肉在化学组成和执行功能上存在一定差异[24]。Lesiow等[25]研究发现,鸡腿肉蛋白形成的凝胶比鸡胸肉蛋白凝胶硬度小。Fretheim等[26]研究表明,鸡胸肉蛋白的保水性显著大于鸡腿肉蛋白。廖国周等[27]运用双向电泳技术筛选云南腾冲雪鸡腿肌与胸肌的差异蛋白,结果表明,腿肌含有高表达蛋白点56 个,经鉴定,对应9 种蛋白质;胸肌中含有高表达蛋白点54 个,对应10 种蛋白质。本研究筛选出鸡腿肉中的高表达蛋白71 个,鸡胸肉中27 个,鉴定数量较多。鸡腿肉中的上调蛋白主要参与酰基辅酶A脱氢酶催化的脂肪酸β-氧化、三羧酸循环等生物学过程;在分子功能中,其主要参与氧化还原酶活性、脂肪酰基辅酶A结合等功能;并且主要富集于细胞组分线粒体内。三羧酸循环是化学合成和能量代谢的核心,氧化还原酶可以催化底物发生氧化还原反应,而线粒体则是进行氧化代谢的重要细胞器[28-29]。由GO富集分析可知,鸡腿肉中的高表达蛋白均富集于运动相关功能中,可能与腿肌具有负重与行走等功能、需参与有氧与无氧运动有关。对韩国土鸡腿肉运用双向电泳分析蛋白差异发现,高表达的蛋白质主要为磷酸葡萄糖变位酶1、肌钙蛋白、热休克蛋白B1、细胞色素C还原酶、乙醛酸酶1和DNA甲基转移酶3b,其中磷酸葡萄糖变位酶1、肌钙蛋白和乙醛酸酶1等均与腿肌运动相关,此结果与本研究对鸡腿肉的功能推测相符[30]。对鸡胸肉中的上调蛋白进行GO组分富集分析,结果表明,在生物学过程中,在骨骼肌收缩与心肌收缩过程富集的蛋白质较多,在细胞组分中富集于胞外外泌体中的蛋白质最多,且没有蛋白质富集于分子功能中。鸡胸部肌肉的主要功能有使肱骨内收、协助肱骨内旋、辅助深呼吸肌及上提肋骨等,因此可能导致鸡胸肉中富集于肌肉收缩功能的上调蛋白较多。Cai等[31]研究木质鸡胸肉和普通鸡胸肉,运用双向电泳技术筛选出8 个差异蛋白点,分别为与肌肉收缩、蛋白衔接、血浆中蛋白、糖酵解、ATP再生功能相关的蛋白质,而肌肉收缩、ATP再生功能与本研究鸡胸肉所参与的功能基本相符。2 组数据的GO富集分析结果表明,鸡腿肉和鸡胸肉中的高表达蛋白均富集于完全不同的功能中,这与鸡腿肉与鸡胸肉的肉质差异有关。
鸡腿肉和鸡胸肉中共有875 个蛋白质与16 855 条肽段,共筛选出98 个差异蛋白,其中包括鸡腿肉中的上调差异蛋白71 个。GO功能分析结果表明,鸡腿肉中的高表达蛋白均富集于运动相关功能中,而鸡胸肉中的上调蛋白多富集于肌肉收缩功能。
[1] 陶柏秋, 徐红颖. 兔肉与鸡肉、猪肉中脂肪和蛋白质含量的比较分析[J]. 黑龙江畜牧兽医, 2015(6): 118-120. DOI:10.13881/j.cnki.hljxmsy.2015.0387.
[2] 巨晓军, 刘一帆, 章明, 等. 鸡肉品质性状评价指标与方法研究进展[J]. 中国家禽, 2019, 41(2): 44-48. DOI:10.16372/j.issn.1004-6364.2019.02.010.
[3] 扈文盛. 常用食品数据手册[M]. 北京: 中国食品出版社, 1989: 450-451.
[4] NEGRÃO C C, MIZUBUTI I Y, MORITA M C, et al. Biological evaluation of mechanically deboned chicken meat protein quality[J]. Food Chemistry, 2005, 90: 579-583. DOI:10.1016/j.foodchem.2004.05.017.
[5] 陈伟, 刘伟胜. 纯鸡肉粉营养及其生产工艺发展现状[J]. 现代食品,2018(17): 167-169. DOI:10.16736/j.cnki.cn41-1434/ts.2018.17.047.
[6] 王海超, 张德权, 曹立创, 等. 质量等级对白羽肉鸡肌肉质构特性的影响[J]. 食品科技, 2018, 43(4): 102-108. DOI:10.13684/j.cnki.spkj.2018.04.021.
[7] 刘娜. 鸡腿肉中肌原纤维蛋白的性质研究[D]. 天津: 天津商业大学,2012: 1-2. DOI:10.13684/j.cnki.spkj.2018.04.021.
[8] 周雪松, 赵谋明, 林伟锋, 等. 鸡肉蛋白质组成与分离研究[J]. 食品与发酵工业, 2005(10): 9-12. DOI:10.13995/j.cnki.11-1802/ts.2005.10.003.
[9] 赵雅娟, 苏琳, 尹丽卿, 等. 蛋白质组学技术在肉品质中的研究进展[J].食品工业, 2016, 37(4): 233-236.
[10] PANDEY A. Proteomics to study genes and genomes[J]. Nature, 2000,405(6788): 837-846. DOI:10.1038/35015709.
[11] KIM G D, YANG H S, JEONG J Y. Intramuscular variations of proteome and muscle fiber type distribution in Semimembranosus and Semitendinosus muscles associated with pork quality[J].Food Chemistry, 2017, 429(16): 143-152. DOI:10.1016/j.foodchem.2017.10.046.
[12] XING Tong, WANG Chong, ZHAO Xue, et al. Proteome analysis using isobaric tags for relative and absolute analysis quantitation(iTRAQ) reveals alterations in stress-induced dysfunctional chicken muscle[J]. Journal of Agricultural and Food Chemistry, 2017, 65(13):2913-2922. DOI:10.1021/acs.jafc.6b05835.
[13] ROSA A F, MONCAU C T, POLETI M D, et al. Proteome changes of beef in Nellore cattle with different genotypes for tenderness[J]. Meat Science, 2017, 138: 1-9. DOI:10.1016/j.meatsci.2017.12.006.
[14] 谢遇春. 内蒙古绒山羊骨骼肌差异蛋白质组学研究[D]. 呼和浩特:内蒙古农业大学, 2018: 19-30.
[15] LAMETSCH R, KARLSSON A, ROSENVOLD K, et al. Postmortem proteome changes of porcine muscle related to tenderness[J]. Journal of Agricultural and Food Chemistry, 2003, 51(24): 6992-6997.DOI:10.1021/jf034083p.
[16] 黄晓毅. 生鲜猪肉品质变化的差异蛋白质组学研究[D]. 杭州: 浙江工商大学, 2010: 11-12.
[17] DOHERTY M K, MCLEAN L, HAYTER J R, et al. The proteome of chicken skeletal muscle: changes in soluble protein expression during growth in a layer strain[J]. Proteomics, 2004, 4(7): 2082-2093.DOI:10.1002/pmic.200300716.
[18] 毛衍伟, 张一敏, 朱立贤, 等. 应用蛋白质组学研究肉品品质形成的机理[J]. 食品与发酵工业, 2014, 40(9): 107-114. DOI:10.13995/j.cnki.11-1802/ts.2014.09.052.
[19] LUO J, SHEN Y L, LEI G H. Correlation between three glycometabolic-related hormones and muscle glycolysis, as well as meat quality, in three pig breeds[J]. Journal of the Science of Food and Agriculture, 2016, 97(9): 2706-2713. DOI:10.1002/jsfa.8094.
[20] RYU Y C, KIM B C. The relationship between muscle fiber characteristics, postmortem metabolic rate, and meat quality of pig Longissimus dorsi muscle[J]. Meat Science, 2005, 71(2): 351-357.DOI:10.1016/j.meatsci.2005.1004.1015.
[21] POLATI R, MENINI M, ROBOTTI E, et al. Proteomic changes involved in tenderization of bovine Longissimus dorsi muscle during prolonged ageing[J]. Food Chemistry, 2012, 135(3): 2052-2069.DOI:10.1016/j.foodchem.2012.006.093.
[22] POON T C W, JOHNSON P J. Proteome analysis and its impact on the discovery of serological tumor markers[J]. Clinica Chimica Acta,2001, 313(1): 231-239. DOI:10.1016/S0009-8981(01)00677-5.
[23] SAYD T, MORZEL M, CHAMBON C, et al. Proteome analysis of the sarcoplasmic fraction of pig Semimembranosus muscle: implications on meat color development[J]. Journal of Agricultural and Food Chemistry, 2006, 54(7): 2732-2737. DOI:2710.1021/jf052569v.
[24] ZHANG Q, LEE H G, HAN J A, et al. Differentially expressed proteins during fat accumulation in bovine skeletal muscle[J]. Meat Science, 2010, 86(3): 814-820. DOI:10.1016/s0309-1740(02)00206-1.
[25] LESIOW T, XIONG YoulingL.. Chicken muscle homogenate gelation properties: effect of pH and muscle fiber type[J]. Meat Science, 2003,64(4): 399-403.
[26] FRETHEIM K, SAMEJIMA K, EGELANDSDAL B. Myosins from red and white bovine muscles: Part 1-Gel strength (elasticity) and water-holding capacity of heat-induced gels[J]. Food Chemistry, 1986,22(2): 107-121. DOI:10.1016/0308-8146(86)90029-4.
[27] 廖国周, 王桂瑛, 程志斌, 等. 云南腾冲雪鸡肌肉蛋白质组学研究[J].肉类研究, 2013, 27(7): 1-5.
[28] 文宇桥, 李晨, 宋关兵, 等. 细胞间线粒体转运的研究进展[J].生物化学与生物物理进展, 2019, 46(1): 13-19. DOI:10.16476/j.pibb.2018.0089.
[29] 杨光影, 赵彤, 田静涵, 等. 酵母线粒体ATP合酶生物合成及组装机制研究进展[J]. 菌物学报, 2018, 37(11): 1424-1440. DOI:10.13346/j.mycosystema.180223.
[30] LIU X D, JAYASENA D D, JUNG Y, et al. Differential proteome analysis of breast and thigh muscles between Korean native chickens and commercial broilers[J]. Asian-Australasian Journal of Animal Sciences, 2012, 25(6): 895-902. DOI:10.5713/ajas.2011.11374.
[31] CAI K, SHAO W, CHEN X, et al. Meat quality traits and proteome profile of woody broiler breast (Pectoralis major) meat[J]. Poultry Science, 2017, 97(1): 337-346. DOI:10.3382/ps/pex284.
Proteomic Study of Differential Proteins in Different Muscles from White Feathered Broilers Based on Sequential Window Acquisition of All Theoretical Fragment-Ion Spectra
农业农村部动物遗传育种与繁殖重点实验室开放课题项目(2019004)
LIU Zhihong, NAI Rile, XIE Yuchun, et al. Proteomic study of differential proteins in different muscles from white feathered broilers based on sequential window acquisition of all theoretical fragment-ion spectra[J]. Meat Research, 2019,33(8): 1-6. DOI:10.7506/rlyj1001-8123-20190424-083. http://www.rlyj.net.cn