鹿茸多肽研究进展
张玲莺,李墨翰,李乳姝,郑 艳,杨 梅,武俊瑞,乌日娜,岳喜庆*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:鹿茸多肽占鹿茸总湿质量的50%~60%,是鹿茸中最为重要的生理活性物质之一。本文结合前人研究成果,综述鹿茸多肽的化学成分、提取方法和分离纯化方法,着重介绍鹿茸多肽对免疫系统、神经系统、心血管系统、骨骼系统的作用及其抗疲劳、抗氧化、抗肿瘤等生物活性,并对鹿茸多肽的发展趋势及研究前景进行展望。
关键词:鹿茸多肽;化学成分;提取方法;分离纯化方法;生理作用
鹿茸是脊椎动物门哺乳纲鹿科动物马鹿(Cervuselaphus linnaeus)或梅花鹿(Cervus nippon Temminck)的雄鹿未骨化密生茸毛的幼角,前者称马鹿茸(青毛茸),后者称花鹿茸(黄毛茸)[1]。鹿茸作为我国传统的名贵中药之一,最早记载于《神农本草经》,至今已有两千多年的使用历史。马鹿与梅花鹿作为我国鹿茸资源的主要来源品种,在我国的分布十分广泛。马鹿分为8 个亚种,分别为阿尔泰亚种、阿拉善亚种、东北亚种、甘肃亚种、四川亚种、塔里木亚种、天山亚种和西藏亚种[2]。梅花鹿分为6 个亚种,分别为东北亚种、华北亚种、华南亚种、山西亚种、四川亚种和台湾亚种。马鹿与梅花鹿东北亚种的道地产区主要为吉林省和黑龙江省,其饲养量约占全国的1/2。据统计,目前鹿茸全球生产量每年接近1 300 t[3]。作为一种特殊的软骨组织和可连续再生的哺乳动物器官,鹿茸中含有多种活性因子,化学成分较为复杂且含有多种有机和无机成分,主要为蛋白质、多肽、氨基酸、维生素、激素、胶质、脂类、黏多糖、碱基、核酸、芳香族化合物、酶类、多胺、微量元素及其他无机物等[4-5]。现代医学研究表明,鹿茸的化学成分较为复杂,具有广泛的生理作用,如对免疫系统、血液循环系统、骨代谢及糖代谢的调节作用[6-7]。鹿茸多肽作为鹿茸中的天然活性成分,占鹿茸总湿质量的50%~60%,是鹿茸中最为重要的生理活性物质之一[8],因此对鹿茸多肽的研究具有重要意义。本文介绍了鹿茸多肽的化学成分、提取方法及分离纯化方法,并着重介绍了鹿茸多肽对免疫系统、神经系统、心血管系统、骨骼系统的作用及其抗疲劳、抗氧化、抗肿瘤等生物活性,综述了目前鹿茸多肽的研究进展与发展前景,以期为我国鹿茸加工行业的发展提供参考。
1 鹿茸多肽的化学成分
鹿茸多肽的化学成分及构成较为复杂,其中氨基酸是鹿茸多肽的基本组成单位。研究表明,鹿茸多肽中已检测出7 种必需氨基酸、11 种非必需氨基酸[9-11]。不同品种、同一品种不同部位的鹿茸多肽中氨基酸含量与种类差异很大,必需氨基酸中亮氨酸和缬氨酸含量较高,非必需氨基酸中甘氨酸、谷氨酸和丙氨酸的含量较高[9,11]。
同时,鹿茸多肽的分子质量也因品种、部位、提取方式的不同而有所差异:王华等[12]采用硫酸胺分级沉淀、凝胶层析柱及高效液相色谱柱对鹿茸多肽进行提取纯化,得到的多肽分子质量小于800 Da;周秋丽等[13]采用电泳与质谱相结合的方法,从梅花鹿鹿茸中提取出分子质量约为1~3 kDa的多肽;王丰等[14]通过凝胶过滤、离子交换、高效液相色谱、电泳及质谱等一系列技术手段,从马鹿鹿茸中提取出分子质量为3 095.1 Da的多肽;翁梁等[15]采用柱色谱及反相高效液相色谱等方法从马鹿鹿茸中提取出一种由32 个氨基酸残基组成(32肽)的分子质量为3 216 Da的单体多肽化合物,但该多肽在梅花鹿鹿茸多肽组分中未被检出,说明其极可能是马鹿鹿茸中特有的活性物质;张郑瑶等[11]从梅花鹿鹿茸中分离出一种新多肽,并进一步通过激光解析电离飞行时间质谱法(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF MS)分析得出该多肽的分子质量为3 263.4 Da,氨基酸序列为VLSATDKTNV LAAWGKVGGNAPAFGAEALERM,此梅花鹿鹿茸多肽与翁梁等[15]提取的马鹿鹿茸多肽在结构上较为相似,均由包含32 个氨基酸残基的直链多肽组成,但第5、8、11和30位氨基酸残基不同;严铭铭等[9]从梅花鹿鹿茸中分离提取出1 种分子质量为1 479.902 8 Da的单体多肽CNT14,并使用电喷雾串联质谱法测得其氨基酸序列为EPTVLDEVCLAHGP;霍玉书等[16]利用分子筛从冷冻鹿茸的缓冲液提取物中分离得到的蛋白质多肽类物质分子质量在10 kDa以上。
2 鹿茸多肽的提取工艺
几种常用的鹿茸多肽提取方法及其优缺点如表1所示。
表 1 不同鹿茸多肽提取方法的比较
Table 1 Comparison of different extraction methods for velvet antler polypeptides
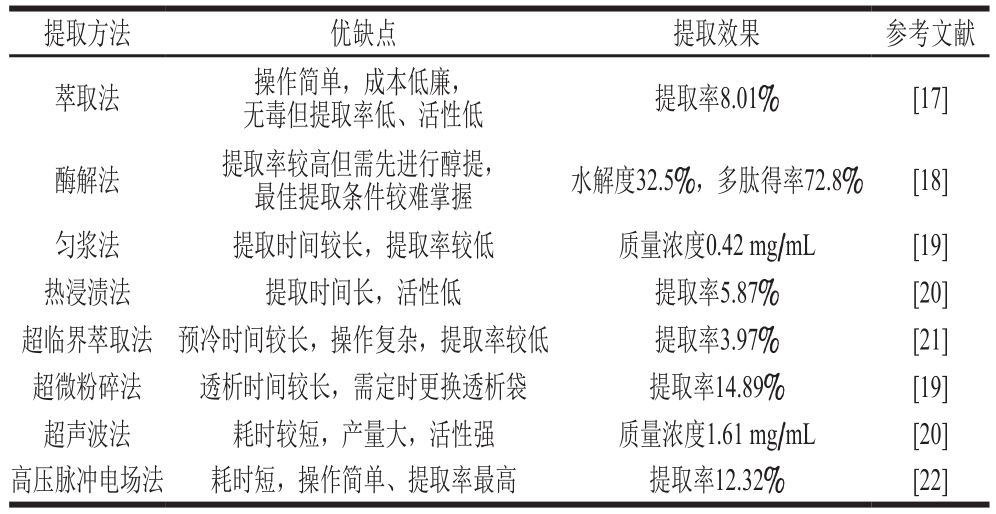
提取方法 优缺点 提取效果 参考文献萃取法 操作简单,成本低廉,无毒但提取率低、活性低 提取率8.01% [17]酶解法 提取率较高但需先进行醇提,最佳提取条件较难掌握 水解度32.5%,多肽得率72.8% [18]匀浆法 提取时间较长,提取率较低 质量浓度0.42 mg/mL [19]热浸渍法 提取时间长,活性低 提取率5.87% [20]超临界萃取法 预冷时间较长,操作复杂,提取率较低 提取率3.97% [21]超微粉碎法 透析时间较长,需定时更换透析袋 提取率14.89% [19]超声波法 耗时较短,产量大,活性强 质量浓度1.61 mg/mL [20]高压脉冲电场法 耗时短,操作简单、提取率最高 提取率12.32% [22]
2.1 萃取法
有机溶剂在自然界中分布广泛,使用有机溶剂对鹿茸多肽进行萃取不仅造价低廉、安全无毒性,而且方便后续回收和处理。乙醇常被用作萃取剂来提取鹿茸中的蛋白质及多肽等有效成分,董万超等[23]采用乙醇萃取法对梅花鹿鹿茸多肽进行提取,成功分离出2 种不同组分;吴庆燕等[24]分别采用乙醇和丙酮提取鹿茸多肽,并对鹿茸多肽的活性进行检测;张展[17]采用乙醇萃取的方式提取鹿茸多肽,并证明分子质量0.5~0.6 kDa的寡肽促进人脂肪间充质干细胞增殖的效果最好。在我国绝大部分鹿产品加工厂内,萃取法是提取鹿茸中有效成分最为普遍的手段。但是在采用有机溶剂萃取鹿茸多肽时,会对鹿茸多肽的活性造成一定的破坏,并且提取过程要始终保持低温,增加了提取成本。
2.2 酶解法
酶解法提取鹿茸多肽不受温度条件的限制,在对酶种类、反应温度、反应时间、酶添加量及pH值等条件进行合理分析及实验,筛选出最佳组合后,能提取出活性更强、纯度更高、产量更多的鹿茸多肽,更有利于工业化生产。徐明等[18]将胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、复合蛋白酶两两组合,筛选出的最佳提取组合为温度48 ℃、pH 7.2、底物质量浓度7.5 g/100 mL、酶浓度6 000 U/g、胰蛋白酶和复合蛋白酶比例1∶1、水解时间4 h,在此条件下水解度为32.5%,多肽得率为72.8%;王华等[12]考察酶用量、底物浓度和反应时间对酶解法提取鹿茸多肽的影响,确定最佳条件为酶与底物质量比1∶150、底物与溶剂质量比1∶13、水解时间60 min,最终测得蛋白含量为70.45%。由此可见,酶解法提取鹿茸多肽的提取率高于萃取法,但酶解法在提取前大多需要进行醇提,且需要调控的因素过多,最佳提取条件较难确定。
2.3 超声波法
超声波法提取鹿茸多肽采用超声波振动的方式,溶剂快速进入样品中,将鹿茸多肽尽可能完全地溶解于有机溶剂中。才凤等[25]采用超声波法提取鹿茸多肽,经正交试验得出最适条件为料液比1∶10、提取3 次、提取时间10 min;朱国丰[26]对提取时间、提取次数、浓度及pH值进行优化,筛选出的最佳条件为乙醇胺-盐酸提取液pH值为10.0、浓度4.0 mol/L、提取时间15 min、提取7 次,在此条件下鹿茸多肽的提取率为95.31 μg/g。超声波法提取鹿茸多肽耗时较短、成本低、适应性广、提取物产量高且提取的鹿茸多肽活性较强,因而成为目前许多鹿产品深加工企业提高产品质量的首选。
2.4 高压脉冲电场法
高压脉冲电场提取法将液态的鹿茸多肽溶液作为电解质,利用高压电场产生的高强度脉冲破坏细胞膜,改变其通透性,使细胞内容物流出,从而达到提取效果[27]。赵景辉等[28]利用高压脉冲电场法提取鹿茸多肽,并经正交试验确定最佳组合为电场强度22 kV/cm、脉冲数8、料液比1∶12,最终鹿茸多肽的提取率为1.72%。高压脉冲电场法提取鹿茸多肽能将提取时间缩短至1 s内,最大程度减少多肽活性的降低,同时产量极高、操作便捷,未来有望成为鹿茸多肽提取的主流技术方法。
2.5 超微粉碎法
超微粉碎法指利用机器本身或流体动力将物料颗粒粉碎至微米甚至纳米级超细粉末的过程。李超华等[29]研究表明,超微粉碎法提取鹿茸多肽产量大、含量高、神经保护作用强,提取率高达14.892%。超微粉碎过程可在低温状态下进行,避免了局部过热的现象,并且粉碎速度较快,粒径分布均匀,能够最大限度地保留鹿茸多肽的生物活性,有利于提高提取率。
2.6 其他方法
提取鹿茸多肽的方法有很多,但每种方法各有利弊,表1列出了几种常用的鹿茸多肽提取方法及其优缺点。目前很多学者采用将表1中2 种或2 种以上方法结合的手段提高鹿茸多肽提取率,如酸醇-酶解结合法[18]、匀浆-超微粉碎结合法[20]、CO2超临界萃取法[21]等。但是由于鹿茸多肽极易受到温度、化学试剂等因素影响而变性失活,因此对鹿茸多肽提取工艺的优化仍有待研究。
3 鹿茸多肽的分离纯化
3.1 盐析法
鹿茸多肽在硫酸铵、硫酸镁、氯化钠等中性盐溶液中的溶解度随含盐量的增加而上升,而当含盐量上升到一定质量浓度时,鹿茸多肽溶解度却不断降低直至析出,这一过程称为盐析。刘唯佳[30]采用硫酸铵盐析分级沉淀与超滤杯结合的方法对鹿茸多肽进行分离纯化,提高了多肽提取率。盐析法操作简便,成本低廉,但在透析脱盐过程中蛋白质和多肽极易析出,使其变性失活。
3.2 超滤法
超滤法提取鹿茸多肽是在压力或离心力的作用下,使小分子多肽和水通过超滤膜,而大分子物质则被截留,从而达到分离纯化的目的。郝洁[31]用超滤技术提取鹿茸中的有效成分,分别用普通聚醚砜(polyethersulfone,PES)超滤膜和改性PES膜对胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)的提取进行对比实验,对鹿茸多肽的分子质量、pH值、压力和浓缩倍数等因素进行正交试验,最终得到超滤法提取的最佳组合为分子质量10 kDa、压力0.3 MPa、pH 12、浓缩倍数1.25 倍,此时膜回收蛋白率为69.20%。实际操作中,样品的密度、超滤膜的透过性、压力及流速等条件均会对结果产生影响,因此要根据提取多肽的分子质量选择适宜的超滤膜及超滤条件。
3.3 离子交换法
离子交换色谱主要分为阳离子交换柱和阴离子交换柱,主要根据蛋白质或多肽所带电荷的差异选择柱型,影响离子交换色谱分离效果的因素主要有pH值、离子强度、洗脱剂等。王本祥等[32]采用离子交换色谱法从马鹿鹿茸中提取出分子质量为3.2 kDa的多肽,并证明其具有促进骨和软骨细胞增殖的能力。离子交换色谱法能够分离出纯度较高的多肽,并进一步得到纯度更高的肽。同时,离子交换柱可以反复使用,节约成本。
3.4 电泳法
电泳法利用带电粒子在电场中移动速度不同而将鹿茸多肽分离出来。周秋丽等[13]对梅花鹿鹿茸多肽和马鹿鹿茸多肽分别采用电泳法和质谱法进行分离分析,并且对其化学组分及生物活性进行研究。结果表明,梅花鹿鹿茸多肽与马鹿鹿茸多肽的组成差异较为显著。电泳法设备简单、操作方便、分辨率较高,同时还可以准确、清晰地观察到鹿茸多肽分子质量的大小,进而能够更加直观地判断各种组分的含量。
4 鹿茸多肽的生理作用
4.1 对免疫系统的作用
免疫系统主要由免疫器官、免疫细胞及免疫活性物质构成,免疫系统分为固有免疫和适应免疫,其中适应免疫又分为体液免疫和细胞免疫。研究表明,鹿茸具有较强的免疫促进功能,从而增强机体的细胞免疫和体液免疫功能,而鹿茸多肽作为鹿茸的主要活性成分,经验证能够提高细胞免疫和体液免疫能力,具有明显的免疫促进功能[33-34]。从梅花鹿中提取分子质量为3.2 kDa的鹿茸多肽(nVAP32)用于小鼠免疫实验,结果表明,nVAP32能显著刺激脾细胞的增殖,增强淋巴细胞亚群的繁殖能力,同时nVAP32还显示出上调相关细胞因子表达的显著能力[35];进一步采用比色法评估脾细胞增殖和细胞杀伤活性表明,梅花鹿鹿茸重组多肽及其天然对应物均能明显刺激脾细胞增殖,提高脾细胞的增殖能力,而rVAP32也有望作为天然产物nVAP32的替代物研制新的生物制药产品[36]。也有研究指出,鹿茸多肽可以显著提高小鼠单核巨噬细胞的吞噬能力,加快小鼠T、B淋巴细胞的增殖,从而提高机体的免疫功能;同时,鹿茸多肽对多种急慢性炎症均具有明显的抑制作用,是鹿茸抗炎、镇痛的主要功能成分之一[37]。Kim等[38]采用鹿茸的水溶性提取液(含有蛋白质、多肽类物质)对胶原蛋白诱导的关节炎大鼠进行14 d的治疗,结果表明,鹿茸提取液能够抑制关节炎的恶化,减少骨吸收,这与Suh等[39]的研究结果相似,从而进一步证明了鹿茸多肽的免疫促进功能。另外,鹿茸多肽提取物还能够加快皮肤创伤的愈合[33]。鹿茸多肽对于免疫系统的促进功能为鹿茸保健食品的研发提供了新的思路,未来也有望以鹿茸多肽为主要功能成分研发出增强免疫力、提高人体细胞防御力的功能性保健食品。
4.2 对神经系统的作用
神经系统是由神经元和神经胶质细胞构成的复杂机能系统,神经元是构成神经系统的基本机能单位。研究证实,鹿茸多肽可以加快胎鼠脑神经干细胞向神经元细胞分化的过程,同时提高分化细胞的数量,促进神经系统的再生作用,并且在一定使用剂量内呈现出剂量依赖性[40]。Wu Feifei等[41]指出,鹿茸多肽具有能明显改善东莨菪碱及亚硝酸钠诱导小鼠学习记忆障碍的能力。赵天一等[42]采用降支结扎法建立大鼠心肌缺血模型,实验显示,抑制神经细胞凋亡蛋白的表达在鹿茸多肽高、中、低剂量组中均增加,在模型组下降;促进神经细胞凋亡蛋白在2 组中的表达趋势则刚好相反,说明鹿茸多肽可以通过调节抑制神经细胞凋亡蛋白和促进神经细胞凋亡蛋白的比值来抑制神经细胞凋亡。也有研究证实,鹿茸多肽可以降低1-甲基-4-苯基-吡啶离子(1-methyl-4-phenyl pyridinium,MPP+)诱导的SH-SY5Y人神经母细胞瘤细胞损伤,起到一定程度的神经元保护作用[43]。Zhang Lihong等[44]进一步发现,鹿茸多肽能够在体外诱导神经干细胞向神经元的分化,分化细胞与神经元极为相似,并且检测出一些特殊生长因子,如胶质细胞源性神经营养因子、神经生长因子等,而分化的神经元细胞可以表征为特殊的神经分子。鹿茸对神经系统及记忆力的增强作用使得日后相关产品的开发成为可能,但对相关通路的机理还有待进一步研究。同时,因鹿茸多肽对于神经系统在一定使用剂量内呈现出剂量依赖性,其使用安全性及毒副作用还有待进一步评估。
4.3 对心血管系统的作用
早在古代,鹿茸就已被用于心律失常、心衰等心血管系统疾病的治疗。心血管系统是一个封闭的管道系统,主要由心脏和血管组成,有关鹿茸多肽对心血管系统作用的研究也多集中在心脏细胞与血管细胞。Xiao Xiang等[45]采用液相色谱-质谱联用技术,对缺血缺氧条件下心脏微血管内皮细胞的增殖、凋亡情况及线粒体膜电位检测后发现,鹿茸多肽能够明显减少凋亡细胞的数量,增强心脏微血管内皮细胞的活力和增殖能力,并通过调节对应信号通路改善缺血缺氧诱导的心脏微血管内皮细胞损伤。Zhao Lihong等[46]用鹿茸多肽对横向主动脉缩窄术诱导的心脏纤维化大鼠灌胃后得出,鹿茸多肽能够破坏转化生长因子β1与其受体的结合,阻断血管紧张素的下游信号传导,从而达到对心脏的抗纤维化作用。Zhu Wenhe等[47]对过氧化氢诱导损伤的静脉内皮细胞的线粒体膜电位、细胞内活性氧水平及细胞凋亡相关蛋白进行检测后发现,鹿茸多肽能够显著增强其细胞生存能力,降低细胞凋亡率,并调节过氧化氢造成的下游信号传导凋亡的相关表达。目前市场上已经出现以鹿茸为原料的心脑血管保健食品及药品,但由于鹿茸多肽对心血管系统的作用机制并不完全明确,且对于以鹿茸多肽作为主要功能成分的靶向研究较为缺乏,因此高纯度鹿茸多肽的保健功能食品或药品仍有待开发。
4.4 对骨骼的作用
鹿茸多肽对骨质疏松具有一定的治疗作用,且疗效稳定,安全性高。目前对鹿茸多肽抗骨质疏松的研究较多:梅花鹿鹿茸多肽具有促进维A酸诱导骨质疏松大鼠成骨细胞增殖的作用,使骨吸收小于骨形成,起到抗骨质疏松的效果,且当多肽质量浓度为20 mg/kg时,软骨细胞和成骨细胞的增殖情况最好,骨折的愈合率最高[48];鹿茸多肽还能加快骨折大鼠骨痂的形成,促进骨痂内骨胶原和钙盐的积累,改善骨折部位的生物力学性能,从而缩短骨折愈合时间,促进骨折愈合[49];Li Na等[50]基于高分离度快速液相色谱-四极杆飞行时间质谱(rapid resolution liquid chromatography coupled with quadrupole-timeof-flight tandem mass spectrometry,RRLC-Q-TOF/MS)代谢组学技术对骨折大鼠的尿液进行检测后得出,鹿茸多肽对骨质疏松症的作用可能与其调节氨基酸代谢和磷脂代谢功能有关。采用聚合酶链式反应(polymerase chain reaction,PCR)实时定量技术对青春期大鼠成骨细胞基因、胶原、碱性磷酸酶、骨钙素和骨桥蛋白的表达进行检测后得出,鹿茸多肽能够显著刺激成骨基因的表达,并对青春期大鼠的骨生长有促进作用[51],有望作为生长迟缓的青少年和先天性生长障碍患者的食品补充剂。
4.5 抗疲劳作用
研究表明,鹿茸多肽能够增加骨骼肌肌钙蛋白mRNA的表达,并通过上调肌肉收缩相关基因来增加肌肉力量,进而表现出抗疲劳效应[52]。罗翔丹等[53]使用不同质量浓度鹿茸多肽对小鼠进行连续30 d灌胃,对小鼠进行常压耐缺氧实验、断头缺氧实验、爬杆实验、负重游泳实验等耐缺氧实验后得出,鹿茸多肽灌胃后的小鼠耐缺氧能力增强,且其耐缺氧能力与鹿茸多肽的剂量呈正相关,小鼠血清中的乳酸质量浓度与鹿茸多肽的剂量呈负相关,由此可以证明鹿茸多肽具有良好的耐缺氧和抗疲劳作用。也有研究通过基因芯片测定血糖、血尿和乳酸等多项疲劳指标的含量,发现鹿茸多肽通过上调负责肌肉收缩的基因表达、增加肌肉的力量来达到抗疲劳作用[52]。
4.6 抗氧化作用
研究证实鹿茸多肽具有较强的抗氧化作用[54],当其质量浓度达到10 mg/mL以上时,对羟自由基的清除作用高达100%,且在一定的范围内呈现出剂量依赖关系[12]。刘春娟[55]采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、羟自由基清除能力、超氧阴离子自由基清除能力、脂质体氧化抑制能力及还原能力5 种方法综合比较不同分子质量鹿茸多肽的抗氧化活性,得出分子质量6 214 Da以下、质量浓度8.0~10.0 mg/mL的鹿茸多肽抗氧化活性最强。李思明等[56]也得出相同的结论,在将鹿茸多肽溶解于细胞培养液中后,检测细胞中丙二醛、羟脯氨酸的质量浓度及过氧化氢酶活性,结果表明,鹿茸多肽能够增强细胞的抗氧化能力。
4.7 抗肿瘤作用
鹿茸多肽能够抑制前列腺癌肿瘤细胞的增殖能力并诱导其凋亡,在用8 μg/kg的剂量急性口服灌胃后,小鼠的骨髓微核实验和精子畸形实验阴性结果表明,鹿茸多肽对致突变性无明显毒性,由此说明其具有较高的生物安全性[57]。徐岩等[58]向胶质瘤细胞中加入不同质量浓度的鹿茸多肽继续培养,48 h后观察显微镜下细胞的形态学变化,结果表明,鹿茸多肽能够将细胞阻滞在G2/M期,从而对人胶质瘤细胞的增殖表现出抑制作用,并具有量效关系。杨吉利等[59]使用鹿茸多肽对乳腺癌细胞诱导的乳腺癌骨转移大鼠连续给药20 d,结果表明,鹿茸多肽能抑制破骨细胞的过度激活,并可以减少骨吸收和保护骨质,维持成骨作用和破骨作用的平衡,从而抑制肿瘤的生长。
4.8 其他作用
鹿茸多肽具有一定的抗肥胖作用,Ding等[60]采用鹿茸多肽,以300 mg/kg的剂量对小鼠连续灌胃13 周后,发现其能够显著降低由高脂饮食引起的体质量、血清葡萄糖和甘油三酯的升高,同时还能够减少肝脏脂滴的积聚程度及脂肪细胞的大小;鹿茸多肽还具有降低血糖血脂的作用,对链脲佐菌素诱导的糖尿病小鼠采取300 μg/kg剂量的鹿茸多肽腹膜给药后,小鼠的血糖和胰岛素质量浓度显著增加,并且有效改善了糖尿病小鼠的脂质代谢[61]。
5 结 语
鹿茸多肽作为鹿茸中的主要生物活性成分之一,近年来已引起中外研究者的广泛关注。但是由于鹿茸价格高昂且较难获得,同时由于鹿茸多肽性质不稳定,极易受温度、化学试剂等条件影响而变性失活,因此对于鹿茸多肽单体的提取与分离纯化工艺仍有待进一步研究与优化。鹿茸多肽作为鹿茸中最为重要的活性物质之一,具有多种生理功能:在免疫系统方面,可以增强细胞免疫和体液免疫功能;在神经系统方面,可以加快神经细胞的再生作用,抑制神经细胞凋亡;在心血管系统方面,可以增强心血管内皮细胞的繁殖能力;同时还具有抗疲劳、抗氧化、抗肿瘤等其他生理功能。目前,国内外对于鹿茸多肽化学成分和结构组成的研究相对滞后,其作用机理尚不明确,无法定位发挥鹿茸多肽的生理功能及作用。因此利用蛋白质组学、代谢组学等前沿科技,阐明鹿茸多肽各种生理作用的机制,寻找特异性治疗的靶点,有望进一步加强对鹿茸多肽的了解与认识,并使其科学性得到不断拓展和开发。
参考文献:
[1] HUO Yushu, HUO Hong, ZHANG Jie. The contribution of deer velvet antler research to the modern biological medicine[J]. Chinese Journal of Integrative Medicine, 2014, 20(10): 723-728. DOI:10.1007/s11655-014-1827-1.
[2] 周璨林, 陈开旭, 马合木提·哈力克. 马鹿的演化与种系发生进展[J].新疆大学学报(自然科学版), 2016, 33(4): 384-387; 398.
[3] 郭延蜀, 郑惠珍. 中国梅花鹿地史分布、种和亚种的划分及演化历史[J]. 兽类学报, 2000, 20(3): 168-179.
[4] 王志兵, 邱芳萍, 解耸林. 鹿角盘蛋白多肽的制备与活性研究[J]. 中国食品学报, 2008(3): 28-32.
[5] KANG S K, KIM K S, KIM S I, et al. Immunosuppressive activity of deer antler extracts of Cervus korean TEMMINCK var. mantchuricus Swinhoe, on type Ⅱ collagen-induced arthritis[J]. In Vitro Cellular and Developmental Biology-Animal, 2006, 42(3/4): 100-107.DOI:10.2307/4295672.
[6] KIM K H, KIM K S, CHOI B J, et al. Anti-bone resorption activity of deer antler aqua-acupunture, the pilose antler of Cervus korean TEMMINCK var. mantchuricus Swinhoe (Nokyong) in adjuvantinduced arthritic rats[J]. Journal of Ethnopharmacology, 2005, 96(3):497-506. DOI:10.1016/j.jep.2004.09.039.
[7] LI Chunyi, ZHAO Haiping, LIU Zhen, et al. Deer antler: a novel model for studying organ regeneration in mammals[J]. The International Journal of Biochemistry and Cell Biology, 2014, 56:111-122. DOI:10.1016/j.biocel.2014.07.007.
[8] SKEDROS J G, KEENAN K E, COOPER D M L, et al.Histocompositional organization and toughening mechanisms in antler[J]. Journal of Structural Biology, 2014, 187(2): 129-148.DOI:10.1016/j.jsb.2014.06.004.
[9] 严铭铭, 曲晓波, 王旭, 等. 梅花鹿茸中活性多肽的纯化、测序及功能研究[J]. 高等学校化学学报, 2007(10): 1893-1896.
[10] 杨阳. 鹿茸活性肽的分离提纯及成分测定[J]. 林业科技, 2016,41(4): 77-78.
[11] 张郑瑶, 段冷昕, 周秋丽, 等. 梅花鹿茸多肽的化学结构及生物活性[J]. 高等学校化学学报, 2012, 33(9): 2000-2004.
[12] 王华, 黄宜兵, 高科翔, 等. 酶解鹿茸肽的制备、纯化及抗氧化活性[J]. 高等学校化学学报, 2010, 31(12): 2390-2395.
[13] 周秋丽, 刘永强, 王颖, 等. 梅花鹿茸和马鹿茸多肽化学性质及生物活性比较[J]. 中国中药杂志, 2001(10): 51-54.
[14] 王丰, 梅子青, 周秋丽, 等. 鹿茸多肽的分离纯化及药理活性[J].吉林大学学报(理学版), 2003(1): 111-114.
[15] 翁梁, 周秋丽, 王丽娟, 等. 鹿茸多肽促进表皮和成纤维细胞增殖及皮肤创伤愈合[J]. 药学学报, 2001(11): 817-820.
[16] 霍玉书, 霍虹. 鹿茸神经生长因子活性及促分化作用的研究[J].中药新药与临床药理, 1997(2): 16-18; 63.
[17] 张展. 鹿茸肽促进人脂肪来源间充质干细胞增殖及成软骨分化的研究[D]. 长春: 吉林大学, 2011: 32-33.
[18] 徐明, 岳喜庆. 酶解法制备鹿茸多肽的研究[J]. 食品工业科技, 2012,33(5): 205-207.
[19] 张维, 于珊珊, 尹宏兵. 超声破碎法及匀浆法提取鹿茸多肽的比较研究[J]. 吉林中医药, 2017, 37(12): 1252-1254.
[20] 李超华. 鹿茸蛋白提取方法的建立和神经保护作用研究[D]. 哈尔滨: 东北农业大学, 2016: 7-13.
[21] 高冷, 王昊天, 牛晓晖, 等. 鹿茸多肽蛋白的提取及功能研究[J]. 吉林中医药, 2018, 38(7): 825-828.
[22] 董思敏, 王海璐, 王全凯, 等. 高压脉冲电场法联合提取鹿茸中蛋白质、多糖的工艺优化[J]. 中国药学杂志, 2016, 51(8): 620-624.
[23] 董万超, 张秀莲, 刘春华, 等. 梅花鹿茸多肽新成分的提取分离及其生物效应研究[J]. 特产研究, 2000(2): 7-10.
[24] 吴庆燕, 宋健, 贾泓瑶, 等. 促渗剂对鹿茸多肽透皮吸收的影响及鹿茸多肽免疫活性检测[J]. 中国兽医学报, 2012, 32(11): 1703-1707.
[25] 才凤, 苗翠, 李洪江. 鹿茸多肽超声提取工艺研究[J]. 实用药物与临床, 2012, 15(1): 32; 51.
[26] 朱国丰. 超声提取-超滤-冻干工艺用于分离鹿茸中胰岛素样生长因子-1的研究[D]. 天津: 天津大学, 2009: 33-44.
[27] 曾新安, 高大维, 于淑娟, 等. 高压电场脉冲在食品生化工业中的应用[J]. 食品科学, 1996, 17(7): 3-6.
[28] 赵景辉, 王再幸, 赵伟刚, 等. 高压脉冲电场法快速提取鹿茸提取物工艺研究[J]. 中国现代中药, 2011, 13(2): 42-44.
[29] 李超华, 王毅, 何忠梅, 等. 鹿茸蛋白2 种不同提取方法的比较研究[J].中国生化药物杂志, 2015, 35(9): 23-25.
[30] 刘唯佳. 鹿茸中水溶性蛋白质的提取及鹿茸综合利用的研究[D]. 长春: 吉林大学, 2013: 25.
[31] 郝洁. 超临界CO2萃取-超滤浓缩技术提取分离鹿茸中有效成分的研究[D]. 天津: 天津大学, 2010: 50.
[32] 王本祥, 陈晓光, 张伟. 鹿茸有效成分对小鼠肝脏RNA和蛋白质合成的影响[J]. 药学学报, 1990(5): 321-325.
[33] DAI Tingyeu, WANG Chihhua, CHEN Kunnan, et al. The antiinfective effects of velvet antler of formosan sambar deer (Cervus unicolor swinhoei) on Staphylococcus aureus-infected mice[J].Evidence-Based Complementray and Alternative Medicine, 2011: 1-9.DOI:10.1155/2011/534069.
[34] ZHENG Kexin, FAN Yudan, JI Ruiqin, et al. Distinctive effects of pilose antler on mouse peripheral blood immune cell populations[J].Food and Agricultural Immunology, 2017, 28(3): 1-15. DOI:10.1080/0 9540105.2017.1332011.
[35] ZHA Enhui, LI Xingxia, LI Dandan, et al. Immunomodulatory effects of a 3.2 kDa polypeptide from velvet antler of Cervus nippon Temminck[J]. International Immunopharmacology, 2013, 16(2):210-213. DOI:10.1016/j.intimp.2013.02.027.
[36] ZHA Enhui, GAO Shenyang, PI Yuzhen, et al. Wound healing by a 3.2 kDa recombinant polypeptide from velvet antler of Cervus nippon Temminck[J]. Biotechnology Letters, 2012, 34(4): 789-793.DOI:10.1007/s10529-011-0829-8.
[37] ZHA Enhui, LI Dandan, BAI Xue, et al. A recombinant polypeptide from velvet antler of Cervus nippon Temminck exhibits similar immunomodulatory effects as its natural counterpart[J]. Journal of Immunopharmacology,2016, 38(6): 385-389. DOI:10.1080/08923973.2016.1233978.
[38] KIM K W, SONG K H, LEE J M, et al. Effects of TGF1 and extracts from Cervus korean TEMMINCK var. mantchuricus Swinhoe on acute and chronic arthritis in rats[J]. Journal of Ethnopharmacology, 2008,118: 280-283. DOI:10.1016/j.jep.2008.04.010.
[39] SUH S J, KIM K S, LEE A R, et al. Prevention of collagen-induced arthritis in mice by Cervus korean TEMMINCK var. mantchuricus Swinhoe[J]. Environmental Toxicology and Pharmacology, 2007, 23:147-153. DOI:10.1016/j.etap.2006.08.001.
[40] CHAABANE F, MUSTAPHA N, MOKDADBZEOUICH I, et al. In vitro and in vivo anti-melanoma effects of Daphne gnidium aqueous extract via activation of the immune system[J]. Tumor Biology, 2016,37(5): 6511-6517. DOI:10.1007/s13277-015-4492-x.
[41] WU Feifei, LI Huaqiang, JIN Liji, et al. Deer antler base as a traditional Chinese medicine: a review of its traditional uses, chemistry and pharmacology[J]. Journal of Ethnopharmacology, 2013, 145(2):403-417. DOI:10.1016/j.jep.2012.12.008.
[42] 赵天一, 姜彤伟, 张永和. 鹿茸多肽对缺血动物模型心肌细胞线粒体凋亡相关基因蛋白Bc-l2/Bax的影响[J]. 吉林中医药, 2013, 33(3):281-282.
[43] XIN Jile, ZHANG Yang, LI Yan, et al. Protective effects of Cervus nippon Temminck velvet antler polypeptides against MPP+ induced cytotoxicity in SH SY5Y neuroblastoma cells[J]. Molecular Medicine Reports, 2017, 16(4): 5143-5150. DOI:10.3892/mmr.2017.7303.
[44] ZHANG Lihong, ZHUANG Zhihong, SUN Yanan, et al. Velvet antler polypeptide is able to induce differentiation of neural stem cells towards neurons in vitro[J]. Journal of Traditional Chinese Medicine,2017, 37(3): 308-313. DOI:10.1016/S0254-6272(17)30065-1.
[45] XIAO Xiang, XU Sunqiang, LI Lin, et al. The effect of velvet antler proteins on cardiac microvascular endothelial cells challenged with ischemia-hypoxia[J]. Front Pharmacol, 2017, 8: 601. DOI:10.3389/fphar.2017.00601.
[46] ZHAO Lihong, MI Yang, GUAN Hongya, et al. Velvet antler peptide prevents pressure overload-induced cardiac fi brosis via transforming growth factor (TGF)-β1 pathway inhibition[J]. European Journal of Pharmacology, 2016, 783: 33-46. DOI:10.1016/j.ejphar.2016.04.039.
[47] ZHU Wenhe, WANG Huiyan, ZHANG Wei, et al. Protective effects and plausible mechanisms of velvet polypeptide against hydrogen peroxide induced injury in human umbilical vein endothelial cells[J].Canadian Journal of Physiology and Pharmacology, 2016, 95(5): 610-619. DOI:10.1139/cjpp-2016-0196.
[48] 段冷昕, 马吉胜, 翁梁, 等. 鹿茸总多肽对维A酸致骨质疏松大鼠的防治作用[J]. 中国药学杂志, 2007(4): 264-267.
[49] 朱文赫, 钟秀宏, 张巍, 等. 鹿茸多肽-胶原蛋白/壳聚糖复合材料对家兔下颌骨缺损愈合的促进作用及其机制[J]. 吉林大学学报(医学版), 2017, 43(3): 527-531.
[50] LI Na, ZHAO Lijing, LIN Zhe, et al. Metabonomics study of the anti-osteoporosis effect of velvet collagen hydrolysate using rapid resolution liquid chromatography combined with quadrupole time-offlight tandem mass spectrometry[J]. Journal of Liquid Chromatography and Related Technologies, 2015, 38(1): 117-122. DOI:10.1080/10826 076.2014.883540.
[51] KYUNG K H, MYUNG-GYOU K, KANG-HYUN L. Comparison of the effect of velvet antler from different sections on longitudinal bone growth of adolescent rats[J]. Evidence-Based Complementary and Alternative Medicine, 2016: 1-9. DOI:10.1155/2016/1927534.
[52] CHEN J C, HSIANG C Y, LIN Y C, et al. Deer antler extract improves fatigue effect through altering the expression of genes related to muscle strength in skeletal muscle of mice[J]. Evidence-Based Complementary and Alternative Medicine, 2014(4): 540580.DOI:10.1155/2014/540580.
[53] 罗翔丹, 潘风光, 张铁华, 等. 鹿茸多肽对小鼠耐缺氧和抗疲劳能力的影响[J]. 食品科学, 2008, 29(4): 386-388.
[54] 赵磊, 张雅莉, 张晓蕾, 等. 鹿茸蛋白水解肽的抗炎及肠吸收机制[J].中国食品学报, 2018, 18(10): 51-57.
[55] 刘春娟. 不同分子质量鹿茸多肽抗氧化活性的研究[J]. 食品工业科技, 2015, 36(13): 53-56.
[56] 李思明, 张昕, 苏丹, 等. 鹿茸多肽对HaCaT细胞抗氧化作用检测[C]//全国动物生理生化第七届全国代表大会暨第13次学术交流会论文集. 北京: 中国畜牧兽医学会动物生理生化学分会, 2014.
[57] YANG Huihai, WANG Lulu, SUN Hang, et al. Anticancer activity in vitro and biological safety evaluation in vivo of Sika deer antler protein[J]. Journal of Food Biochemistry, 2017, 41(6): e12421.DOI:10.1111/jfbc.12421.
[58] 徐岩, 许佳明, 何璐, 等. 鹿茸多肽对人胶质瘤细胞生长抑制率及细胞周期的影响[J]. 吉林中医药, 2014, 34(10): 1019-1021.
[59] 杨吉利, 景年财, 郭环宇, 等. 鹿茸多肽对大鼠乳腺癌骨转移模型肿瘤生长及破骨细胞的影响[J]. 中国老年学杂志, 2014, 34(13):3684-3685.
[60] DING Y, WANG Y, JEON B T, et al. Enzymatic hydrolysate from velvet antler suppresses adipogenesis in 3T3-L1 cells and attenuates obesity in high-fat diet-fed mice[J]. Excli Journal, 2017, 16: 328-339.DOI:10.17179/excli2016-638.
[61] JIANG Ning, ZHANG Suangjian, ZHU Jing, et al. Hypoglycemic,hypolipidemic and antioxidant effects of peptides from red deer antlers in streptozotocin-induced diabetic mice[J]. Tohoku Journal of Experimental Medicine, 2015, 236(1): 71-79. DOI:10.1620/tjem.236.71.
Progress in Research on Velvet Antler Polypeptides
ZHANG Lingying, LI Mohan, LI Rushu, ZHENG Yan, YANG Mei, WU Junrui, WU Rina, YUE Xiqing*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract: Velvet antler polypeptides account for 50% to 60% of the total wet mass of velvet antler and are one of the most important physiologically active substances in velvet antler. This article presents a systematic review of previous studies on the composition of velvet antler polypeptides and the methods used to extract and purify them, with focuses on their effects on the immune system, nervous system, cardiovascular system and skeletal system and their anti-fatigue, antioxidant, anti-tumor and other biological activities. Moreover, future trends and research prospects are discussed as well.
Keywords: velvet antler polypeptides; chemical composition; extraction methods; separation and purification methods;physiological effects
收稿日期:2019-02-26
基金项目:国家自然科学基金面上项目(31370502);沈阳市科技局创新项目(Y17-0-028)
第一作者简介:张玲莺(1998—)(ORCID: 0000-0002-5015-2497),女,本科生,研究方向为动物性食品加工。E-mail: 532205289@qq.com
*通信作者简介:岳喜庆(1966—)(ORCID: 0000-0001-5558-1461),男,教授,博士,研究方向为动物性食品加工。E-mail: yxqsyau@126.com
DOI:10.7506/rlyj1001-8123-20190226-033
中图分类号:R282.74
文献标志码:A
文章编号:1001-8123(2019)06-0064-06
引文格式:张玲莺, 李墨翰, 李乳姝, 等. 鹿茸多肽研究进展[J]. 肉类研究, 2019, 33(6): 64-69. DOI:10.7506/rlyj1001-8123-20190226-033.http://www.rlyj.net.cn
ZHANG Lingying, LI Mohan, LI Rushu, et al. Progress in research on velvet antler polypeptides[J]. Meat Research, 2019,33(6): 64-69. DOI:10.7506/rlyj1001-8123-20190226-033. http://www.rlyj.net.cn
