
图1 二维液相系统内部结构和阀门切换系统示意图
Fig. 1 Schematic illustration of internal structure of two-dimensional liquid chromatography system with valve switching system
A. 系统利用第1根色谱柱对样品进行分离;B. 系统利用第2根色谱柱对样品进一步分离后进检测器检测。
苯并(a)芘(benzoapyrene,BaP)是一种五环芳香烃化合物[1-2],不溶于水,易溶于苯、丙酮等有机溶剂,被国际癌症研究机构列为Ⅰ类强致癌物质[3-4]。苯并(a)芘的产生主要有2 个途径:1)在缺氧、高温、不完全燃烧条件下,食品中的碳水化合物、脂肪、蛋白质等有机物经过热裂解、环化、聚合等复杂的化学反应产生苯并(a)芘,特别是在油炸、烧烤等高温制作过程中发生焦糊的食品中,苯并(a)芘含量比普通食品高10~20 倍[5-7];2)煤炭、石油产品等燃料不完全燃烧也会产生苯并(a)芘,通过污染土壤[8-9]、水、空气进入到食品中[10-11]。
熏烧烤肉制品是将畜禽肉、鱼肉等原料经过腌制后,以烟气、高温空气、明火或高温固体为媒介加热制成的熟肉制品,可分为熏烤类和烧烤类2 种。由于熏烤肉制品香气诱人、美味适口,一直是人们爱吃的传统食品。不过,熏烧烤食物中含有一些致癌物质,经过研究发现其中主要的致癌物质为苯并(a)芘[12-14]。熏烤食品时所使用的熏烟中就含有苯并(a)芘等多环芳烃类物质,其来源主要有:1)熏烤所用的燃料木炭含有少量的苯并(a)芘,在高温下有可能伴随烟雾侵入食品中;2)烤制时,滴于火上的食物脂肪焦化产物发生热聚合反应,形成苯并(a)芘,附着于食物表面,这是烤制食物中苯并(a)芘的主要来源;3)熏烤的鱼或肉等自身的化学成分,即糖和脂肪的不完全燃烧也会产生苯并(a)芘及其他多环芳烃;4)食物炭化时,脂肪因高温裂解,产生自由基,并相互结合生成苯并(a)芘[15-16]。目前的研究对苯并(a)芘的形成机理尚不十分清楚。澳大利亚学者Badger 1960年提出苯并(a)芘的形成步骤:首先是在高温缺氧条件下,有机物裂解产生碳氢自由基,结合生成乙炔,然后经聚合作用形成乙烯基乙炔或1,3-丁二烯,再经环化作用生成己基苯,再进一步合成丁基苯和四氢化萘,最后通过中间体形成苯并(a)芘[17-18]。
由于苯并(a)芘的强致癌性,目前各国对食品中苯并(a)芘的残留有严格的控制。例如,德国对肉制品中苯并(a)芘的残留限量标准为1.0 µg/kg,我国国家食品安全标准GB 2762—2017《食品安全国家标准 食品中污染物限量》[19]中规定,烟、熏、烤肉制品中苯并(a)芘限量值为5.0 µg/kg[20-22]。熏烤肉制品中的苯并(a)芘残留量安全问题日益突显,建立快速、准确、高效的烧烤肉制品中苯并(a)芘检测方法,对保障烧烤肉制品安全性十分重要。
目前,食品中苯并(a)芘的检测方法主要有薄层色谱法、荧光分光光度法、高效液相色谱法[23-24]、气相色谱-质谱联用法、液相色谱-质谱联用法及免疫学检测法等[25-26]。薄层色谱法和荧光分光光度法样品前处理繁琐、耗时长、试剂消耗量大,而且只能粗略定量;高效液相色谱法具有操作简单、定量准确、重现性好等优点,是目前检测苯并(a)芘最常用的方法[27-29]。按照GB 5009.27—2016《食品安全国家标准 食品中苯并(a)芘的测定》对熏烧烤肉制品进行处理并检测其苯并(a)芘含量时,在处理时需要将样品经过苯并(a)芘分子印迹柱净化、氮吹仪浓缩,而且还需使用大量的二氯甲烷这一毒害性高的试剂,导致操作复杂、分析时间长、消耗溶剂多、危险性高。近年来,二维色谱分离技术已经被越来越多地应用到食品分析中[30-32],本研究建立一种二维液相色谱测定烧烤肉制品中苯并(a)芘含量的方法,无需使用高毒性有机试剂与固相小柱,简化前处理步骤,具有经济、高效的特点。
市场上烧烤摊售卖的烧烤肉制品5 批。
二氯甲烷(色谱纯)、正己烷(色谱纯)、乙腈(色谱纯)、异丙醇(色谱纯)、苯并(a)芘标准品(质量浓度20 μg/mL) 农业部环境保护科研监测所;MIP-BAP苯并(a)芘专用固相萃取印迹柱(500 mg、6 mL) 德国CNW公司。
1260 Infinity二维液相色谱仪(配备2 个高压二元泵、1 个六通阀、荧光检测器)、色谱柱1(岛津Inertsil ODS柱(4.6 mm×150 mm,5 µm))、色谱柱2(ChromSpher Pi柱(3.0 mm×80 mm,5 µm)) 美国安捷伦科技有限公司;Quintix 224-1CN电子天平 德国赛多利斯公司;AllegraX-15R离心机 美国贝克曼库尔特有限公司;J2正压固相萃取仪 北京普利泰科仪器有限公司。
二维液相系统内部组成结构和阀门切换系统如图1所示。

图1 二维液相系统内部结构和阀门切换系统示意图
Fig. 1 Schematic illustration of internal structure of two-dimensional liquid chromatography system with valve switching system
A. 系统利用第1根色谱柱对样品进行分离;B. 系统利用第2根色谱柱对样品进一步分离后进检测器检测。
1.3.1 标准曲线的绘制
准确吸取25.0 µL苯并(a)芘标准品(质量浓度20 μg/mL)于10 mL容量瓶中,用正己烷-异丙醇(1∶1,V/V)定容,得到质量浓度分别为50 ng/mL的苯并(a)芘标准中间液;分别取质量浓度为50 ng/mL的标准中间液0.20、0.50、1.00、1.50、2.00 mL于10 mL容量瓶中,用正己烷-异丙醇(1∶1,V/V)定容,得到质量浓度分别为1.0、2.5、5.0、7.5、10.0 ng/mL的标准工作液,现配现用。
标准曲线的绘制:以标准溶液质量浓度为横坐标(x),标准溶液峰面积为纵坐标(y)绘制标准曲线,进而得到线性回归方程及线性相关系数和范围。
1.3.2 样品前处理
称取经绞碎、混匀的样品2.5 g(精确到0.000 1 g)于具有塑料塞的15 mL离心管中,用正己烷-异丙醇(1∶1,V/V)稀释至5.0 mL,摇匀,涡旋混合0.5 min,使样品混合均匀;4 000 r/min、4 ℃冷冻离心4 min,取上清液,用0.22 μm有机相微孔滤膜过滤,弃去初滤液,续滤液进液相小瓶,即得供试样品溶液,待测。
1.3.3 色谱条件
在图1中的二维液相色谱分析系统中,在进样的3.5 min内,色谱柱1进行第1维分离,主要作用是将样品中的非目标物和大部分基体杂质(蛋白质、脂肪等)与苯并(a)芘分离,同时采用大体积进样,使苯并(a)芘分析物在色谱柱1富集;在进样的3.5 min后,通过六通阀切换系统,将色谱柱1切入第2维检测系统,通过流动相的变化将色谱柱1上的苯并(a)芘进行洗脱,并在色谱柱2上进一步分离检测。
色谱柱1采用岛津Inertsil ODS柱(4.6 mm×150 mm,5 µm),色谱柱2采用ChromSpher Pi柱(3.0 mm×80 mm,5 µm)。泵1和色谱柱1为第1维分离,流动相为乙腈-水(85∶15,V/V),流速1.0 mL/min;泵2和色谱柱2为第2维分离,流动相为异丙醇-乙腈(60∶40,V/V),流速1.2 mL/min,柱温均为40 ℃。检测器:荧光检测器;激发波长384 nm;发射波长406 nm;进样量500 μL(采用500 μL定量环进样)。进样后系统切换阀处于图1A所示状态,进样3.5 min后,系统切换阀切换至图1B所示状态,测定完成后系统切回到图1A所示状态,平衡3 min后进行下次测定。
实验所得数据、谱图采用Thermo Scientific™Dionex™ Chromeleon™ 7.2 SR4色谱数据系统软件进行处理分析。
在仪器第1维、第2维分析中,第1维采用岛津Inertsil ODS色谱柱,其在第1维分析中起到分离杂质、富集样品中苯并(a)芘的作用,第2维色谱柱在第1维分离杂质的基础上,采用苯并(a)芘分析专用色谱柱安捷伦ChromSpher Pi柱进行进一步分离与分析,为样品中苯并(a)芘的定量分析柱。
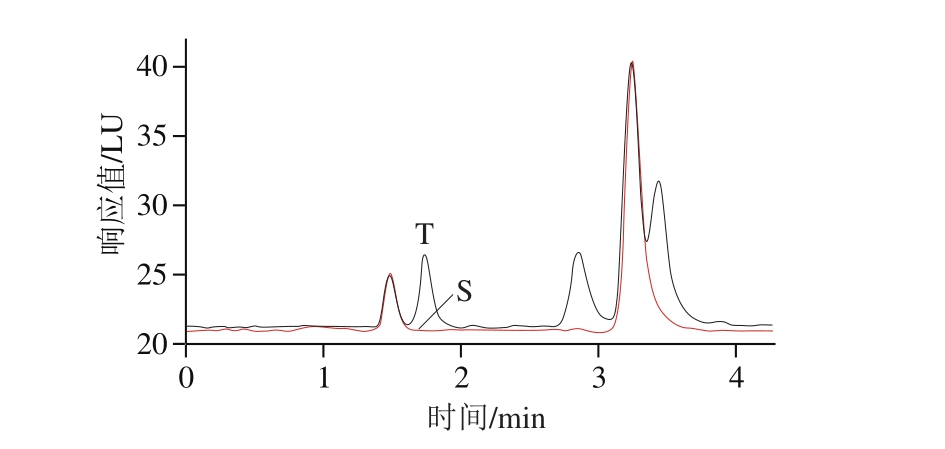
图2 苯并(a)芘标准溶液色谱图
Fig. 2 Typical chromatogram of standard solution of benzo(a)pyrene
T. 样品色谱图;S. 苯并(a)芘标准溶液色谱图。
由图2可知,当第1维以乙腈-水(85∶15,V/V)为流动相时,样品的基体杂质流出时间在3 min内,目标物苯并(a)芘流出时间约为3.25 min后,目标物与基体杂质基本能够分离。根据图2确定分析系统中的六通阀切换时间为3.5 min,如果提前切换阀门,则会给第2维液相带入比较多的基体杂质,不利于第2维液相的分离与检测;如阀门切换时间推后,将导致部分目标分析物流入废液池,方法的回收率显著降低。
2.2.1 线性范围
将不同质量浓度的标准工作液,依次从低质量浓度到高质量浓度进样,通过已知质量浓度的标准溶液对应的峰面积,得出线性回归方程。结果表明,方法在苯并(a)芘质量浓度1.0~20.0 ng/mL范围内呈线性关系,质量浓度范围与国标方法一致,线性回归方程为y=1.847 1x-0.103 3(r=0.999),表明线性良好。
2.2.2 检出限
准确称取样品2.5 g(精确到0.000 1 g),加入0.10 mL质量浓度为50 ng/mL的苯并(a)芘标准中间液,按照1.3.2节的前处理方法处理样品,用高效液相色谱仪观察苯并(a)芘目标色谱峰信噪比(RS/N)和对应苯并(a)芘添加量,RS/N>3时对应的添加量为方法的检出限。
按上述方法处理,当样品中添加苯并(a)芘0.08 µg/kg时,苯并(a)芘RS/N为4.3,色谱图如图3所示,则方法的检出限为0.08 µg/kg。
检出限为各化合物的3 倍信噪比(RS/N=3),结果表明,苯并(a)芘RS/N>3,可以确定方法的检出限为0.08 μg/kg,优于国家标准(0.1 μg/kg)。
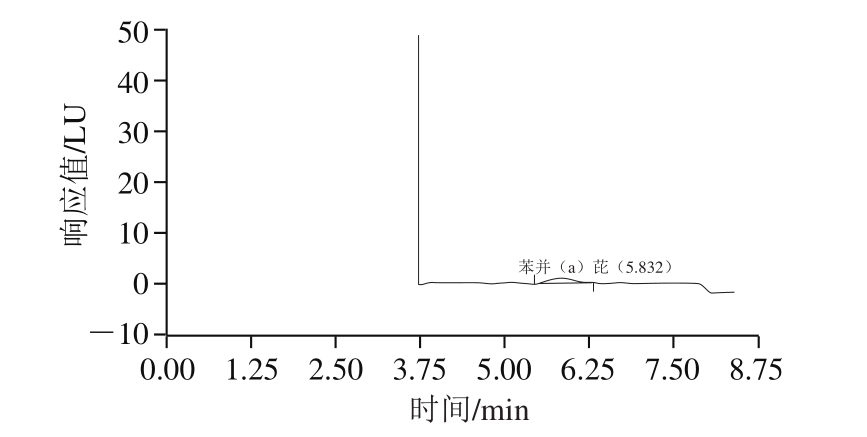
图3 方法检出限(0.08 µg/kg)色谱图
Fig. 3 Chromatogram showing detection limit (0.08 µg/kg)
2.2.3 方法回收率与精密度
对市场上购买的烧烤肉制品进行测试,采用标准添加法进行准确度与精密度实验,分别进行高、中、低水平添加,每个添加水平测定6 次。
表1 方法的准确度和精密度测定结果(n=6)
Table 1 Recovery and precision (RSD) of the method (n= 6)

苯并(a)芘含量/(µg/kg) 偏差/% 回收率/% 相对标准偏差/%0 1.00 98.2 2.52 93.4 3.44 1.49 1.00 97.1 2.77 94.1 3.78 3.79 3.00 99.7 2.11 95.3 2.99 5.38 5.00 101.5 1.92 96.0 2.52 13.80 10.00 105.2 1.55 97.8 2.11添加量/(µg/kg)本方法 GB 5009.27—2016方法回收率/% 相对标准
由表1可知,本方法回收率为97.1%~105.2%,相对标准偏差为1.55%~2.77%,与国标方法的回收率和相对标准偏差接近,实验结果符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》[33]对准确度和精密度的要求,表明该方法对烧烤肉制品中苯并(a)芘的提取、检测是稳定的,具有良好的准确度和精密度。
从市场上购买5 份烧烤肉制品,分别采用本方法和GB 5009.27—2016中的方法进行测定,每份样品重复测定5 次。
表2 实际样品的检测结果(n=5)
Table 2 Results of determination of actual samples (n= 5)

样品编号变异系数/%1 0 0 0 0 0 0 2 1.49 0.028 8 1.94 1.59 0.031 1 1.96 3 3.79 0.041 6 1.09 3.98 0.054 0 1.36 4 5.38 0.044 7 0.83 5.48 0.044 4 0.81 5 13.80 0.135 0 0.98 13.90 0.172 0 1.24本方法 GB 5009.27—2016方法测定结果/(µg/kg)标准偏差/(µg/kg)变异系数/%测定结果/(µg/kg)标准偏差/(µg/kg)
由表2及图4可知,在对市场上购买的5 份实际样品进行检测时,与国标方法相比,本方法的检测结果、标准偏差及变异系数与国标方法一致。
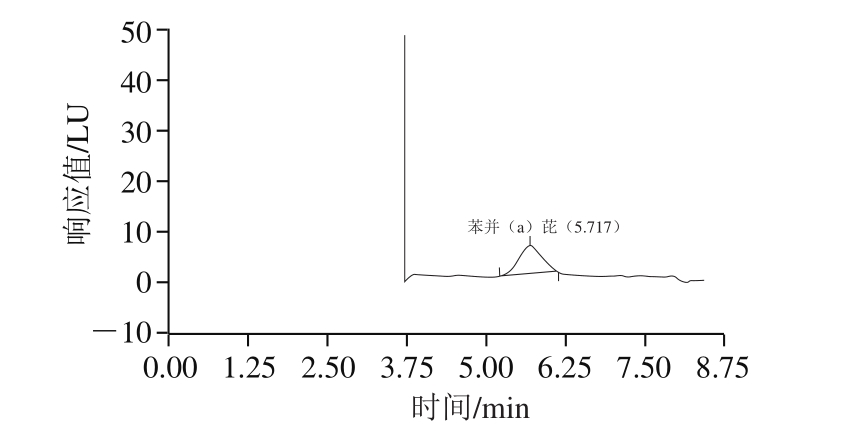
图4 样品的第2维液相色谱图
Fig. 4 Second-dimensional liquid chromatogram of samples
通过采用六通阀搭建的二维液相分析系统,将烧烤肉制品的中苯并(a)芘检测的前处理简单化,样品加入正己烷、异丙醇溶剂稀释、过滤后,直接进样分析,利用六通阀切换在线去除样品杂质,提高了检测效率,无需用到有毒有机溶剂,减少了操作时对身体的伤害,降低了检测成本,方法的检出限、准确度及精密度等指标均与国标方法相一致,可以应用于烧烤肉制品等容易受到苯并(a)芘污染食品的安全检测。
[1] 王欣, 周智慧, 赵晓联. 苯并(a)芘危害性及其检测技术[J]. 粮食与油脂, 2011(3): 48-49. DOI:10.3969/j.issn.1008-9578.2011.03.013.
[2] 吴丹. 食品中苯并(a)芘污染的危害性及其预防措施[J]. 食品工业科技, 2008, 29(5): 309-311. DOI:10.13386/j.issn1002-0306.2008.05.080.
[3] 万红丽. 烧烤肉制品中3,4-苯并(a)芘的分析检测与残留变化规律的研究[D]. 南京: 南京农业大学, 2007: 1-8.
[4] 汪敏. 肉及肉制品中苯并(a)芘研究进展[J]. 肉类工业, 2016(10):49-51. DOI:10.3969/j.issn.1008-5467.2016.10.015.
[5] 朱小玲. 烹饪过程中多环芳烃的产生及控制[J]. 四川烹饪高等专科学校学报, 2012(5): 22-25. DOI:10.3969/j.issn.1008-5432.2012.05.008.
[6] 王卫. 工艺改进以减少熏烤兔肉苯并(a)芘含量的研究[J]. 食品工业科技, 2005(4): 129-131. DOI:10.13386/j.issn1002-0306.2005.04.036.
[7] 冯亚净, 王瑞鑫, 李书国. 食品中苯并(a)芘的来源及减控方法的研究[J]. 粮食与油脂, 2017, 30(2): 72-75. DOI:10.3969/j.issn.1008-9578.2017.02.018.
[8] 黄燕芬, 田立. 食品中苯并(a)芘的研究进展[J]. 食品安全导刊,2016(8): 8-9. DOI:10.16043/j.cnki.cfs.2016.24.002.
[9] 陈胜姝, 孟祥忍. 食品中苯并(a)芘的来源及减控方法的研究[J].现代食品, 2018(13): 18-19. DOI:10.16736/j.cnki.cn41-1434/ts.2018.13.006.
[10] 梁菡峪, 石晶, 丁晓雯, 等. 市售中式香肠苯并(a)芘来源分析[J]. 食品工业科技, 2013, 34(17): 122-125. DOI:10.13386/j.issn1002-0306.2013.17.07.
[11] 史巧巧, 席俊, 陆启玉. 食品中苯并(a)芘的研究进展[J]. 食品工业科技, 2014, 35(5): 379-381; 386. DOI:10.13386/j.issn1002-0306.2014.05.066.
[12] 衣海龙, 陈明星. 肉制品中多环芳烃前处理技术研究进展[J]. 肉类研究, 2009, 23(5): 54-58.
[13] 吴丽, 袁玉超, 侯银臣, 等. 肉制品中苯并(a)芘的研究进展[J]. 现代牧业, 2017, 1(4): 39-44. DOI:10.3969/j.issn.1008-3111.2017.04.009.
[14] 侯利霞. 食用油中多环芳烃研究进展[J]. 河南工业大学学报(自然科学版), 2017, 38(3): 115-122. DOI:10.3969/j.issn.1673-2383.2017.03.021.
[15] 王广峰. 苯并(a)芘对人体的危害和食品中苯并(a)芘的来源及防控[J]. 菏泽学院学报, 2014, 36(2): 66-70. DOI:10.3969/j.issn.1673-2103.2014.02.016.
[16] 万红丽, 周光宏, 陈明, 等. 烧烤肉制品中3,4-苯并(a)芘检测的前处理方法[J]. 南京农业大学学报, 2007, 24(1): 140-143. DOI:10.7685/j.issn.1000-2030.2007.04.029.
[17] 孙艳. 食品中多环芳烃含量检测方法研究[J]. 中国卫生检验杂志,2005, 15(11): 1319-1320. DOI:10.3969/j.issn.1004-8685.2005.11.016.
[18] 杨美娟. 浅析3,4-苯并(a)芘的危害及其预防[J]. 农产品加工(综合刊), 2011(10): 71-72. DOI:10.3969/j.issn.1671-9646-C.2011.10.050.
[19] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中污染物限量: GB 2762—2017[S].北京: 中国标准出版社, 2017.
[20] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中苯并(a)芘的测定:GB 5009.27—2016[S]. 北京: 中国标准出版社, 2016.
[21] 农业部肉及肉制品质量监督检验测试中心. 肉制品中苯并[a]芘的测定 高效液相色谱法: NY/T 1666—2008[S]. 北京: 中国农业出版社, 2008.
[22] 大连市产品质量监督检验所, 国家粮食质量监督检验中心, 大连标准检测技术研究中心. 动植物油脂 苯并(a)芘的测定 反相高效液相色谱法: GB/T 22509—2008[S]. 北京: 中国标准出版社, 2008.
[23] 梁瑞, 段兰萍, 黄瑞, 等. 固相萃取-高效液相色谱法测定粮油中苯并(a)芘残留[J]. 粮食科技与经济, 2016(5): 46-49. DOI:10.16465/j.gste.cn431252ts.20160512.
[24] 李念念, 周光宏, 徐幸莲, 等. 高效液相色谱-荧光法测定腊肉中的苯并(a)芘残留[J]. 食品工业科技, 2013, 34(1): 319-322. DOI:10.13386/j.issn1002-0306.2013.01.022.
[25] 李永新, 张宏, 毛丽莎, 等. 气相色谱/质谱法测定熏肉中多环芳烃[J]. 色谱, 2003, 21(5): 476-479.
[26] 肖海波. 利用新型核壳纳米粒子作为SERS基底检测苯并芘[D].厦门: 集美大学, 2012: 4-7.
[27] 贾涛. 液相色谱-荧光法测定饲料用油中的苯并(a)芘含量[J]. 饲料研究, 2012(7): 70-72. DOI:10.3969/j.issn.1002-2813.2012.07.025.
[28] 彭小东. 液相萃取-反相高效液相色谱法联用测定植物油中的苯并(a)芘[J]. 中国油脂, 2018, 43(10): 112-114. DOI:10.3969/j.issn.1003-7969.2018.10.023.
[29] 黄坤. 高效液相色谱法测定大米和小麦粉中的苯并(a)芘[J]. 粮食与油脂, 2018, 31(10): 86-88. DOI:10.3969/j.issn.1008-9578.2018.10.022.
[30] 张艳海, 朱晓艳, 曹国洲, 等. 在线二维柱切换-高效液相色谱法同时测定婴幼儿强化奶粉中维生素A、D3和E的含量[J]. 分析化学,2013, 41(5): 771-775. DOI:10.3724/SP.J.1096.2013.20868.
[31] 张艳海, 其布勒哈斯, 金燕, 等. 在线二维柱切换-高效液相色谱法同时测定婴幼儿和成人配方营养品中维生素A、D3和E的含量[J]. 色谱, 2015, 33(3): 291-297.
[32] 周提军, 陈小珍, 王瑾, 等. 基于柱切换技术的高压液相色谱法检测奶粉中的维生素D[J]. 食品安全质量检测学报, 2013(2): 467-472.
[33] 中华人民共和国浙江出入境检验检疫局, 中国合格评定国家认可中心. 实验室质量控制规范 食品理化检测: GB/T 27404—2008[S].北京: 中国标准出版社, 2008.
Determination of Benzo(a)pyrene in Barbecued Meat Products by Two-Dimensional Liquid Chromatography
LIANG Jianfeng, LI Ya, LIANG Feng. Determination of benzo(a)pyrene in barbecued meat products by two-dimensional liquid chromatography[J]. Meat Research, 2019, 33(5): 55-59. DOI:10.7506/rlyj1001-8123-20190313-055. http://www.rlyj.net.cn