滩羊肉风味形成中重要蛋白质的解析
李子欣,尤丽琴,罗瑞明*,苑昱东,赵晓策,姬 琛
(宁夏大学农学院,宁夏 银川 750021)
摘 要:以冷鲜滩羊肉为研究对象,应用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术以及液相色谱-串联质谱技术,寻找与滩羊肉中风味前体物质形成及调控相关的差异蛋白质。对宰后0~12 d的滩羊肉进行定量分析,结合数据库搜索,鉴定和筛选可信蛋白质及差异蛋白质。结果表明:3 组滩羊肉样品中共鉴定到814 个蛋白质,0 d/4 d组发现159 个差异蛋白质,4 d/8 d组发现151 个差异蛋白质,8 d/12 d组发现151 个差异蛋白质;对各比对组的差异蛋白质进行分析发现,糖原磷酸化酶、磷酸丙糖异构酶、甘油醛-3-磷酸脱氢酶等21 个蛋白质可能与滩羊肉的风味前体物质及其风味表达的差异有关。
关键词:冷鲜滩羊肉;同位素标记相对和绝对定量技术;风味前体物质;差异表达蛋白质
色、香、味、质构是评价羊肉及其制品品质的重要指标,对其评定方法多有研究,但从微观水平阐述其形成机理,特别是在屠宰后、加工熟制、杀菌、保藏中发生的微观水平变化与品质改变宏观表现之间的关系缺乏机理性的研究[1-3]。目前,针对肉类和肉类产品的评价主要在颜色、香味、味道和质地方面进行评估。对肉品风味物质的研究还停留在滋气味物质的分析鉴定,对其来源尚不清楚,关于反应过程中的前体物质和中间物质尚不清楚;反应中的反应条件、调控因素及其形成机理并没有进行深入研究,特别是滩羊肉贮藏加工中发生的微观变化及其与宏观表现的联系尚缺乏深入研究[4-6]。
肉本身含有风味前体化合物,其在加热过程中经历一系列化学变化,形成肉味。风味前体物质是研究肉类风味和肉质重要组成部分的关键因素。一般来说,风味物质前体、中间体中的蛋白质经基因复制、转录、翻译、表达生成,脂质、糖类等合成不由基因直接控制,但合成酶由基因调控[7-9]。羊在宰杀后活体的生命活动停止,但器官、组织、细胞仍然存活一定时间,基因复制、转录、翻译、表达与活体相比进入新的阶段。新的蛋白质推动着代谢物的变化,产生新的物质及新的生命活动[10-12]。通过蛋白质组学研究宰后基因转录、翻译、表达与风味物质前体、中间体的关联,是研究滩羊肉风味物质前体及中间体合成途径及其调控机制的有效途径,同时为代谢组学研究宰后组织代谢物与风味物质前体、中间体的关联提供一定理论基础[13-15]。
本研究以滩羊肉为研究对象,采用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术以及多维液相色谱-串联质谱技术,对不同贮藏期的盐池滩羊肉进行定量分析,鉴定和筛选出差异蛋白质,找出差异蛋白质与风味物质前体、中间体的关联,为进一步研究滩羊肉屠宰后的代谢生化反应提供理论参考。
1 材料与方法
1.1 材料与试剂
样品来自宁夏盐池县大夏牧场食品有限公司,所取样本均来自现宰杀的盐池滩羊。采集贮藏温度4 ℃、相对湿度为85%的滩羊背最长肌200 mg,封装于灭菌冷冻管中待用。采样周期为3 d,即采样时间点为0、4、8、12 d,每组样本做3 个平行。
尿素(分析纯)、二硫苏糖醇(dithiothreotol,DTT,色谱纯)、碘乙酰胺(iodoacetamide,IAA,色谱纯)、甲酸(formic acid,FA,色谱纯) 美国GE公司;十二烷基硫酸钠(sodium dodecyl sulfonate,SDS,色谱纯)、三羧基氨基甲烷(tricarboxyl aminomethane,Tris,色谱纯)、三氯乙酸(three chloroacetic acid,TCA,色谱纯)、过硫酸铵(ammonium persulfate,AP,色谱纯)、四甲基乙二胺(tetramethylethylenediamine,TEMED,色谱纯)美国Amresco公司;三乙二胺碳酸盐(triethylenediamine carbonate,TEAB,色谱纯)、考马斯亮蓝G-250(色谱纯) 美国Sigma公司;胰蛋白酶(色谱纯) 美国Promega公司;乙腈(acetonitrile,ACN,色谱纯)、水(分析纯) 美国Thermo公司。
1.2 仪器与设备
Sciex Triple TOF 5600质谱仪(配备纳升喷雾Ⅲ离子源)、Eksigent nano LC-1D plus液相系统(Analyst TF 1.6数据处理软件) 美国Sciex公司;Eppendorf冷冻离心机 德国Eppendorf公司;Image Scanner扫描仪 美国GE Healthcare公司;EXF32086A真空冷冻干燥机 美国Thermo公司;VCX130超声波细胞粉碎机 美国Sonics公司;Mini PROTEAN tetra Cell电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 样品的制备
取适量冷冻样品,转移至1.5 mL离心管中,加入500 μL SDS裂解液,之后加入蛋白酶抑制剂,使其最终浓度为0.001 mol/L;使用匀浆器将肌肉组织打碎,冰上超声破碎功率为80 W,超声破碎1.0 s,封闭1.0 s,持续3 min;将溶液在室温条件下15 000×g离心15 min,取上清液,再次离心取上清液;加入5 倍体积的预冷却丙酮摇匀并混合,在-20 ℃条件下沉淀过夜;4 ℃、12 000×g离心10 min,收集沉淀;加入适量的预冷丙酮摇匀,混合,4 ℃、12 000×g离心15 min,收集沉淀,重复此步骤1 次;常温干燥后(3 min左右),溶解于样品裂解液中,室温溶解3 h;将溶液在室温条件下12 000×g离心10 min,取上清液,再次离心取上清液;上清液是组织的总蛋白质溶液,测定并记录蛋白质浓度,-80 ℃贮藏使用。
1.3.2 蛋白质浓度的测定
采用BCA蛋白质浓度测定方法[16]。
1.3.3 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDSPAGE)
取含有15 μg蛋白质的样品溶液,采用12%凝胶的SDS-PAGE进行分离;用考马斯亮蓝染色法分离凝胶,采用Candiano等[17]的方法进行染色。具体操作如下:固定2 h、染色12 h、水洗至背景清晰;染色后的凝胶应用ImageScanner扫描仪进行扫描,扫描模式为全彩模式,光密度值为300 dpi。
1.3.4 胰蛋白酶酶解及标记
参考Wisniewski等[18]的方法酶解蛋白质:1)蛋白质定量后每个样品各取含有100 μg蛋白质的样品溶液,于10 K的超滤管中,加入120 μL还原剂缓冲液(含0.01 mol/L DTT、0.008 mol/L尿素和0.1 mol/L TEAB,pH 8.0),60 ℃反应1 h;2)加入IAA至终浓度为0.05 mol/L,室温避光反应40 min;3)4 ℃、12 000 r/min离心20 min,弃掉收集管底部溶液;4)加入100 μL 0.1 mol/L TEAB缓冲液,12 000 r/min离心20 min,2 次;5)更换新收集管,在超滤管中加入100 μL的100 mmol/L TEAB缓冲液,并加入2 μL 1 μg/μL的测序级胰蛋白酶溶液,37 ℃反应12 h;6)12 000 r/min离心20 min,收集酶解后肽段,在超滤管中再加入50 μL 0.1 mol/L TEAB缓冲液,12 000 r/min离心20 min,收集管底溶液并冻干;7)向冻干样品中加入100 μL 0.1 mol/L TEAB缓冲液,涡流混匀,取出40 μL样品于1.5 mL EP管中进行标记反应;8)从冰箱中取出iTRAQ试剂,平衡到室温,将iTRAQ试剂离心至管底,加入200 μL异丙醇,涡流混匀,离心,重复1 次;9)取100 μL iTRAQ试剂加到样品中,涡流混匀,室温放置2 h;10)加入200 μL水终止反应30 min,冻干后于-80 ℃保存。
1.3.5 反相色谱分离
液相色谱仪:Agilent 1100 HPLC;色谱柱:Agilent Zorbax Extend-C18窄径柱(2.1 mm×150 mm,5 μm);检测波长:紫外210、280 nm;流动相A:ACN-H2O(2∶98,V/V);流动相B:ACN-H2O(90∶10,V/V);流速:300 μL/min;梯度洗脱条件:0~8 min,98%流动相A;8~8.01 min,98%~95%流动相A;8.01~38 min,95%~75%流动相A;38~50 min,75%~60%流动相A;50~50.01 min,60%~10%流动相A;50.01~60 min,10%流动相A;60~60.01 min,10%~98%流动相A;60.01~65 min,98%流动相A。
收集8~50 min的样品,依次每隔1 min收集洗脱液到1~10号离心管中;收集好后真空冷冻干燥,样品冷冻保存待上质谱。
1.4 数据处理
实验数据采用ProteinPilot 5.0软件(美国Sciex公司)进行分析,所用数据库为来自于Uniprot的绵羊数据库。
2 结果与分析
2.1 蛋白质鉴定结果及整体分布分析
利用iTRAQ技术对宰后0~12 d的滩羊肉样品经质谱分析及查库,最终鉴定结果如表1所示。
表1 蛋白质基本鉴定结果统计
Table 1 Statistics of identified proteins
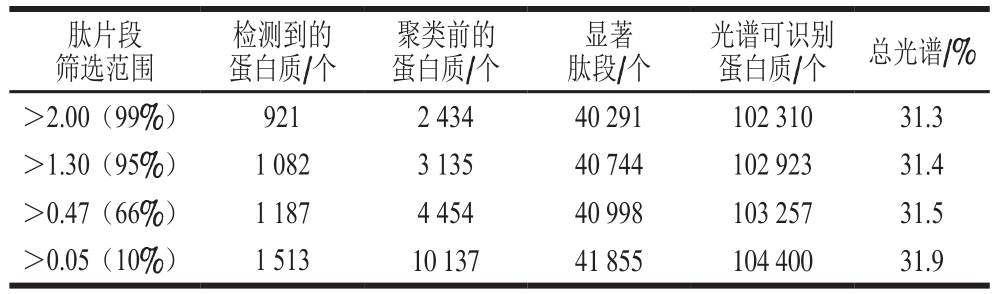
肽片段筛选范围检测到的蛋白质/个聚类前的蛋白质/个显著肽段/个光谱可识别蛋白质/个 总光谱/%>2.00(99%) 921 2 434 40 291 102 310 31.3>1.30(95%) 1 082 3 135 40 744 102 923 31.4>0.47(66%) 1 187 4 454 40 998 103 257 31.5>0.05(10%) 1 513 10 137 41 855 104 400 31.9
对宰后0、4、8、12 d的4 组、12 份滩羊肉样品中鉴定出的蛋白质进行主成分分析。由图1可知,同组滩羊肉中的蛋白质呈现一定发散分布,有较好的重复性,不同组滩羊肉蛋白质存在较为显著的差异,实验数据可行、有效,能够用于后续的数据分析。
2.2 差异蛋白质分析
酶解标记后的样品利用液相色谱-串联质谱技术进行分析,分析后进行数据库检索;对检索结果按照未使用片段>1.3且肽段≥1,并去除空白值和反库数据的标准筛选可信蛋白,基于筛选出的可信蛋白(多组重复以均能鉴定到的可信蛋白结果为基础进行分析),计算得到每一比较组的差异倍数值和差异显著性P值,以差异倍数值>1.2或差异倍数值<5/6且P值<0.05为标准筛选差异显著蛋白。
表2 可信蛋白及差异蛋白筛选结果
Table 2 Screening for credible and differential proteins
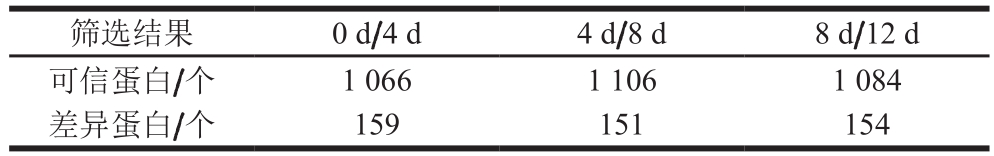
筛选结果 0 d/4 d 4 d/8 d 8 d/12 d可信蛋白/个 1 066 1 106 1 084差异蛋白/个 159 151 154
由表2可知,0 d/4 d组中筛选出1 066 个可信蛋白,4 d/8 d组中筛选出1 106 个可信蛋白,8 d/12 d组中筛选出1 084 个可信蛋白,3 组中均鉴定到的可信蛋白有814 个。差异显著蛋白筛选结果为:0 d/4 d组筛选出159 个差异蛋白,4 d/8 d组筛选出151 个差异蛋白,8 d/12 d组筛选出154 个差异蛋白。此外,对各差异比较组的差异蛋白取并集,得到动态变化蛋白315 个,这部分蛋白可以较好地诠释不同差异比较组中蛋白的表达模式。
2.3 多组数据韦恩图分析
针对3 组实验数据,通过韦恩图分析每组中差异蛋白的特性和共性,根据韦恩图结果以及之前的实验数据,筛选得到3 组共有的差异蛋白及独有的差异蛋白。
由图2可知,0 d/4 d组中独有32 个差异显著蛋白,4 d/8 d组中独有36 个差异显著蛋白,8 d/12 d组中独有43 个差异显著蛋白,3 组样品共有的差异表达蛋白有75 个,后续研究以3 组共有的蛋白质为主。
2.4 滩羊肉风味前体物质差异蛋白质的筛选
在韦恩图的基础上找到3 组共有的差异蛋白75 个,在这75 个蛋白质中,除去结构性蛋白质及功能性蛋白质,筛选出表达量变化大的蛋白质(酶),对比其在3 组中相对含量的变化幅度,发现糖原磷酸化酶、磷酸丙糖异构酶、甘油醛-3-磷酸脱氢酶等20 个与风味前体物质有关的蛋白质。
表3 差异蛋白表达量的变化
Table 3 Variation in differential protein expressions
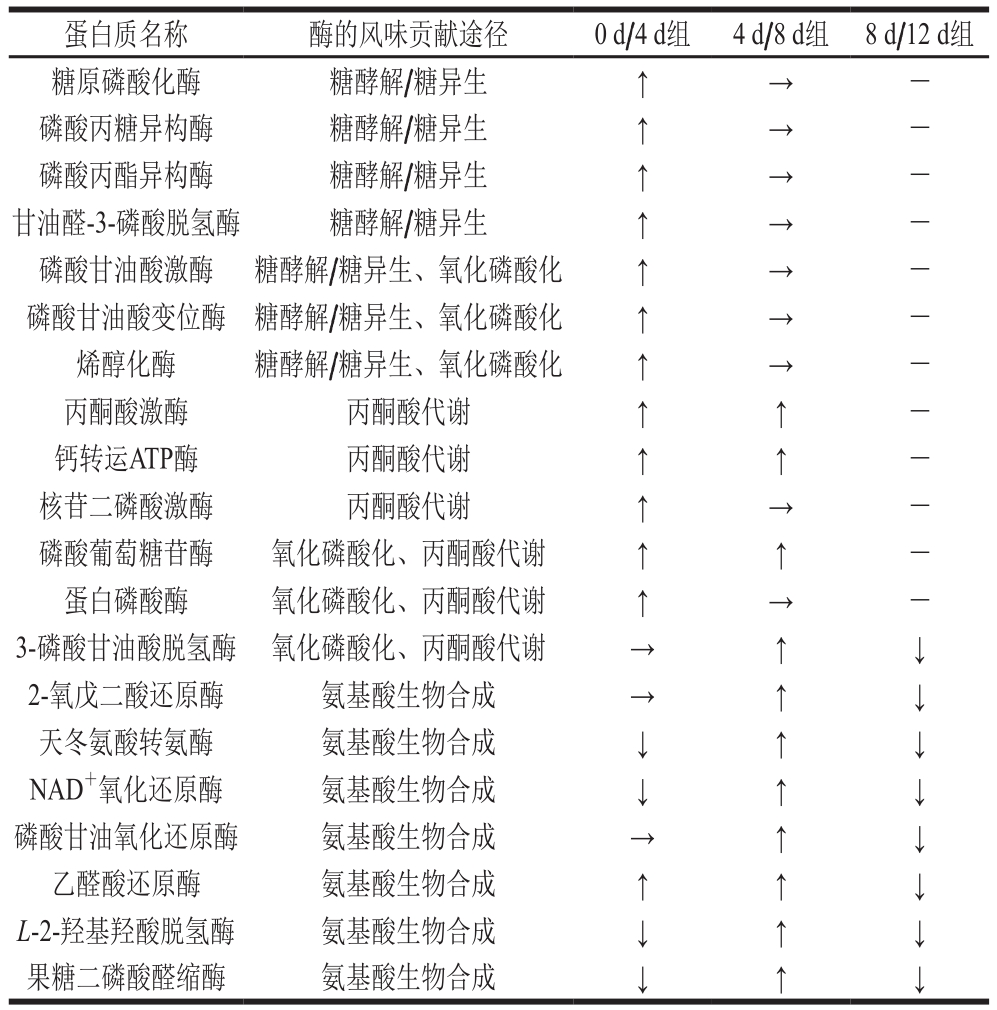
注:NAD+. 烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide);↑. 表达量显著上升;→. 表达量变化持平;↓. 表达量显著下降;-. 未检出。
蛋白质名称 酶的风味贡献途径 0 d/4 d组 4 d/8 d组 8 d/12 d组糖原磷酸化酶 糖酵解/糖异生 ↑ → -磷酸丙糖异构酶 糖酵解/糖异生 ↑ → -磷酸丙酯异构酶 糖酵解/糖异生 ↑ → -甘油醛-3-磷酸脱氢酶 糖酵解/糖异生 ↑ → -磷酸甘油酸激酶 糖酵解/糖异生、氧化磷酸化 ↑ → -磷酸甘油酸变位酶 糖酵解/糖异生、氧化磷酸化 ↑ → -烯醇化酶 糖酵解/糖异生、氧化磷酸化 ↑ → -丙酮酸激酶 丙酮酸代谢 ↑ ↑ -钙转运ATP酶 丙酮酸代谢 ↑ ↑ -核苷二磷酸激酶 丙酮酸代谢 ↑ → -磷酸葡萄糖苷酶 氧化磷酸化、丙酮酸代谢 ↑ ↑ -蛋白磷酸酶 氧化磷酸化、丙酮酸代谢 ↑ → -3-磷酸甘油酸脱氢酶 氧化磷酸化、丙酮酸代谢 → ↑ ↓2-氧戊二酸还原酶 氨基酸生物合成 → ↑ ↓天冬氨酸转氨酶 氨基酸生物合成 ↓ ↑ ↓NAD+氧化还原酶 氨基酸生物合成 ↓ ↑ ↓磷酸甘油氧化还原酶 氨基酸生物合成 → ↑ ↓乙醛酸还原酶 氨基酸生物合成 ↑ ↑ ↓L-2-羟基羟酸脱氢酶 氨基酸生物合成 ↓ ↑ ↓果糖二磷酸醛缩酶 氨基酸生物合成 ↓ ↑ ↓
生肉是没有香味的,生肉中的风味前体物质,如糖类、氨基酸等,经过加热发生一系列化学反应,最终产生肉的特殊香味。风味前体物质大多来源于碳代谢、糖代谢、蛋白质代谢等生理代谢活动,代谢通路包括糖酵解/糖异生、氧化磷酸化、丙酮酸代谢及氨基酸生物合成等。由表3可知,糖原磷酸化酶[19]、磷酸丙糖异构酶[20]、磷酸丙酯异构酶[21]、甘油醛-3-磷酸脱氢酶[22]、磷酸甘油酸激酶、磷酸甘油酸变位酶[23]及烯醇化酶均参与糖酵解/糖异生代谢通路;磷酸甘油酸激酶、磷酸甘油酸变位酶、烯醇化酶、磷酸葡萄糖苷酶、蛋白磷酸酶及3-磷酸甘油酸脱氢酶[24]均参与氧化磷酸化代谢通路;丙酮酸激酶[25]、钙转运ATP酶[26]、核苷二磷酸激酶、磷酸葡萄糖苷酶、蛋白磷酸酶及3-磷酸甘油酸脱氢酶均参与丙酮酸代谢通路;2-氧戊二酸还原酶、天冬氨酸转氨酶[27]、NAD+氧化还原酶、磷酸甘油氧化还原酶[28]、乙醛酸还原酶[29]、L-2-羟基羟酸脱氢酶及果糖二磷酸醛缩酶[30]均参与氨基酸生物合成代谢通路,这些酶通过调控不同代谢通路,影响风味前体物质的形成。
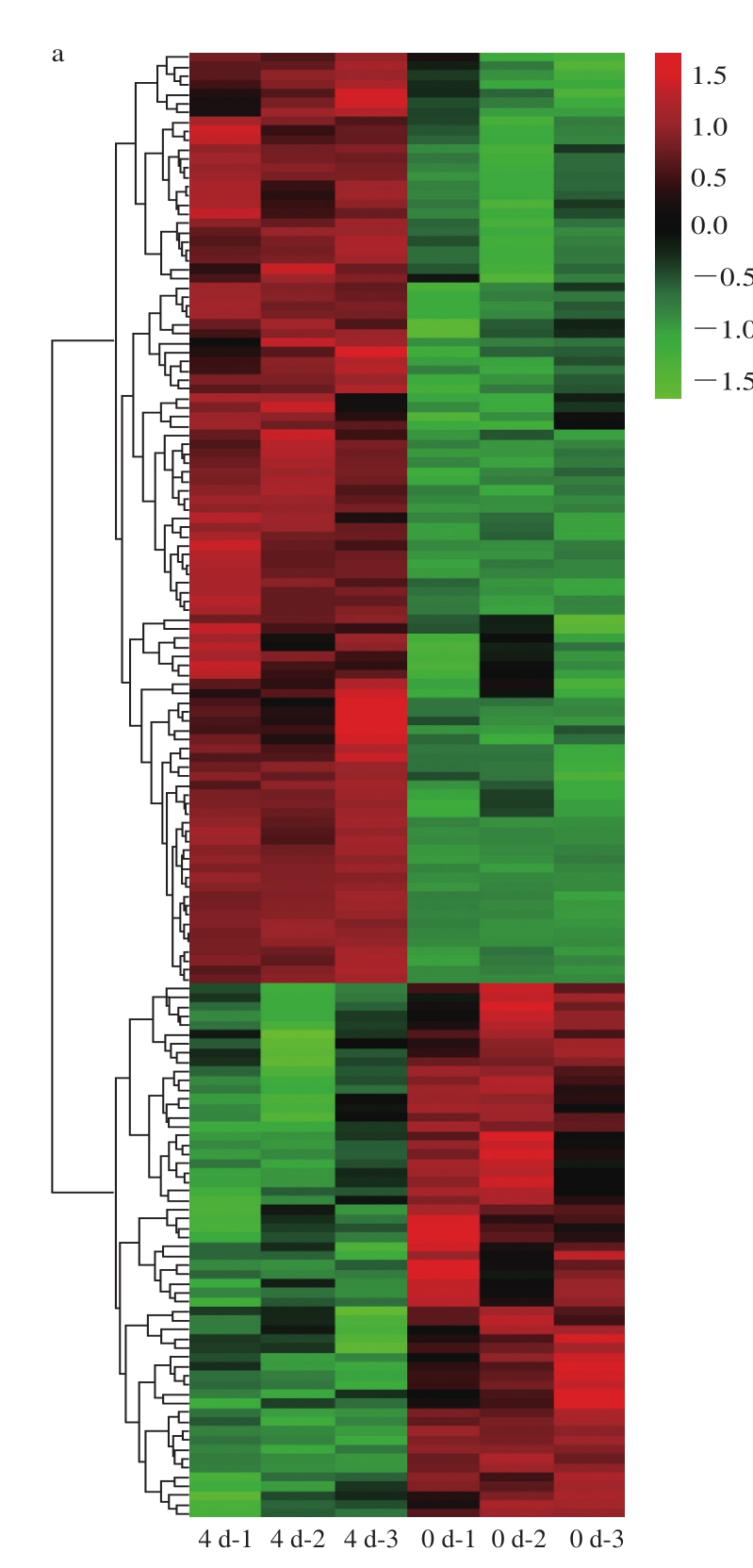
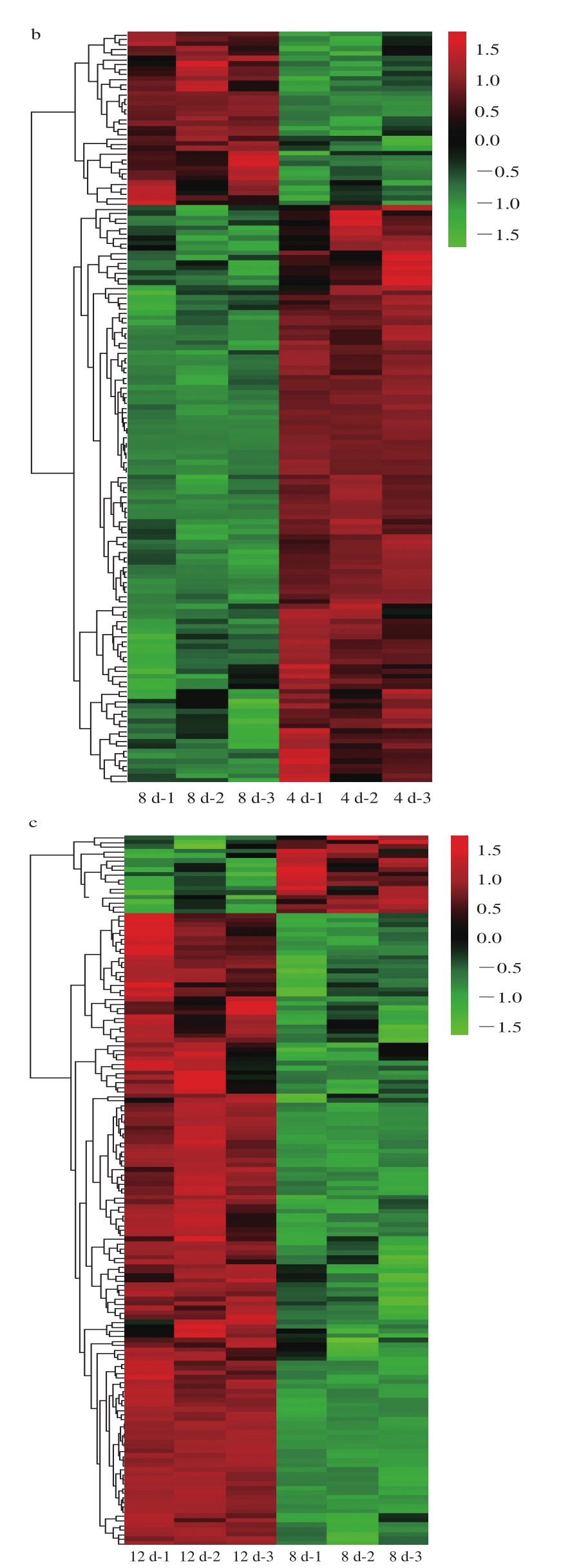
2.5 滩羊肉差异蛋白质层次聚类分析
针对多组数据,通过表达模式聚类热图对每组中的差异点表达模式进行分析,热图是对实验数据分布的直观可视化方法,可以用来进行标准化后实验数据的质量控制和差异数据富集后的定制化数据展示[31-32]。热图也可以对数据和样品进行聚类,观测样品质量,同时也可以根据表达谱对共表达数据进行分组。
本研究基于R语言进行表达模式聚类热图分析。由图3可知,0 d/4 d、4 d/8 d、8 d/12 d组滩羊肉与风味前体物质相关的蛋白质含量分布差异很明显。根据蛋白质的编号,对照表3进行后续分析。贮藏0~12 d内,差异表达蛋白质的种类随贮藏时间的延长总体呈下降趋势。0 d/4 d组蛋白质含量分布差异非常明显。由图3a可知,烯醇化酶、糖原磷酸化酶、磷酸丙糖异构酶、磷酸丙酯异构酶、甘油醛-3-磷酸脱氢酶、磷酸甘油酸激酶、磷酸甘油酸变位酶、丙酮酸激酶及蛋白磷酸酶等差异蛋白在4 d组的含量较高,而在0 d组的含量相对较低;由图3b可知,3-磷酸甘油酸脱氢酶、2-氧戊二酸还原酶、天冬氨酸转氨酶、磷酸甘油氧化还原酶、乙醛酸还原酶及L-2-羟基羟酸脱氢酶等差异蛋白在8 d组的含量较高,而在4 d组的含量相对较低。8 d是代谢活动的分水岭,贮藏8 d后,代谢酶含量开始下降,与风味前体物质形成相关的代谢途径关闭。
3 结 论
本研究选取宁夏滩羊羔羊肉为实验样品,应用iTRAQ技术对宰后0、4、8、12 d的滩羊肉样品进行差异蛋白质分析,在整个数据预处理过程中分析数据,数据分析包括可信蛋白质筛选、差异蛋白质筛选、主成分分析、韦恩图分析及层次聚类分析。3 组样品共筛选出差异蛋白质464 个,根据聚类热图及韦恩图分析筛选出75 个差异蛋白质;从上述差异蛋白质中找到可能和滩羊肉风味前体物质有关联的20 个差异蛋白质,分别为糖原磷酸化酶、磷酸丙糖异构酶、磷酸丙酯异构酶、甘油醛-3-磷酸脱氢酶、磷酸甘油酸激酶、磷酸甘油酸变位酶、烯醇化酶、丙酮酸激酶、钙转运ATP酶、核苷二磷酸激酶、磷酸葡萄糖苷酶、蛋白磷酸酶、3-磷酸甘油酸脱氢酶、2-氧戊二酸还原酶、天冬氨酸转氨酶、NAD+氧化还原酶、磷酸甘油氧化还原酶、乙醛酸还原酶、L-2-羟基羟酸脱氢酶和果糖二磷酸醛缩酶。
寻找差异蛋白质有助于进一步探索宰后滩羊肉的代谢过程,了解肉类的风味以及风味物质前体、中间体的来历、反应过程、反应条件、调控因素及其形成机理。用蛋白质组学研究屠宰后基因的转录、翻译、表达与风味物质前体、中间体的关联,是了解滩羊肉风味物质前体及中间体合成途径及其调控机制的有效方法。本研究为揭示冷鲜肉中差异蛋白质形成之间的关系及研究冷鲜羊肉的代谢驱动提供了理论参考。
参考文献:
[1] 张志超, 段子渊, 张新华, 等. 羊肉肉质风味研究进展[J]. 肉类研究,2018, 32(10): 61-65. DOI:10.7506/rlyj1001-8123-201810011.
[2] 李伟, 罗瑞明, 李亚蕾, 等. 宁夏滩羊肉的特征香气成分分析[J].现代食品科技, 2013, 29(5): 1173-1177. DOI:10.13982/j.mfst.1673-9078.2013.05.010.
[3] 赵万余, 李爱华. 宁夏滩羊不同部位肉中挥发性风味物质分析[J].安徽农业科学, 2012, 40(5): 2725-2727. DOI:10.13989/j.cnki.0517-6611.2012.05.236.
[4] 徐薇薇, 姚瑞基, 袁维新, 等. 宁夏滩羊后腿肉营养评价及挥发性风味物质分析[J]. 肉类研究, 2017, 31(10): 41-45. DOI:10.7506/rlyj1001-8123-201710008.
[5] 王振东, 王彦清, 周瑞铮, 等. 基于主成分分析法的羊肉特征性风味强度评价模型的构建[J]. 食品科学, 2017, 38(22): 162-168.DOI:10.7506/spkx1002-6630-201722025.
[6] 刘登勇, 周光宏, 徐幸莲. 确定食品关键风味化合物的一种新方法:“ROAV”法[J]. 食品科学, 2008, 29(7): 370-374.
[7] 王朕朕. 限时放牧对羊肉风味物质沉积的影响及其机制初探[D]. 北京: 中国农业大学, 2015: 22-34.
[8] 王旭, 张同刚, 龚媛, 等. 响应面法优化固相微萃取-气质联用法检测低温羊肉火腿中挥发性风味物质[J]. 中国调味品, 2015, 40(10):106-111; 119. DOI:10.3969/j.issn.1000-9973.2015.10.027.
[9] 郇延军, 许伟, 赵雅娟, 等. 冷鲜肉品质评价指标的探讨[J]. 食品科学, 2012, 33(21): 107-110.
[10] 周光宏. 畜产品加工学[M]. 北京: 中国农业出版社, 2011: 79-83.
[11] 程述震, 王晓拓, 王志东. 冷鲜肉保鲜技术研究进展[J].食品研究与开发, 2017, 38(16): 194-198. DOI:10.3969/j.issn.1005-6521.2017.16.042.
[12] KOUTSIDIS G, ELMORE J S, ORUNA-CONCHA M J, et al.Water soluble of beef flavor. Part Ⅱ: effect of post-mortem conditioning[J]. Meat Science, 2007, 79(2): 270-277. DOI:10.1016/j.meatsci.2007.09.010.
[13] HUGHES J M, OISETH S K, PURSLOW P P, et al. A structural approach to understanding the interactions between colour, waterholding capacity and tenderness[J]. Meat Science, 2014, 98(3):520-532. DOI:10.1016/j.meatsci.2014.05.022.
[14] 刘思洁, 吴永宁, 方赤光. 代谢组学技术在食品安全中的应用[J]. 食品安全质量检测学报, 2014, 5(4): 1081-1086.
[15] 王稳航, 肜祺, 李得旺, 等. 畜禽屠宰后肌肉细胞死亡机制研究进展[J]. 现代食品科技, 2013, 29(2): 429-433. DOI:10.13982/j.mfst.1673-9078.2013.02.040.
[16] SMITH P K, KROHN R I, HERMANSON G T, et al. Measurement of protein using bicinchoninic acid[J]. Analytical Biochemistry, 1985,150(1): 76-85. DOI:10.1016/0003-2697(85)90442-7.
[17] CANDIANO G, BRUSCHI M, MUSANTE L, et al. Blue silver:a very sensitive colloidal coomassie G-250 staining for proteome analysis[J]. Electrophoresis, 2004, 25(9): 1327-1333. DOI:10.1002/elps.200305844.
[18] WISNIEWSKI J R, ZOUGMAN A, NAGARAJ N, et al. Universal sample preparation method for proteome analysis[J]. Nature Methods,2009, 6(5): 359-362. DOI:10.1038/nmeth.1322.
[19] AGIUS L. Role of glycogen phosphorylase in liver glycogen metabolism[J]. Molecular Aspects of Medicine, 2015, 46: 34-45.DOI:10.1016/j.mam.2015.09.002.
[20] SCHWEIKER S S, LOUGHLIN W A, LOHNING A S, et al.Synthesis, screening and docking of small heterocycles as glycogen phosphorylase inhibitors[J]. European Journal of Medicinal Chemistry,2014, 84: 584-594. DOI:10.1016/j.ejmech.2014.07.063.
[21] 刘思玮, 李琪, 于红, 等. 长牡蛎糖原磷酸化酶基因SNPs与生长性状和糖原含量的相关性分析[J]. 中国水产科学, 2013, 20(3): 481-489.DOI:10.3724/SP.J.1118.2013.00481.
[22] VILAGRAN I, CASTILLO-MARTÍN M, PRIETO-MARTÍNEZ N,et al. Triosephosphate isomerase (TPI) and epididymal secretory glutathione peroxidase (GPX5) are markers for boar sperm quality[J].Animal Reproduction Science, 2016, 165: 22-30. DOI:10.1016/j.anireprosci.2015.12.001.
[23] 张永霞. 克氏原螯虾磷酸丙糖异构酶的纯化及过敏性分析[C]//中国食品科学技术学会第11届年会论文摘要集. 北京: 中国食品科学技术学会, 2014: 12-14.
[24] DAMITIE M, MEKONNEN Z, GETAHUN T, et al. Molecular epidemiology of Giardia duodenalis infection in humans in Southern Ethiopia: a triosephosphate isomerase gene-targeted analysis[J].Infectious Diseases of Poverty, 2018, 7: 17. DOI:10.1186/s40249-018-0397-4.
[25] 徐亦良. GC-MS法研究DXS磷酸丙糖异构化活性机理[D]. 西安: 西北大学, 2014: 12-19.
[26] BANDYOPADHYAY D, PRAKASH S, GUPTA K, et al. Mass spectrometric analysis of dimer-disrupting mutations in Plasmodium triosephosphate isomerase[J]. Analytical Biochemistry, 2016, 500:45-50. DOI:10.1016/j.ab.2016.02.011.
[27] 陶亚飞, 陈青, 徐媛媛, 等. 油脂类型对肉鸡不同组织甘油醛-3-磷酸脱氢酶基因相对表达量的影响[J]. 动物营养学报, 2017, 29(5):1750-1758.
[28] 禹淞文. 甘油醛-3-磷酸脱氢酶的原核表达及其单克隆抗体的制备[D]. 长沙: 湖南农业大学, 2014: 18-26.
[29] 禹淞文, 李清明. 甘油醛-3-磷酸脱氢酶的应用进展[J]. 农产品加工(学刊), 2014(9): 51-53.
[30] 李亭亭. 乙酰化修饰对甘油醛-3-磷酸脱氢酶的调控机制及其在细胞增殖中作用的研究[D]. 上海: 复旦大学, 2014: 17-21.
[31] THOMPSON J A, CARLSON G M. The regulatory α and β subunits of phosphorylase kinase directly interact with its substrate, glycogen phosphorylase[J]. Biochemical and Biophysical Research Communications, 2017, 482(2): 221-225. DOI:10.1016/j.bbrc.2016.11.044.
[32] KANTSADI A L, STRAVODIMOS G A, KYRIAKIS E, et al. van der Waals interactions govern C-β-D-glucopyranosyl triazoles’ nM inhibitory potency in human liver glycogen phosphorylase[J].Journal of Structural Biology, 2017, 199(1): 57-67. DOI:10.1016/j.jsb.2017.05.001.
Analysis of Important Proteins for Flavor Formation of Tan Sheep Meat
LI Zixin, YOU Liqin, LUO Ruiming*, YUAN Yudong, ZHAO Xiaoce, JI Chen
(School of Agriculture, Ningxia University, Yinchuan 750021, China)
Abstract: In this study, chilled Tan sheep meat was analyzed by isobaric tags for relative and absolute quantitation (iTRAQ)and liquid chromatography tandem mass spectrometry (LC-MS/MS) in order to identify the differential proteins related to the formation and regulation of fl avor precursors in Tan sheep meat. Quantitative analysis of Tan sheep meat from 0 to 12 days after slaughter was carried out, and credible proteins and differential proteins were screened out and identified via database search. A total of 814 proteins were identified in three comparative groups of meat samples. A total of 159 differential proteins were found between 0 and 4 days postmortem, and 151 both between 4 and 8 days, and between 8 and 12 days. By analyzing these groups of differential proteins, it was found that 21 proteins, such as glycogen phosphorylase,triose phosphate isomerase and glyceraldehyde-3-phosphate dehydrogenase, might be related to the variability of flavor precursors and fl avor expression in Tan sheep meat.
Keywords: chilled Tan sheep meat; isotope marker relative and absolute quantitative technique; flavor precursors;differentially expressed proteins
收稿日期:2019-02-26
基金项目:国家自然科学基金地区科学基金项目(31860427)
第一作者简介:李子欣(1995—)(ORCID: 0000-0002-9591-7123),女,硕士研究生,研究方向为畜产品贮藏与加工。E-mail: 635872396@qq.com
*通信作者简介:罗瑞明(1964—)(ORCID: 0000-0003-3704-0519),男,教授,博士,研究方向为畜产品贮藏与加工。E-mail: ruimingluo.nx@163.com
DOI:10.7506/rlyj1001-8123-20190226-036
中图分类号:TS251.1
文献标志码:A
文章编号:1001-8123(2019)05-0007-06
引文格式:李子欣, 尤丽琴, 罗瑞明, 等. 滩羊肉风味形成中重要蛋白质的解析[J]. 肉类研究, 2019, 33(5): 7-12. DOI:10.7506/rlyj1001-8123-20190226-036. http://www.rlyj.net.cn
LI Zixin, YOU Liqin, LUO Ruiming, et al. Analysis of important proteins for fl avor formation of Tan sheep meat[J]. Meat Research, 2019, 33(5): 7-12. DOI:10.7506/rlyj1001-8123-20190226-036. http://www.rlyj.net.cn