
图 1 SEM抗原合成路线图
Fig. 1 SEM hapten synthesis and conjugation to BSA
呋喃西林(Nitrofural),又称呋喃新、硝基呋喃腙、呋喃星,是一种硝基呋喃类药物,是一种可以治疗牲畜疾病的合成抗菌药。动物源性食品中硝基呋喃类药物及其代谢物的残留可通过食物链传递给人类并在机体内富集,长期富集会导致毒性和致癌风险,这种危害已引起了世界各国的极大关注。美国、澳大利亚、日本、欧盟、加拿大及新加坡等国家明确规定禁止在食品工业中使用此类药物[1-2]。各国严格执行对水产中该类药物的残留检测。残留监控措施主要从监控计划、抽样、检测、结果发布和处理五方面进行把控[3]。我国农业部已将呋喃西林列入首批禁用药第235号公告[4],相关部门在全国范围围绕畜、禽、水产品的抗生素、禁用化合物及兽药残留超标等问题开展专项整治活动,严厉打击包括硝基呋喃类在内的药物非法使用、生产和销售。
呋喃类药物及其代谢物在机体内稳定性很差,在弱酸条件下(如人类胃液的酸性条件)从蛋白质中释放出来,在机体内其代谢物与组织蛋白结合后,可以形成稳定状态的化合物[5],其中呋喃西林在组织中结合的代谢产物滞留时间最长,相对毒性反应也最强,现在各国明令禁止其在畜牧生产活动中添加或使用,在这种大环境下对呋喃类药物及其代谢物的研究及检测对从源头遏制此类药物的滥用显得尤为重要。
目前,对呋喃西林代谢物的检测方法主要有高效液相色谱(high performance liquid chromatography,HPLC)法、分光光度法、免疫分析法(immunoassay,IA)等。于慧娟等[6]利用HPLC法测定水产品中呋喃唑酮的残留量,方法灵敏度高,检测限为1.0 μg/kg。彭涛等[7]利用气相色谱-质谱联用(liquid chromatography with tandem mass spectrometry,LC-MS/MS)方法同时测定动物肌肉组织中4 种呋喃类药物呋喃它酮、呋喃唑酮、呋喃妥因和呋喃西林的代谢物,呋喃它酮代谢物(5-morpholinomethyl-3-amino-2-oxalidinone,AMOZ)和呋喃唑酮代谢物(3-amino-2-oxalidinone,AOZ)的定量限均为0.1 ng/g,呋喃西林代谢物(氨基脲盐酸盐)(semicarbazide hydrochloride,SEM)和呋喃妥因代谢物(1-amino-hydantoin,AHD)均为0.5 ng/g;AMOZ和AOZ的检测限均为0.05 ng/g,SEM和AHD均为0.1 ng/g。Cooper等[8]建立了虾组织中呋喃唑酮代谢物3-氨基-2-恶唑烷酮的酶联免疫分析方法,检测限为0.1 μg/kg。
色谱技术样品处理过程繁琐、耗时、成本高,而且需要经过专门训练的人员来操作复杂的设备,并且其复杂的前处理不适合筛选大批量样品[9]。作为一种快速、灵敏、特异的检测方法,荧光免疫层析方法是热门且公认的快速检测方法[10]。本研究先通过衍生化进行抗原合成,再通过细胞杂交瘤技术制备单克隆抗体,对能够稳定、特异性分泌抗呋喃西林代谢物衍生物单克隆抗体的杂交瘤细胞株进行建株,使用单克隆抗体建立用于检测呋喃西林代谢物残留的荧光免疫方法。
1.1.1 动物
BALB/c小鼠购自河北医科大学。
1.1.2 药品
盐酸氨基脲(semicarbazide hydrochloride,SEM·HCl)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride,EDC)、二甲基甲酰胺(N,N-dimethylformamide,DMF)、牛血清白蛋白(bovine serum albumin,BSA)、鸡卵清白蛋白(ovalbumin,OVA) 美国Sigma公司;N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 索莱宝生物科技有限公司;邻醛基苯甲酸(2-carboxybenzaldehyde,2-CBA)、对醛基苯甲酸(4-carboxybenzaldehyde,4-CBA) 阿拉丁试剂(上海)有限公司;无水甲醇无锡亚泰联合化工有限公司。
722紫外-可见分光光度计 上海光学仪器厂;JIDI-16R台式多用途高速冷冻离心机 广州吉迪仪器有限公司;MiLLi-Q Ingegral Lo超纯水系统 德国密理博公司;BS 124S电子天平 赛多利斯科学仪器(北京)有限公司;T-Meter I荧光免疫分析仪 河北特温特生物科技发展有限公司。
1.3.1 免疫抗原的制备
半抗原的合成[11]:将0.4 g 4-CBA加入到2 mL纯水中,并将DMF缓缓加入上述溶液中,边滴加边搅拌直至4-CBA完全溶解,然后缓慢加入0.5 g SEM·HCl,并在室温下反应4 h;过滤反应溶液,得到淡黄色固体,用纯水洗涤3 次,在50 ℃条件下进行干燥,得到半抗原呋喃西林衍生物CPSEM(CP(羧基苯甲醛)与SEM的衍生物)。
抗原的合成:称取21 mg CPSEM溶于2 mL DMF中,缓慢加入溶有18 mg NHS的PBS缓冲液,搅拌反应5 min后,加入3 mL溶有40 mg EDC的0.01 mol/L PBS缓冲液,在室温下搅拌2 h;称取60 mg BSA溶于2 mL PBS中,然后将上述反应溶液缓慢加入,4 ℃搅拌过夜;0.01 mol/L PBS透析3 d,-20 ℃保存备用。SEM抗原合成路线图如图1所示。检测原同法制备。

图 1 SEM抗原合成路线图
Fig. 1 SEM hapten synthesis and conjugation to BSA
1.3.2 免疫抗原的鉴定
1.3.2.1 紫外扫描法
用PBS对CPSEM和BSA进行适当稀释,测定BSA的蛋白浓度,把CPSEM-BSA稀释到与BSA相同浓度,在220~700 nm波长下扫描,参考杨立国等[12]的方法计算BSA与CPSEM的分子偶联比。
1.3.2.2 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)鉴定
选择分离凝胶为12%,浓缩凝胶为5%,通过SDS-PAGE对合成物进行鉴定。
1.3.2.3 免疫法
根据李春生等[13]的方法,通过CPSEM-BSA免疫BALB/c小鼠,并进行融合实验。
1.3.3 荧光微球(quantum dot submicrobeads,QBs)标记SEM单克隆抗体
采用EDC法偶联QBs和SEM抗体[14]:将QBs用0.1 mol/L、pH 5.5的MES溶液清洗2 遍,再用0.1 mol/L、pH 5.5的MES溶液5 mL复溶,10 000 r/min离心30 min,沉淀用MES溶液重悬,加入一定量的0.01 mol/L EDC,混合反应12 h;10 000 r/min离心30 min,沉淀用0.1 mol/L的Tris-1% Casein溶液复溶,混合反应4 h;10 000 r/min离心30 min,用0.1 mol/L的Tris-1%聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)溶液复溶,制备得到将SEM抗体用QBs标记的产物,即QBs探针,4 ℃保存,备用。
1.3.4 硝化纤维素(nitrocellulose,NC)膜封闭条件的优化
通过改变NC膜封闭液的各组分浓度,来降低背景干扰和假阳性率。采用筛选的封闭液浸泡NC膜,37 ℃烘干4 h,之后用划膜仪将T线和C线包被在NC膜上,37 ℃干燥3 h。干燥环境密封保存备用。
1.3.5 荧光免疫层析试纸条的组成
QBs荧光免疫层析试纸条的组成如图2所示,其中QBs探针包被在结合垫上,SEM抗原作为T线、羊抗兔二抗作为C线喷涂在NC膜上。
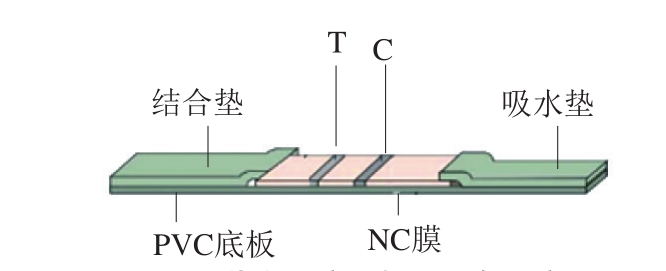
图 2 荧光免疫层析试纸条示意图
Fig. 2 Schematic of the fluorescence immunochromatographic test strip
1.3.6 样品预处理
取2 g均质鱼肉样本于50 mL离心管中,依次加入4 mL去离子水、0.5 mL 1 mol/L HCl和100 μL 2-硝基苯甲醛,充分振荡,置于60 ℃恒温水浴孵育1 h;取出后依次加入5 mL 0.1 mol/L K2HPO4、0.4 mL 1 mol/L NaOH和5 mL乙酸乙酯,充分振荡2 min,室温条件下5 000 r/min离心10 min;取出2.5 mL乙酸乙酯层(上层)到5 mL离心管中,50 ℃氮气吹干,加入1 mL正己烷溶解,加入1 mL PBS充分混合30 s;室温条件下5 000 r/min离心10 min,取50 μL下层用于分析。
1.3.7 荧光免疫层析试纸条性能测试
1.3.7.1 检测限
根据欧盟《动物源性食品中兽药残留检测方法》的规定[15],分别测定20 份鱼肉组织空白样品,按照1.3.6节的方法处理样品,用回归方程计算样品残留浓度,用SPSS软件得出样品浓度的平均值( )和标准差(s),以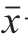 +3s作为鱼肉组织的最低检测限。
+3s作为鱼肉组织的最低检测限。
1.3.7.2 准确度
通过鱼肉样本添加回收实验检测荧光免疫层析试纸条的准确度[16-18]。在空白鱼肉组织中添加不同质量浓度的待测物,按照1.3.6节的方法处理样品,重复3 次,用荧光免疫层析试纸条进行测试,在荧光免疫分析仪上读取检测结果。按照公式(1)计算回收率。
1.3.7.3 精密度
精密度实验结果用变异系数来表示[19-21]。取3 个批次的试剂盒进行批间和批内测定,批间测定:向鱼肉组织中添加2 个不同质量浓度的待测物,每个质量浓度重复测定5 次,得出 和s;批内测定:向鱼肉组织中添加2 个不同质量浓度的待测物,进行重复测定,得出
和s;批内测定:向鱼肉组织中添加2 个不同质量浓度的待测物,进行重复测定,得出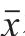 和s,计算变异系数,分析批内和批间精密度。按照公式(2)计算变异系数。
和s,计算变异系数,分析批内和批间精密度。按照公式(2)计算变异系数。
1.3.7.4 稳定性
将荧光免疫层析试纸条分为3 组,分别在2~8 ℃、37 ℃、-20 ℃温度条件下进行稳定性测试[22-24]。2~8 ℃条件下保存6 个月、每个月检测1 次,37 ℃和-20 ℃条件下放置6 d、每天检测1 次,测定阴性样本的测定值和回收率等参数。
采用SPSS统计软件进行数据处理,Origin制图软件绘制标准曲线。
2.1.1 紫外扫描法鉴定
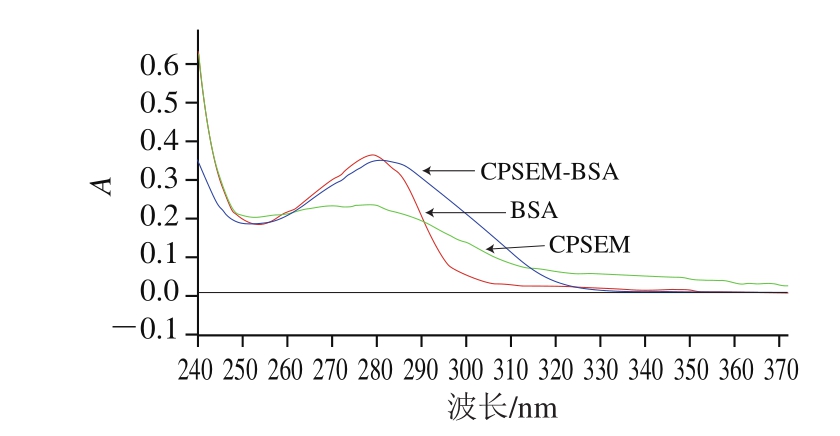
图 3 CPSEM-BSA紫外扫描图
Fig. 3 UV spectrum of CPSEM-BSA
由图3可知,BSA的最大吸收峰在280 nm波长处,CPSEM的最大吸收峰在275 nm波长处,BSA和CPSEM偶联后,主峰位移至285 nm波长处,出现紫外叠加,表明偶联成功。根据朗伯-比尔定律,计算出CPSEM-BSA的分子结合比为11.8∶1。同理,计算出CPSEM-OVA的分子结合比为21∶1。
2.1.2 SDS-PAGE法鉴定
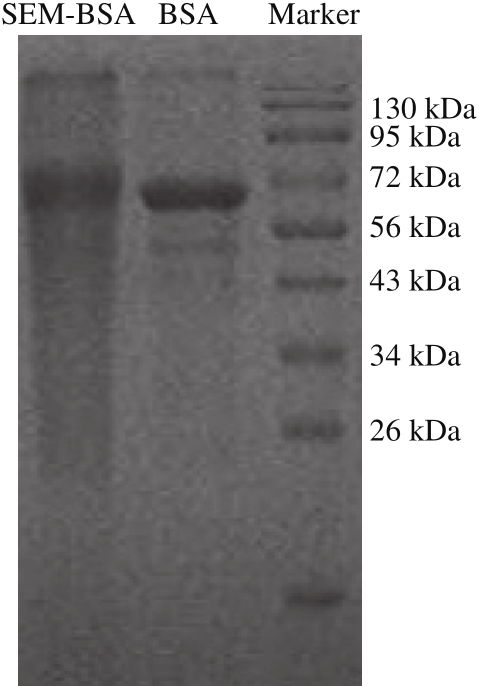
图 4 CPSEM-BSA的SDS-PAGE鉴定结果
Fig. 4 SDS-PAGE of CPSEM-BSA
由图4可知,BSA条带约在68 kDa处,CPSEM-BSA与BSA的电泳速率稍有差异,CPSEM-BSA的条带滞后,说明其分子质量较BSA有所增加,推断是BSA连接了CPSEM所致,通过紫外凝胶成像系统分析软件计算的偶联比和紫外扫描结果一致。
2.1.3 效价测定
通过间接酶联免疫吸附法测定小鼠血清效价,针对抗体和抗原特异性结合情况判断免疫是否成功。由表1可知,人工合成的SEM抗原免疫小鼠后,效价最高达1∶512 000,特异性良好。
表 1 间接酶联免疫吸附法检测效价
Table 1 Titer measurement by indirect enzyme-linked immunosorbent assay
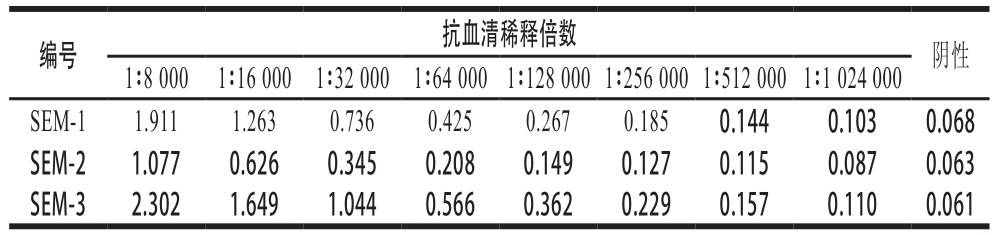
编号 抗血清稀释倍数 阴性1∶8 000 1∶16 000 1∶32 000 1∶64 0001∶128 0001∶256 0001∶512 0001∶1 024 000 SEM-1 1.911 1.263 0.736 0.425 0.267 0.185 0.144 0.103 0.068 SEM-2 1.077 0.626 0.345 0.208 0.149 0.127 0.115 0.087 0.063 SEM-3 2.302 1.649 1.044 0.566 0.362 0.229 0.157 0.110 0.061
表 2 不同封闭液的选择
Table 2 Screening for optimal blocking buffer
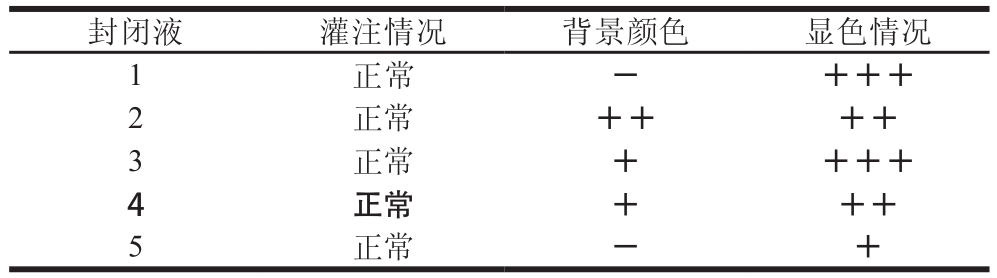
注:背景颜色:-. 无背景颜色,+. 有背景颜色,+越多,代表颜色越深;显色情况:+. 显色深浅,+越多,代表显色越深。
封闭液 灌注情况 背景颜色 显色情况1正常 - +++2正常 ++ ++3正常 + +++4正常 + ++5正常 - +
封闭液目的在于封闭多余的结合位点,阻断金标抗体在NC膜上的非特异性结合,保持背景的干净,突出检测线的颜色[25-26]。由表2可知,采用封闭液1封闭后,显色明显,且无背景颜色,说明封闭液1封闭效果很好。采用封闭液3封闭后,得到的检测线颜色虽然很深、很明显,但增加了一定的背景颜色,降低了检测线相对于背景的反差。封闭液4和5的背景颜色浅,但是检测线颜色浅,显色效果不明显。因此,选择封闭液1进行封闭。
2.3.1 标准曲线的建立
标准曲线方程为y=-1.444 5x+1.485 5(R²=0.992 9),线性关系良好。测定20 份空白鱼肉组织样品的平均值为0.154 μg/L,标准差为0.031 μg/L,鱼肉组织的检测限为0.247 μg/L。
2.3.2 准确度及精密度测定结果
表 3 回收率实验结果
Table 3 Results of recovery test
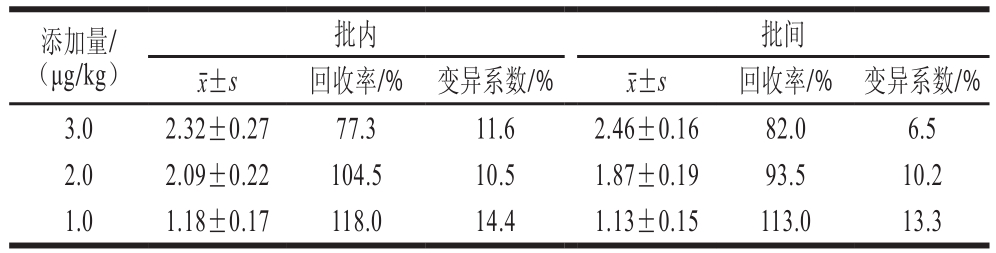
添加量/(μg/kg)批内 批间±s 回收率/% 变异系数/%3.0 2.32±0.27 77.3 11.6 2.46±0.16 82.0 6.5 2.0 2.09±0.22 104.5 10.5 1.87±0.19 93.5 10.2 1.0 1.18±0.17 118.0 14.4 1.13±0.15 113.0 13.3±s 回收率/% 变异系数/%
由表3可知,鱼肉组织添加回收实验的回收率均在70%~120%之间,批内、批间变异系数均在15%以下,符合我国动物源食品中兽药残留检测方法相关指导文件的规定。
2.3.3 稳定性测定结果
由表4可知,SEM荧光免疫层析试纸条的阴性样本测定值(T/C值)、R2、样本回收率没有超出正常范围,其中阴性样本测定值(T/C值)随着保存时间的延长有所下降,但仍在3.0以上。试纸条的各项指标均符合指导原则的要求。
表 4 稳定性实验结果
Table 4 Results of stability test

试纸条保存条件 阴性样本测定值(T/C值)/(μg/L)样品回收率/%R2 2~8 ℃,1~6 个月 3.50±0.13 70~120 >0.99 37 ℃,1~6 d 3.40±0.18 70~120 >0.98-20 ℃,1~6 d 3.50±0.29 70~120 >0.98
药物残留免疫荧光检测方法的建立包括待测物的甄选、完全抗原的合成、特异性抗体的制备、检测方法的建立及样本的预处理等内容[27]。完全抗原的合成很关键,如果结构中含有药物的特征结构,尤其是立体化学特征,则能够被免疫活性细胞识别并特异性结合[28],SEM半抗原自身缺乏羧基末端,通过NHS-EDC法添加上含苯环结构的羧基末端[29],且苯环结构作为含有活性末端的间隔臂,有助于特异性部位的暴露与识别。SEM是小分子物质,相对分子质量为75,不具备免疫原性,只有反应原性,目前还没有针对SEM的特异性抗体出现,目前的研究都只是针对SEM的衍生物CPSEM。故本研究通过衍生化引入苯环结构,使特异性部位暴露,增强SEM的免疫原性,使其与蛋白质偶联,刺激机体产生免疫应答,从而刺激机体产生特异性抗体。
基于免疫分析技术研究的报道目前较少,市售的产品也很紧缺,主要为来自德国Biopharm公司的产品。国内有一些针对SEM的研究报道,但针对酶联免疫吸附检测和胶体金的研究居多。唐勇等[30]通过制备抗CPSEM单抗-纳米金-单链硫醇化DNA复合物,建立了SEM免疫吸附生物条码检测方法,此检测方法灵敏度为8 pg/mL。何方洋等[31]建立了基于免疫胶体金技术的快速检测方法,用于测定饲料样本中的呋喃西林,此方法的检测限为2 μg/L。赵正苗等[32]建立胶体金免疫层析法检测动物组织中残留的呋喃西林代谢物,此方法的检测限为1.0 μg/L。荧光免疫层析法是目前快速发展的一种免疫学检测技术,常用的荧光物质包括荧光素和荧光乳胶微球,荧光层析试纸条借助荧光检测仪器可以实现结果的定量检测。
本研究通过将QBs与SEM抗体结合,制备得到QBs探针,用于鱼肉组织检测时的检测限为0.247 μg/L,不同添加量条件下的回收率均在70%~120%之间,批内、批间变异系数均在15%以下,符合我国动物源食品中兽药残留检测方法相关指导文件的规定,且在2~8 ℃条件下可以保存6 个月以上,稳定性良好。
[1] 李军, 张会彩, 刘聚祥, 等. 酶联免疫吸附检测动物饲料中呋喃唑酮[J]. 中国兽医杂志, 2009, 45(8): 85-86. DOI:10.3969/j.issn.0529-6005.2009.08.034.
[2] 蒋宏伟. 酶联免疫技术在动物产品中硝基呋喃类药物残留检测的应用[J]. 陕西农业科学, 2006(5): 53-55.
[3] 祝伟霞, 刘亚风, 梁伟, 等. 动物性食品中硝基呋喃类药物残留检测研究进展[J]. 动物医学进展, 2010, 31(2): 99-102. DOI:10.3969/j.issn.1007-5038.2010.02.023.
[4] 中华人民共和国农业部第235号公告[EB/OL]. (2002-12-24) [2018-12-10].
[5] LAI W H, FUNG D Y, XU Y, et al. Screening procedures for clenbuterol residue determination in law swine livers using lateral-flow assay and enzyme-linked immunosorbent assay[J]. Journal of Food Protection, 2008, 71(4): 865-869.
[6] 于慧娟, 蔡友琼, 毕士川, 等. 高效液相色谱法测定水产品中呋喃唑酮的残留量[J]. 色谱, 2005, 23(1): 114-117. DOI:10.3321/j.issn:1000-8713.2005.01.031.
[7] 彭涛, 邱月明, 李淑娟, 等. 高效液相色谱-串联质谱法测定动物肌肉中硝基呋喃类抗生素代谢物[J]. 检验检疫科学, 2003, 13(6): 23-28.DOI:10.3969/j.issn.1674-5354.2003.06.007.
[8] COOPER K M, CADDELL A. Production and characterization of polyclonal antibodies to a derivative of 3-amino-2-oxazolidinone, a metabolite of the nitrofuran furazolidone[J]. Analytica Chimica Acta,2004, 520: 79-86. DOI:10.1016/j.aca.2004.05.074.
[9] 王丽娜, 刘凯, 杜柏林, 等. UPLC/MS/MS测定动物尿液中9 种β-受体激动剂残留量[J]. 现代畜牧兽医, 2013(8): 42-46. DOI:10.3969/j.issn.1672-9692.2013.08.018.
[10] 葛怀礼, 王莲, 李金卿, 等. 盐酸克伦特罗荧光定量检测试剂盒质量评价[J]. 中国畜牧兽医, 2014, 41(10): 285-289.
[11] 赵亦静, 傅小伟, 张明洲, 等. 呋喃西林免疫抗原的合成与鉴定[J]. 现代农业科技, 2008, 14: 197-199. DOI:10.3969/j.issn.1007-5739.2008.14.151.
[12] 杨立国, 胡少昶, 魏平华, 等. 酶免疫测定技术[M]. 南京: 南京大学出版社, 1998: 189-284.
[13] 李春生, 刘静静, 杜顺丰, 等. 呋喃唑酮代谢物单克隆抗体和胶体金免疫层析试纸条的研制[J]. 现代食品科技, 2017, 43(3): 326-331.DOI:10.13982/j.mfst.1673-9078.2017.6.048.
[14] 丁桥棋, 李丽, 范文韬, 等. 基于新型量子点荧光微球的氯霉素免疫层析试纸条的制备和应用[J]. 分析化学研究报告, 2017, 45(11):1686-1693. DOI:10.11895/j.issn.0253-3820.170300.
[15] 解泉源, 赖卫华, 刘春梅, 等. 大肠杆菌O157:H7荧光微球免疫层析试纸条的研制[J]. 食品科学, 2013, 34(16): 353-357. DOI:10.7506/spkx1002-6630-201316072.
[16] 李军, 刘莲娜, 孟晓璐, 等. 硝基呋喃类药物胶体金免疫层析试纸条的研制[J]. 畜牧与兽医, 2014, 46(1):74-77.
[17] 段宏, 陈雪岚, 江湖, 等. 量子点荧光微球免疫层析试纸条定量检测恶性恶性疟原虫[J]. 分析化学, 2015, 43(3): 338-343. DOI:10.11895i ssn.0253-3820.140848.
[18] ZHANG Mingxia, LI Cun, WU Yinliang. Determination of phenylethanolamine A in animal hair, tissues and feeds by reversed phase liquid chromatography tandem mass spectrometry with QuEChERS[J]. Journal of Chromatogrephy B, 2012, 900: 94-99.DOI:10.1016/j.jchromb.2012.05.030.
[19] 唐海波, 齐维, 唐诗幸, 等. 荧光定量快速检测鲜奶中四环素总量残留[J]. 现代食品科技, 2012, 28(11): 1600-1602.
[20] 胡华军, 付涛, 张明洲, 等. CdTe/ZnSe壳核量子点免疫层析试纸条检测科伦特伦的研究[J]. 分析化学, 2010, 38(12): 1727-1731.DOI:10.3724/SP.J.1096.2010.01727.
[21] 郭诗静, 唐海波, 齐维, 等. 免疫荧光层析快速检测猪尿中克伦特罗含量[J]. 现代食品科技, 2013, 29(5): 1154-1156.
[22] 方琦, 黄锡荣, 李凯, 等. 降钙素原荧光免疫层析定量检测方法的建立及性能评估[J]. 中华检验医学杂志, 2012, 35(12): 1102-1107.DOI:10.3760/cma.j.issn.1009-9158.2012.12.011.
[23] 郭艳宏, 李飞, 邹明强, 等. 用于检测氯霉素类残留物的荧光免疫检测试纸条的研制[J]. 化学试剂, 2010, 32(6): 496-498. DOI:10.3969/j.issn.0258-3283.2010.06.005.
[24] 范放, 朱海, 洪小柳, 等. 氯霉素荧光纳米颗粒免疫层析法的建立[J].现代农业科学, 2009, 16(9): 13-14.
[25] KE Yan, FU Lanli, HONG Xiafei, et al. Acute clenbuterol induces hypotension, atrioventricular block and cardiacasystole in the rabbit[J].Cardiovasc Toxicol, 2013, 13(1): 85-90. DOI:10.1007/sl2012-012-9185-8.
[26] 胡佳丽, 于东升, 刘小雷, 等. 荧光免疫层析法快速测定牛奶中头孢氨苄残留量[J]. 中国食品卫生杂志, 2014, 26(4): 362-366.DOI:10.13590/j.cjfh.2014.04.015.
[27] 姜艳彬, 孙冠如, 王海, 等. 盐酸克伦特罗胶体金快速检测试纸条的研制[J]. 中国畜牧兽医, 2010, 37(10): 109-113.
[28] 朱海, 范放, 洪小柳, 等. 氯霉素荧光纳米颗粒免疫层析法的建立[J].现代农业科学, 2009, 16(9): 13-14.
[29] 李丹妮, 黄华, 张倩, 等. 3 种β-受体激动剂荧光免疫层析试纸条的制备及特性研究[J]. 中国畜牧兽医, 2017, 44(8): 2437-2442.DOI:10.16431/j.cnki.1671-7236.2017.08.031.
[30] 唐勇, 王五洲, 向军俭, 等. 呋喃西林代谢物氨基脲免疫吸附生物条码检测方法的初步研究[J]. 食品科学, 2009, 30(18): 274-277.
[31] 何方洋, 冯才伟, 孙震, 等. 饲料中硝基呋喃类药物免疫胶体金检测试纸条的研制[J]. 饲料工业, 2012, 33(23): 35-38.
[32] 赵正苗, 罗晓琴, 汪善良, 等. 应用胶体金免疫层析法检测动物组织中呋喃西林代谢物的残留[J]. 上海畜牧兽医通讯, 2012(5): 4-5.
Preparation of Monoclonal Antibody and Fluorescence Immunochromatographic Test Strip for Detecting Furacilin Metabolites
郭会灿, 崔海波, 徐冬梅. 呋喃西林代谢物单克隆抗体及荧光免疫层析试纸条的制备[J]. 肉类研究, 2019, 33(3): 46-51.DOI:10.7506/rlyj1001-8123-20181211-229. http://www.rlyj.net.cn
GUO Huican, CUI Haibo, XU Dongmei. Preparation of monoclonal antibody and fluorescence immunochromatographic test strip for detecting furacilin metabolites[J]. Meat Research, 2019, 33(3): 46-51. DOI:10.7506/rlyj1001-8123-20181211-229.http://www.rlyj.net.cn