表 1 梯度洗脱程序
Table 1 Gradient elution conditions

时间/min 流动相体积分数/%0.1%甲酸-水 0.1%甲酸-乙腈0 95 5 0.5 95 5 4.0 85 15 5.5 5 95 6.5 5 95 7.0 95 5 9.0 95 5
由于养殖业的快速发展和生态环境的恶化,导致各种动物疾病频发,大量兽药开始应用于预防和治疗,从而可能蓄积于动物组织形成药物残留[1-2],通过食物链进入人体内,对人体健康和生命安全产生不良影响[3-5]。喹诺酮类兽药作为一类人工合成的广谱性抗菌类抗生素,由于其吸收效果好、毒性较低而被广泛应用于各种动物[6-7]。欧盟、联合国粮农组织等均已指定多种喹诺酮类兽药的最高残留限量[8],我国农业部发布的相关公告也对喹诺酮类兽药的使用做出了明确规定。
目前,动物性食品中喹诺酮类兽药残留的检测方法主要有高效液相色谱(high performance liquid chromatography,HPLC)法(研究对象为畜禽肉[9-11]和水产品[12-13])和高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法(研究对象分别为畜禽肉[14-16]、畜副产品[17]、禽蛋[18]和牛乳[19]等),但由于存在复杂基质干扰、前处理过程复杂、固相萃取耗时及回收率较低等问题,目前液相色谱法的应用受到限制。而QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)是一种快速、简单、廉价、高效、可靠和安全的分散固相萃取技术,目前已广泛应用于食品中兽药残留[20-22]和农药残留检测[23-25],但是将该样品前处理方法运用于检测畜禽肉中喹诺酮类兽药残留的方法不多。针对以上问题,本研究建立了一种QuEChERS-超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法测定畜禽肉中11 种喹诺酮类兽药残留的方法。
畜禽肉样品为本实验室日常抽检样品。
恩诺沙星(纯度99.9%)、盐酸环丙沙星(纯度94.0%)、氧氟沙星(纯度99.3%)、甲磺酸二水培氟沙星(纯度99.0%)、诺氟沙星(纯度99.1%)、盐酸洛美沙星(纯度98.7%)、盐酸沙拉沙星(纯度91.2%)、甲磺酸双氟沙星(纯度98.2%)、司帕沙星(纯度99.3%)、氟罗沙星(纯度99.5%)、甲磺酸达氟沙星(纯度99.0%)、氘代恩诺沙星、氘代环丙沙星及氘代诺氟沙星,共14 种固体标准品 德国Dr.Ehrenstorfer公司;乙腈、甲酸(均为色谱级) 美国Thermo Fisher Scientific公司;超纯水 自制。
XEVO TQ-S超高效液相色谱-串联质谱仪 美国Waters公司;ME2002E、XS204电子天平 梅特勒-托利多仪器(上海)有限公司;Talboys数显型涡旋混合器美国Troemner公司;Allegra X-15R离心机 美国贝克曼库尔特有限公司;RKTS-23050快速溶剂蒸发仪 英国Genevac公司;QuEChERS净化剂(含有乙二胺-N-丙基硅烷、C18、无水硫酸镁的混合填料,混合质量比1∶2∶50)实验室自配。
1.3.1 标准溶液的配制
准确称取适量的恩诺沙星、盐酸环丙沙星、氧氟沙星、甲磺酸二水培氟沙星、诺氟沙星、盐酸洛美沙星、盐酸沙拉沙星、甲磺酸双氟沙星、司帕沙星、氟罗沙星和甲磺酸达氟沙星标准品,用乙腈配制成质量浓度100 μg/mL的单一标准储备溶液,必要时可加入少量甲酸超声助溶。将以上各标准储备溶液用0.1%的甲酸水溶液稀释,配制成各标准品质量浓度均为1 μg/mL的混合标准储备溶液。
准确称取适量的氘代恩诺沙星、氘代环丙沙星、氘代诺氟沙星标准品,用乙腈配制成质量浓度500 μg/mL的单一内标储备溶液,然后用0.1%的甲酸水溶液稀释,配制成各标准品质量浓度均为1 μg/mL的混合内标储备溶液。
分别准确移取混合标准储备溶液(1 μg/mL)20、50、100、200、300、500、800 μL和200 μL混合内标储备溶液(1 μg/mL)于10 mL容量瓶中,加入初始比例的流动相稀释并定容,即得内标质量浓度为20 ng/mL的2、5、10、20、30、50、80 ng/mL系列混合标准工作溶液。
1.3.2 样品溶液的制备
准确称取试样5.00 g(精确到0.01 g)于50 mL离心管中,加入40 μL混合内标储备溶液和15 mL 2%甲酸-乙腈,涡旋分散后均质提取5 min,以10 000 r/min离心5 min;取全部上清液,向其中加入QuEChERS净化剂5 g,涡旋混匀2 min,以4 000 r/min离心5 min,上清液于45 ℃条件下快速溶剂蒸发至近干,加入初始比例的流动相定容至2 mL,然后过0.22 μm微孔滤膜待分析。
1.3.3 色谱及质谱条件
1.3.3.1 色谱条件
超高效液相色谱仪:Waters Acquity UPLC,色谱柱:Waters BEH C18色谱柱(50 mm×2.1 mm,1.7 μm),柱温40 ℃,样品池温度15 ℃,流速0.3 mL/min,进样量2 μL。流动相及梯度洗脱条件如表1所示。
表 1 梯度洗脱程序
Table 1 Gradient elution conditions

时间/min 流动相体积分数/%0.1%甲酸-水 0.1%甲酸-乙腈0 95 5 0.5 95 5 4.0 85 15 5.5 5 95 6.5 5 95 7.0 95 5 9.0 95 5
1.3.3.2 质谱条件
质谱仪选择电喷雾离子源,正离子模式,毛细管电压为2.50 kV,脱溶剂气和锥孔气流量分别设定为1 000 L/h和60 L/h,离子源温度和脱溶剂气温度分别为150 ℃和350 ℃。
2.1.1 色谱参数的选择
分别考察乙腈-水、乙腈-0.1%三乙胺和0.1%甲酸乙腈-0.1%甲酸水作为流动相的效果,进行样品测定。结果表明,采用乙腈-0.1%三乙胺流动相体系时,信号响应值较低,而采用乙腈-水流动相体系时,峰型欠佳,综合分离效果、响应强度及稳定性考虑,最终选择0.1%甲酸乙腈-0.1%甲酸水作为流动相进行洗脱,喹诺酮类兽药的峰型对称,保留时间适宜。
2.1.2 质谱参数的选择
表 2 11 种喹诺酮类兽药和3 种氘代内标的质谱分析参数
Table 2 Mass spectral conditions for 11 quinolones and 3 deuterated internals
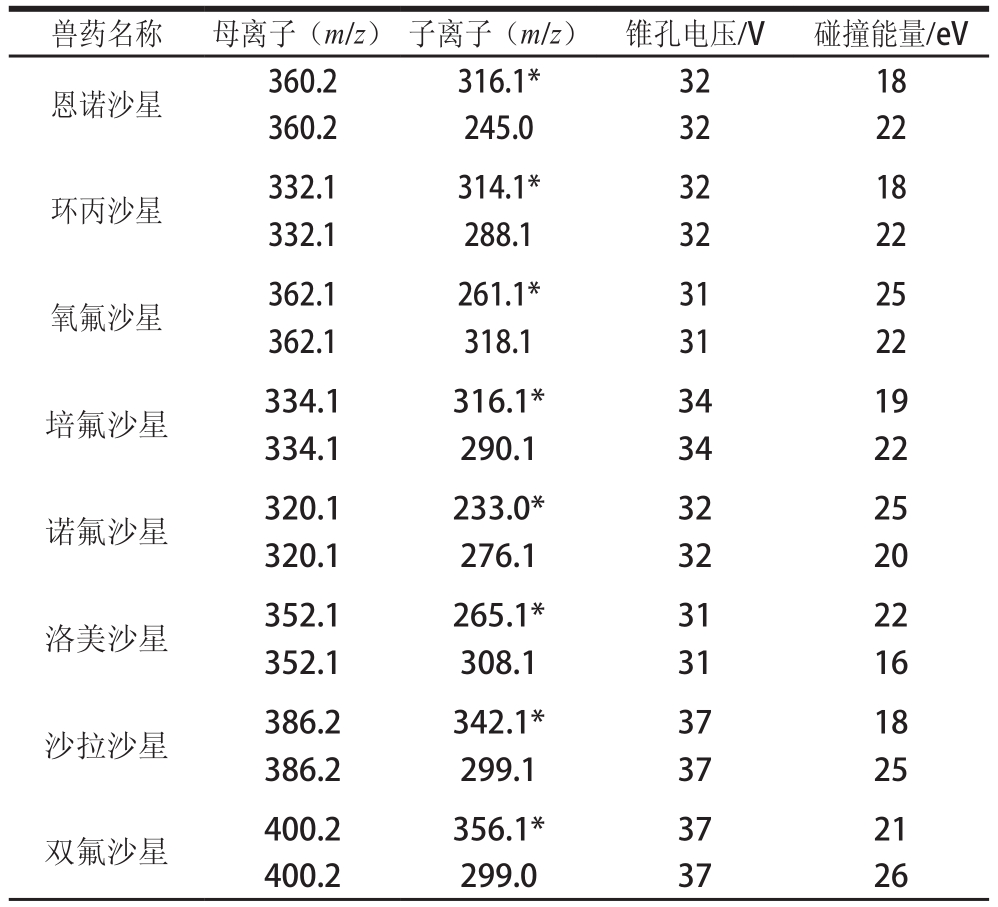
兽药名称 母离子(m/z) 子离子(m/z) 锥孔电压/V 碰撞能量/eV恩诺沙星 360.2 316.1* 32 18 360.2 245.0 32 22环丙沙星 332.1 314.1* 32 18 332.1 288.1 32 22氧氟沙星 362.1 261.1* 31 25 362.1 318.1 31 22培氟沙星 334.1 316.1* 34 19 334.1 290.1 34 22诺氟沙星 320.1 233.0* 32 25 320.1 276.1 32 20洛美沙星 352.1 265.1* 31 22 352.1 308.1 31 16沙拉沙星 386.2 342.1* 37 18 386.2 299.1 37 25双氟沙星 400.2 356.1* 37 21 400.2 299.0 37 26

注:*. 定量子离子。
兽药名称 母离子(m/z) 子离子(m/z) 锥孔电压/V 碰撞能量/eV司帕沙星 393.2 349.1* 37 20 393.2 292.1 37 24氟罗沙星 370.1 326.1* 34 19 370.1 269.1 34 25达氟沙星 358.2 96.0* 32 27 358.2 314.1 32 20氘代恩诺沙星364.9 320.9* 40 18 364.9 244.8 40 28氘代环丙沙星325.1 307.2* 36 14 325.1 281.1 36 18 340.3 322.1* 40 18 340.3 295.8 40 20氘代诺氟沙星
以5 μL/min的流速注入质量浓度均为100 ng/mL的11 种喹诺酮类兽药混合标准溶液和质量浓度均为200 ng/mL的3 种氘代喹诺酮类内标混合标准溶液,进行一级质谱扫描,确定较为合适的母离子扫描条件;再对母离子进行二级扫描,筛选信号最强的离子对作为定量离子,信号次强的离子对作为定性离子对。得到多反应监测(multiple reaction monitoring,MRM)条件,包括定量及定性离子对、锥孔电压和碰撞能量,详见表2。在优化的色谱和质谱条件下,11 种喹诺酮类兽药标准溶液(质量浓度80 ng/mL)的总离子流图如图1所示。



图 1 11 种喹诺酮类兽药标准溶液的总离子流图
Fig. 1 Total ion chromatogram for the standard solution of 11 kinds of quinolones
目前,对于喹诺酮类兽药残留的测定,现行国家标准分别采用酸化乙腈[26]和EDTA-Mcllvaine缓冲液(pH=4.0)[27],有研究表明,酸化乙腈的提取液未净化会导致较强的基质效应,而EDTA-Mcllvaine缓冲液由于提取液浑浊而导致固相萃取小柱堵塞,2 种提取方式均存在不足[28]。本研究选择QuEChERS净化剂对提取液进行净化,可以较好地对提取液进行除杂处理,同时解决了过柱处理的繁琐和耗时。考虑到乙腈具有沉淀蛋白的作用,而喹诺酮类兽药在中性偏酸的环境中具有较好的稳定性[29],故本研究采用2%甲酸-乙腈作为提取溶剂,对畜禽肉中的喹诺酮类兽药残留进行提取。
表 3 11 种喹诺酮类兽药的标准曲线、相关系数、检出限及定量限
Table 3 Linear equations, correlation coefficients, limits of detection and limits of quantification of 11 quinolones

兽药名称 线性回归方程 相关 定量限/(μg/kg)恩诺沙星y=1.056x+0.563 0.996 3 0.8 2.4环丙沙星y=4.705x-1.047 0.998 8 2.0 6.0氧氟沙星y=9.931x+9.163 0.999 2 0.8 2.4培氟沙星y=3.537x-6.608 0.995 9 1.8 5.4诺氟沙星y=3.023x-3.244 0.994 5 2.0 6.0洛美沙星y=6.906x+1.601 0.997 2 0.5 1.5沙拉沙星y=2.598x+2.532 0.998 3 2.0 6.0双氟沙星y=8.514x+1.013 0.995 4 0.8 2.4司帕沙星y=2.744x+2.535 0.995 7 0.8 2.4氟罗沙星y=7.309x+1.375 0.994 8 1.0 3.0达氟沙星y=2.541x-1.170 0.997 6 0.5 1.5系数R2检出限/(μg/kg)
取质量浓度分别为2、5、10、20、30、50、80 ng/mL的系列混合标准工作溶液,按照所确定的色谱和质谱条件进行检测。其中恩诺沙星、沙拉沙星、司帕沙星以氘代恩诺沙星为内标,环丙沙星、洛美沙星、双氟沙星、达氟沙星以氘代环丙沙星为内标,诺氟沙星、氧氟沙星、培氟沙星、氟罗沙星以氘代诺氟沙星为内标,以标准物质质量浓度与内标质量浓度的比值ρx/ρ0对标准物质定量离子峰面积与内标定量离子峰面积的比值Ax/A0绘制标准曲线。
由表3可知,11 种喹诺酮类兽药在2~80 ng/mL质量浓度范围内线性关系良好,R2均大于0.99,以信噪比RS/N=3结合实际基质噪音情况确定方法的检出限为0.5~2.0 μg/kg,以RS/N=10确定方法的定量限为1.5~6.0 μg/kg。
为了验证本方法测定畜禽肉中11 种喹诺酮类兽药残留的可行性和准确性,采用空白猪肉和鸡肉基质样品(已检测过的阴性样品)进行加标回收率验证,加标水平分别为10、25、50 μg/kg,按照前述方法处理,每个水平重复6 次实验,计算平均回收率和相对标准偏差(relative standard deviation,RSD)。
表 4 猪肉中11 种喹诺酮类药物的加标回收率和RSD(n=6)
Table 4 Average recoveries and RSD of 11 quinolones in spiked blank pork samples ( = 6)n
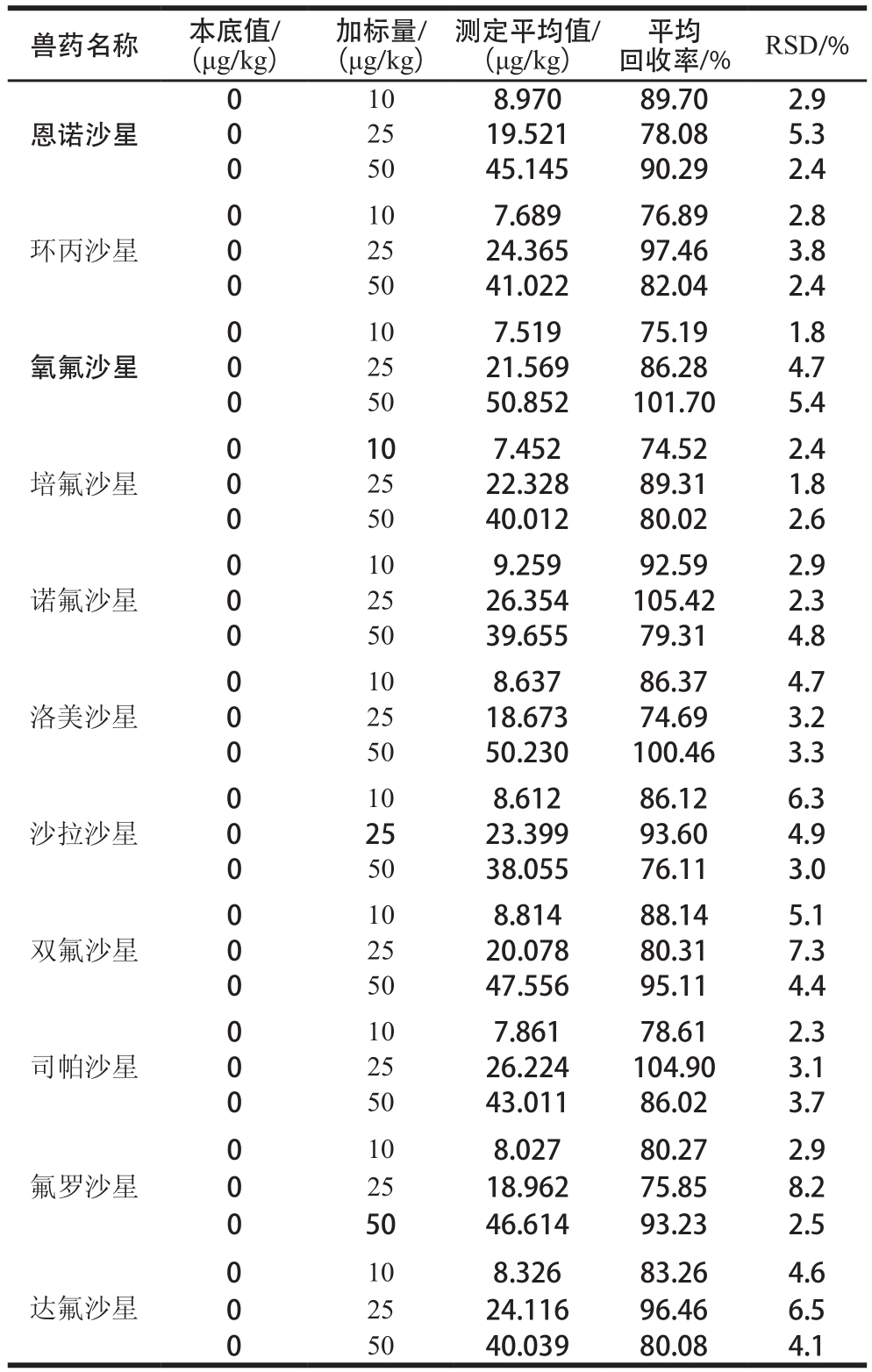
兽药名称 本底值/(μg/kg)加标量/(μg/kg)测定平均值/(μg/kg)平均回收率/% RSD/%10 8.970 89.70 2.9 0 25 19.521 78.08 5.3 0 50 45.145 90.29 2.4 0恩诺沙星0环丙沙星10 7.689 76.89 2.8 0 25 24.365 97.46 3.8 0 50 41.022 82.04 2.4 0氧氟沙星10 7.519 75.19 1.8 0 25 21.569 86.28 4.7 0 50 50.852 101.70 5.4培氟沙星0 10 7.452 74.52 2.4 0 25 22.328 89.31 1.8 0 50 40.012 80.02 2.6 0诺氟沙星10 9.259 92.59 2.9 0 25 26.354 105.42 2.3 0 50 39.655 79.31 4.8 0洛美沙星10 8.637 86.37 4.7 0 25 18.673 74.69 3.2 0 50 50.230 100.46 3.3 0沙拉沙星10 8.612 86.12 6.3 0 25 23.399 93.60 4.9 0 50 38.055 76.11 3.0 10 8.814 88.14 5.1 0 25 20.078 80.31 7.3 0 50 47.556 95.11 4.4 0双氟沙星0司帕沙星10 7.861 78.61 2.3 0 25 26.224 104.90 3.1 0 50 43.011 86.02 3.7 0氟罗沙星10 8.027 80.27 2.9 0 25 18.962 75.85 8.2 0 50 46.614 93.23 2.5 0达氟沙星10 8.326 83.26 4.6 0 25 24.116 96.46 6.5 0 50 40.039 80.08 4.1
表 5 鸡肉中11 种喹诺酮类药物的加标回收率和RSD(n =6)
Table 5 Average recoveries and RSD of 11 quinolones in spiked blank chicken samples (n = 6)
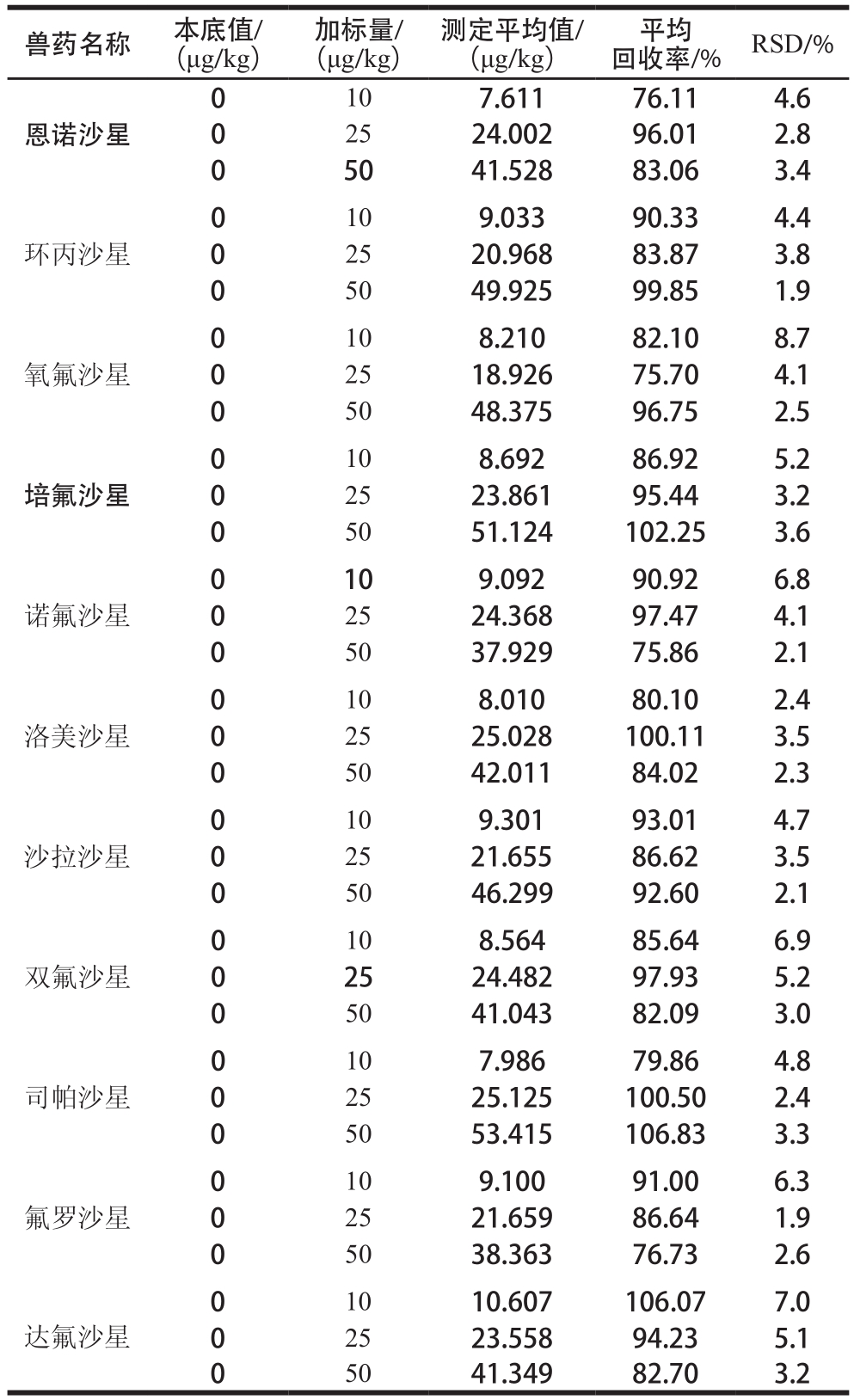
兽药名称 本底值/(μg/kg)加标量/(μg/kg)测定平均值/(μg/kg)平均回收率/% RSD/%0恩诺沙星10 7.611 76.11 4.6 0 25 24.002 96.01 2.8 0 50 41.528 83.06 3.4 0环丙沙星10 9.033 90.33 4.4 0 25 20.968 83.87 3.8 0 50 49.925 99.85 1.9 0氧氟沙星10 8.210 82.10 8.7 0 25 18.926 75.70 4.1 0 50 48.375 96.75 2.5 0培氟沙星10 8.692 86.92 5.2 0 25 23.861 95.44 3.2 0 50 51.124 102.25 3.6诺氟沙星0 10 9.092 90.92 6.8 0 25 24.368 97.47 4.1 0 50 37.929 75.86 2.1 0洛美沙星10 8.010 80.10 2.4 0 25 25.028 100.11 3.5 0 50 42.011 84.02 2.3 0沙拉沙星10 9.301 93.01 4.7 0 25 21.655 86.62 3.5 0 50 46.299 92.60 2.1 0双氟沙星10 8.564 85.64 6.9 0 25 24.482 97.93 5.2 0 50 41.043 82.09 3.0 0司帕沙星10 7.986 79.86 4.8 0 25 25.125 100.50 2.4 0 50 53.415 106.83 3.3 0氟罗沙星10 9.100 91.00 6.3 0 25 21.659 86.64 1.9 0 50 38.363 76.73 2.6 0达氟沙星10 10.607 106.07 7.0 0 25 23.558 94.23 5.1 0 50 41.349 82.70 3.2
由表4~5可知,空白猪肉和鸡肉基质样品中11 种喹诺酮类兽药的平均回收率为74.52%~106.83%,RSD为1.8%~8.7%,满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》[30]中对方法回收率的要求。
按本研究所建立的方法,对实验室抽检的一批50 份畜禽肉中的喹诺酮类兽药残留进行检测,测得其中2 份鸡肉不合格,分别含恩诺沙星(以恩诺沙星与环丙沙星之和计)781 μg/kg和氧氟沙星17.4 μg/kg,说明相关养殖行业存在喹诺酮类兽药滥用的现状,亟需对此类风险进行管控。同时采用现行国标GB/T 21312—2007《动物源性食品中14 种喹诺酮药物残留检测方法 液相色谱-质谱/质谱法》对2 份不合格样品进行复测,结果均无明显差异。比对实验表明,在保证测定结果准确性的前提下,本研究所建立的方法与现行国标相比在简化实验流程上有一定优势。
本研究建立了一种同时测定畜禽肉中11 种喹诺酮类兽药残留的QuEChERS-UPLC-MS/MS方法,该方法分析过程简单、快速、回收率好、灵敏度高,满足对畜禽肉中喹诺酮类兽药残留测定的相关要求,能够为畜禽肉及相关农产品的安全监测与评估提供技术依据。
[1] 施杏芬, 陆国林. 兽用喹诺酮类药物残留的危害及对策[J]. 中国动物检疫, 2008, 25(9): 16-17. DOI:10.3969/j.issn.1005-944X.2008.09.012.
[2] HE Xiuting, DENG Maosheng, WANG Qi, et al. Residues and health risk assessment of quinolones and sulfonamides in cultured fish from Pearl River Delta, China[J]. Aquaculture, 2016, 60(2): 38-46.DOI:10.1016/j.aquaculture.2016.02.006.
[3] BALL P. Quinolone-induced QT interval prolongation: a not-sounexpected class effect[J]. Journal of Antimicrobial Chemotherapy,2000, 46(5): 847-848. DOI:10.1093/jac/45.5.557.
[4] 陆昌华, 胡肄农, 谭业平, 等. 我国畜产品兽药残留的公共经济学分析及对策[J]. 家畜生态学报, 2016, 37(6): 1-7. DOI:10.3969/j.issn.1673-1182.2016.06.001.
[5] 王芬, 靳胜福, 黄涛. 畜产品兽药残留的起因、危害及其控制措施[J]. 家畜生态学报, 2013, 34(8): 86-88. DOI:10.3969/j.issn.1673-1182.2013.08.018.
[6] 李俊锁, 邱月明, 王超. 兽药残留分析[M]. 上海: 上海科学技术出版社, 2002: 365-390.
[7] 华孝成, 杨飞萍, 邵歆, 等. 超高效液相色谱-串联质谱法同时测定畜禽肉中27 种磺胺及喹诺酮类药物的残留[J]. 农产品质量与安全,2013(5): 36-40. DOI:10.3969/j.issn.1674-8255.2013.05.010.
[8]HERN NDEZ-ARTESEROS J A, BARBOSA J, COMPA
NDEZ-ARTESEROS J A, BARBOSA J, COMPA
 R, et al.Analysis of quinolone residues in edible animal products[J]. Journal of Chromatography A, 2002, 945(1/2): 1-24. DOI:10.1016/S0021-9673(01)01505-9.
R, et al.Analysis of quinolone residues in edible animal products[J]. Journal of Chromatography A, 2002, 945(1/2): 1-24. DOI:10.1016/S0021-9673(01)01505-9.
[9] 赵思俊, 李存, 江海洋, 等. 高效液相色谱检测动物肌肉组织中7 种喹诺酮类药物的残留[J]. 分析化学, 2007(6): 786-790. DOI:10.3321/j.issn:0253-3820.2007.06.002.
[10] 林保银. 鸡肉中11 种喹诺酮类药物多残留的高效液相色谱检测[J]. 色谱, 2009, 27(2): 206-210. DOI:10.3321/j.issn:1000-8713.2009.02.015.
[11] 田婧, 辛可启, 朱子冬, 等. 咪唑类离子液体用于猪肉中喹诺酮类抗生素的高效液相色谱检测方法的建立[J]. 肉类研究, 2017, 31(9):58-62. DOI:10.7506/rlyj1001-8123-201709010.
[12] 洪波, 曾春芳, 高峰, 等. 高效液相色谱-紫外法测定水产品中四环素类、喹诺酮类抗生素残留[J]. 湖南农业科学, 2013(21): 81-84.DOI:10.3969/j.issn.1006-060X.2013.21.024.
[13] 贺江, 李晓月, 仇玉洁, 等. 固相萃取-超高效液相色谱法测定水产品中6 种氟喹诺酮类药物残留[J]. 食品与机械, 2018, 34(5): 77-81.DOI:10.13652/j.issn.1003-5788.2018.05.015.
[14] 徐春奎, 李艳, 徐欣然, 等. UPLC-MS/MS同时检测猪肉中10 种磺胺类和10 种喹诺酮类药物快速前处理方法研究[J]. 黑龙江畜牧兽医,2019(1): 135-139. DOI:10.13881/j.cnki.hljxmsy.2018.04.0047.
[15] 梁素丹, 陈剑刚, 张艳. 全自动固相萃取-超高效液相色谱-串联质谱法同时测定动物肌肉中喹诺酮类和四环素类兽药残留[J]. 中国食品卫生杂志, 2018, 30(2): 151-157. DOI:10.13590/j.cjfh.2018.02.006.
[16] 蔡勤仁, 冯家望, 张毅, 等. 液相色谱-串联质谱结合谱库检索测定猪组织中13 种氟喹诺酮类药物[J]. 现代食品科技, 2011, 27(1):109-113. DOI:10.3969/j.issn.1673-9078.2011.01.027.
[17] TOUSSAINT B, CHEDIN M, BORDIN G, et al. Determination of (fluoro) quinolone antibiotic residues in pig kidney using liquid chromatography-tandem mass spectrometry: Part Ⅱ: Intercomparison exercise[J]. Journal of Chromatography A, 2005(1): 40-48.DOI:10.1016/j.chroma.2005.02.016.
[18] 王敏娟, 胡佳薇, 田丽, 等. 超高效液相色谱-串联质谱法同时测定鸡蛋中21 种喹诺酮及四环素类抗生素残留[J]. 中国卫生检验杂志,2017(4): 26-29.
[19] 刘艳丽, 吴昊, 杜晓慧, 等. 磁分散固相萃取-高效液相色谱法测定牛奶中5 种禁用喹诺酮类药物[J]. 分析科学学报, 2018, 34(2):196-200. DOI:10.13526/j.issn.1006-6144.2018.02.010.
[20] 张朋杰, 张宪臣, 容裕棠, 等. QuEChERS-高效液相色谱-质谱/质谱法同时测定水产品中磺胺类和氯霉素类药物[J]. 食品安全质量检测学报, 2018, 9(20): 5403-5409. DOI:10.3969/j.issn.2095-0381.2018.20.023.
[21] 刘艳, 汪建明, 王敏, 等. QuEChERS-HPLC-MS/MS测定猪肉猪肝中苯乙醇胺A[J]. 中国农业科技导报, 2018, 20(10): 131-137.DOI:10.13304/j.nykjdb.2017.0592.
[22] 任明兴, 刘正才, 唐寰宇, 等. QuEChERS方法结合超高效液相色谱-串联质谱法快速检测鸡肉组织中扎那米韦药物的残留量[J]. 分析测试学报, 2016, 35(7): 854-858. DOI:10.3969/j.issn.1004-4957.2016.07.013.
[23] 高璐斐. QuEChERS净化液相色谱质谱法快速筛查小麦中污染物方法的建立[D]. 杨凌: 西北农林科技大学, 2018: 13-18.
[24] 罗彤, 付文雯, 郭卢云, 等. QuEChERS-气相色谱-三重四级杆串联质谱法测定茶叶中草甘膦和氨甲基膦酸残留[J]. 食品研究与开发,2018, 39(14): 153-158. DOI:10.3969/j.issn.1005-6521.2018.14.027.
[25] 邓慧芬, 张建莹, 黄科, 等. QuEChERS-液相色谱-串联质谱法测定蔬菜中105 种农药残留[J]. 色谱, 2018, 36(12): 1211-1222.DOI:10.3724/SP.J.1123.2018.09012.
[26] 中华人民共和国山东出入境检验检疫局. 动物源产品中喹诺酮类残留量的测定 液相色谱-串联质谱法: GB/T 20366—2006[S]. 北京:中国标准出版社, 2006.
[27] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 动物源性食品中14 种喹诺酮药物残留检测方法 液相色谱-质谱/质谱法: GB/T 21312—2007[S]. 北京: 中国标准出版社,2007.
[28] 廖艳华, 周劭桓, 林文斯, 等. 超高效液相色谱-串联质谱法测定鸡蛋中11 种喹诺酮类抗生素残留的样品前处理方法优化[J]. 中国卫生检验杂志, 2012, 28(8): 910-914.
[29] 李晓东, 赵颖, 徐宜宏, 等. QuEChERS试剂盒: 超高效液相色谱-串联质谱法同时检测畜禽肉中18 种喹诺酮类兽药残留研究[J]. 畜牧与饲料科学, 2016, 37(12): 12-16. DOI:10.16003/j.cnki.issn1672-5190.2016.12.004.
[30] 中国合格评定国家认可中心. 实验室质量控制规范 食品理化检测:GB/T 27404—2008[S]. 北京: 中国标准出版社, 2008.
Simultaneous Determination of 11 Quinolone Residues in Livestock and Poultry Meat by QuEChERS and Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
黄坤, 吴婉琴, 罗彤, 等. QuEChERS-超高效液相色谱-串联质谱法同时测定畜禽肉中11 种喹诺酮类兽药残留[J]. 肉类研究, 2019, 33(3): 40-45. DOI:10.7506/rlyj1001-8123-20190210-025. http://www.rlyj.net.cn
HUANG Kun, WU Wanqin, LUO Tong, et al. Simultaneous determination of 11 quinolone residues in livestock and poultry meat by QuEChERS and ultra performance liquid chromatography-tandem mass spectrometry[J]. Meat Research, 2019,33(3): 40-45. DOI:10.7506/rlyj1001-8123-20190210-025. http://www.rlyj.net.cn