表 1 所选用蛋白酶及其最适反应条件
Table 1 Reaction conditions with different proteases
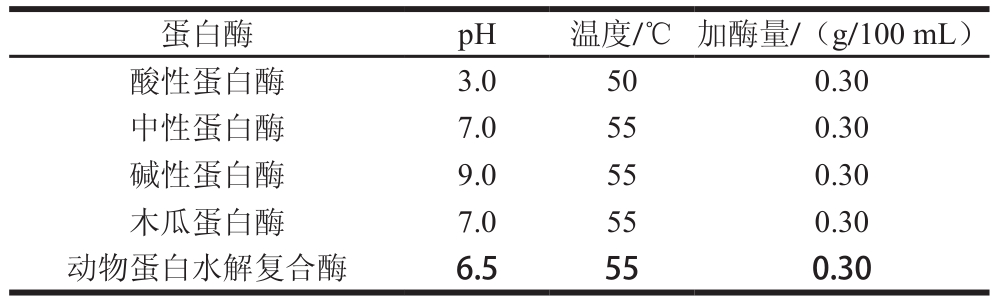
蛋白酶 pH 温度/℃ 加酶量/(g/100 mL)酸性蛋白酶 3.0 50 0.30中性蛋白酶 7.0 55 0.30碱性蛋白酶 9.0 55 0.30木瓜蛋白酶 7.0 55 0.30动物蛋白水解复合酶 6.5 55 0.30
据我国农业部和欧盟的专家对牛乳需求量的分析推测,到2030年可繁殖奶牛的存栏量将达1 500 万头以上,如果这些奶牛都能正常产犊,每年将有同等数量的牛犊出生,按公、母牛犊1∶1的比例,每年可产公犊奶牛约750 万头[1]。目前公犊奶牛少量用作培育种公牛,其他大多被宰杀淘汰,犊牛资源严重浪费[2-3]。本课题组陈珍等[4]对初生公犊奶牛肉的营养成分进行分析,发现其蛋白质含量仅次于成年牛肉,达到鲜质量的23%,同时含有许多活性成分,如铁、锌、共轭亚油酸和B族维生素等,而且微量元素的含量高于成年牛肉[5-6]。公犊奶牛肉营养价值高,除生产食用肉制品外,利用肉中的营养成分生产高附加值产品,如功能性食品,将会大大提升公犊奶牛肉的经济和健康价值[7]。生物活性肽的重要来源是肉类[8],其具有降高血压及其他促进健康的功能,如用作抗氧化剂、抗血栓形成、抗癌、免疫调节和抗菌活性[9]。因此可以利用公犊奶牛肉开发抗氧化活性生物肽,应用于商业功能性食品和营养保健品[10]。食品级外源蛋白酶可将肉类蛋白水解为大量的生物肽。
蛋白酶解技术是改造蛋白质、实现蛋白质功能多元化、提高其营养价值和功能特性最有效的途径之一[11-13]。在牛肉蛋白质的酶类水解方面,陈珍等[14]曾对单一酶解和复合酶解进行了总结与展望。除此之外,厉望等[15]采用碱性蛋白酶酶解带鱼蛋白制备抗氧化肽;洪鹏志[16]对罗非鱼肉蛋白酶解液及其超滤液的抗氧化性进行研究;Shu Guowei等[17]采用复合蛋白酶(碱性蛋白酶和木瓜蛋白酶)水解山羊奶酪蛋白,制备抗氧化活性肽。由此可知,酶解蛋白制备抗氧化多肽是开发天然抗氧化剂的重要途径之一[18]。
本研究以初生公犊奶牛肉为研究对象,利用蛋白酶解技术将牛肉水解为抗氧化活性多肽和氨基酸,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率作为抗氧化性评价的指标,通过蛋白酶的选择、酶解条件的单因素试验及响应面试验探讨初生公犊奶牛肉酶解的最佳条件,最后通过感官评价等方法,利用水解产物制备功能性多肽口服液,为术后的康复病人、胃肠消化功能欠佳者、运动员以及需要氨基酸和多肽的老人和孩童提供更高价值的健康促进产品,具有十分重要的实际应用价值。
本研究选用的初生公犊奶牛肉为尚未喂给饲料的初生公犊奶牛肉,由上海光明乳业牧场提供。
酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶及动物蛋白水解复合酶 江苏锐阳生物科技有限公司;焦糖(3%~4%)、肉类香精 湖北鑫润德化工有限公司;蜂蜜(3%~5%) 河南淮滨蜂蜜养殖基地;氢氧化钠、乙醇、盐酸及碳酸氢钠 国药集团化学试剂有限公司;所用试剂均为分析纯。
FE20 pH计 瑞士梅特勒-托利多公司;DK-S24电热恒温水浴锅 上海华连医疗器械有限公司;UV-2000紫外分光光度计 尤尼柯(上海)仪器有限公司;3K15台式离心机 德国Sigma公司;Ag1100安捷伦液相色谱仪 美国安捷伦公司。
1.3.1 初生公犊奶牛肉酶解工艺
参考王玲玲[19]、成晓瑜[20]等的方法,并结合公犊奶牛的肉质特点,经过多次实验,确定出牛肉酶解液制作工艺。具体如下:初生公犊奶牛后腿肉清洗→去皮切块→绞碎成肉糜状→按比例加入水→90 ℃加热10 min,搅拌均匀→降至55 ℃→调节pH值至7.0→加入蛋白酶→匀速搅拌,恒温酶解3 h→灭酶→离心(8 000 r/min,4 ℃,10 min)→酶解产物
1.3.2 最适蛋白酶的选择
表 1 所选用蛋白酶及其最适反应条件
Table 1 Reaction conditions with different proteases

蛋白酶 pH 温度/℃ 加酶量/(g/100 mL)酸性蛋白酶 3.0 50 0.30中性蛋白酶 7.0 55 0.30碱性蛋白酶 9.0 55 0.30木瓜蛋白酶 7.0 55 0.30动物蛋白水解复合酶 6.5 55 0.30
实验所选用的5 种蛋白酶参见表1,分别在其最适反应条件下对初生公犊奶牛肉进行酶解,酶解工艺参考1.3.1节,并测定酶解产物的DPPH自由基清除率,分析其抗氧化性。
1.3.3 DPPH自由基清除率测定
参考韦献雅[21]、Ozcelik[22]等的方法。准确配制质量浓度为50 g/100 mL的DPPH自由基无水乙醇溶液,室温静置10 min后,取2.5 mL加入0.5 mL待测样品溶液中,混合均匀,室温条件下避光反应20 min后,在光程为1 cm的比色皿中测定其在517 nm波长处的吸光度(Am),同时测定0.5 mL待测样品溶液与2.5 mL无水乙醇混合溶液在517 nm波长处的吸光度(An)以及0.5 mL蒸馏水与2.5 mL 0.04 mg/mL的DPPH自由基无水乙醇溶液在517 nm波长处的吸光度(A0)。每个样品平行测定3 次,结果取平均值。DPPH自由基清除率按照下式计算。
式中:Am为样品溶液的吸光度;An为空白溶液的吸光度;A0为对照溶液的吸光度。
1.3.4 酶解条件的单因素试验
根据1.3.2节的实验结果,用筛选出的中性蛋白酶对公犊奶牛肉进行酶解,基础酶解条件:加酶量为0.30 g/100 mL、温度55.0 ℃、pH 7.0、酶解3.0 h。为了消除各因素之间的交互影响,固定其中3 个因素改变1 个因素,进行单因素试验优化。
1.3.4.1 酶解pH值的选择
所选用的中性蛋白酶标明的最适pH值范围为5.5~8.0。选定加酶量为0.30 g/100 mL、酶解温度55 ℃、酶解时间3 h,pH值分别为5.5、6.0、6.5、7.0、7.5、8.0,测定不同pH值条件下酶解物的DPPH自由基清除率,确定最适pH值。
1.3.4.2 酶解温度的选择
中性蛋白酶最适反应温度范围为40~65 ℃。选定加酶量为0.30 g/100 mL、pH值为最适值、酶解时间3 h,酶解温度分别为40、45、50、55、60、65 ℃,测定不同温度条件下酶解物的DPPH自由基清除率,确定最适温度。
1.3.4.3 加酶量的选择
选定酶解时间3 h,pH值和温度分别为最适值,加酶量分别为0.3、0.6、0.9、1.2、1.5、1.8 g/100 mL,测定酶解物的DPPH自由基清除率,确定最适加酶量。
1.3.4.4 酶解时间的选择
按选定的酶解pH值、酶解温度及加酶量的最佳参数,酶解时间分别为1、2、3、4、5 h,测定酶解物的DPPH自由基清除率,确定最适酶解时间。
1.3.5 响应曲面法试验设计
通过单因素试验确定加酶量、酶解温度、酶解时间与pH值显著影响牛肉蛋白酶解物的抗氧化能力。因此运用Box-Behnken中心组合试验设计,以pH值(A)、酶解温度(B)、加酶量(C)和酶解时间(D)为变量,DPPH自由基清除率为响应值,进行4因素3水平的响应面试验,数据采用二次多项式回归法处理。根据单因素试验结果,最适因子固定在2 个水平之间,高水平和低水平分别取最适因子的相邻值。响应面试验的因素水平设计如表2所示。
表 2 响应面试验因素与水平表
Table 2 Factors with coded and actual levels used in response surface design

因素水平A pHB酶解温度/℃C加酶量/(g/100 mL)D酶解时间/h-1 6.5 50 0.3 2.0 0 7.0 55 0.6 3.0 1 7.5 60 0.9 4.0
1.3.6 SDS-PAGE分析
参考张谦益等[23]的方法。采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoeresis,SDS-PAGE),分离胶和浓缩胶分别为12%和5%;染色及蛋白质的定量参考考马斯亮蓝法[24]。
1.3.7 活性肽口服液的制备
按照表3配方中的比例,将获得的初生公犊奶牛肉抗氧化肽酶解液分别与白砂糖、蜂蜜、糖浆及其他配料一起加入调配罐,用搅拌器搅拌,再加入反渗透水至规定容量。过滤掉杂质后,预热至50 ℃进行均质处理,均质压力保持在20~25 MPa,连续均质2 次,防止产品出现分层、沉淀现象;同时为了延长活性肽口服液的保质期,对料液进行脱气处理,脱气压力为0.05 MPa,最后进行80 ℃灭菌30 min。
表 3 公犊奶牛肉活性肽口服液配料表
Table 3 Formulation of active peptide oral liquid g/L
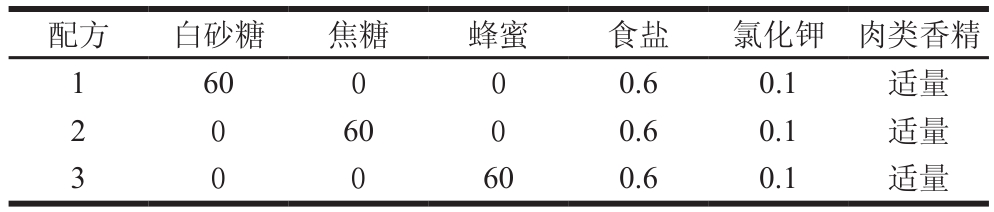
配方 白砂糖 焦糖 蜂蜜 食盐 氯化钾 肉类香精1 60 0 0 0.6 0.1 适量2 0 60 0 0.6 0.1 适量3 0 0 60 0.6 0.1 适量
1.3.8 活性肽口服液的感官评价
参考王林山等[25]的感官分析评级指标,从色泽、香味、滋味、组织状态4 个方面对上述3 种公犊奶牛肉活性肽口服液进行综合评分,有差距的酌情扣分,10 分为满分。评分标准如表4所示。
表 4 公犊奶牛肉活性肽口服液的感官评分标准
Table 4 Criteria for sensory evaluation of active peptide oral liquid

项目 评分标准 分值色泽(2 分)1 级:浅黄色 1.5~2.0 2 级:棕色 1.0~1.4 3 级:深棕色 <1.0香味(3 分)1 级:香味浓郁,无肉腥味 2.5~3.0 2 级:香味偏淡,无肉腥味 2.0~2.4 3 级:几乎无香味,有肉腥味 <2.0滋味(3 分)1 级:口感细腻饱满,协调柔和,甜味适中 2.5~3.0 2 级:口感淡薄,甜味不够协调 2.0~2.4 3 级:口感黏滞,甜味怪异 <2.0组织状态(2 分)1 级:明亮澄清,无沉淀、分层现象 1.5~2.0 2 级:较均匀,有些许浑浊 1.0~1.4 3 级:均匀性差,有分层或沉淀 <1.0
整理后的数据采用SPSS 20.0分析软件进行统计学检验及方差分析。

图 1 不同蛋白酶对初生公犊奶牛肉酶解产物DPPH自由基清除率的影响
Fig. 1 Effect of different proteases on DPPH radical scavenging activity of veal protein hydrolysates
由图1可知,随着酶解时间的增加,各酶解产物的DPPH自由基清除率均呈现先升高后降低的趋势。其中,酸性蛋白酶酶解产物的DPPH自由基清除率在反应5 h时达到最高,为86.24%;木瓜蛋白酶酶解产物的DPPH自由基清除率在3 h时达到最高,为85.71%,4 h之后明显下降;动物蛋白水解复合酶酶解产物的DPPH自由基清除率在3 h时达到最高,为76.10%,随后在1 h内,迅速降低至40%左右;碱性蛋白酶酶解产物的DPPH自由基清除率变化很小,且一直处在较低水平(40%以下),这是由于碱性蛋白酶是一种疏水性蛋白,不适合动物蛋白的水解,比较适合植物蛋白水解;而中性蛋白酶酶解产物的DPPH自由基清除率在反应初期就迅速增加,在3 h时就达到最高(90.17%),并且中性蛋白酶是一种内切酶,可用于各种蛋白质,将各种大分子蛋白质水解成小分子肽或氨基酸,有利于蛋白质的有效吸收和利用。例如,陈卫明[26]采用酶解法,筛选出中性蛋白酶为制备贻贝抗氧化肽的最适蛋白酶。
酶的选择是本研究的关键,酶的种类决定了肽链长度和水解的作用位点。同时,酶的选择决定了基团特异性和不同酶解产物,决定产物的功能和性质。对比酶解不同物质的最适蛋白酶发现,碱性蛋白酶更适合水解植物蛋白,而中性蛋白酶更适合水解动物蛋白,综合考虑反应时间及DPPH自由基清除率,并且中性蛋白酶又是一种微生物蛋白,相对其他酶的成本更低,因此选择中性蛋白酶作为酶法制备初生公犊奶牛肉抗氧化肽的蛋白酶,并在此基础上优化反应条件。
2.2.1 pH值对DPPH自由基清除率的影响

图 2 pH值对初生公犊奶牛肉酶解产物DPPH自由基清除率的影响
Fig. 2 Effect of pH on DPPH radical scavenging activity of veal protein hydrolysates
由图2可知,在pH值为7.0时,酶解产物的DPPH自由基清除率达到最大(83.2%),与其他pH值条件下酶解产物的DPPH自由基清除率相比具有显著性差异(P<0.05)。在酶水解过程中,pH值是决定酶活性的重要因素之一。pH值偏酸或偏碱均会降低酶的活性,影响蛋白酶和底物的结合,使底物蛋白的水解程度下降,从而影响抗氧化活性肽的产生[27]。因此,确定最适pH值为7.0。

图 3 酶解温度对初生公犊奶牛肉酶解产物DPPH自由基清除率的影响
Fig. 3 Effect of temperature on DPPH radical scavenging activity of veal protein hydrolysates
2.2.2 酶解温度对DPPH自由基清除率的影响由图3可知,酶解产物DPPH自由基清除率随着酶解温度的升高而逐渐增大,在55 ℃达到最大值85.6%(P<0.05),然后随酶解温度的进一步升高而降低。低温条件下,酶结构稳定,当酶解温度从40 ℃增加到55 ℃,蛋白水解反应占据主导地位;随着酶解温度的升高,酶的活性不断增强,水解反应程度增大,抗氧化活性增强[28]。高温会破坏酶的结构,使其失活,当酶解温度超过60 ℃时,酶活性下降,水解速率下降,生成的抗氧化肽段减少,因此酶解物的DPPH自由基清除率下降。刘进杰等[29]的研究结果表明,中性蛋白酶的最佳酶解温度为55 ℃,此温度条件下螺旋藻酶解物的抗氧化性最高,与本研究的结果一致。因此,确定中性蛋白酶的最佳酶解温度为55 ℃。
2.2.3 加酶量对DPPH自由基清除率的影响
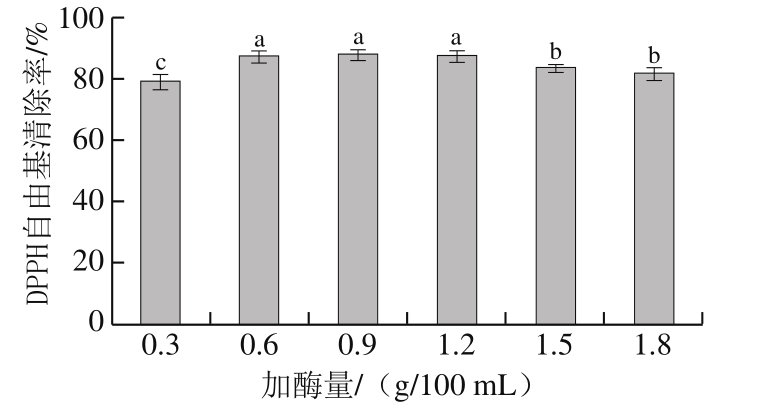
图 4 加酶量对初生公犊奶牛肉酶解产物DPPH自由基清除率的影响
Fig. 4 Effect of enzyme dose on DPPH radical scavenging activity of veal protein hydrolysates
由图4可知:加酶量为0.3~0.6 g/100 mL时,酶解产物的DPPH自由基清除率呈现上升趋势(P<0.05);当加酶量从0.6 g/100 mL增加到1.2 g/100 mL时,DPPH自由基清除率基本无变化(P>0.05);当加酶量超过0.6 g/100 mL后,DPPH自由基清除率显著下降(P<0.05)。随着加酶量的增加,酶解产物的抗氧化活性逐渐增加,但当酶添加量达到一定水平时,酶解产物的抗氧化活性降低。这主要是由于加酶量增加,酶解能力增强,体系初始反应速率很快,大多数蛋白质在短时间内降解成肽[30];当蛋白质浓度降低到一定水平时,蛋白质水解速率减缓,DPPH自由基清除率的增加变得缓慢。酶质量浓度过大时,当蛋白质水解成多肽后,这些具有抗氧化性的多肽继续被降解为无抗氧化性的小肽段及游离氨基酸,造成酶解物DPPH自由基清除率降低。为了节约酶用量、降低成本,确定水解初生公犊奶牛肉蛋白质的酶用量为0.6 g/100 mL。
2.2.4 酶解时间对DPPH自由基清除率的影响
由图5可知,酶解产物的DPPH自由基清除率随酶解时间的增加而显著上升(P<0.05);酶解时间3~4 h时,DPPH自由基清除率无明显变化(P>0.05);酶解时间超过4 h后,酶解产物的DPPH自由基清除率明显下降(P<0.05)。这是由于随着酶解时间的延长,抗氧化肽可能会过度水解,短肽和氨基酸含量增加[31],从而使酶解物的DPPH自由基清除率下降。为了节约成本,确定酶解初生公犊奶牛肉蛋白质的时间为3 h。

图 5 酶解时间对初生公犊奶牛肉酶解产物DPPH自由基清除率的影响
Fig. 5 Effect of hydrolysis time on DPPH radical scavenging activity of vealt protein hydrolysates
根据单因素试验结果,选择pH值、酶解温度、加酶量和酶解时间4 个因素,以DPPH自由基清除率为响应值,设计4因素3水平的响应面试验。中性蛋白酶水解公犊奶牛肉的条件优化采用Box-Behnken试验设计进行29 组试验,其中1~24组为分析试验和零点试验,25~29组为中心点重复试验。试验方案如表5所示,显著性检验和方差分析如表6所示。
表 5 响应面试验设计方案及结果
Table 5 Experimental design with results for RSM
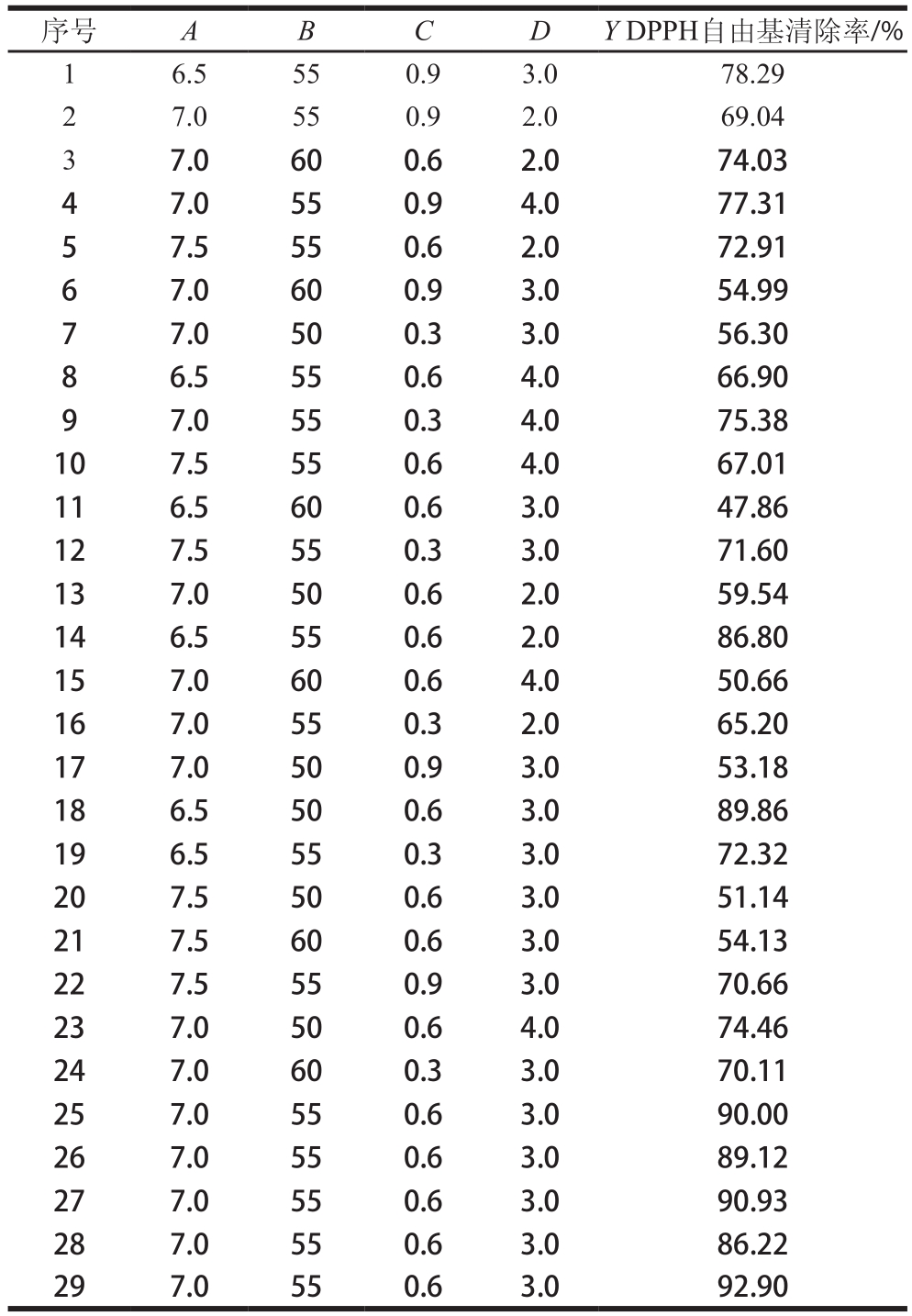
序号A B C D Y DPPH自由基清除率/%1 6.5 55 0.9 3.0 78.29 2 7.0 55 0.9 2.0 69.04 3 7.0 60 0.6 2.0 74.03 4 7.0 55 0.9 4.0 77.31 5 7.5 55 0.6 2.0 72.91 6 7.0 60 0.9 3.0 54.99 7 7.0 50 0.3 3.0 56.30 8 6.5 55 0.6 4.0 66.90 9 7.0 55 0.3 4.0 75.38 10 7.5 55 0.6 4.0 67.01 11 6.5 60 0.6 3.0 47.86 12 7.5 55 0.3 3.0 71.60 13 7.0 50 0.6 2.0 59.54 14 6.5 55 0.6 2.0 86.80 15 7.0 60 0.6 4.0 50.66 16 7.0 55 0.3 2.0 65.20 17 7.0 50 0.9 3.0 53.18 18 6.5 50 0.6 3.0 89.86 19 6.5 55 0.3 3.0 72.32 20 7.5 50 0.6 3.0 51.14 21 7.5 60 0.6 3.0 54.13 22 7.5 55 0.9 3.0 70.66 23 7.0 50 0.6 4.0 74.46 24 7.0 60 0.3 3.0 70.11 25 7.0 55 0.6 3.0 90.00 26 7.0 55 0.6 3.0 89.12 27 7.0 55 0.6 3.0 90.93 28 7.0 55 0.6 3.0 86.22 29 7.0 55 0.6 3.0 92.90
对表5的实验数据进行处理,得到公犊奶牛肉酶解物DPPH自由基清除率(Y)对pH值(A)、酶解温度(B)、加酶量(C)及酶解时间(D)的二次多项式回归方程:Y=89.83-4.55A-2.73B-0.62C-1.32D+11.25AB-1.73AC+3.50AD-3.00BC-9.58BD-0.48CD-8.30A2-19.95B2-10.19C2-7.08D2。
表 6 回归模型方差分析
Table 6 Analysis of variance (ANOVA) for regression equation
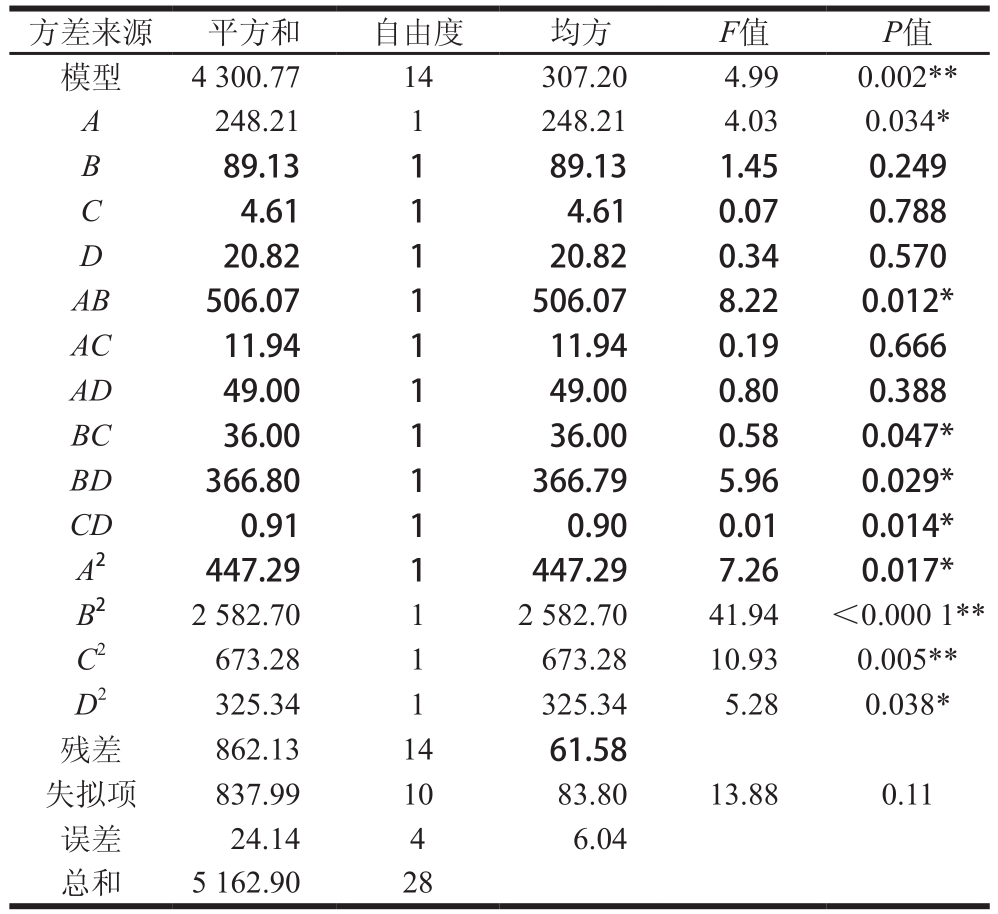
注:**. 极显著(P<0.01);*. 显著(P<0.05)。
方差来源 平方和 自由度 均方F值P值模型 4 300.77 14 307.20 4.99 0.002**A 248.21 1 248.21 4.03 0.034*B 89.13 1 89.13 1.45 0.249 C 4.61 1 4.61 0.07 0.788 D 20.82 1 20.82 0.34 0.570 AB 506.07 1 506.07 8.22 0.012*AC 11.94 1 11.94 0.19 0.666 AD 49.00 1 49.00 0.80 0.388 BC 36.00 1 36.00 0.58 0.047*BD 366.80 1 366.79 5.96 0.029*CD 0.91 1 0.90 0.01 0.014*A2 447.29 1 447.29 7.26 0.017*B2 2 582.70 1 2 582.70 41.94 <0.000 1**C2 673.28 1 673.28 10.93 0.005**D2 325.34 1 325.34 5.28 0.038*残差 862.13 14 61.58失拟项 837.99 10 83.80 13.88 0.11误差 24.14 4 6.04总和 5 162.90 28
由表6可知,模型中的失拟项P=0.11>0.05(不显著),表明该设计模型拟合程度较好。模型的F=4.99,P=0.002<0.01,表明该模型极显著[32]。综合以上分析结果,说明模型方程可以较好地反映其真实性[33],可用于研究所选4 个因素的变化对公犊奶牛肉酶解液DPPH自由基清除率的影响,得到最佳工艺条件。4 个因素对酶解产物DPPH自由基清除率大小的影响顺序为pH值>酶解温度>酶解时间>加酶量。因素A以及AB、BC、BD、CD的两两因素交互作用对酶解产物DPPH自由基清除率的影响显著(P<0.05)。

图 6 pH值和酶解温度交互作用影响酶解产物DPPH自由基清除率的响应面图和等高线图
Fig. 6 Response surface and contour plots showing the interactive effect of pH value and hydrolysis temperature on DPPH radical scavenging activity of veal protein hydrolysates
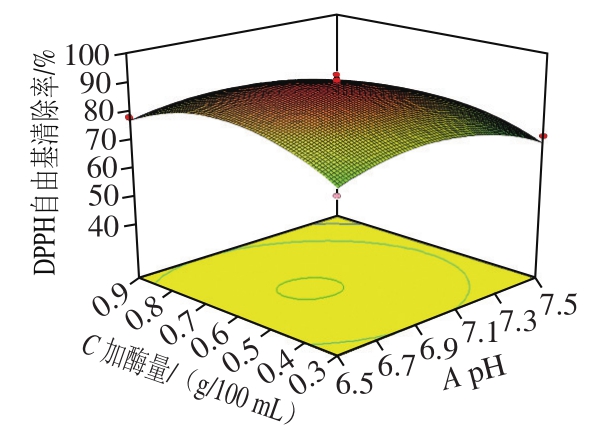
图 7 pH值和加酶量交互作用响酶解产物DPPH自由基清除率的响应面图和等高线图
Fig. 7 Response surface and contour plots showing the interactive effect of pH value and enzyme dosage on DPPH radical scavenging activity of veal protein hydrolysates
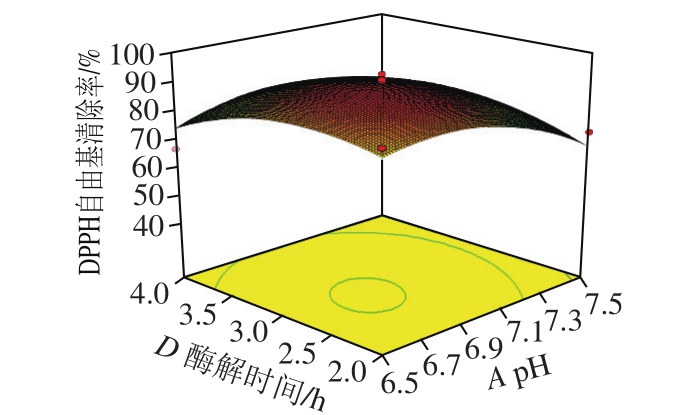
图 8 pH值和酶解时间交互作用影响酶解产物DPPH自由基清除率的响应面图和等高线图
Fig. 8 Response surface and contour plots showing the interactive effect of pH value and hydrolysis time on DPPH radical scavenging of veal protein hydrolysates

图 9 酶解温度和加酶量交互作用影响酶解产物DPPH自由基清除率的响应面图和等高线图
Fig. 9 Response surface and contour plots showing the interactive effect of hydrolysis temperature and enzyme dosage on DPPH radical scavenging activity of veal protein hydrolysates
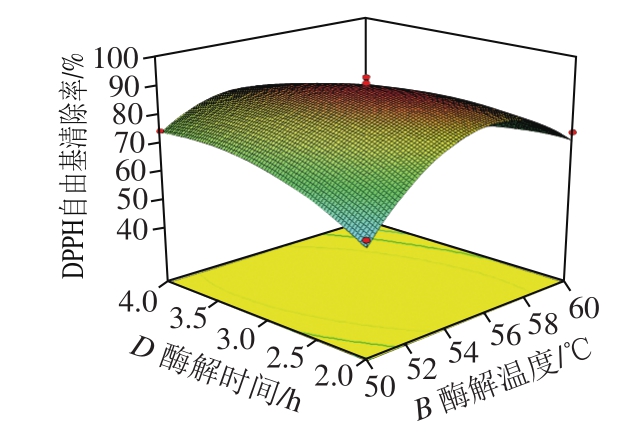
图 10 酶解温度和酶解时间交互作用影响酶解产物DPPH自由基清除率的响应面图和等高线图
Fig. 10 Response surface and contour plots showing the interactive effect of hydrolysis temperature and time on DPPH radical scavenging activity of veal protein hydrolysates
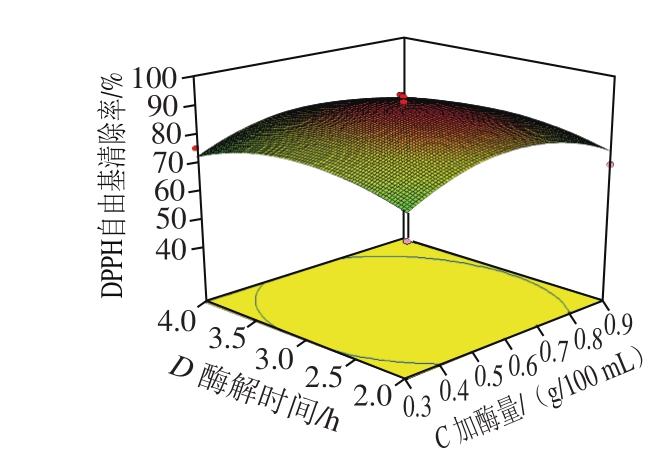
图 11 加酶量和酶解时间交互作用影响酶解产物DPPH自由基清除率的响应面图和等高线图
Fig. 11 Response surface and contour plots showing the interactive effect of enzyme dosage and hydrolysis time on DPPH radical scavenging activity of veal protein hydrolysates
由图6~11可知,各因素之间两两交互作用的响应面图呈抛物线形状。其中AB、BD、BC、CD的两因素交互作用响应面坡度较为陡峭,其椭圆形的等高线表明两因素具有显著的交互作用[28]。AC、AD的响应曲面较为平缓,其圆形的等高线表明两因素交互作用不显著。响应曲面及等高线图结果与回归模型方差分析的结果基本一致。利用Design Expert 8.05b软件得出最优酶解条件为pH值6.80、酶解温度54.17 ℃、加酶量0.61 g/100 mL、酶解时间2.92 h。
考虑实际操作过程中的实施情况,可修正酶解参数为pH值6.80、酶解温度54 ℃、加酶量0.61 g/100 mL、酶解时间2.92 h。在此条件下进行3 次平行实验,测得DPPH自由基清除率为(92.25±0.51)%,与预测值91.03%相比误差为1.22%,表明预测值和实际值有很好的拟合性,说明模型优化出的条件较为准确,证明中性蛋白酶水解制备初生公犊奶牛肉酶解产物时最佳水解条件的可靠性和预测结果的实际可行性。
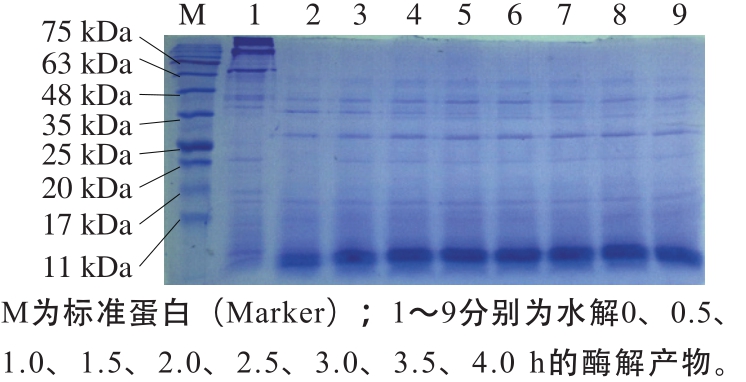
图 12 初生公犊奶牛肉酶解产物的SDS-PAGE图
Fig. 12 SDS-PAGE of veal protein hydrolysate
由图12可知:上清液中的蛋白质都是大分子蛋白质,其分子质量基本上都大于75 kDa;加入蛋白酶后,随着水解反应的进行,大分子蛋白质被水解完全,不再出现清晰的条带;酶解产物电泳图的条带主要集中在11 kDa以下的位置,并且随着反应的进行,条带颜色越来越深。通过蛋白质分子的电泳迁移率计算多肽的分子质量,可以判断出随着酶解反应的进行,牛肉大分子蛋白质被水解成分子质量小于7 kDa的肽段或游离氨基酸。
本实验室的前期工作已对初生公犊奶牛肉酶解产物中的氨基酸进行了检测,酶解产物中含有大量的游离氨基酸,其中8 种必需氨基酸占酶解产物总游离氨基酸的51.65%[4]。此外,还在酶解产物中检测到0.176 mg/mL的牛磺酸[34]。研究表明,牛磺酸具有调节心肌细胞膜功能、抗氧化、解毒和维持细胞内外渗透压等作用[35]。
以公犊奶牛肉酶解产物调配的功能性口服液,按照其色泽、香味、滋味和组织状态为考核指标,召集30 名评价员,采用盲标的形式按照感官评分标准对3 种口服液进行打分,并比较不同因素及水平产品的质量状况。
表 7 公犊奶牛肉多肽口服液感官评分
Table 7 Sensory scores of active peptide oral liquid

配方 色泽评分 香味评分 滋味评分 组织状态评分 总分1 1.2 2.7 1.4 1.3 6.6 2 1.5 2.7 1.5 1.3 7.0 3 1.5 2.5 2.2 2.0 8.2
由表7可知,得分最高的为配方3,加入蜂蜜使口服液的滋味及组织状态最好。通过感观评价得出口服液的最适配方为蜂蜜60 g/L、食盐0.6 g/L、氯化钾0.1 g/L,调配出来的口服液为色泽均匀一致、呈棕黄色的透明液体,味甘甜,具有牛肉风味,无外来不良气味,无异物和沉淀物。
选择中性蛋白酶作为酶法制备初生公犊奶牛肉抗氧化肽的最适蛋白酶,并对水解产物的DPPH自由基清除率进行测定和分析,并通过响应面优化分析方法对酶解条件进行优化,得到最适的反应条件,即pH值6.80、加酶量0.61 g/100 mL、酶解温度54 ℃、酶解时间2.92 h。通过初生公犊奶牛肉水解产物的SDS-PAGE分析,进一步验证了在中性蛋白酶作用下初生公犊奶牛肉水解为分子质量小于7 kDa的多肽。最终,利用酶解得到的产物制备了一种具有抗氧化活性的多肽口服液,并通过感观评价优化了口感,使其更受大众的欢迎。
[1] 李春芳. 不同日粮营养水平对荷斯坦淘汰奶牛、奶公牛生长性能及肉品质的影响[D]. 保定: 河北农业大学, 2013: 1-3.
[2] 胡猛, 张文举, 尹君亮, 等. 奶公犊牛资源利用及肉品质研究进展[J].饲料博览, 2012(3): 13-16. DOI:10.3969/j.issn.1001-0084. 2012.03.004.
[3] 胡猛. 成荷斯坦奶公牛与其他3 个品种牛的肉品质比较研究[J]. 中国畜牧兽医, 2013, 40(3): 95-99. DOI:10.3969/j.issn.1671-7236.2013.03.021.
[4] 陈珍, 刘涛, 顾千辉, 等. 奶公犊牛肉营养成分的分析[J]. 肉类研究,2016, 30(4): 21-24. DOI:10.15922/j.cnki.rlyj.2016.04.005.
[5] LAFARGA T, HAYES M. Bioactive peptides from meat muscle and by-products: generation, functionality and application as functional ingredients[J]. Meat Science, 2014, 98(2): 227-239. DOI:10.1016/j.meatsci.2014.05.036.
[6] MORA L, REIG M, TOLDR F. Bioactive peptides generated from meat industry by-products[J]. Food Research International, 2014, 65:344-349. DOI:10.1016/j.foodres.2014.09.014.
F. Bioactive peptides generated from meat industry by-products[J]. Food Research International, 2014, 65:344-349. DOI:10.1016/j.foodres.2014.09.014.
[7] DECKER E A, PARK Y. Healthier meat products as functional foods[J]. Meat Science, 2010, 86(1): 49-55. DOI:10.1016/j.meatsci.2010.04.021.
[8] UDENIGWE C C, HOWARD A. Meat proteome as source of functional biopeptides[J]. Food Research International, 2013, 54(1):1021-1032. DOI:10.1016/j.foodres.2012.10.002.
[9] FU Y, YOUNG J F, THERKILDSEN M. Bioactive peptides in beef:endogenous generation through postmortem aging[J]. Meat Science,2017, 123: 134-142. DOI:10.1016/j.meatsci.2016.09.015.
[10] LORENZO J M, MUNEKATA P E S, GOMEZ B, et al. Bioactive peptides as natural antioxidants in food products: a review[J]. Trends in Food Science and Technology, 2018, 79: 136-147. DOI:10.1016/j.tifs.2018.07.003.
[11] 李少辉, 贾俊强, 桂仲争. 微细化-蛋白酶解对蚕蛹蛋白营养价值和功能特性的影响[J]. 食品科学, 2018, 39(7): 181-187. DOI:10.7506/spkx1002-6630-201807027.
[12] UDENIGWE C C, GONG M, MOHAN A, et al. Role of surface charge of hydrolysed bovine caseins in their iron (Ⅱ)-binding affinity and antioxidative capacity in iron (Ⅱ)-facilitatedβ-carotene and glutathione oxidation[J]. Journal of Food and Nutrition Research,2017, 56(2): 149-154.
[13] VILLAMIL O, V QUIRO H, SOLANILLA J F. Fish viscera protein hydrolysates: production, potential applications and functional and bioactive properties[J]. Food Chemistry, 2017, 224: 160-171.DOI:10.1016/j.foodchem.2016.12.057.
QUIRO H, SOLANILLA J F. Fish viscera protein hydrolysates: production, potential applications and functional and bioactive properties[J]. Food Chemistry, 2017, 224: 160-171.DOI:10.1016/j.foodchem.2016.12.057.
[14] 陈珍, 安鑫, 王亚茜, 等. 牛肉酶解工艺及其产物的研究进展[J]. 肉类研究, 2014, 28(10): 29-32.
[15] 厉望, 靳挺, 武玉学. 带鱼酶解条件优化及酶解物抗氧化性能[J]. 食品科学, 2013, 34(9): 234-239. DOI:1002-6630(2013)09-0234-06.
[16] 洪鹏志. 罗非鱼肉蛋白酶解液及其超滤液的抗氧化活性研究[J].广东农业科学, 2015, 42(20): 102-106. DOI:10.3969/j.issn.1004-874X.2015.20.020.
[17] SHU Guowei, MEI Sha, ZHANG Qian, et al. Application of the Plackett-Burman design to determine the main factors affecting the anti-oxidative activity of goat’s milk casein hydrolyzed by alcalase and papain[J]. Acta Scientiarum Polonorum: Technologia Alimentaria,2018, 17(3): 257-266. DOI:10.17306/J.AFS.2018.0580.
[18] 焦驼文. 酶解蛋白制备抗氧化多肽的研究现状与展望[J]. 中国酿造,2007(3): 5-7. DOI:10.3969/j.issn.0254-5071.2007.03.002.
[19] 王玲玲. 不同蛋白酶制剂对牛肉的酶解效果研究[J]. 食品研究与开发, 2019, 40(1): 51-56. DOI:10.3969/j.issn.1005-6521.2019.01.010.
[20] 成晓瑜, 李迎楠, 刘文营, 等. 牛骨酶解物对制备牛肉香精中挥发性风味成分的影响[J]. 肉类研究, 2016, 30(4): 1-5. DOI:10.15922/j.cnki.rlyj.2016.04.001.
[21] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学, 2014, 35(9): 317-322. DOI:10.7506/spkx1002-6630-201409062.
[22] OZCELIK B, LEE J H, MIN D B. Effects of light, oxygen, and pH on the absorbance of 2,2-diphenyl-1-picrylhydrazyl[J]. Journal of Food Science, 2003, 68(2): 487-490. DOI:10.1111/j.1365-2621.2003.tb05699.x.
[23] 张谦益, 吴洪华. 牛肉酶解物的Tricine-SDS-PAGE电泳分析[J]. 肉类工业, 2006(7): 21-22.
[24] 刘玉明, 钱甜甜, 蒋定文, 等. 凯氏定氮法和考马斯亮蓝法测定方格星虫多糖中蛋白质的含量[J]. 中国实验方剂学杂志, 2013, 19(19):96-98. DOI:10.11653/syfj2013190096.
[25] 王林山, 文连奎. 南瓜乳酸发酵饮料加工工艺研究[J]. 食品工业科技, 2005(7): 123-125. DOI:10.3969/j.issn.1002-0306.2005.07.047.
[26] 陈卫明. 酶解制备贻贝抗氧化肽与功能性鱼糕的研制[J].食品科学技术学报, 2016, 34(6): 24-30. DOI:10.3969/j.issn.2095-6002.2016.06.005.
[27] 赵爽, 刘昆仑, 陈复生. 酶法制备富硒糙米抗氧化肽的研究[J]. 河南工业大学学报(自然科学版), 2017, 38(5): 5-10; 16. DOI:10.16433/j.cnki.issn1673-2383.2017.05.002.
[28] 安攀宇, 赵珊, 张淼, 等. 响应面法优化鸡胸肉蛋白酶解工艺[J]. 肉类研究, 2018, 32(11): 22-29. DOI:10.7506/rlyj1001-8123-201811004.
[29] 刘进杰, 岳思涵, 邹宁, 等. 中性蛋白酶水解螺旋藻制备抗氧化肽的工艺研究[J]. 食品工业, 2018, 39(11): 27-31.
[30] 周燕芳, 黄晓丽. 响应面法优化酶解海产小杂鱼及酶解液抗氧化性[J].食品工业, 2018, 39(10): 99-104.
[31] 刘盼, 陈晓磊, 陈夫山. 复合蛋白酶水解法制备麦麸多肽及其抗氧化性能研究[J]. 齐鲁工业大学学报, 2018, 32(3): 1-6. DOI:10.16442/j.cnki.qlgydxxb.2018.03.001.
[32] 张蕾, 程润青, 孙媛媛, 等. 河蚬多肽螯合钙的制备和抗氧化活性分析[J]. 食品工业, 2017, 38(3): 94-98.
[33] 刘晶晶, 徐蕴桃, 周蓉, 等. 河蚬多肽螯合亚铁的制备工艺研究[J].食品工业科技, 2018, 39(2): 224-228. DOI:10.13386/j.issn1002-0306.2018.02.042.
[34] 陈珍. 公犊奶牛肉酶解制备抗氧化肽及其应用[D]. 上海: 上海大学,2016: 49-50.
[35] 黄春喜, 袁建敏, 周向梅. 牛磺酸对断奶小鼠小肠发育的影响[J].中国农业大学学报, 2014, 19(4): 129-136. DOI:10.11841/j.issn.1007-4333.2014.04.19.
Optimization of the Preparation Process for Enzymatic Hydrolysate with Antioxidant Activity from Veal Protein and Formulation of an Active Peptide Oral Liquid
何梓钰, 陈珍, 黄俊逸, 等. 酶解公犊奶牛肉制备抗氧化活性肽口服液的工艺优化[J]. 肉类研究, 2019, 33(3): 26-33.DOI:10.7506/rlyj1001-8123-20190210-027. http://www.rlyj.net.cn
HE Ziyu, CHEN Zhen, HUANG Junyi, et al. Optimization of the preparation process for enzymatic hydrolysate with antioxidant activity from veal protein and formulation of an active peptide oral liquid[J]. Meat Research, 2019, 33(3): 26-33.DOI:10.7506/rlyj1001-8123-20190210-027. http://www.rlyj.net.cn