表 1 响应面试验因素水平表
Table 1 Factors at three levels used in response surface experiments
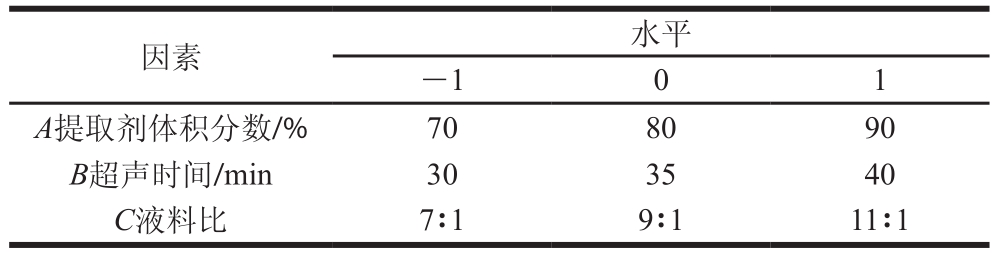
因素 水平-1 0 1 A提取剂体积分数/% 70 80 90 B超声时间/min 30 35 40 C液料比 7∶1 9∶1 11∶1
熏鸡作为我国著名的传统特色美食,是酱卤肉制品的典型代表之一,其加工工艺主要包括原料的处理、卤制及熏制等,因独特的工艺和配方造就了熏鸡色艳味佳、油而不腻、造型优美等特点,得到广大消费者的认可。然而,熏鸡在运输、贮藏和销售过程中会发生一系列的变化,从而导致产品品质下降,而氧化导致的色素变化就是其中的一个主要机制,最终导致熏鸡色泽的变化以及货架期的缩短[1-3]。此外,烟熏在为熏鸡提供特有烟熏风味和良好烟熏色泽的同时,也容易产生杂环胺等有害物质,不利于熏鸡产业的发展。相较于传统木烟熏制而言,糖烟熏制的优势在于可以为熏鸡提供与木熏相似的烟熏味和烟熏色泽,最为重要的是,糖熏过程中产生的杂环胺等有害物质更少、更安全、更有利于熏鸡产业的发展和增加消费者的认可度[4-5]。鉴于此,本研究采用糖熏熏鸡为材料展开研究。目前有关熏鸡的研究主要集中在风味物质和干燥工艺等[3-4,6]方面,色素的提取则在植物(如红树莓花青素[7]、花椒红色素[8]、栀子黄色素[9]、β-胡萝卜素[10]、番茄红素[11]和紫薯皮色素[12]等)和微生物(如酵母红色素[13]、红曲红色素[14]等)方面研究较多,有关糖熏熏鸡颜色的相关研究鲜有报道。
传统的提取方法,如浸提法,耗时耗材且效率低下[15],因此,需要采取一种省时省力的高效提取方法。与常规溶剂提取技术相比,超声辅助提取因其机械效应和声学空化作用而具备高效率、短时间、低成本及高自动化的优点[7,16]。超声通常用于色素提取,因为它可以防止天然色素的成分受到结构性破坏,能较好地维持色素的稳定性。使用超声提取熏鸡皮色素时,有很多工艺条件需要进行优化,如提取剂的浓度、液料比、超声温度等,这些变量的相互作用共同影响着色素的提取率。在这种情况下,响应面法(response surface methodology,RSM)成功地结合了统计和数学系统,比其他经典方法[17-19]更有效地节省了时间,方便优化,广泛应用于工艺优化研究[20-21]。
利用超声辅助提取糖熏熏鸡皮色素,以色素提取液吸光度作为衡量指标,通过单因素试验结果,分析乙醇体积分数、液料比和超声时间对糖熏熏鸡皮色素提取效果的影响,在此基础上,进行响应面试验,优化提取工艺,为糖熏熏鸡皮色素的高效提取及对糖熏熏鸡颜色的探究提供理论依据。
糖熏熏鸡,购于锦州万达超市。
氯仿、无水乙醇、甲醇、乙酸乙酯、二氯甲烷、苯、石油醚、正己烷均为分析纯 美国Sigma-Aldrich公司。
Allgra 64R冷冻离心机 上海普迪生物技术有限公司;FRQ小型超声波清洗机 杭州法兰特超声波科技有限公司;QSJ-A03A1切碎机 佛山市小熊电器有限公司;PL203电子天平 上海梅特勒-托利多有限公司;UV2550紫外-可见分光光度计 北京优谱通用科技有限公司。
1.3.1 糖熏熏鸡皮色素提取工艺
糖熏熏鸡皮→预处理(去除黑点、毛根等)→切碎机绞碎→取样(2 g)→加乙醇→超声处理(25 ℃、400 W)→离心→过滤→取样(0.5 mL)→定容(100 mL)→测定吸光度(282 nm)。
1.3.2 糖熏熏鸡皮色素的光谱特性测定
糖熏熏鸡皮多次绞碎后,获取熏鸡皮碎末,取2 g于离心管内,加入适量体积分数的无水乙醇,超声波辅助提取适当时间后,6 000 r/min条件下离心15 min,滤去残渣后吸取0.5 mL定容于100 mL容量瓶,在200~400 nm波长下进行光谱扫描,得到糖熏熏鸡皮色素的紫外-可见分光光谱图。
1.3.3 糖熏熏鸡皮色素提取剂的选择
以吸光度为指标,称取2 g熏鸡皮碎末,在一定液料比和提取时间条件下分析蒸馏水、无水乙醇、石油醚、甲醇、氯仿、二氯甲烷、乙酸乙酯、苯和正己烷对糖熏熏鸡皮色素提取效果的影响。
1.3.4 单因素试验设计
以吸光度为指标进行单因素试验:1)提取剂乙醇体积分数的选择:超声波处理提取时间为35 min,液料比9∶1(V/m),乙醇体积分数分别为60%、70%、80%、90%、100%;2)超声波处理提取时间的选择:液料比9∶1,提取液为80%乙醇溶液,提取时间分别为25、30、35、40、45 min;3)液料比的选择:提取液为80%乙醇溶液,超声波处理提取时间35 min,液料比分别为5∶1、7∶1、9∶1、11∶1、13∶1。
1.3.5 响应面优化试验设计
单因素试验结束后,遵循Box-Behnken设计原理,以吸光度为优化目标,展开响应面试验,利用Design-Expert软件进行参数优化,筛选出糖熏熏鸡皮色素的最佳提取参数。响应面试验的因素与水平如表1所示。
表 1 响应面试验因素水平表
Table 1 Factors at three levels used in response surface experiments

因素 水平-1 0 1 A提取剂体积分数/% 70 80 90 B超声时间/min 30 35 40 C液料比 7∶1 9∶1 11∶1
1.3.6 验证实验
在最佳提取工艺条件下,分别以超声功率0 W和400 W进行提取实验,测定相应的光谱图,以验证在此提取条件下,提取物质是否发生降解以及确定超声处理对实验的影响。
采用Origin 8.6软件对数据进行统计处理,应用Design-Expert 8.0软件设计及分析响应面试验。
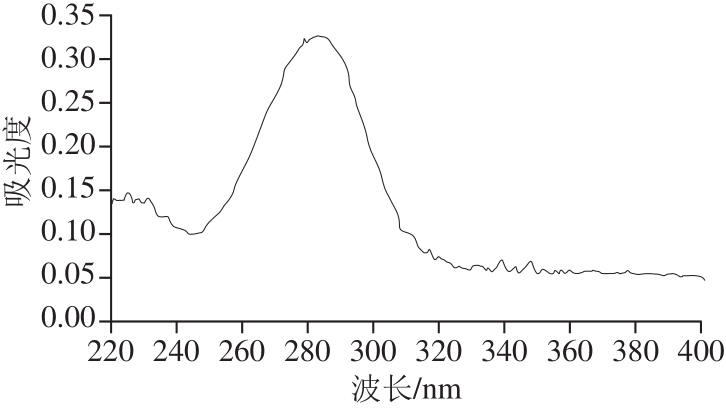
图 1 糖熏熏鸡皮色素的紫外-可见光谱图
Fig. 1 UV-visible spectrum of sugar-smoked chicken skin pigment
由图1可知,糖熏熏鸡皮色素的最大吸收峰在282 nm波长处,因此,本研究选择在282 nm波长处测定吸光度,来表示糖熏熏鸡皮色素的相对含量。
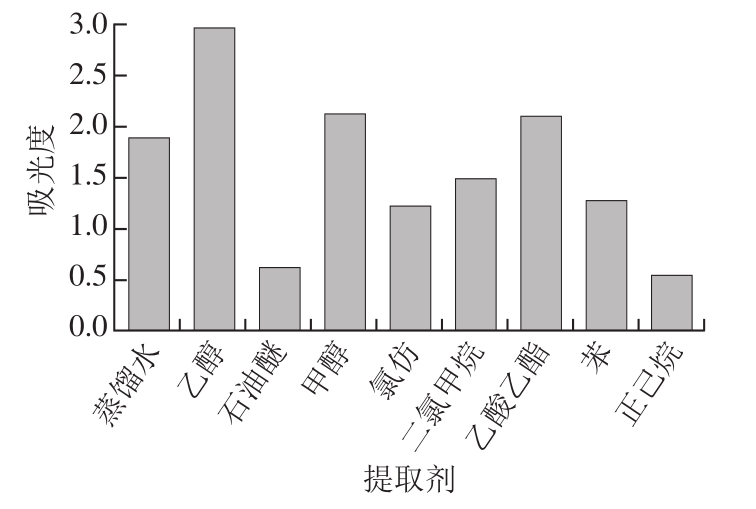
图 2 不同提取剂提取时糖熏熏鸡皮色素的吸光度
Fig. 2 Effect of extraction solvent on absorbance of sugar-smoked chicken skin pigment
在一定液料比和超声时间条件下[7],以蒸馏水、乙醇、石油醚、甲醇、氯仿、二氯甲烷、乙酸乙酯、苯和正己烷为提取剂,提取糖熏熏鸡皮色素。由图2可知,在相同提取条件下,乙醇对该色素提取效果最好,吸光度达2.975,较其他组提取效果最优,其次是甲醇(A=2.136),正己烷(A=0.554)提取效果最差。因此选定乙醇溶液作为本研究的提取剂。
2.3.1 超声波处理提取时间的选择
由图3可知,随着超声波处理提取时间逐渐增加,糖熏熏鸡皮色素的吸光度先增加后减小,35 min时,吸光度达到最大值1.572。这主要是由于超声的空化效应可以增加分子的运动速率和介质的穿透能力,使得溶剂和熏鸡皮快速作用,此外,前期提取剂和待提物之间有着较大的渗透压,在此情况下色素成分会快速溶出,增大提取率。但是当超声波处理提取时间超过35 min后,超声的机械、空化及热效应有可能会破环糖熏熏鸡皮色素的结构[22-24],导致其吸光度下降。因此适宜的超声波处理提取时间为35 min。
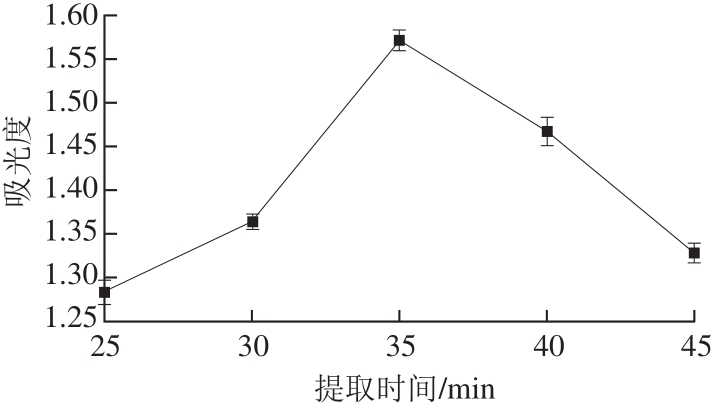
图 3 不同超声波处理提取时间条件下糖熏熏鸡皮色素的吸光度
Fig. 3 Effect of ultrasonic time on absorbance of sugar-smoked chicken skin pigment
2.3.2 液料比的选择
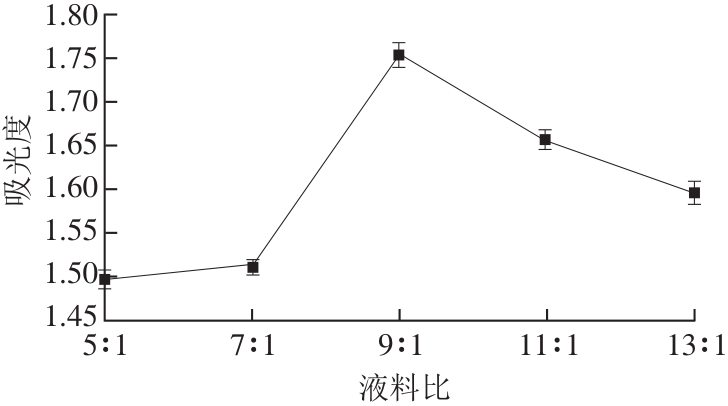
图 4 不同料液比条件下糖熏熏鸡皮色素的吸光度
Fig. 4 Effect of solid-to-solvent ratio on absorbance of sugar-smoked chicken skin pigment
由图4可知:在液料比为9∶1时,糖熏熏鸡皮色素的吸光度达到最大值1.748;随着液料比的增大,即液料比为9∶1~13∶1时,色素吸光度下降,这是由溶剂增多,色素溶液相对稀释所致。此外,考虑到经济问题和后续的工作量,液料比也不宜过大[25-27]。因此,选定9∶1作为本研究的液料比。
2.3.3 乙醇体积分数的选择
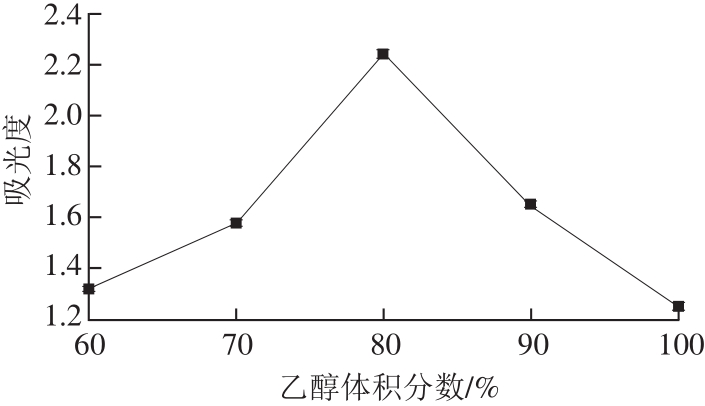
图 5 不同乙醇体积分数条件下糖熏熏鸡皮色素的吸光度
Fig. 5 Effect of ethanol concentration on absorbance of sugar-smoked chicken skin pigment
由图5可知,随着乙醇体积分数逐渐增加,糖熏熏鸡皮色素的吸光度先增加后减小,乙醇体积分数为80%时,吸光度达到最大值2.245。这是由于乙醇为有机溶剂,随着其体积分数的增加,会破坏色素与基质之间的成键能力,增大溶解量,使得吸光度增大;但是,当乙醇体积分数继续增大时,会使得溶剂的极性降低,减少色素的溶出量,降低色素提取液的吸光度[28-30]。因此,选定乙醇体积分数为80%。
2.4.1 模型建立与方差分析
响应面试验的设计方案与结果如表2所示。利用Design Expert 8.0软件对表中数据进行二次多项式回归拟合,得到吸光度的回归方程为:Y=3.37+0.12A-0.14B+8.38×10-3C-0.32AB-9.00×10-3AC-0.37BC-0.50A2-0.38B2-0.49C2。
表 2 响应面试验设计与结果
Table 2 xperimental design and results for response surface analysis
xperimental design and results for response surface analysis
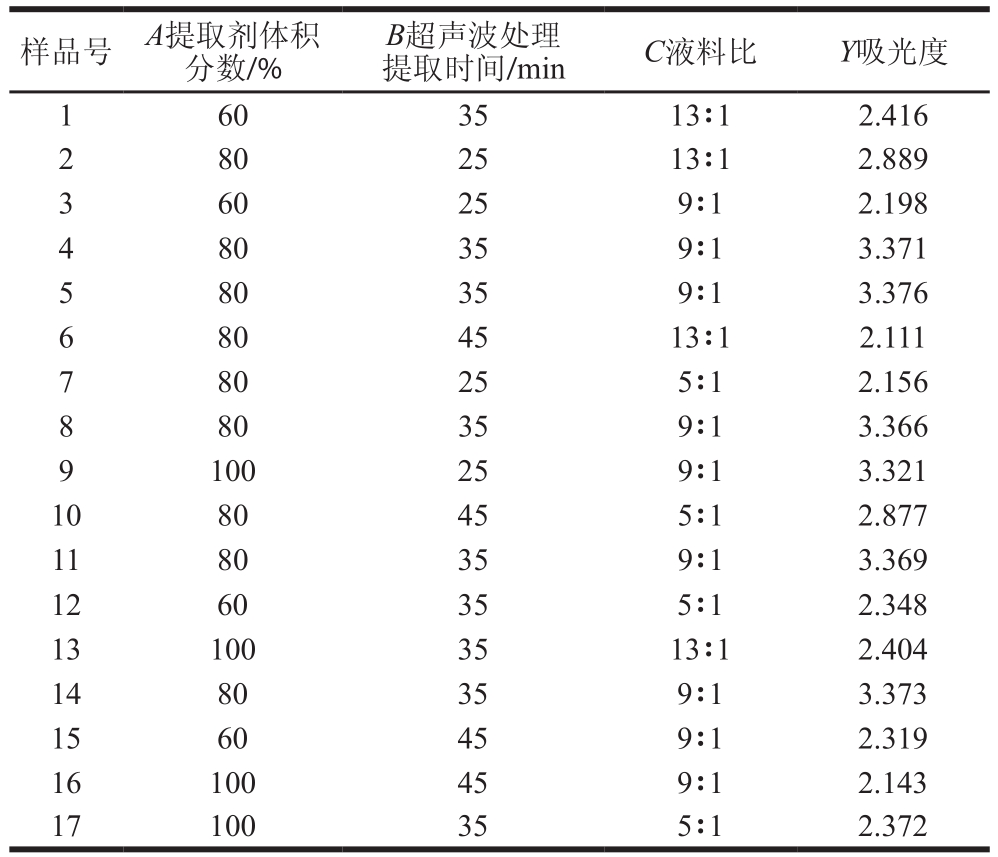
样品号A提取剂体积分数/%B超声波处理提取时间/minC液料比Y吸光度60 35 13∶1 2.416 2 80 25 13∶1 2.889 3 60 25 9∶1 2.198 4 80 35 9∶1 3.371 5 80 35 9∶1 3.376 6 80 45 13∶1 2.111 7 80 25 5∶1 2.156 8 80 35 9∶1 3.366 9 100 25 9∶1 3.321 10 80 45 5∶1 2.877 11 80 35 9∶1 3.369 12 60 35 5∶1 2.348 13 100 35 13∶1 2.404 14 80 35 9∶1 3.373 15 60 45 9∶1 2.319 16 100 45 9∶1 2.143 17 100 35 5∶1 2.372 1
表 3 回归模型方差分析
Table 3 Analysis of variance of regression model

注:**. 极显著(P<0.01)。
方差来源 平方和 自由度 均方和F值P值模型 4.21 9 0.47 13.53 0.001 1**A 0.11 1 0.11 3.40 0.107 7 B 0.15 1 0.16 4.59 0.069 4 C 5.61×10-4 1 5.61×10-41.70×10-2 0.901 1 AB 0.42 1 0.42 12.48 0.009 6**AC 3.24×10-4 1 3.24×10-49.58×10-3 0.924 7 BC 0.56 1 0.56 16.62 0.004 7**A2 1.05 1 1.05 31.12 0.000 8**B2 0.60 1 0.60 17.66 0.004 0**C2 1.00 1 1.60 29.52 0.001 0**残差 0.24 7 3.40×10-2失拟项 0.24 3 7.90×10-2 3 383.25 <0.000 1**纯误差 9.32×10-5 4 2.33×10-5总离差 4.44 16决定系数R2=0.946 7,RS/N=10.933
由表3可知,回归模型和失拟项均极显著(P<0.01),决定系数R2=0.946 7,RS/N=10.933,说明此模型拟合度好,实验误差小,可以利用此模型分析影响因素与响应值之间的关系,并可以确定最佳提取工艺参数。二次项A2、B2、C2均极显著(P<0.01),根据F值确定3 个单因素对提取率的影响大小依次为料液比<乙醇体积分数<超声波处理提取时间。
2.4.2 因素间的交互作用
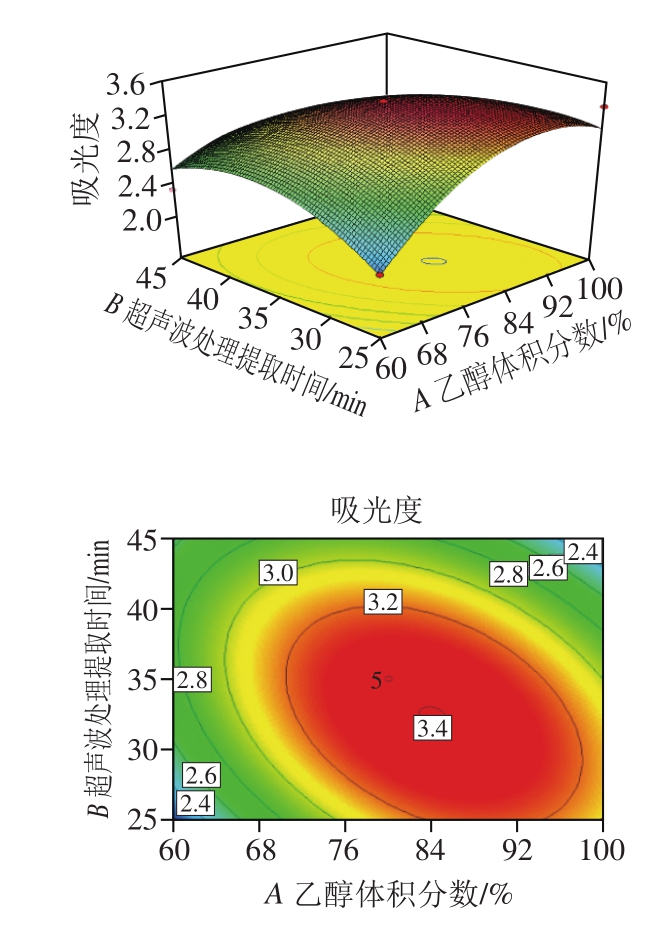
图 6 乙醇体积分数与超声波处理提取时间影响吸光度的响应曲面图和二维等高线图
Fig. 6 Response surface and two-dimensional contour plots showing the influence of ethanol concentration and ultrasonic time on absorbance
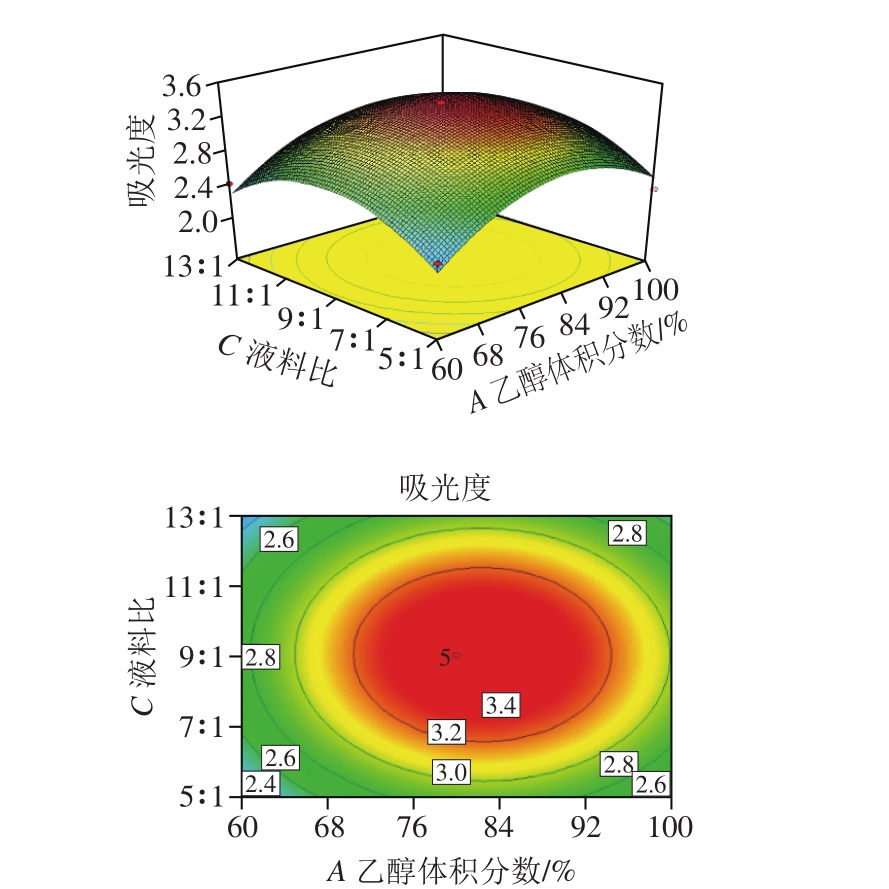
图 7 液料比与乙醇体积分数影响吸光度的响应曲面图和二维等高线图
Fig. 7 Response surface and two-dimensional contour plots showing the influence of solid-to-liquid ratio and ethanol concentration on absorbance
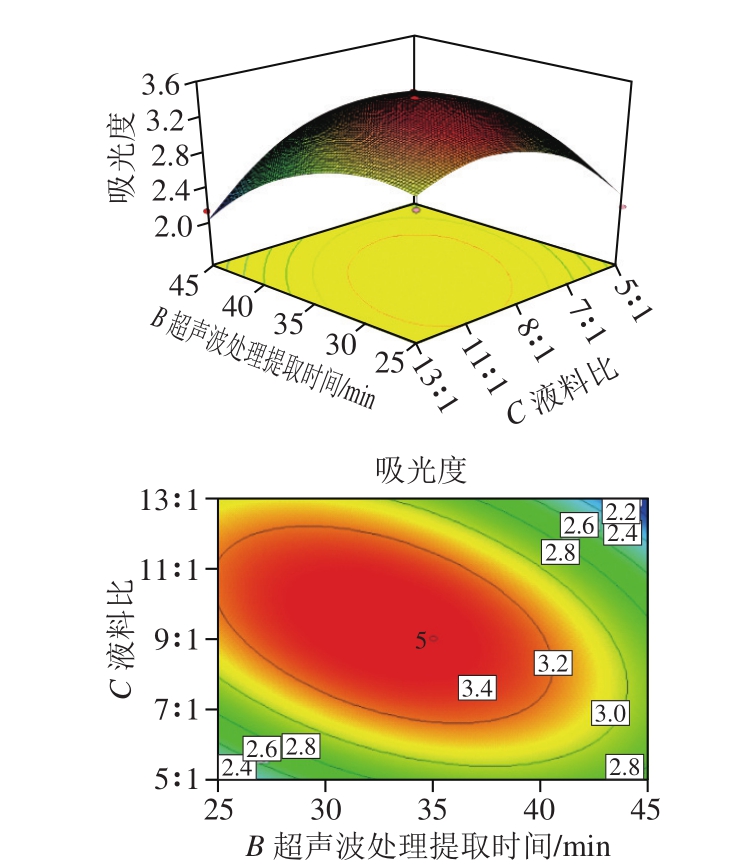
图 8 液料比与超声波处理提取时间影响吸光度的响应曲面图和二维等高线图
Fig. 8 Response surface and two-dimensional contour plots showing the influence of solid-to-liquid ratio and ultrasonic time on absorbance
由图6~8可知,乙醇体积分数与超声波处理提取时间(A、B)、超声波处理提取时间与液料比(B、C)的交互作用对色素提取率的影响均极显著(P<0.01),而乙醇体积分数与液料比(A、C)的交互作用对提取率的影响并不显著(P>0.05)。
2.4.3 回归模型验证
利用Design-Expert软件,对响应面回归方程求偏导,得到本实验的最佳工艺参数为液料比9.58∶1、超声波处理提取时间31.41 min,乙醇体积分数85%,理论吸光度为3.410。为了现实操作的可行性,将提取的最佳工艺条件更正为液料比10∶1、超声波处理提取时间32 min、乙醇体积分数85%,在更正工艺下,重复3 次实验,糖熏熏鸡皮色素吸光度为3.397±0.025,与理论值相差0.38%,说明该优化工艺较为可靠。

图 9 不同超声功率处理时糖熏熏鸡皮色素的紫外-可见光谱图
Fig. 9 UV-visible spectra of sugar-smoked chicken skin pigment obtained with different ultrasonic powers
由图9可知,2 组糖熏熏鸡皮色素的最大吸收峰均在282 nm波长处,说明在本研究的最佳提取工艺下,超声处理并没有影响到该色素的光谱特性,此外,超声功率400 W处理组在此提取条件下的吸光度优于超声功率0 W处理组,说明超声处理有助于糖熏熏鸡皮色素的提取。
以超声波辅助提取糖熏熏鸡皮色素,糖熏熏鸡皮色素最大吸收峰在282 nm波长处。采用响应面法优化提取工艺,各因素对色素提取效果影响大小的排列顺序依次为液料比<乙醇体积分数<超声时间,其中,乙醇体积分数与超声波处理提取时间(A、B)、超声波处理提取时间与液料比(B、C)的交互作用对吸光度影响均极显著(P<0.01)。最优提取条件为液料比10∶1、超声波处理提取时间32 min、乙醇体积分数85%,在此条件下,重复3 次实验,色素吸光度为3.397±0.025,与理论值相差0.38%,表明该工艺合理可行。本研究采用超声辅助提取糖熏熏鸡皮色素,为糖熏熏鸡皮色素的高效提取以及糖熏熏鸡颜色的探究提供相关理论依据。
[1] ANNE V R L, PAUL A, GALLAGHER E I, et al. The effect of temperature during retail display on the colour stability of CO pretreated vacuum packaged beef steaks[J]. Meat Science, 2018, 145:16-22. DOI:10.1016/j.meatsci.2018.05.017.
[2] 孙卫青, 周光宏, 徐幸莲. 切片火腿色泽稳定性的影响因素研究[J]. 食品工业科技, 2011, 32(6): 192-194. DOI:10.13386/j.issn1002-0306.2011.06.066.
[3] 刘君. 熏鸡冷风干燥过程中工艺、品质改良及货架期预测[D]. 无锡: 江南大学, 2013.
[4] 刘登勇, 吴金城, 王继业,等. 沟帮子熏鸡主体风味成分分析[J]. 食品工业科技, 2018, 39(7): 237-242. DOI:10.13386/j.issn1002-0306.2018.07.042.
[5] CHEN Shaun, KAO Tsaihua, CHEN Chiaju, et al. Reduction of carcinogenic polycyclic aromatic hydrocarbons in meat by sugarsmoking and dietary exposure assessment in Taiwan[J]. Journal of Agricultural and Food Chemistry, 2013, 61(31): 7645-7653.DOI:10.1021/jf402057s.
[6] 杨合超. 沟帮子熏鸡的加工制作方法[J]. 肉类研究, 2002, 16(3): 19-20.
[7] CHEN Fang, SUN Yangzhao, ZHAO Guanghua, et al. Optimization of ultrasound-assisted extraction of anthocyanins in red raspberries and identification of anthocyanins in extract using high-performance liquid chromatography-mass spectrometry[J]. Ultrasonics-Sonochemistry,2007, 14(6): 767-778. DOI:10.1016/j.ultsonch.2006.12.011.
[8] CHEN Xi, WEI Zhiqiang, ZHU Lei, et al. Efficient approach for the extraction and identification of red pigment fromZanthoxylum bungeanum Maxim and its antioxidant activity[J]. Molecules, 2018,23(5): 1109-1125. DOI:10.3390/molecules23051109.
[9] ZHU Xingyi, MANG Yili, SHEN Fengqiong, et al. Homogenate extraction of gardenia yellow pigment fromGardenia jasminoides Ellis fruit using response surface methodology[J]. Journal of Food Science and Technology, 2014, 51(8): 1575-1581. DOI:10.1007/s13197-012-0683-2.
[10] MIRHELI M, TAGHIAN DINAIN S. Extraction ofβ-carotene pigment from carrot processing waste using ultrasonic-shaking incubation method[J]. Journal of Food Measurement and Characterization, 2018,12(3): 1818-1828. DOI:10.1007/s11694-018-9796-2.
[11] SHANMIM R, SOMAYEH T D. Lycopene extraction from tomato processing waste using ultrasound and cell-wall degrading enzymes[J].Journal of Food Measurement and Characterization, 2018, 12(4):2394-2403. DOI:10.1007/s11694-018-9856-7.
[12] 海妮·巴音达, 阿不都拉·阿巴斯. 响应面试验优化紫薯皮色素提取工艺及其稳定性分析[J]. 食品科学, 2016, 37(14): 56-61.DOI:10.7506/spkx1002-6630-201614010.
[13] MUTHEZHILAN R, RAGUL R, PUSHPAM A C, et al. Isolation,optimization and extraction of microbial pigments from marine yeastRhodotorula sp (Amby109) as food colourants[J]. Biosciences Biotechnology Research Asia, 2016, 11(1): 271-278. DOI:10.13005/bbra/1420.
[14] SAID F M, HAMID N F B. Optimization of red pigment production byMonascus purpureus FTC 5356 using response surface methodology[J]. Chemical and Biotechnology Engineering, 2018,19(1): 34-47. DOI:10.31436/iiumej.v19i1.814.
[15] YOLMEH M, HABIBI NAJAFI M B, FARHOOSH R. Optimisation of ultrasound-assisted extraction of natural pigment from annatto seeds by response surface methodology (RSM)[J]. Food Chemistry, 2014,155(2): 319-324. DOI:10.1016/j.foodchem.2014.01.059.
[16] CHEN Guangjing, BU Fan, CHEN Xuhui, et al. Ultrasonic extraction,structural characterization, physicochemical properties and antioxidant activities of polysaccharides from bamboo shoots (Chimonobambusa quadrangularis) processing by-products[J]. International Journal of Biological Macromolecules, 2018, 112: 656-666. DOI:10.1016/j.ijbiomac.2018.02.013.
[17] MARAN J P, MANIKANDAN S, NIVETHA C V, et al. Ultrasound assisted extraction of bioactive compounds fromNephelium lappaceum L. fruit peel using central composite face centered response surface design[J]. Arabian Journal of Chemistry, 2017, 10(1): 1145-1157. DOI:10.1016/j.arabjc.2013.02.007.
[18] CHEN Yang, YIN Lizi, ZHAO Ling, et al. Optimization of the ultrasound-assisted extraction of antioxidant phloridzin fromLithocarpus polystachyus Rehd. using response surface methodology[J]. Journal of Separation Science, 2017, 40(22): 4329-4337. DOI:10.1002/jssc.201700686.
[19] HE Bo, ZHANG Longli, YUE Xueyang, et al. Optimization of ultrasound-assisted extraction of phenolic compounds and anthocyanins from blueberry (Vaccinium ashei) wine pomace[J]. Food Chemistry, 2016, 204: 70-76. DOI:10.1016/j.foodchem.2016.02.094.
[20] 赵刚, 顾佳丽, 励建荣. Plackett-Burman设计及响应面法优化芹菜中总黄酮的超声提取工艺[J]. 中国食品学报, 2017, 17(8): 147-155.DOI:10.16429/j.1009-7848.2017.08.020.
[21] VIEIRA G S, PEREIRA L M, HUBINGER M D. Optimisation of osmotic dehydration process of guavas by response surface methodology and desirability function[J]. International Journal of Food Science and Technology, 2015, 47(1): 132-140. DOI:10.1111/j.1365-2621.2011.02818.x.
[22] 刘永, 连纯仪, 韦寿莲, 等. 超声辅助提取柚子黄油胞层黄色素的研究[J]. 食品工业科技, 2015, 36(11): 223-226. DOI:10.13386/j.issn1002-0306.2015.11.037.
[23] ZHANG Shuai, ZHENG Baodong, LIN Liangmei, et al.Microwave-ultrasonic assisted extraction and antioxidant activity of polysaccharides from bamboo shoot shell[J]. Food Science, 2015,36(16): 72-76. DOI:10.7506/spkx1002-6630-201516013.
[24] 刘永, 李新茹, 韦寿莲. 超声辅助提取椰枣核色素的研究[J]. 食品工业, 2018,(5): 148-150.
[25] MARAN J P, PRIYA B. Multivariate statistical analysis and optimization of ultrasound-assisted extraction of natural pigments from waste red beet stalks[J]. Food Science and Technology, 2016, 53(1):792-799. DOI:10.1007/s13197-015-1988-8.
[26] 李红姣, 李巨秀, 赵忠. 响应面试验优化超声波辅助提取山杏种皮黑色素工艺及其抗氧化活性[J]. 食品科学, 2016, 37(18): 26-33.DOI:10.7506/spkx1002-6630-201618005.
[27] LI Tian, LI Haiping, YUAN Yahong, et al. Optimization of ultrasoundvacuum assisted extraction of polyphenols from apple pomace[J].Food Science, 2017, 38(14): 233-239. DOI:10.7506/spkx1002-6630-201714036.
[28] ZHANG Xu, CAO Lijuan, ZHAO QING Yujing, et al. Ultrasonic extraction process of polyphenols from walnut green husk pomace[J].Food Science and Technology, 2016, 41(3): 218-223. DOI:10.13684/j.cnki.spkj.2016.03.044.
[29] PANG T C, SHANG-YING H U, GAN H. Research on stability and antioxidant activity ofRussula pigment by ultrasonic extraction[J].Food and Fermentation Industries, 2015, 41(11): 222-227.DOI:10.13995/j.cnki.11-1802/ts.201511040.
[30] LIU Yong, WEI Shoulian, WU Min, et al. Phenolic compounds from date pits: ultrasonic-assisted extraction, antioxidant activity and component identification[J]. Journal of Food Measurement and Characterization, 2017, 12(2): 1-7. DOI:10.1007/s11694-017-9711-2.
Response Surface Methodology Applied to Optimize the Extraction Process of Pigment from Sugar Smoked Chicken Skin
陆逢贵, 邹玉峰, 刘登勇, 等. 响应面法优化糖熏熏鸡皮色素提取工艺[J]. 肉类研究, 2019, 33(3): 20-25. DOI:10.7506/rlyj1001-8123-20190107-006. http://www.rlyj.net.cn
LU Fenggui, ZOU Yufeng, LIU Dengyong, et al. Response surface methodology applied to optimize the extraction process of pigment from sugar smoked chicken skin[J]. Meat Research, 2019, 33(3): 20-25. DOI:10.7506/rlyj1001-8123-20190107-006. http://www.rlyj.net.cn