6 种农业特种养殖动物肉中18 种氨基酸含量分析
辛丽娜1,刘常凯1,何林飞1,袁榕穗2,陈圣杰3,王 捷4,*
(1.广西-东盟食品药品安全检验检测中心,广西 南宁 530021;2.广西壮族自治区食品药品审评查验中心,广西 南宁 530029 ;3.广西医科大学药学院,广西 南宁 530021;4.广西医科大学制药厂,广西 南宁 530021)
摘 要:针对目前国内新兴的6 种农业特种养殖动物,即蓝孔雀、眼镜蛇、滑鼠蛇、海蛇、海龙和海星,探讨6 种动物肉中18 种氨基酸含量的检测方法。运用全自动氨基酸分析仪法测定上述6 种动物的18 种氨基酸含量,样品经90%乙醇沉淀蛋白质后用6 mol/L盐酸溶液水解22 h后离心,上清液氮吹干,用样品稀释液复溶,过滤膜上机检测。以柠檬酸钠和氢氧化钠溶液为流动相进行梯度洗脱,荧光检测器测定,除脯氨酸(Pro)检测波长为440 nm外,其余17 种氨基酸检测波长均为570 nm。结果表明:除胱氨酸质量浓度范围为1.6~8.0 mg/L、牛磺酸为2.0~10.0 mg/L外,其余16 种氨基酸质量浓度范围为3.2~16.0 mg/L时线性良好(r=0.998 5~0.999 9);方法检出限为0.04~0.42 mg/L;低质量浓度(16 种氨基酸质量浓度为6.4 mg/L,胱氨酸为3.2 mg/L,牛磺酸为4.0 mg/L)条件下的加标回收率为96.11%~109.76%,相对标准偏差(relative standard deviation,RSD)为0.14%~1.62%,高质量浓度(16 种氨基酸质量浓度为12.8 mg/L,胱氨酸为6.4 mg/L,牛磺酸为8.0 mg/L)条件下的加标回收率为96.12%~104.13%,RSD为0.11%~1.88%;精密度RSD为0.08%~0.94%,稳定性RSD为0.16%~0.97%,重复性RSD为0.09%~0.91%。表明该方法快速易行、准确可靠,可用于蓝孔雀、眼镜蛇、滑鼠蛇、海蛇、海龙和海星的检验方法优化。
关键词:蓝孔雀;眼镜蛇;滑鼠蛇;海蛇;海龙;海星;牛磺酸;氨基酸
蓝孔雀、眼镜蛇、滑鼠蛇、海蛇、海龙和海星为我国近年来新兴的农业特种养殖动物,国家政策鼓励和支持特种养殖动物的研究开发利用及产业发展,减少对野生资源的依赖,具有保护野生动物和生态意义。同时,上述6 种动物是我国传统中医药药材及特色食材。我国明朝李时珍《本草纲目》收载孔雀,曰其辟恶,解大毒、中毒、药毒。服食孔雀后,服药必不效,为其解毒也[1-3]。西汉《神农木草经》和唐代《本草拾遗》记载蛇,均曰其祛风燥湿、通络活血,用于治疗风湿痹痛、四肢麻术等。我国民间自古有南人嗜蛇的说法。滑鼠蛇蛇肉中所含的亮氨酸、赖氨酸、丙氨酸及缬氨酸为人体必需氨基酸,所含的谷氨酸使蛇肉清香味美,还能够增强脑细胞活力,帮助记忆[4-5]。眼镜蛇肉质细腻、滋味鲜美、祛风除湿、舒筋活络,主治风湿性关节炎、无名疼痛等,是深受人们喜爱的可用于强身壮体的美味佳肴[6-7]。海蛇,味辛、咸、性平,归肝、肾经,祛风止痛、通络活血、滋补强壮等,用于治疗风湿痹病、四肢麻木、关节疼痛及疥癣恶疮等[8]。海龙可降低呼吸中枢兴奋性,使呼吸运动趋于安静而呈现镇咳和平喘作用,海龙可强精益气,主治四肢发冷、水肿的肾阳虚证[9-11]。海星可抗菌、降血压、降血糖、抗疲劳、抗炎、促骨细胞生长、抗骨质疏松及调节生殖发育等[12]。牛磺酸可以调节机体糖类和脂类代谢、加强心脏功能、增强体质、消除疲劳和提高机体免疫力,尤其是可以改善学习记忆能力。随着现代科技和医学发展,人们日益认识到这6 种资源较高的营养、保健及医药价值,因其利于健康和防治疾病,市场需求不断上升,推动了产业发展。
目前,检测氨基酸的方法主要有高效液相色谱(high performance liquid chromatography,HPLC)[13-15]、HPLC-串联质谱(HPLC-tandem mass spectrometry,HPLC-MS/MS)[16-18]和全自动氨基酸分析仪测定法[19-21]。全自动氨基酸分析仪的优点[22]在于采用在线衍生和氮气全封闭系统,可获得较高灵敏度、较低检出限和较好重现性。之前未见报道用全自动氨基酸分析仪测定蓝孔雀、眼镜蛇和滑鼠蛇肉中牛磺酸的含量,本研究运用全自动氨基酸分析仪法测定上述6 种动物肉中包括牛磺酸在内的18 种氨基酸的含量。
1 材料与方法
1.1 材料与试剂
人工养殖蓝孔雀肉干粉 广西龙凤谷农业种植养殖场;人工养殖眼镜蛇的活蛇样品和滑鼠蛇的活蛇样品及肉干粉样品 广西灵山龙璇蛇业有限公司;海蛇、海龙、海星 钦州市嘉园农商开发有限公司;将眼镜蛇、滑鼠蛇活蛇样品安乐死,洗净并吸干表面水分,去皮及内脏,拆去蛇骨,剩余为实验用的纯蛇肉,以上样品均为6 个批次。
氨基酸混合标准溶液(包括天冬氨酸、苏氨酸、丝氨酸、谷氨酸、脯氨酸、甘氨酸、丙氨酸、胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、赖氨酸、组氨酸和精氨酸,共17 种,除胱氨酸含量为1.25 μmol/mL外,其余16 种氨基酸含量均为2.50 μmol/mL) 德国Sigma-Aldrich公司;牛磺酸标准物质(纯度99.0%) 上海安谱实验科技股份有限公司。
盐酸(优级纯)、乙酸锌、亚铁氰化钾(均为分析纯)国药集团化学试剂有限公司;0.04 mol/L柠檬酸钠缓冲液(pH 3.45)、0.5 mol/L氢氧化钠再生溶液、样品稀释液(0.12 mol/L盐酸溶液,pH 2.20)、茚三酮(均为色谱纯) 德国Sykam公司;高纯氮气(纯度99.99%) 广西瑞达化工技术有限公司;超纯水(电阻率18.2 MΩ·cm) 实验室自制。
1.2 仪器与设备
S433D全自动氨基酸分析仪 德国Sykam公司;XS205DU电子天平 瑞士Mettler Toledo公司;G560E快速混匀器 美国Scientific Industries有限公司;N-EVAP 112氮吹仪 美国Organomation Associates公司;Milli-Q超纯水仪 美国Millipore公司;韩国大韩WEB-6水浴锅苏州安创仪器有限公司;S120H超声波发生器 德国Elma公司。
1.3 方法
1.3.1 色谱条件
色谱柱:磺酸型阳离子交换树脂;分离柱:不锈钢柱(4.6 mm×60 mm,7 μm),填充交换树脂,型号:No.855-3506(强酸型#2622SC-PH,日立);柱温57 ℃;流动相流速0.40 mL/min;反应柱:不锈钢柱(4.6 mm×40 mm,7 μm),填充石英砂,型号:No.855-3523(日立);反应器温度135 ℃;茚三酮流速0.35 mL/min;进样量50 μL;检测波长:脯氨酸在440 nm波长处测定,其余16 种氨基酸和牛磺酸在570 nm波长处测定;流动相梯度洗脱程序如表1所示。
表1 流动相梯度洗脱程序
Table 1 Mobile phase gradient program
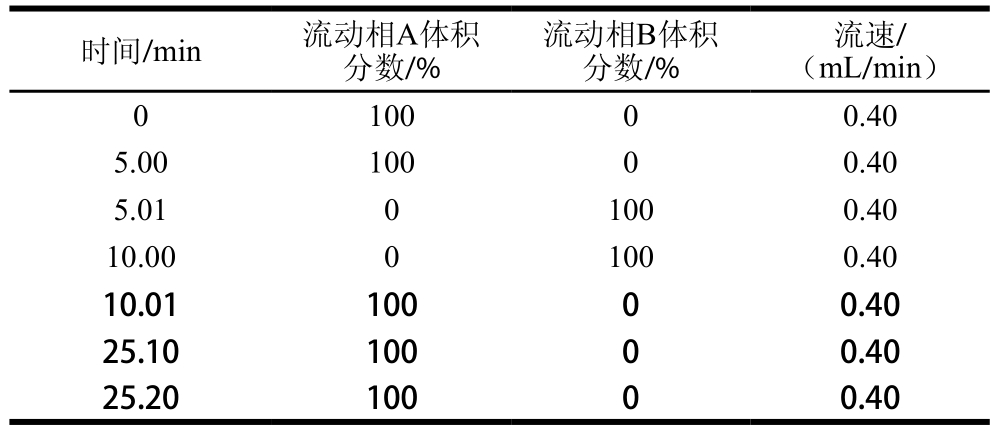
注:流动相A为0.04 mol/L柠檬酸钠溶液(pH 3.45),流动相B为0.5 mol/L氢氧化钠再生溶液。
时间/min 流动相A体积分数/%流动相B体积分数/%流速/(mL/min)0 100 0 0.40 5.00 100 0 0.40 5.01 0 100 0.40 10.00 0 100 0.40 10.01 100 0 0.40 25.10 100 0 0.40 25.20 100 0 0.40
1.3.2 样品前处理
眼镜蛇鲜肉和滑鼠蛇鲜肉分别取2.0 g,加入90%乙醇沉淀蛋白后,加10 mL 6 mol/L HCl溶液均质粉碎均匀后转移至水解管中,补足10 mL 6 mol/L HCl溶液;充入氮气将水解管中的氧气赶净后立即密封,置烘箱中110 ℃水解22 h后取出;放置至室温,测得其pH值约为4.9;转移至离心管中,10 000 r/min离心5 min,取上清液5.0 mL水浴蒸干,用样品稀释液复溶至5.0 mL。
蓝孔雀肉干粉、滑鼠蛇肉干粉、海蛇肉干粉、海龙肉干粉和海星肉干粉分别称取2.0 g,加入90%乙醇沉淀蛋白后,加10 mL 6 mol/L HCl溶液,置于水解管中,充入氮气将水解管中的氧气赶净后立即密封,置烘箱中110 ℃水解22 h后取出;放置至室温,测得其pH值约为6.6;用6 mol/L HCl溶液调节pH值至5.0±0.2后转移至离心管中,10 000 r/min离心5 min,取上清液5.0 mL水浴蒸干,用样品稀释液复溶至5.0 mL。
1.3.3 标准溶液的配制
精密称取牛磺酸标准品100.0 mg,置于10 mL容量瓶中,用超纯水定容,摇匀,配制成质量浓度为10 mg/mL的标准储备溶液。取牛磺酸标准储备溶液1 mL置于50 mL容量瓶中,用样品稀释液定容,摇匀,配制成质量浓度为200 μg/mL的标准工作溶液,置于4 ℃冰箱中1 个月,备用。
分别精密量取牛磺酸标准工作溶液和氨基酸混合标准溶液0.1、0.2、0.3、0.4、0.5 mL,分别加入到10 mL容量瓶中,用样品稀释液稀释成不同质量浓度的系列混合标准溶液。
1.3.4 氨基酸含量测定
对蓝孔雀等6 种动物肉各6 个批次进行游离氨基酸含量测定及分析,按照公式(1)~(2)计算。
1.3.5 回收率实验
取蓝孔雀肉干粉样品,将其作为空白基质,加入低质量浓度混合标准溶液(16 种氨基酸质量浓度为6.4 mg/L,胱氨酸质量浓度为3.2 mg/L,牛磺酸质量浓度为4.0 mg/L)和高质量浓度混合标准工作溶液(16 种氨基酸质量浓度为12.8 mg/L,胱氨酸质量浓度为6.4 mg/L,牛磺酸质量浓度为8.0 mg/L),按照1.3.2节的方法处理样品,分别进行3 次平行实验,测定相应的峰面积,计算平均回收率和相对标准偏差(relative standard deviation,RSD)。
1.3.6 精密度实验
精密吸取同一批蓝孔雀样品溶液,按照1.3.1节中的色谱条件,进样50 μL,平行测定5 次。分别测定18 种氨基酸的含量,计算RSD,考察方法的精密度。
1.3.7 稳定性实验
精密吸取同一批蓝孔雀样品溶液,在0、2、4、6、8 h各进样50 μL,分别测定18 种氨基酸的含量,计算RSD,考察方法的稳定性。
1.3.8 重复性实验
均匀称取蓝孔雀样品6 份,每份1.00 g,按照1.3.2节的方法处理样品,分别测定18 种氨基酸的含量,计算RSD,考察方法的重复性。
2 结果与分析
2.1 样品前处理条件的优化
眼镜蛇鲜肉和滑鼠蛇鲜肉均为鲜肉样品,计算结果按干基折算。经过反复实验,鲜肉样品的pH值为6.1,肉干粉样品性状已经为干基,肉干粉的pH值为6.8,根据氨基酸分析仪特性和氨基酸结构特点,最后上机样品需为酸性,pH值3.5~4.5,此时对氨基酸的分离效果比较好。
表2 不同沉淀剂对样品蛋白质的去除效果
Table 2 Efficiency of deproteinization with different precipitants

沉淀剂名称 用量/mL 沉淀剂去除鲜肉中蛋白质时的现象沉淀剂去除肉干粉中蛋白质时的现象 结果比较90%乙醇 2.0部分絮状物出现,离心分层,可见少量颗粒大量絮状物出现,离心分层鲜肉蛋白沉淀效果不如肉干粉,鲜肉基质基线比肉干粉波动大一些,但总体上2 种基质基线均平稳乙酸锌和亚铁氰化钾 各2.0部分絮状物出现,离心分层,可见少量颗粒大量絮状物出现,离心分层鲜肉蛋白沉淀效果不如肉干粉,2 种基质基线无差别,均较毛躁
由表2可知,鲜肉和肉干粉水解后的状态不同,酸碱性不同,氨基酸水解出来的程度也会不同,因此样品经过水解后的水解液需要测定pH值。同时,无论鲜肉还是肉干粉,样品本身均含蛋白质、脂肪等大分子物质,若上机前不进行去除,杂质会干扰目标峰,影响积分,造成定量不准确。因此,本研究采用2 种不同的样品前处理方法进行考察。
方法1:目前,去除蛋白质的常用溶剂为乙酸锌和亚铁氰化钾溶液[23-25],本研究考察这2 种沉淀剂对鲜肉样品和肉干粉样品中蛋白质的沉淀效果[26-28]。称取样品1.0 g,分别加入上述2 种沉淀剂。由表2可知,乙酸锌和亚铁氰化钾溶液能够很好地去除蛋白质。去除蛋白质等杂质后的样品加入10 mL 6 mol/L HCl溶液进行水解[29-31]。
方法2:常规氨基酸分析仪用90%乙醇溶液对鲜肉样品和肉干粉样品中的蛋白质等大分子物质进行沉淀去除,结果如表2所示。去除蛋白质后的样品经过氮吹干,加入10 mL 6 mol/L HCl溶液,置于水解管中进行水解。
方法1中的乙酸锌和亚铁氰化钾溶液虽然蛋白质沉淀效果较好,但是经过上机发现,各氨基酸的基线不稳,比较毛躁,且目标峰响应值不高,仍有部分杂质峰干扰,原因可能是乙酸锌和亚铁氰化钾影响色谱柱对目标峰的分离。本研究所用色谱柱为阳离子交换柱,上述2 种沉淀剂均含有阳离子,会使得色谱柱柱效降低,进而导致游离氨基酸总量检测不准确。方法2中大部分蛋白质在90%乙醇中变性,再经过酸水解后也能去除一部分蛋白质,使氨基酸肽链断开,各氨基酸基线平稳,目标峰响应值较高,峰形较好,杂质干扰少。综上所述,本研究采用方法2进行样品前处理。
2.2 方法的线性关系及检出限
表3 18 种氨基酸的回归方程、相关系数、线性范围和检出限
Table 3 Regression equations , linear ranges, correlation coefficients and detection limits for 18 amino acids

氨基酸名称回归方程相关系数(r)线性范围/(mg/L)检出限/(mg/L)Asp(天冬氨酸) y=80.15x+50.75 0.999 8 3.2~16.0 0.17 Thr(苏氨酸) y=83.00x+30.53 0.999 7 3.2~16.0 0.15 Ser(丝氨酸) y=85.21x+42.02 0.998 9 3.2~16.0 0.13 Glu(谷氨酸) y=87.40x+50.43 0.999 2 3.2~16.0 0.25 Pro(脯氨酸) y=31.26x+53.94 0.999 9 3.2~16.0 0.50 Gly(甘氨酸) y=80.71x+10.31 0.999 8 3.2~16.0 0.13 Ala(丙氨酸) y=85.47x+55.37 0.998 8 3.2~16.0 0.17 Gys(胱氨酸) y=92.40x+39.60 0.998 5 1.6~8.0 0.32 Val(缬氨酸) y=84.32x+74.58 0.999 2 3.2~16.0 0.12 Met(蛋氨酸) y=83.62x+28.61 0.999 6 3.2~16.0 0.25 Ile(异亮氨酸) y=84.20x+14.17 0.999 8 3.2~16.0 0.20 Leu(亮氨酸) y=86.37x+25.13 0.999 4 3.2~16.0 0.19 Tyr(酪氨酸) y=87.28x+3.02 0.999 7 3.2~16.0 0.32 Phe(苯丙氨酸) y=82.87x+13.53 0.999 1 3.2~16.0 0.26 Lys(赖氨酸) y=87.71x+204.30 0.998 9 3.2~16.0 0.04 His(组氨酸) y=77.52x+482.50 0.998 6 3.2~16.0 0.24 Arg(精氨酸) y=77.61x+135.70 0.999 1 3.2~16.0 0.09 Tau(牛磺酸) y=366.66x+115.37 0.999 7 2.0~10.0 0.42
对1.3.3节的系列混合标准溶液按照优化所得色谱条件依次进样分析,以质量浓度为横坐标(x)、峰面积为纵坐标(y),绘制标准曲线。检出限采用某一已知含量的样品溶液来计算,当信噪比为3时,测定各氨基酸的检出限。
由表3可知,18 种氨基酸的峰面积与其质量浓度均呈良好的线性关系,相关系数r为0.998 5~0.999 9。除胱氨酸质量浓度范围为1.6~8.0 mg/L、牛磺酸为2.0~10.0 mg/L外,其余16 种氨基酸质量浓度范围均为3.2~16.0 mg/L时线性良好;方法检出限为0.04~0.42 mg/L。
2.3 方法回收率、精密度、稳定性及重复性
表4 18 种氨基酸的回收率、精密度、稳定性及重复性
Table 4 Recovery, precision, repeatability and stability in determination of 18 amino acids
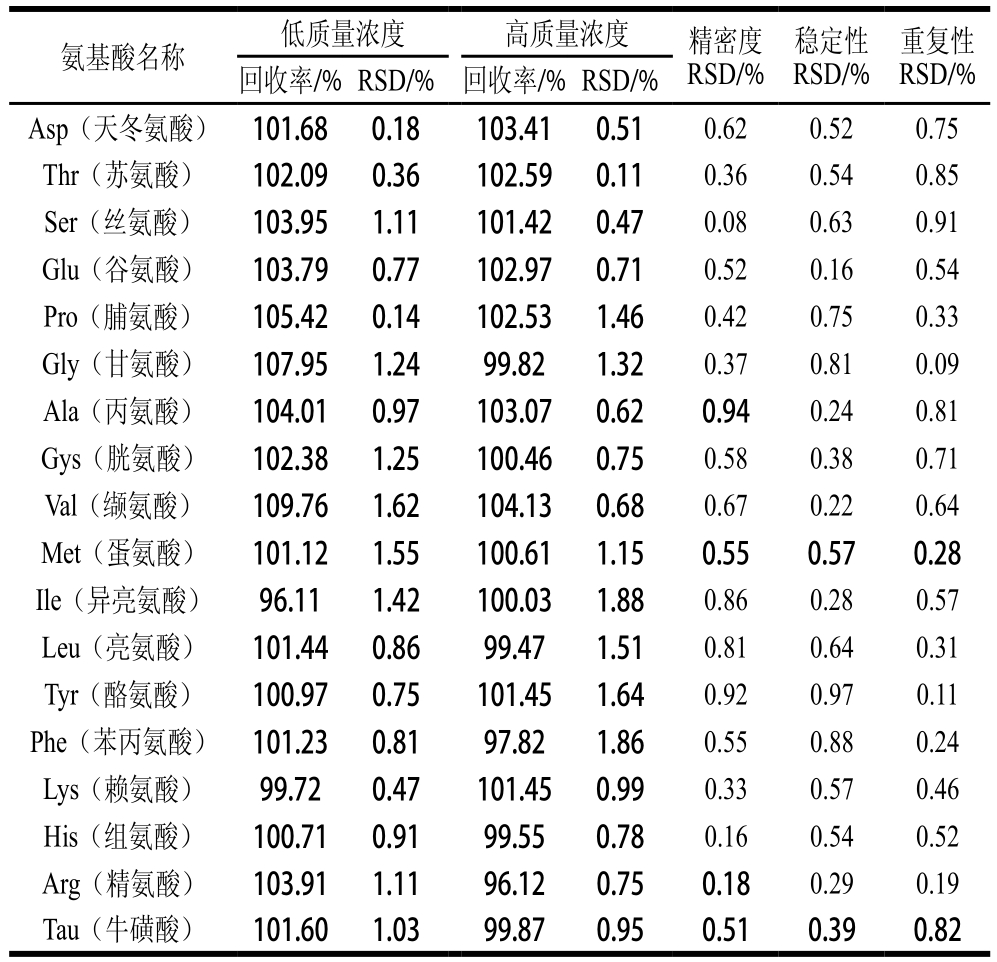
氨基酸名称 低质量浓度 高质量浓度 精密度RSD/%稳定性RSD/%重复性RSD/%回收率/%RSD/% 回收率/%RSD/%Asp(天冬氨酸) 101.68 0.18 103.41 0.51 0.62 0.52 0.75 Thr(苏氨酸) 102.09 0.36 102.59 0.11 0.36 0.54 0.85 Ser(丝氨酸) 103.95 1.11 101.42 0.47 0.08 0.63 0.91 Glu(谷氨酸) 103.79 0.77 102.97 0.71 0.52 0.16 0.54 Pro(脯氨酸) 105.42 0.14 102.53 1.46 0.42 0.75 0.33 Gly(甘氨酸) 107.95 1.24 99.82 1.32 0.37 0.81 0.09 Ala(丙氨酸) 104.01 0.97 103.07 0.62 0.94 0.24 0.81 Gys(胱氨酸) 102.38 1.25 100.46 0.75 0.58 0.38 0.71 Val(缬氨酸) 109.76 1.62 104.13 0.68 0.67 0.22 0.64 Met(蛋氨酸) 101.12 1.55 100.61 1.15 0.55 0.57 0.28 Ile(异亮氨酸) 96.11 1.42 100.03 1.88 0.86 0.28 0.57 Leu(亮氨酸) 101.44 0.86 99.47 1.51 0.81 0.64 0.31 Tyr(酪氨酸) 100.97 0.75 101.45 1.64 0.92 0.97 0.11 Phe(苯丙氨酸) 101.23 0.81 97.82 1.86 0.55 0.88 0.24 Lys(赖氨酸) 99.72 0.47 101.45 0.99 0.33 0.57 0.46 His(组氨酸) 100.71 0.91 99.55 0.78 0.16 0.54 0.52 Arg(精氨酸) 103.91 1.11 96.12 0.75 0.18 0.29 0.19 Tau(牛磺酸) 101.60 1.03 99.87 0.95 0.51 0.39 0.82
由表4可知:低质量浓度条件下的加标回收率为96.11%~109.76%,RSD为0.14%~1.62%,高质量浓度条件下的加标回收率为96.12%~104.13%,RSD为0.11%~1.88%;精密度RSD为0.08%~0.94%;稳定性RSD为0.16%~0.97%;重复性RSD为0.09~0.91%。表明此方法的准确性高,精密度、稳定性及重复性均较好。
2.4 样品测定结果
鲜肉所含水分对检测结果会有影响,所以鲜肉的氨基酸和牛磺酸含量最终结果均按干燥品计算。通过实验,测得眼镜蛇鲜肉和滑鼠蛇鲜肉的水分含量分别为67.85%和69.51%,可见鲜肉中所含水分较大会导致样品结果差异也较大,因此在进行结果计算时,应扣除水分后得到准确结果。
由表5可知,蓝孔雀和滑鼠蛇鲜肉以及海蛇肉干粉的氨基酸总量和牛磺酸含量均较高,虽然不同样品的氨基酸总量和牛磺酸含量有所不同,但结果均高于方法检出限,因此,这些样品原料所含成分具有一定的药用价值,对今后保健品行业也有一定的参考作用。
表5 6 种动物中18 种氨基酸含量测定结果
Table 5 Contents of 18 amino acids in meat from 6 farm animal species g/100 g

海星肉干粉Asp(门冬氨酸) 1.24±0.02 1.18±0.05 6.48±0.01 5.39±0.10 5.33±0.12 4.40±0.08 2.81±0.07 Thr(苏氨酸) 0.58±0.11 0.56±0.04 2.92±0.08 2.55±0.20 2.24±0.04 1.86±0.02 1.58±0.16 Ser(丝氨酸) 0.60±0.07 0.50±0.13 3.10±0.03 2.38±0.08 3.41±0.07 1.94±0.13 1.35±0.09 Glu(谷氨酸) 1.98±0.03 1.93±0.0910.47±0.119.17±0.04 8.86±0.01 5.77±0.02 3.45±0.05 Pro(脯氨酸) 0.62±0.08 0.57±0.03 3.82±0.05 3.76±0.02 6.01±0.17 4.48±0.06 2.17±0.02 Gly(甘氨酸) 0.94±0.04 0.82±0.12 5.81±0.09 6.10±0.07 9.88±0.14 8.94±0.19 2.36±0.01 Ala(丙氨酸) 1.77±0.09 0.76±0.03 4.36±0.04 4.35±0.16 5.39±0.09 4.47±0.07 1.40±0.10 Gys(胱氨酸) 0.18±0.07 0.17±0.22 0.73±0.17 0.44±0.11 1.11±0.03 1.02±0.06 1.20±0.05 Val(缬氨酸) 0.73±0.10 0.63±0.05 3.26±0.02 2.75±0.01 2.40±0.11 1.77±0.14 1.13±0.17 Met(蛋氨酸) 0.35±0.16 0.32±0.20 1.67±0.12 1.44±0.05 1.43±0.07 1.28±0.04 0.97±0.03 Ile(异亮氨酸) 0.58±0.05 0.58±0.09 3.09±0.05 2.55±0.08 2.34±0.10 1.39±0.06 1.15±0.08 Leu(亮氨酸) 0.98±0.13 0.96±0.04 5.17±0.07 4.43±0.23 4.11±0.15 2.21±0.09 1.83±0.25 Tyr(酪氨酸) 0.45±0.21 0.43±0.24 2.26±0.11 1.72±0.19 1.28±0.07 0.96±0.02 0.76±0.06 Phe(苯丙氨酸) 0.55±0.06 0.51±0.11 2.96±0.08 2.77±0.01 2.35±0.04 1.66±0.08 0.86±0.15 Lys(赖氨酸) 1.15±0.08 1.13±0.03 5.73±0.09 4.84±0.18 4.30±0.14 2.51±0.05 1.82±0.02 His(组氨酸) 0.37±0.12 0.36±0.05 1.83±0.20 1.35±0.06 1.04±0.01 0.88±0.10 0.21±0.09 Arg(精氨酸) 0.88±0.15 0.84±0.14 4.67±0.06 4.53±0.20 4.98±0.17 3.84±0.08 1.80±0.02 Tau(牛磺酸) 0.06±0.01 0.06±0.04 0.43±0.13 0.13±0.08 0.32±0.10 0.06±0.07 0.14±0.03氨基酸总量 12.99±0.0412.32±0.0968.33±0.1660.52±0.1166.46±0.0649.38±0.0226.85±0.01氨基酸名称 眼镜蛇鲜肉滑鼠蛇鲜肉滑鼠蛇肉干粉蓝孔雀肉干粉海蛇肉干粉海龙肉干粉
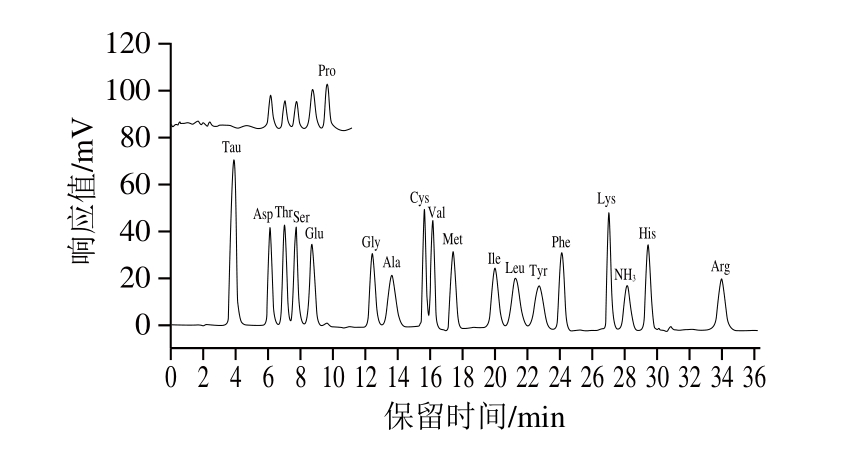
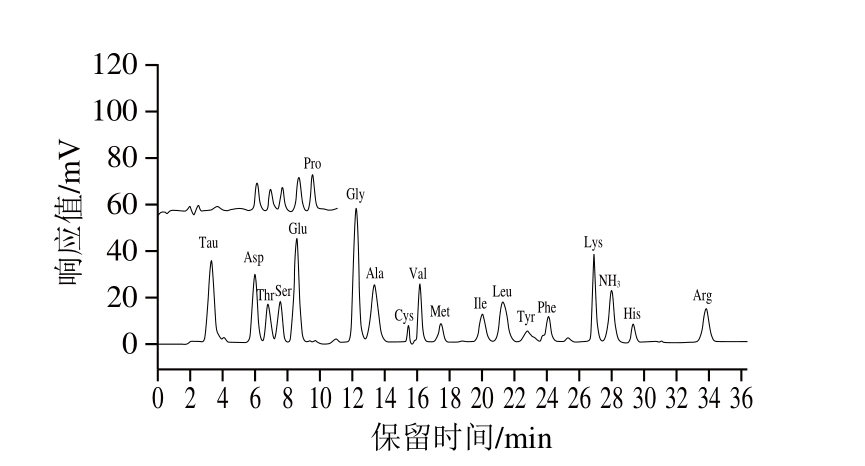
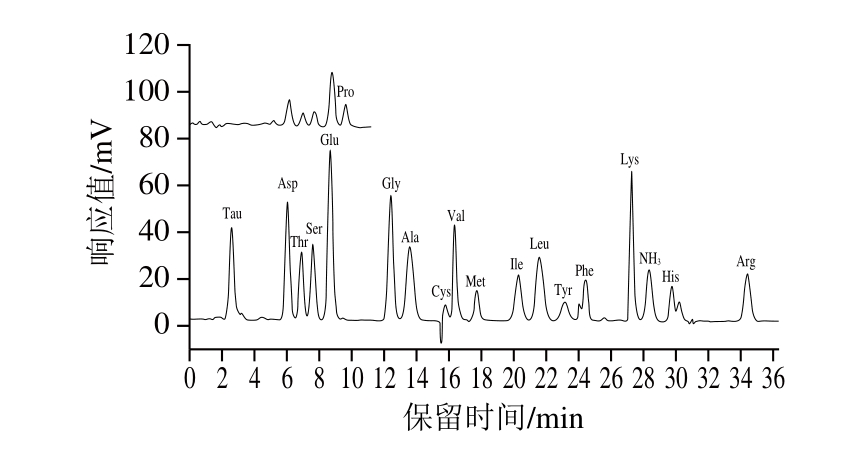
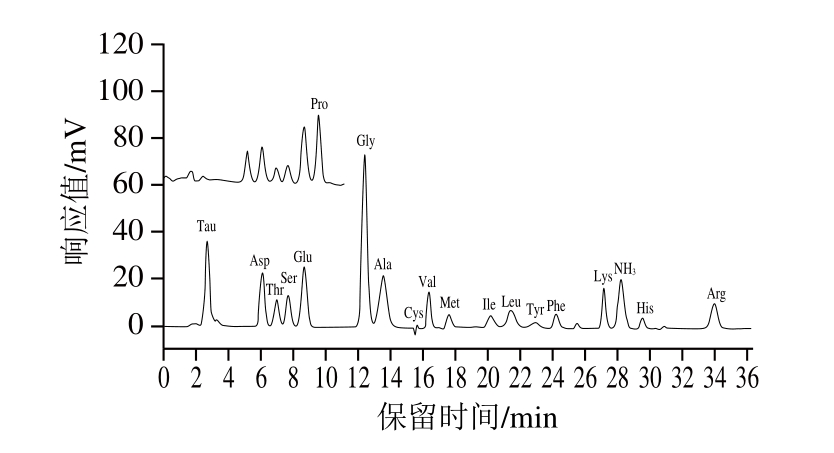
18 种氨基酸标准溶液和6 种动物肉实际样品的色谱图如图1~7所示。由图可知,样品均检出18 种氨基酸,且均能达到很好的分离,峰型也较好。
3 结 论
本方法建立在全自动氨基酸分析仪基础上,对6 种农业特种养殖动物肉的药用价值进行探究,检测出18 种氨基酸,能够为保健品行业提供很好的数据资料。同时,本方法操作简单、便捷、实用性强,实现了全自动氨基酸分析仪对蓝孔雀、眼镜蛇、滑鼠蛇、海蛇、海龙及海星肉中18 种氨基酸含量的快速测定,为今后检测蓝孔雀肉、海蛇肉等动物的包括牛磺酸在内的18 种氨基酸含量提供了参考依据。
参考文献:
[1] 邹琦, 刘伟石, 田秀华, 等. 成年蓝孔雀冬季日粮蛋白质水平与营养质代谢率的测定[J]. 东北林业大学学报, 2003, 31(6): 43-45.DOI:10.13759/j.cnki.dlxb.2003.06.015.
[2] 卢广林, 孙淑霞. 孔雀饲养管理要点[J]. 中国家禽, 2011, 33(12): 50-51.DOI:10.16372/j.issn.1004-6364.2011.12.027.
[3] 郭爱伟. 几种主要特种禽类营养研究现状[J]. 经济动物学报, 2009,13(3): 165-167; 182. DOI:10.13326/j.jea.2009.03.011.
[4] 陈祖发. 滑鼠蛇德尔人工孵化及幼蛇的饲养[J]. 蛇志, 2005, 17(1):20-22.
[5] 赵晓华, 严若谷, 李其斌. 养殖与野生滑鼠蛇蛇肉营养成分比较分析[J]. 蛇志, 2013, 25(1): 13-14.
[6] 谭群英, 郭天国, 龚新国, 等. 眼镜蛇的人工驯养繁殖技术研究[J].蛇志, 2009, 21(3): 183-186.
[7] 严若谷, 赵晓华, 李其斌, 等. 养殖与野生的中华眼镜蛇蛇肉营养成分比较分析[J]. 蛇志, 2013, 25(3): 260-261.
[8] 王宁宁, 翟华强, 戴莹, 等. 药用蛇的历史源流及海蛇药用发展展望[J]. 山东中医杂志, 2018, 37(6): 521-523. DOI:10.16295/j.cnki.0257-358x.2018.06.024.
[9] 李春香, 邹国林, 边洪荣, 等. 海洋药用动物尖海龙的研究概况[J]. 中药材, 2001(9): 686-688. DOI:10.13863/j.issn1001-4454.2001.09.037.
[10] 刘冬玲, 卢振. 药用海洋动物海龙的研究概述[J]. 时珍国医国药,2005(9): 918-919.
[11] 李春香, 边洪荣, 邹国林. 海洋药用动物海龙的研究[J]. 氨基酸和生物资源, 2001(2): 6-9 DOI:10.14188/j.ajsh.2001.02.002.
[12] 吕晓静. 海星质量标准建立及其提取物对成骨细胞影响[D]. 大连:大连理工大学, 2015: 1.
[13] 李丽莉. 几种海产品中氨基酸及牛磺酸含量的比较[J]. 氨基酸和生物资源, 1999, 21(2): 25-26. DOI:10.14188/j.ajsh.1999.02.010.
[14] 雒丽娜, 王颖, 张妮娜, 等. 食品中牛磺酸测定方法比较[J]. 中国卫生检验杂志, 2015, 25(19): 3407-3408.
[15] 王海澍. 高效液相色谱法测定牡蛎中牛磺酸含量[J]. 食品安全导刊,2017(3): 90. DOI:10.16043/j.cnki.cfs.2017.03.064.
[16] 康明芹, 陈明岩, 王岸英, 等. 高效液相色谱串联质谱法直接测定功能性饮料中的牛磺酸[J]. 粮食与油脂, 2018, 31(7): 98-100.
[17] 张婷, 陈雷, 刘芸, 等. 高效液相色谱-高分辨质谱法测定乳粉中的牛磺酸[J]. 食品安全质量检测学报, 2017, 8(6): 2086-2090.
[18] 李鹏飞, 陶蓓蓓, 张绪得, 等. 高效液相色谱-串联质谱法测定人体内30 种氨基酸[J]. 分析化学, 2013, 41(9): 1347-1352.
[19] 蔡梅, 吉文亮, 刘华良, 等. 氨基酸自动分析仪对食品中牛磺酸快速测定方法研究[J]. 中国卫生检验杂志, 2013, 23(1): 41-45.
[20] 张燕婉. 氨基酸分析仪法测定肉食品中牛磺酸含量[J]. 肉类研究,1996, 10(1): 37-39; 47.
[21] 王洪健, 周兴起, 冯志强, 等. 氨基酸自动分析仪测定食品中牛磺酸的方法建立[J]. 现代食品科技, 2012, 28(3): 348-350. DOI:10.13982/j.mfst.1673-9078.2012.03.011.
[22] 秦菁, 魏鲜娥, 蔡伟江, 等. 全自动氨基酸分析仪测定支链氨基酸粉中牛磺酸的含量[J]. 食品安全质量检测学报, 2017, 8(5): 1883-1887.
[23] 王定坤, 冯志强, 文灿, 等. 全脂奶粉中蛋白质和氨基酸组成的比较研究[J]. 现代食品科技, 2012, 28(12): 1803-1805; 1825.DOI:10.13982/j.mfst.1673-9078.2012.12.023.
[24] 张苏平, 邱伟强, 卢祺, 等. 全自动氨基酸分析仪法测定4 种贝类肌肉中谷胱甘肽和游离氨基酸含量[J]. 食品科学, 2017, 38(4): 170-176.DOI:10.7506/spkx1002-6630-201704027.
[25] 冯志强, 周芳梅, 黄永连, 等. 全自动氨基酸分析仪鉴别不同种类酱油中氨基酸的分析研究[J]. 中国食品添加剂, 2013(5): 198-205.
[26] 刘长姣, 杨越越, 王妮, 等. 茚三酮比色法测定秋葵中氨基酸含量条件的优化[J]. 中国食品添加剂, 2018(1): 187-193.
[27] 刘旭辉, 刘萤, 张姗, 等. 婴幼儿配方粉中牛磺酸的前处理优化及氨基酸分析仪分析[J]. 现代仪器与医疗, 2016, 22(5): 92-94.
[28] 林小娟, 许杨彪, 刘向红, 等. 桑椹酒中氨基酸含量分析[J]. 中国酿造, 2017, 36(6): 158-162.
[29] 陈文, 王湘君, 赵阳, 等. 酸水解-全自动氨基酸分析仪测定方格星虫中氨基酸[J]. 食品工业科技, 2017, 38(3): 299-304.
[30] 赵成仕, 臧爱香, 夏莲, 等. 酸水解-全自动氨基酸分析仪测定蜂蜜中17 种氨基酸[J]. 现代农业科技, 2013(3): 325-326.
[31] 韩加敏, 陈梦迪, 董霞, 等. 云南维西县百花蜜17 种游离氨基酸的测定[J]. 中国蜂业, 2018, 69(8): 69-72.
Content s of 18 Amino Acids in Meat from 6 Species of Special Farm Animals
XIN Lina1, LIU Changkai1, HE Linfei1, YUAN Rongsui2, CHEN Shengjie3, WANG Jie4,*
(1.Guangxi-ASEAN Center for Food and Drug Safety Control, Nanning 530021, China; 2.Guangxi Zhuang Autonomous Region Food and Drug Examination and Verification Center, Nanning 530029, China; 3.College of Pharmaceutical, Guangxi Medical University, Nanning 530021, China; 4.Pharmaceutical Factory of Guangxi Medical University, Nanning 530021, China)
Abstract: In this paper, the contents of 18 amino acids in meat from 6 newly developed special farm animals, namely blue peacock, cobra, mouse snake, sea snake, sea dragon and sea star, were determined with an automatic amino acid analyzer.After protein precipitation with 90% ethanol, the samples were hydrolyzed with 6 mol/L hydrochloric acid solution for 22 h and then centrifuged. The supernatant was blown to dryness with nitrogen and the residue was re-dissolved and filtrated before being injected and analyzed. A mixture of sodium citrate and sodium hydroxide solutions was used as the mobile phase for gradient elution and fluorescence detection was performed at 440 nm for Pro and at 570 nm for 17 other amino acids. The results showed that the linear ranges were 1.6-8.0 mg/L for cystine, 2.0-10.0 mg/L for taurine, and 3.2-16.0 mg/L for other amino acids (r = 0.998 5-0.999 9). The detection limits of the method were 0.04-0.42 mg/L. Recoveries from samples spiked at 3.2 mg/L for cystine, 4.0 mg/L for taurine, and 6.4 mg/L for other amino acids were in the range between 96.11% and 109.76% with relative standard deviations (RSDs) between 0.14% and 1.62%. Recoveries from samples spiked at 6.4 mg/L for cystine, 8.0 mg/L for taurine, and 12.8 mg/L for other amino acids were in the range between 96.12% and 104.13% with RSDs were 0.11% -1.88%. The precision, stability and repeatability RSDs were 0.08%-0.94%, 0.16%-0.97% and 0.09%-0.91%,respectively. This method was rapid, accurate and reliable, and could be used to determine amino acids in blue peacock, cobra,mouse snake, sea snake, sea dragon and sea star.
Keywords: blue peacock; cobra; mouse snake; sea snake; sea dragon; starfish; taurine; amino acids
收稿日期:2018-11-26
基金项目:广西南宁市科学研究与技术开发计划项目(20173158-4);广西南宁市青秀区科学研究与技术开发计划项目(2015Z01);广西大宗海洋生物废弃物综合利用及大健康系列产品研发与产业化项目(桂科AA17204085)
第一作者简介:辛丽娜(1982—)(ORCID: 0000-0001-9834-4909),女,工程师,学士,研究方向为食品药品质量与安全。E-mail: 89065222@qq.com
*通信作者简介:王捷(1969—)(ORCID: 0000-0003-2771-2342),男,高级工程师,硕士,研究方向为新药研究、中药资源开发利用和健康促进。E-mail: 2218250952@qq.com
DOI:10.7506/rlyj1001-8123-20181126-219
中图分类号:TS207.3
文献标志码:A
文章编号:1001-8123(2019)02-0058-06
引文格式:
辛丽娜, 刘常凯, 何林飞, 等. 6 种农业特种养殖动物肉中18 种氨基酸含量分析[J]. 肉类研究, 2019, 33(2): 58-63.DOI:10.7506/rlyj1001-8123-20181126-219. http://www.rlyj.pub
XIN Lina, LIU Changkai, HE Linfei, et al. Content s of 18 amino acids in meat from 6 species of special farm animals[J].Meat Research, 2019, 33(2): 58-63. DOI:10.7506/rlyj1001-8123-20181126-219. http://www.rlyj.pub