中国是世界猪肉生产和消费第一大国,多年来,猪肉产量和消费量一直位居世界第一[1],猪肉也是我国居民最主要的肉食品来源,因此保证猪肉品质安全至关重要。猪肉品质安全评价指标包括颜色、纹理、pH值、营养成分含量、嫩度和新鲜度等。新鲜度是肉品腐败变质程度的直接反映,是评价肉品品质安全的最重要参数[2]。 变质猪肉不但营养价值下降甚至具有毒性,危及消费者健康。总挥发性盐基氮(total volatile basic nitrogen,TVB-N) 是蛋白质分解生成氨及胺类等含氮物质的总和,其含量会随着肉品腐败进程逐渐增加,与肉品腐败程度呈正比。目前,TVB-N含量是我国国标评价肉品新鲜度的最重要指标[3]。
冷却猪肉因能最大限度地保证口感与品质安全,已受到越来越多消费者的青睐[4]。但冷却猪肉在贮藏过程中仍会腐败变质,这是由于动物屠宰及加工过程中易被一些嗜冷致腐菌污染,肉的变质程度主要取决于致腐菌的种类和数量[5]。任静等[6]通过对调理预制烤猪肉冷藏过程中微生物生长特性的研究发现,托盘包装和真空包装2 种包装方式猪肉中存在的腐败菌有假单胞菌﹑热杀索丝菌、乳酸菌、节杆菌和气单胞菌。Borch等[7]在猪肉、牛肉及其腌制肉制品中筛选鉴定出热死环丝菌、 假单胞菌属﹑肠杆菌等腐败微生物。Zhao Fan等[8]在对真空包装冷却猪肉贮藏过程中微生物的变化进行研究时发现,腐败菌菌相随贮藏时间的延长不断发生变化,通过16S rDNA测得,贮藏第14天肠杆菌占所检测到的各种腐败微生物总序列的21.63%,第21天为6.50%。黎园园等[9]对解冻猪肉中优势腐败菌致腐能力的研究表明,假单胞菌和热死环丝菌具有较强的致腐能力。 Skandamis等[10]研究表明,致腐菌群体感应现象在肉制品腐败过程中起到重要作用。Zhu Suqin等[11]在4 ℃冷藏对虾的腐败过程中检测到3 种自诱导剂,结合外源添加不同自诱导剂对冷藏对虾腐败影响的研究结果,说明群体感应影响冷藏对虾的腐败。目前,多数研究主要集中在肉品冷却变质过程中的菌相变化、优势致腐菌分类鉴定及群体感应等方面,而对特定致腐菌在冷却肉中致腐作用机制的研究鲜见报道。
本课题组前期从变质冷却猪肉中分离、筛选、鉴定出5 株致腐菌,通过TVB-N含量因子测定确定出2 株优势致腐菌:韩国假单胞菌PS1(Pseudomonas koreensis PS1) 和梭状芽孢杆菌J4(Bacillus fusiformis J4)[12],并近一步利用原位荧光染色结合激光共聚焦扫描显微镜技术研究特定致腐菌P. koreensis PS1侵染猪肉的方式及其在猪肉中的分布情况,初步探索其对冷却猪肉的致腐作用方式[13]。本研究将特定致腐菌P. koreensis PS1、 B. fusiformis J4回接至冷却猪肉,使其腐败变质,测定该过程中细菌总数、蛋白质、TVB-N含量以及脂肪酶和蛋白酶活力的动态变化,更深入地探索特定致腐菌在冷却猪肉中的致腐作用机制。
1 材料与方法
1.1 材料与试剂
冷却里脊肉来自于不同的长白猪,购于江西省南昌市经济技术开发区主要超市肉制品专柜。样品置于密封袋内,放在加有冰袋的保温箱中30 min内运回实验室。
特定致腐菌P. koreensis PS1和B. fusiformis J4,课题组自行从变质冷却猪肉中分离、鉴定、保藏[12]。
无水乙酸钠﹑乙酸﹑氯化钠﹑氢氧化钠﹑盐酸 西陇科学股份有限公司;氧化镁﹑三氯乙酸 天津市大茂化学试剂厂;硫酸铜 天津市永大化学试剂有限 公司;对硝基苯酚 上海展云化工有限公司;牛肉膏、蛋白胨(均为生化试剂) 北京奥博星生物技术有限责任公司;三羟甲基氨基甲烷(Tris)和福林酚 北京 索莱宝(Solarbio)科技有限公司;地衣红-弹性蛋白 美国Sigma公司;所用试剂均为分析纯。
1.2 仪器与设备
722可见分光光度计、UV759紫外-可见分光光度计 上海佑科仪器仪表有限公司;JW-3022HR高速冷冻离 心机 安徽嘉文仪器装备有限公司;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;LRH-250-C生化培养箱 广东省韶关市泰宏医疗器械有限公司;HH恒温水浴锅 江苏省金坛市中大仪器厂。
1.3 方法
1.3.1 菌悬液制备
将甘油管保藏的特定致腐菌P. koreensis PS1和 B. fusiformis J4菌种在试管斜面培养基上活化,取长势良好、无污染的菌体斜面,用无菌水制备成菌悬液,并利用染色显微镜检计数法计数[14],即取5 μL菌悬液于载玻片1 cm2的区域内涂匀,用0.1 g/100 mL结晶紫染色,油镜镜检并随机选取10 个视野进行细菌计数,取平均值计算出菌悬液细胞含量,再用无菌水调整菌体初始浓度约为1×103 个/mL。
1.3.2 肉样制备
在无菌操作台上将肉样表面切除约0.5 cm后,切成大小约为4 cm×4 cm×2 cm的样本60 个,平均分成3 组,用无菌镊子将每个样品置于酒精灯上灼烧30 s,进行表面灭菌;取其中2 组分别在制备好的P. koreensis PS1和 B. fusiformis J4菌悬液中浸润10~15 s进行接种[9,15],取出沥干放入无菌塑料袋中密封,剩余1 组不接种作为对照组;样品全部置于4 ℃冰箱保存,分别于第1、3、5、7、9天的相同时段,3 组肉样中各取4 个肉样进行细菌总数、蛋白质、TVB-N含量以及脂肪酶、弹性蛋白酶、胰蛋白酶和胶原蛋白酶活力测定。
1.3.3 指标测定
1.3.3.1 肉样细菌总数、蛋白质和TVB-N含量测定
采用GB/T 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[16]中的平板菌落计数法测定细菌总数;采用GB/T 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[17]中的分光光度法测定蛋白质含量;采用GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[18]中的半微量定氮法测定TVB-N含量。
1.3.3.2 肉样酶活力测定
参考赵培培[19]的方法测定弹性蛋白酶活力;参考孙文斌[20]的方法测定脂肪酶和胶原蛋白酶活力;参考刘亮亮[21]的方法测定胰蛋白酶活力。4 种酶的酶活力单位 均为U/g。
1.4 数据处理
采用Excel 2010软件进行数据处理,利用Origin 2018软件进行图形绘制,DPS 7.05软件进行显著性分析 (P<0.05为差异显著);测定结果用平均值±标准差表示,实验均重复3 次。
2 结果与分析
2.1 冷却猪肉腐败过程中细菌总数动态变化
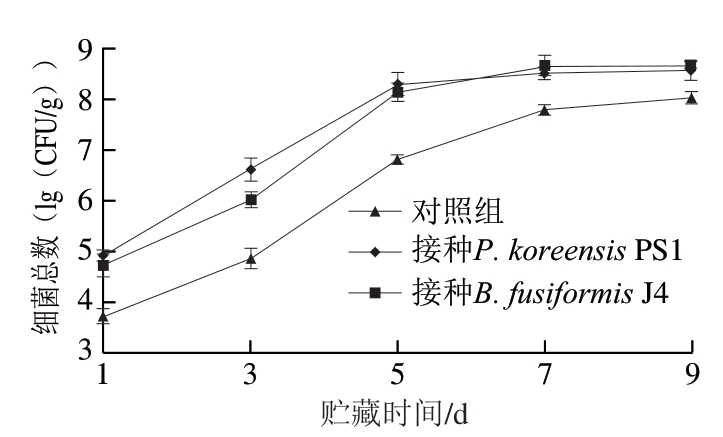
图 1 肉样细菌总数随贮藏时间的变化
Fig. 1 Changes in total bacterial number in meat samples with storage time
优势致腐菌生长繁殖是引起肉样腐败变质的主要原因,因此微生物数量是衡量肉样腐败程度的一个重要指标。由图1可知,随着贮藏时间的延长,对照组和接种特定致腐菌肉样的细菌总数均呈增加趋势,且在贮藏第5天进入稳定期,此时接种特定腐败菌的肉样细菌总数均超过8.0 (lg(CFU/g)),明显高于对照组肉样细菌总数(6.82 (lg(CFU/g)))。这说明接种至肉样中的特定致腐菌P. koreensis PS1、B. fusiformis J4及肉样自身所带的微生物在4 ℃低温下仍能利用肉样中的营养物质快速生长繁殖,细菌总数明显增加,但随着营养物质的消耗和代谢产物的积累以及猪肉体系整个微环境pH值的改变,从而使得致腐菌的生长变得缓慢[22]。
2.2 冷却猪肉腐败过程中蛋白质和TVB-N含量动态变化
蛋白质作为里脊肉中主要的营养物质会被微生物分解利用,同时产生氨气、尸胺和腐胺等生物胺,TVB-N含量是评价肉品新鲜度最重要的指标,我国国标规定生鲜肉类TVB-N含量不可超过15 mg/100 g。
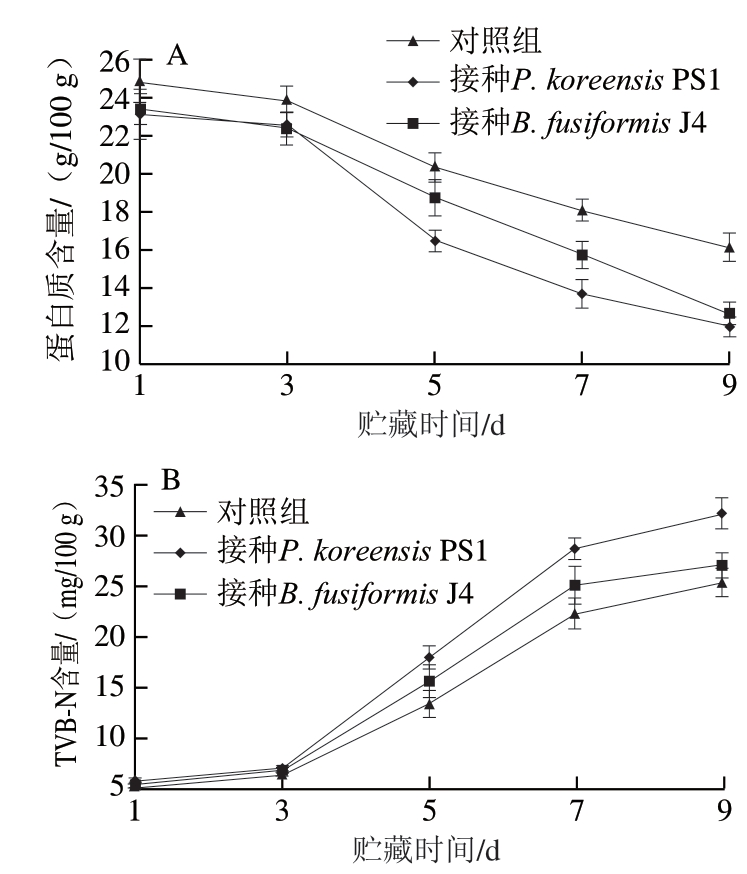
图 2 肉样蛋白质(A)和TVB-N(B)含量随贮藏时间的变化
Fig. 2 Changes in protein (A) and TVB-N (B) contents in meat samples with storage time
由图2可知:各组肉样中蛋白质和TVB-N含量在贮藏前3 d变化不明显,这是由于腐败菌首先利用肉样中的糖原作为生长基质[23];随着贮藏时间的延长,肉样蛋白质含量明显下降,TVB-N含量明显增加,至贮藏第5天,接种特定致腐菌P. koreensis PS1、B. fusiformis J4肉样的TVB-N含量均大于15 mg/100 g,明显高于对照组。在冷却猪肉变质过程中,接种特定致腐菌P. koreensis PS1、B. fusiformis J4的肉样细菌总数增加、蛋白质被消耗和TVB-N含量的变化速率均大于对照组。同时,特定致腐菌P. koreensis PS1在肉样中的生长趋势与B. fusiformis J4类似,但其对蛋白质分解产生TVB-N的能力明显优于 B. fusiformis J4,这与本课题组之前的研究一致[12]。
2.3 冷却猪肉腐败过程中脂肪酶活力动态变化
猪肉脂肪中的亚油酸与油酸在氧气和致腐菌所产脂肪酶的作用下先形成过氧化物,再被分解成醛类﹑酮类等小分子物质,致使猪肉的食用价值丧失[24]。
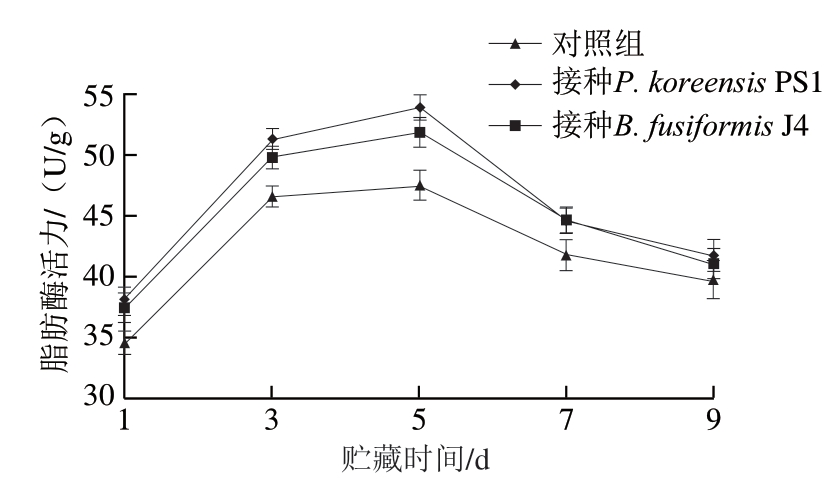
图 3 肉样脂肪酶活力随贮藏时间的变化
Fig. 3 Changes in lipase activity in meat samples with storage time
由图3 可知:在贮藏前3 d,接种特定致腐菌 P. koreensis PS1、B. fusiformis J4和对照组肉样脂肪酶活力快速上升;贮藏第5天,3 组肉样的脂肪酶活力均达到峰值,分别为53.85、51.83、47.51 U/g,而后酶活力均出现下降趋势,在此过程中接种P. koreensis PS1和B. fusiformis J4 肉样的脂肪酶活力保持较高水平,均高于对照组。可见,特定致腐菌P. koreensis PS1、B. fusiformis J4均可产生活性较强的脂肪酶,加快对肉样肌纤维及黏膜中脂肪的破坏,更有利于致腐菌向肉样深层侵染。
2.4 冷却猪肉腐败过程中胰蛋白酶﹑胶原蛋白酶及弹性蛋白酶活力动态变化
肉样蛋白质的分解依靠胰蛋白酶﹑胶原蛋白酶和弹性蛋白酶等的作用来完成,胶原蛋白的破坏导致肉样感官品质发生改变,同时更有利于腐败微生物的侵染。
由图4可知,肉样腐败过程中胰蛋白酶﹑胶原蛋白酶和弹性蛋白酶活力均出现相似的变化趋势,接种致腐菌P. koreensis PS1﹑B. fusiformis J4及对照组肉样的上述3 种蛋白酶活力均呈现先上升后下降的趋势,至贮藏第7天,弹性蛋白酶﹑胶原蛋白酶﹑胰蛋白酶活力均达到峰值,且接种P. koreensis PS1﹑B. fusiformis J4肉样的蛋白酶活力均明显高于对照组,此后3 种蛋白酶活力略有降低。Tsigarida等[25]发现,屠宰后猪肉本身存在内源酶的糖酵解作用,而该作用在pH 5.4~5.5时会被终止,此后内源酶对猪肉的影响相较于腐败菌的酶解作用可被忽略。腐败菌先以糖类﹑脂质为底物进行分解,因而贮藏前3 d 3 种蛋白酶活力无明显变化,之后胰蛋白酶、胶原蛋白酶和弹性蛋白酶活力均快速增加,蛋白质的分解也加快 (图2A),这可能是由于蛋白质氧化降解受活性氧的影响,而不饱和脂肪酸及脂肪氧化产物丙二醛对活性氧的生成具有促进作用[26-27]。
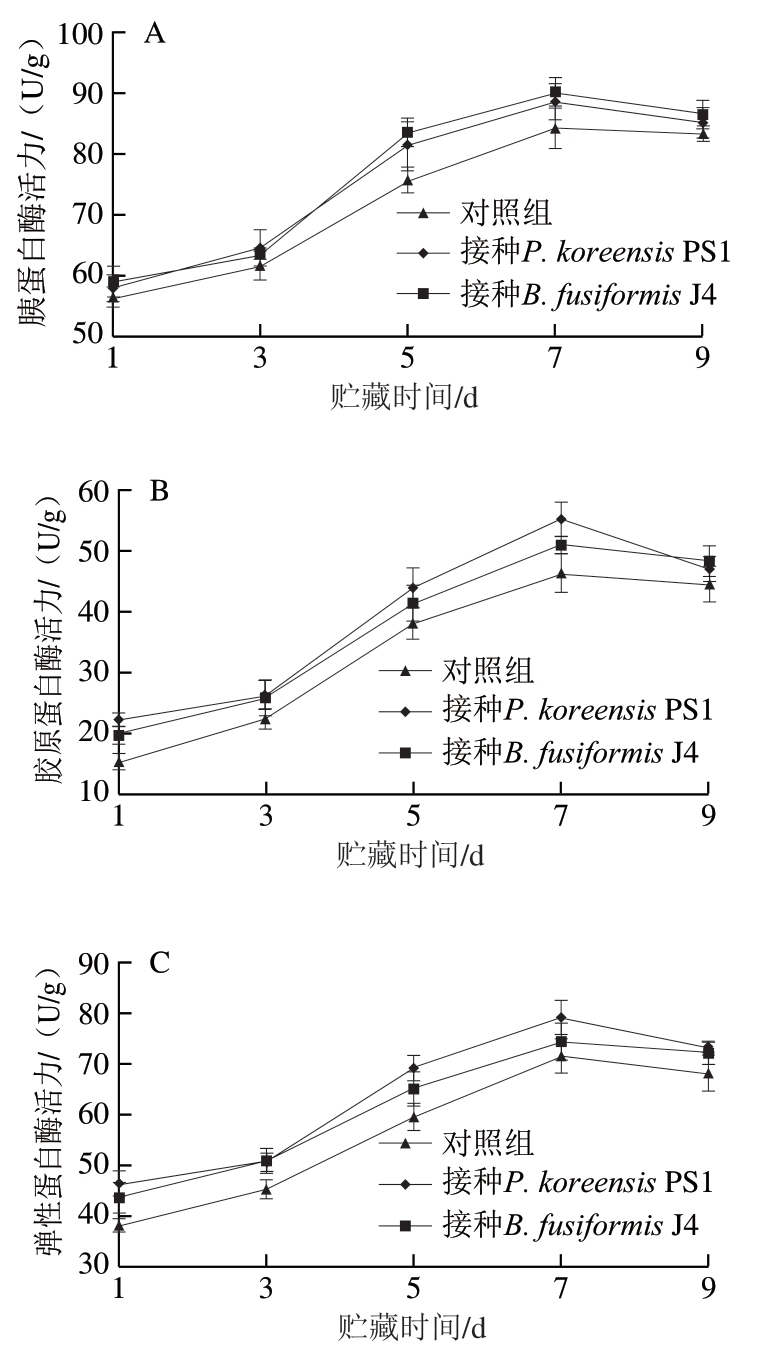
图 4 肉样胰蛋白酶(A)、胶原蛋白酶(B)和弹性蛋白酶(C)活力随贮藏时间的变化
Fig. 4 Changes in activities of trypsin (A), collagenase (B) and elastase (C) in meat samples with storage time
3 讨 论
冷却猪肉在加工和运输过程中易被一些致腐菌侵染,致使猪肉品质下降,因此为更好地保鲜冷却猪肉,需对致腐菌在猪肉中的致腐过程作进一步探讨。顾春涛等[28] 研究冷鲜牛肉微生物菌群变化时发现,假单胞菌和肠杆菌均属于优势致腐菌,其中假单胞菌致腐能力较强。同时Duan Shan等[29]研究发现,假单胞菌在4 ℃条件下冷藏的罗非鱼中属于优势腐败菌,且细菌总量与贮藏时间呈正比,将分离筛选得到的荧光假单胞菌和梭状芽孢杆菌分别接种于冷却猪肉,发现2 种腐败菌在冷却猪肉中快速生长,且细菌总数不断增加,这与Li Ning等[30]对冷鲜猪肉贮藏过程中细菌群落组成研究中得出的随着肉样贮藏时间的延长致腐菌数量不断上升的结果相一致。
猪肉富含蛋白质、脂肪等物质,其腐败的原因主要是由于这些物质被致腐菌产生的蛋白酶及脂肪酶所降解,因而酶解反应是影响冷却猪肉腐败的重要因素[31]。Arslan等[32]发现,假单胞菌能产生具有较高活性的蛋白酶。Zhang Qiuqin等[33]将荧光假单胞菌回接至鸡肉汤,进行致腐实验,最终检测到较强的蛋白酶和脂肪酶活性。肉制品腐败过程中的脂质和蛋白质氧化被认为是相互影响的。Li等[27]在对脂质氧化分解产物丙二醛对兔肌球蛋白结构的影响进行研究时发现,丙二醛能促进蛋白质的氧化分解。本研究通过测定接种特定致腐菌冷却猪肉腐败过程中多种酶的活力变化表明,肉样腐败在致腐菌所产脂肪酶和蛋白酶的共同作用下完成。特定致腐菌产生的脂肪酶能够对肉样肌纤维膜及黏膜中的脂肪进行氧化分解,破坏肌肉结构组织,促进致腐菌的侵染繁殖,但随着酶的作用和活力的增强,脂肪氧化分解产物醛、酮、酸等积累,会反馈阻遏和抑制相关脂肪酶的作用,并且贮藏5 d后出现细菌总数没有明显下降而脂肪酶活力快速下降的现象。同时,随着致腐菌对肉样深层的侵染繁殖,其弹性蛋白酶﹑胶原蛋白酶和胰蛋白酶等多种蛋白酶的活力有所增加,在贮藏第7天达到最大值,相应地,TVB-N含量也在此时增加最快,之后由于生物胺等代谢产物的积累,导致蛋白酶活力呈现下降趋势。这与Zhang Qiuqin等[33]在将荧光假单胞菌接种至鸡肉汤进行的致腐实验中得到的蛋白酶与脂肪酶活力变化趋势相类似。
致腐菌在生长初期能够优先利用糖类﹑脂质等物质,而后产生蛋白酶以降解猪肉蛋白质,供其生长,这也是TVB-N含量在贮藏初期变化不明显的原因。此后随着贮藏时间的延长,肉样蛋白质不断被分解,TVB-N则会大量累积,产生该现象的直接原因可能与致腐菌的生长繁殖有关,这也与黎园园等[9]研究猪肉优势腐败菌产TVB-N的情况相近。因此降低致腐菌酶体系的活力,能够很大程度上抑制腐败的产生,这也为冷却猪肉的保鲜提供了相关的理论依据。
4 结 论
特定致腐菌P. koreensis PS1﹑B. fusiformis J4在新鲜冷却猪肉中仍能快速生长,导致细菌总数呈现先上升后稳定的趋势,特定致腐菌优先产生脂肪酶,导致肌肉肌纤维及黏膜中脂肪氧化降解,并在酶活力较强的弹性蛋白酶﹑胶原蛋白酶和胰蛋白酶等多种蛋白酶作用下,促使肉样中蛋白质分解,并增加TVB-N的释放,从而加速冷却猪肉的腐败变质。
[1] 梁泽闽, 赵文豪, 陶红军. 我国猪肉产业国际竞争力研究[J]. 中国猪业, 2019, 14(5): 21-28. DOI:10.16174/j.cnki.115435.
[2] LI Yongyu, ZHANG Leilei, PENG Yankun, et al. Hyperspectral imaging technique for determination of pork freshness attributes[C]//Sensing for Agriculture and Food Quality and Safety III. International Society for Optics and Photonics, Orlando, Florida, United States, 2011: 80270H. DOI:10.1117/12.883652.
[3] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 鲜(冻)畜、禽产品: GB 2707—2016[S]. 北京: 中国标准出版社, 2016.
[4] 顾海宁, 李强, 李文钊, 等. 冷却猪肉贮存中的品质变化及货架期预测[J]. 现代食品科技, 2013, 29(11): 2621-2626. DOI:10.13982/j.mfst.1673-9078.2013.11.023.
[5] BOUJU-ALBER A, PILET M F, GUILLOU S. Influence of lactate and acetate removal on the microbiota of French fresh pork sausages[J]. Food Microbiology, 2018, 76: 328-336. DOI:10.1016/j.fm.2018.06.011.
[6] 任静, 牛海力, 张欢, 等. 调理预制烤猪肉冷藏过程中微生物生长特性的研究[J]. 中国食品学报, 2017, 17(7): 230-238. DOI:10.16429/j.1009-7848.2017.07.029.
[7] BORCH E, KANTMUERMANS M L, BLIXT Y. Bacterial spoilage of meat and cured meat products[J]. International Journal of Food Microbiology, 1996, 33(1): 103-120. DOI:10.1016/0168-1605(96)01135-X.
[8] ZHAO Fan, ZHOU Guanghong, YE Keping, et al. Microbial changes in vacuum-packed chilled pork during storage[J]. Meat Science, 2015, 100: 145-149. DOI:10.1016/j.meatsci.2014.10.004.
[9] 黎园园, 董庆利, 梁娜, 等. 解冻猪肉中优势腐败菌致腐能力研究[J]. 食品科学, 2011, 32(5): 123-127.
[10] SKANDAMIS P N, NYCHAS G J E. Quorum sensing in the context of food microbiology[J]. Applied and Environmental Microbiology, 2012, 78(16): 5473-5482. DOI:10.1128/AEM.00468-12.
[11] ZHU Suqin, WU Haohao, ZENG Mingyong, et al. The involvement of bacterial quorum sensing in the spoilage of refrigerated Litopenaeus vannamei[J]. International Journal of Food Microbiology, 2015, 192: 26-33. DOI:10.1016/j.ijfoodmicro.2014.09.029.
[12] 黄林, 陈全胜, 张燕华, 等. 冷却猪肉优势腐败菌分离鉴定及致腐能力测定[J]. 食品科学, 2013, 34(1): 205-209.
[13] 黄林, 赵杰文, 陈全胜, 等. 冷却猪肉优势腐败菌原位荧光染色检测方法研究[J]. 中国食品学报, 2014, 14(3): 145-150. DOI:10.16429/j.1009-7848.2014.03.004.
[14] 沈萍, 陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社, 2007: 218.
[15] 彭勇. 冷却猪肉常见腐败微生物致腐能力的研究[D]. 北京: 中国农业大学, 2005: 18-19.
[16] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016.
[17] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中蛋白质的测定: GB/T 5009.5—2016[S]. 北京: 中国标准出版社, 2016.
[18] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 中国标准出版社, 2016.
[19] 赵培培. 产新型弹性蛋白酶产吲哚金黄杆菌的分离鉴定及酶学性质研究[D]. 雅安: 四川农业大学, 2012: 13-14.
[20] 孙文斌. 海洋微生物源胶原蛋白酶等酶系的研究[D]. 大连: 大连工业大学, 2014: 14-17.
[21] 刘亮亮. 羊胰酶提取工艺及水解酪蛋白动力学研究[D]. 兰州: 甘肃农业大学, 2010: 19.
[22] AKKERMANS S, VAN IMPE J F. Mechanistic modelling of the inhibitory effect of pH on microbial growth[J]. Food Microbiology, 2018, 72: 214-219. DOI:10.1016/j.fm.2017.12.007.
[23] 黄敏欣, 赵文红, 白卫东, 等. 冷却猪肉腐败菌的研究进展[J]. 肉类工业, 2015(5): 38-42; 46.
[24] CARLSEN C U, MOLLER J K S, SKIBSTED L H. Heme-iron in lipid oxidation [J]. Coordination Chemistry Reviews, 2005, 249(3/4): 485-498. DOI:10.1016/j.ccr.2004.08.028.
[25] TSIGARIDA E, NYCHAS G J E. Ecophysiological attributes of a Lactobacillus sp. and a Pseudomonas sp. on sterile beef fillets in relation to storage temperature and film permeability[J]. Journal of Applied Microbiology, 2001, 90(5): 696-705. DOI:10.1046/j.1365-2672.2001.01292.x.
[26] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition and Food Research, 2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[27] LI S J, KING A J. Structural changes of rabbit myosin subfragment 1 altered by malonaldehyde, a byproduct of lipid oxidation[J]. Journal of Agricultural and Food Chemistry, 1999, 47(8): 3124-3129. DOI:10.1021/jf990028y.
[28] 顾春涛, 毕伟伟, 朱军莉. 冷鲜牛肉贮藏中菌群结构及优势菌致腐性的分析[J]. 食品科学, 2019, 40(18): 76-82. DOI:10.7506/spkx1002-6630-20180925-263.
[29] DUAN Shan, ZHOU Xingzhi, MIAO Jianyin, et al. Succession of bacterial microbiota in tilapia fillets at 4 ℃ and in situ investigation of spoilers[J]. World Journal of Microbiology and Biotechnology, 2018, 34(5): 69. DOI:10.1007/s11274-018-2452-5.
[30] LI Ning, ZHANG Youxiong, WU Qingping, et al. High-throughput sequencing analysis of bacterial community composition and quality characteristics in refrigerated pork during storage[J]. Food Microbiology, 2019, 83: 86-94. DOI:10.1016/j.fm.2019.04.013.
[31] 赵丽珺, 谢晶, 冯淑娇, 等. 冷却猪肉中产蛋白酶腐败菌的分离 鉴定[J]. 食品工业科技, 2014, 35(7): 134-139; 143. DOI:10.13386/j.issn1002-0306.2014.07.041.
[32] ARSLAN S, EYI A, ÖZDEMIR F. Spoilage potentials and antimicrobial resistance of Pseudomonas spp. isolated from cheeses[J]. Journal of Dairy Science, 2011, 94(12): 5851-5856. DOI:10.3168/jds.2011-4676.
[33] ZHANG Qiuqin, YE Keping, WANG Huhu, et al. Inhibition of biofilm formation of Pseudomonas aeruginosa by an acylated homoserine lactones-containing culture extract[J]. LWT-Food Science and Technology, 2014, 57(1): 230-235. DOI:10.1016/j.lwt.2013.12.022.