松香是来源于松树的一种天然物质,包含多种树脂酸,其中松香酸(abietic acid,AA)和脱氢松香酸(dehydroabietic acid,DHAA)是其主要成分。AA和DHAA能显著抑制水蚤、虹鳟鱼等的生长发育[1]。在细胞毒理学方面,AA可导致人体肺泡上皮细胞溶解,而DHAA能够促进人体上皮细胞、成纤维细胞死亡并对人体红细胞有毒害作用[2]。作为一种普通工业原料,松香被广泛用于肥皂、造纸、油漆涂料等领域。AA和DHAA广泛存在于造纸厂废水中,在日用消费品,如药剂、化妆品等中也常有检出,甚至可以通过包装材料迁移进入食品中[3-4]。
因加热后具有优良的黏附特性,松香曾被畜禽屠宰加工企业广泛用于畜禽屠宰,尤其是鸭(鹅)屠宰的二次脱毛。值得关注的是,残留在水禽胴体中的AA和DHAA经过烹饪加工后依然残留在水禽肉制品中,给消费者健康带来潜在危害[5]。2009年,我国《食品安全法》禁止在畜禽屠宰中使用松香脱毛,但是中小畜禽加工企业违禁使用松香脱毛的现象仍然十分严重。
AA和DHAA作为松香残留的主要标志物,一般通过气相色谱(gas chromatographic,GC)法和高效液相色谱(high performance liquid chromatography,HPLC)法进行分析[6-8]。相对而言,HPLC的应用更为普遍[9-11]。酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA) 法灵敏度高,具有特异性强、成本低、检测容量大等特点,适用于大批量样本中微量污染物的快速分析[12-14]。近年来,ELISA技术发展迅速,除医药、临床领域外,在环境监测、食品安全等方面也获得广泛应用,并已成为有机污染物残留快速检测的主要分析手段之一[15-17]。本课题前期建立了水禽肉制品中AA和DHAA同时测定的HPLC-紫外-荧光分析方法,同时成功合成了DHAA的人工抗原,并通过免疫新西兰大白兔制备了多克隆抗体[18-20]。因此,本研究通过优化抗原包被质量浓度、抗体稀释倍数及二抗稀释倍数等参数,进一步建立白条鸭表皮组织中DHAA含量的间接竞争ELISA检测方法,为畜禽产品中松香残留快速分析方法标准的制定提供参考。
1 材料与方法
1.1 材料与试剂
23 种品牌冷冻白条鸭 南京冷链批发市场。
AA标准品(纯度95%) 北京百灵威科技有限 公司;DHAA标准品(纯度98%)、异海松酸标准品(纯度98%)、长叶松酸标准品(纯度97%)、海松酸标准品(纯度95%) 北京乐博生物科技有限公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔免疫球蛋白G(immunoglobulin G)(IgG-HRP) 上海拜力生物科技有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
Epoch2全波长酶标仪 美国伯腾仪器有限公司;Biofuge stratos高速离心机 德国Heraeus公司;T25高速匀浆机 德国IKA公司;酶标板 上海源叶生物科技有限公司。
1.3 方法
1.3.1 DHAA人工抗原合成及抗体制备
前期研究中合成了D H A A 的人工抗原并制备了多克隆抗体[2 1]。简述如下:以脱氢松香胺(dehydroabietylamine,DHAM)作为半抗原,首先与琥珀酸酐(succine anhydride,SUC)进行酰化反应,生成DHAM-SUC,通过红外光谱、核磁共振及质谱进行表征;DHAM-SUC进一步分别与牛血清蛋白(bovine serum albumin,BSA)和钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)进行偶联反应,合成完全抗原DHAM-SUC-BSA和DHAM-SUC-KLH,偶联比分别为12∶1和35∶1;用DHAM-SUC-KLH免疫家兔,制备、纯化抗血清;以DHAM-SUC-BSA为包被抗原,采用间接ELISA测定抗血清滴度。结果表明,4号新西兰大白兔的抗血清效价达1.28×105,可以用于建立白条鸭表皮组织中DHAA含量的间接竞争ELISA方法。
1.3.2 标准溶液的配制
称取适量的DHAA标准品,用甲醇配制成质量浓度为1 mg/mL的标准储备液;用磷酸盐缓冲液(phosphate buffer saline,PBS)稀释成质量浓度分别为10、20、40、80、160、320、640、1 280、2 560、5 120 ng/mL的系列工作溶液。
1.3.3 间接竞争ELISA测定步骤
参考Gurmit等[22]的方法。以一定质量浓度的抗原包被96 孔酶标板,每孔100 μL,4 ℃孵育过夜;12 h后倾去孔内液体,用磷酸盐-吐温缓冲液(phosphate buffer saline with Tween-20,PBST)洗涤3 次,每次5 min,在干净的吸水纸上拍干;用质量浓度2 g/100 mL明胶(纯水配制)进行封闭,每孔100 μL,37 ℃孵育1 h,PBST洗涤3 次后拍干;加入系列质量浓度的标准溶液(或被检抗原)和一定稀释倍数的抗血清,按体积比1∶1混合后,每孔100 μL,37 ℃孵育2 h,PBST洗涤3 次后拍干;加入一定稀释倍数的羊抗兔IgG-HRP,每孔100 μL,37 ℃孵育5 min,PBST洗涤3 次后拍干;加入新鲜配制的四甲基联苯胺底物溶液,每孔100 μL,显色10 min;每孔加入50 μL 2 mol/L浓硫酸终止反应;反应结束后,用酶标仪在450 nm波长处测定各孔光密度(optical density,OD) 值。以标准溶液质量浓度的对数为横坐标,抑制率为纵坐标,绘制抑制率曲线。抑制率按下式计算。
1.3.4 样品前处理
参考张苏珍等[23]的方法,并稍作修改。分别在每只肉鸭颈、翅、胸、背、腿5 个部位取表皮组织,剪碎、混合均匀备用。称取2 g混合样品置于10 mL离心管,加入4 mL甲醇,超声振荡15 min后4 000 r/min离心5 min,取1 mL上清液加入1.5 mL PBS混合后待ELISA检测。
1.4 数据处理
测定结果均用平均值±标准差表示,采用SPSS statistics 17.0软件对数据进行相关性分析。
2 结果与分析
2.1 间接竞争ELISA条件的优化
在前期实验中,利用DHAM为半抗原合成了DHAA的完全抗原,并通过免疫新西兰大白兔制备了多克隆抗体。合成的松香人工抗原具有理想的免疫原性,获得的多克隆抗体具有较好的灵敏度[21]。本研究在前期研究的基础上通过优化一系列参数,包括抗原包被质量浓度、抗体稀释倍数、二抗稀释倍数等,建立白条鸭表皮组织中DHAA残留检测的间接竞争ELISA方法。
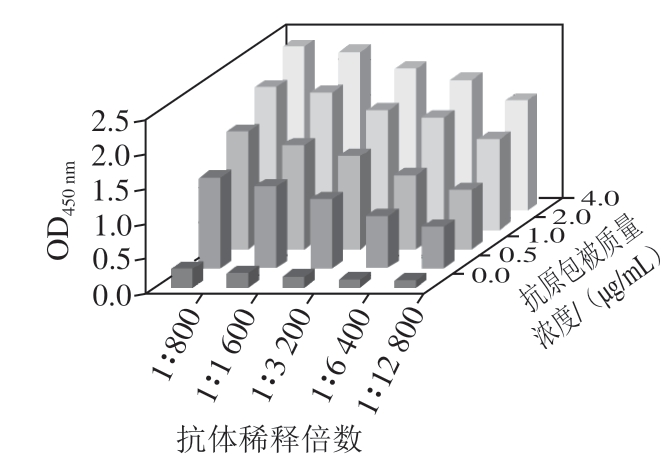
图 1 三维滴定法确定最佳抗原包被质量浓度及抗体稀释倍数
Fig. 1 A three-dimensional titration for optimization of coating antigen and dilution of antiserum
采用三维滴定法确定最佳抗原包被质量浓度及抗体稀释倍数。设置抗原包被质量浓度范围为0.0~ 4.0 μg/mL,抗体稀释倍数范围为1∶800~1∶12 800。由 图1可知,按照OD450 nm接近于1.0所对应实验组合为最佳组合的标准,确定包被抗原质量浓度为1.0 μg/mL,抗体稀释倍数为1∶6 400。
采用单因素控制法,在1∶5 000、1∶10 000、1∶20 000、1∶40 000、1∶80 000二抗稀释倍数条件下分别进行间接竞争ELISA分析,按照阳性血清OD450 nm/阴性血清OD450 nm比值最大的选取原则,确立二抗稀释倍数为1∶10 000。
2.2 线性范围、检出限
配制质量浓度范围为10~10 240 ng/mL的DHAA标准溶液,在最优条件下进行间接竞争ELISA分析,绘制抑制率曲线。结果表明,线性范围为10~5 120 ng/mL,回归方程为y=26.03x-13.87(R2=0.992),式中:x为标准溶液质量浓度的对数,y为抑制率。
在间接竞争ELISA方法中,最低检测限定义为抑制率10%对应的分析物质量浓度,工作质量浓度范围定义为抑制率20%~80%对应的分析物质量浓度。通过线性回归方程计算可知,方法检测限为8.2 ng/mL,工作质量浓度范围为20.0~4 030.0 ng/mL,抑制率50%时对应的分析物质量浓度为283.8 ng/mL。根据鸭表皮组织的前处理条件,鸭表皮组织中DHAA的检测限及检测范围分别为41.0 ng/g和100.0~20 150.0 ng/g。根据Zhu Yongzhi等[24]的报道,使用松香脱毛后,鸭表皮组织中的DHAA含量范围为160~3 750 ng/g。因此本研究建立的间接竞争ELISA方法工作质量浓度范围可以满足鸭表皮组织中DHAA的检测需求。
2.3 交叉反应实验
松香是树脂酸混合物,除了AA和DHAA还包括其他树脂酸,如长叶松酸、海松酸、异海松酸等[25-27],这些树脂酸在松香中含量虽少,但它们都是三环二萜类含氧化合物,可能会和抗体产生反应,从而干扰检验结果[28-29]。通过交叉反应评价本研究建立的间接竞争ELISA方法检测DHAA的特异性。
分别配制质量浓度为1 mg/mL的AA、长叶松酸、海松酸、异海松酸4 种标准储备液,用PBS梯度稀释成系列工作溶液,进行间接竞争ELISA分析,得到抑制率曲线。根据各线性回归方程计算抑制率分别为20%、50%、80%时所对应的标准溶液质量浓度。
表 1 不同树脂酸的交叉反应率及对应的检测限
Table 1 Cross-reactivity with different resin acids and corresponding lower and upper detection limits
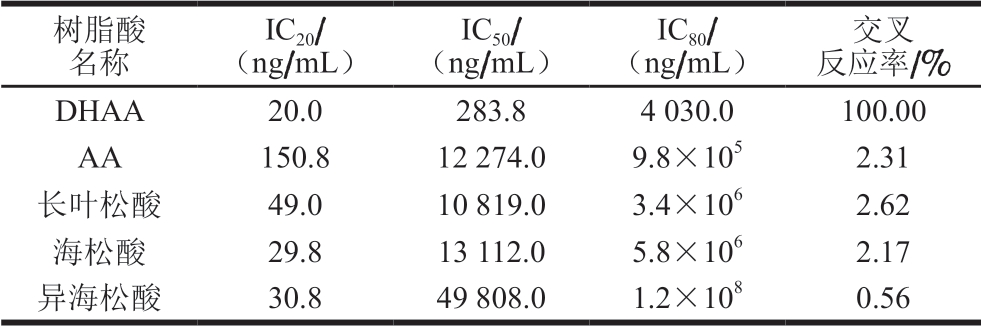
注:IC20、IC50、IC80分别为抑制率20%、50%、80%所对应的标准溶液质量浓度。
树脂酸名称IC20/(ng/mL)IC50/(ng/mL)IC80/(ng/mL)交叉反应率/%DHAA 20.0 283.8 4 030.0 100.00 AA 150.8 12 274.0 9.8×105 2.31长叶松酸 49.0 10 819.0 3.4×106 2.62海松酸 29.8 13 112.0 5.8×106 2.17异海松酸 30.8 49 808.0 1.2×108 0.56
由表1可知,AA、长叶松酸、海松酸、异海松酸4 种树脂酸与DHAA的交叉反应率均小于3.00%,表明这些结构类似的树脂酸对DHAA测定的影响很小,可以忽略不计,因此,本研究所建立的间接竞争ELISA检测方法对DHAA具有优良的特异性。
2.4 精密度实验
选择3 个DHAA含量不同的白条鸭样本开展精密度实验,包括日内和日间精密度实验,评价建立的间接竞争ELISA方法的重复性。日内精密度实验在1 d内进行、共设置6 个重复;日间精密度实验每天3 个重复、连续 进行4 d实验。
表 2 3 种样品精密度实验结果
Table 2 Precision for three samples
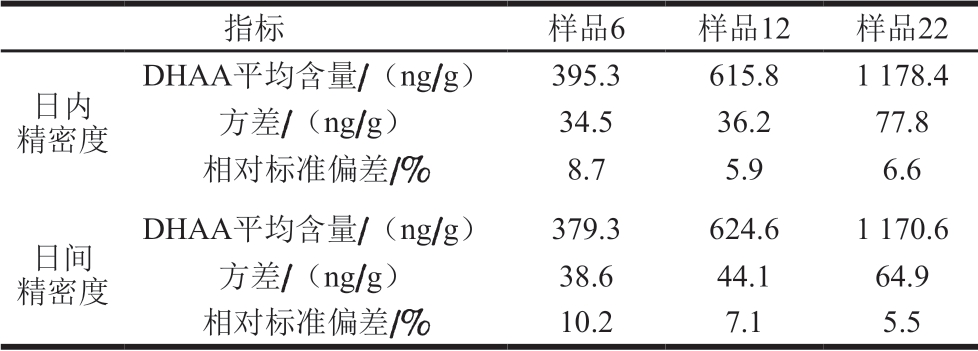
指标 样品6 样品12 样品22日内精密度DHAA平均含量/(ng/g) 395.3 615.8 1 178.4方差/(ng/g) 34.5 36.2 77.8相对标准偏差/% 8.7 5.9 6.6日间精密度DHAA平均含量/(ng/g) 379.3 624.6 1 170.6方差/(ng/g) 38.6 44.1 64.9相对标准偏差/% 10.2 7.1 5.5
由表2可知,日内和日间精密度实验测定结果为相对标准偏差分别为5.9%~8.7%和5.5%~10.2%,表明本研究建立的间接竞争ELISA方法具有良好的重复性。
2.5 回收率实验
表 3 不同添加水平DHAA回收率测定结果(n=3)
Table 3 Recoveries of DHAA at different spiked levels (n = 3)
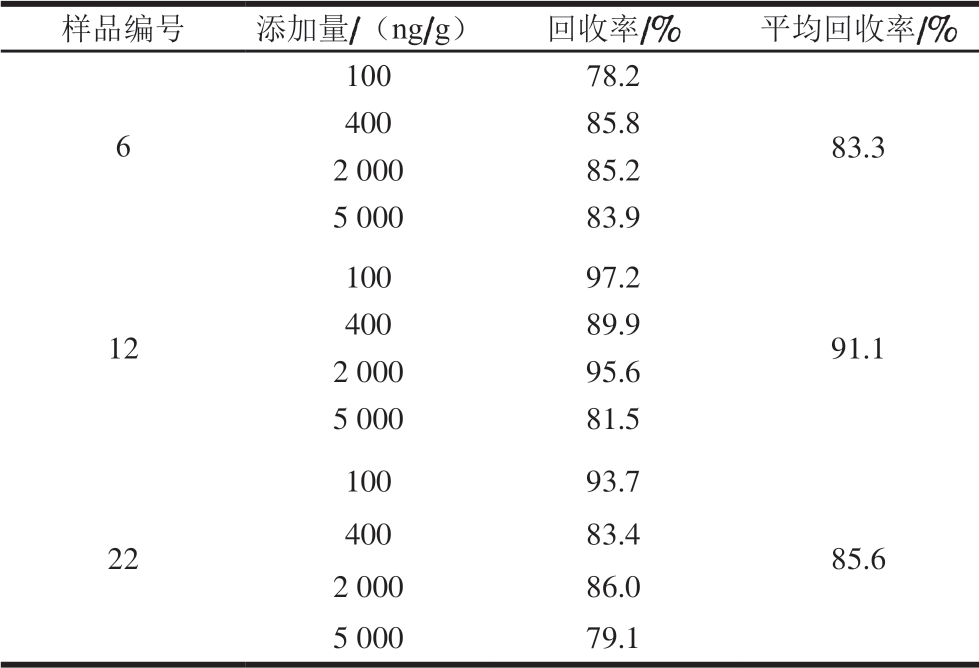
样品编号 添加量/(ng/g) 回收率/% 平均回收率/%6 100 78.2 83.3 400 85.8 2 000 85.2 5 000 83.9 12 100 97.2 91.1 400 89.9 2 000 95.6 5 000 81.5 22 100 93.7 85.6 400 83.4 2 000 86.0 5 000 79.1
选择3 个DHAA含量不同的白条鸭样本,进行4 个不同水平的添加回收实验,评价建立的间接竞争ELISA方法的准确度。由表3可知,回收率范围为78.2%~97.2%,表明所建立的间接竞争ELISA检测方法准确度较高。
2.6 实际样品分析
表 4 间接竞争ELISA方法和HPLC-FLD方法检测鸭表皮组织中 DHAA含量的测定结果(n=3)
Table 4 Concentrations of DHAA determined in duck skin by indirect competitive ELISA and HPLC-FLD (n = 3)
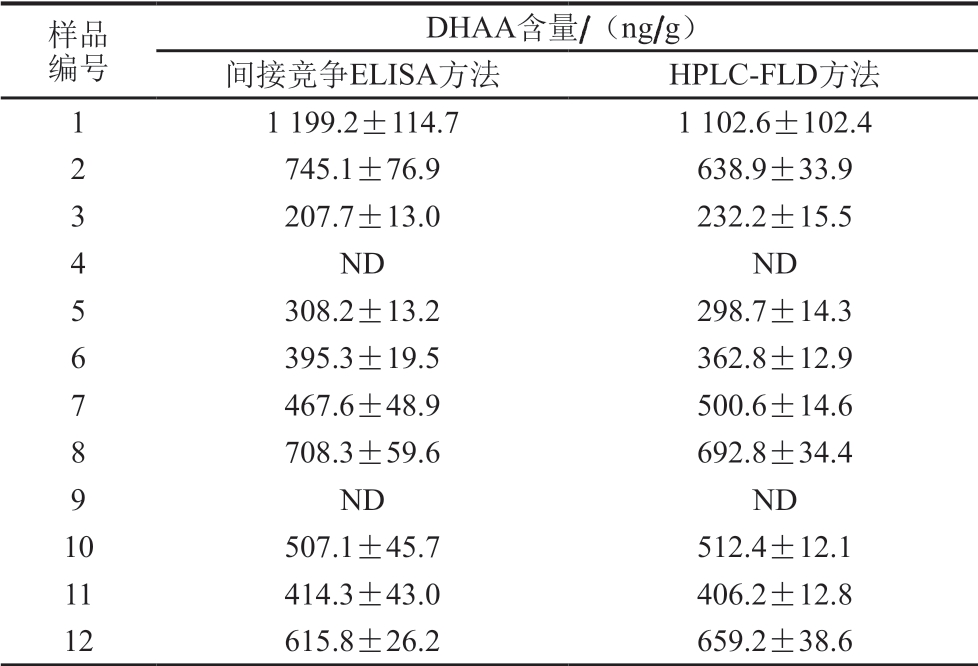
样品编号DHAA含量/(ng/g)间接竞争ELISA方法 HPLC-FLD方法1 1 199.2±114.7 1 102.6±102.4 2 745.1±76.9 638.9±33.9 3 207.7±13.0 232.2±15.5 4 ND ND 5 308.2±13.2 298.7±14.3 6 395.3±19.5 362.8±12.9 7 467.6±48.9 500.6±14.6 8 708.3±59.6 692.8±34.4 9 ND ND 10 507.1±45.7 512.4±12.1 11 414.3±43.0 406.2±12.8 12 615.8±26.2 659.2±38.6
续表4
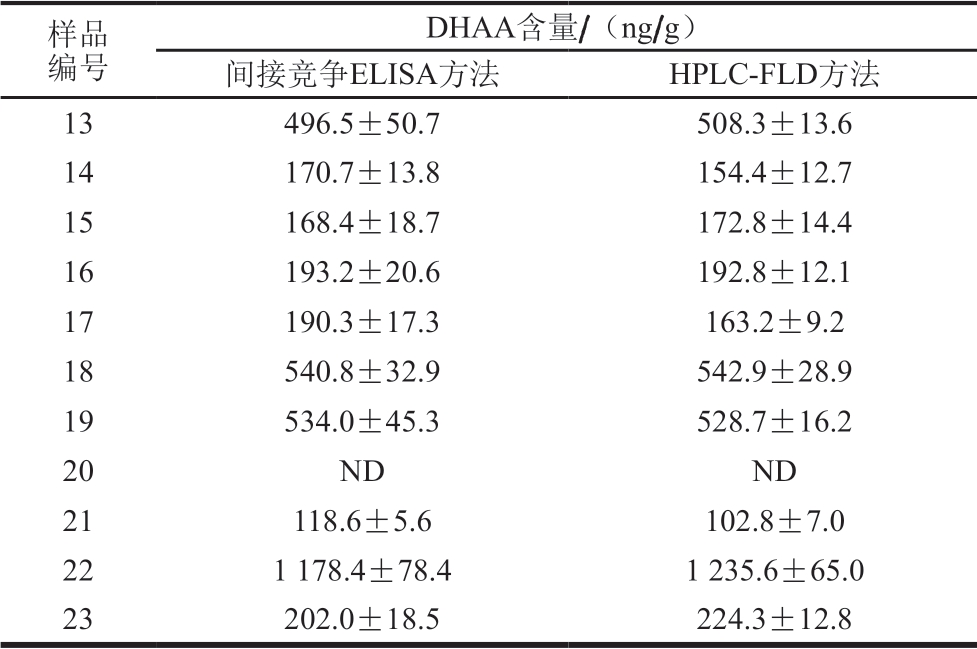
注:ND. 未检出;FLD. 荧光检测器(fluorescence detector)。
样品编号DHAA含量/(ng/g)间接竞争ELISA方法 HPLC-FLD方法13 496.5±50.7 508.3±13.6 14 170.7±13.8 154.4±12.7 15 168.4±18.7 172.8±14.4 16 193.2±20.6 192.8±12.1 17 190.3±17.3 163.2±9.2 18 540.8±32.9 542.9±28.9 19 534.0±45.3 528.7±16.2 20 ND ND 21 118.6±5.6 102.8±7.0 22 1 178.4±78.4 1 235.6±65.0 23 202.0±18.5 224.3±12.8
用所建立的间接竞争ELISA方法分别对23 个白条鸭样本中的DHAA含量进行检测,并与HPLC-FLD方法的测定结果进行对比。由表4可知,2 种方法的测定结果无明显差异。ELISA方法测定结果表明,23 个白条鸭样本中,20 个样本检出DHAA,阳性率达87.0%,DHAA含量范围为118.6~1 199.2 ng/g,无论是阳性率还是DHAA残留水平均与Zhu Yongzhi等[30]的报道基本一致。因此,本研究所建立的白条鸭表皮组织中DHAA含量的间接竞争ELISA分析方法准确度高,可以满足流通领域中白条鸭表皮组织中DHAA含量的快速分析。
3 结 论
通过间接竞争ELISA参数的优化,建立白条鸭表皮组织中DHAA含量的间接竞争ELISA测定方法。方法的检测限及检测范围分别为41.0 ng/g和100.0~20 150.0 ng/g。回收率实验、交叉反应实验及实际样本测定结果表明,本研究建立的间接竞争ELISA方法具有良好的灵敏度和准确度,操作简便、快捷,适用于大样本量的白条鸭中DHAA残留量的分析检测,也可用于市场流通领域中违禁使用松香脱毛加工的白条鸭的鉴别。
[1] KAMAYA Y, TOKITA N, SUZUKI K, et al. Effects of dehydroabietic acid and abietic acid on survival, reproduction, and growth of the crustacean Daphnia magna[J]. Ecotoxicology and Environmental Safety, 2005, 61(1): 83-88. DOI:10.1016/j.ecoenv.2004.07.007.
[2] PENG Guomei, ROBERTS J C. Solubility and toxicity of resin acids[J]. Water Research, 2000, 34(10): 2779-2785. DOI:10.1016/s0043-1354(99)00406-6.
[3] LISS S N, BICHO P A, SADDLER J N. Microbiology and biodegradation of resin acids in pulp mill effluents: a mini review[J]. Canadian Journal of Microbiology, 1997, 43(7): 599-611. DOI:10.1139/M97-086.
[4] SMITH P A, GARDNER D R, DROWN D B, et al. Detection of resin acid compounds in airborne particulate generated from rosin used as a soldering flux[J]. American Industrial Hygiene Association Journal, 1997, 58(12): 868-875. DOI:10.1080/15428119791012207.
[5] 张苏珍, 卞欢, 王道营, 等. 肉鸭经松香脱毛后表皮松香残留的薄层色谱检测研究[J]. 江西农业学报, 2013, 25(5): 117-119. DOI:10.19386/j.cnki.jxnyxb.2013.05.035.
[6] MITANI K, FUJIOKA M, UCHIDA A, et al. Analysis of abietic acid and dehydroabietic acid in food samples by in-tube soid phase microextraction coupled with liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2007, 1146(1): 61-66. DOI:10.1016/j.chroma.2007.01.118.
[7] 张苏珍, 卞欢, 王道营, 等. 食品中松香残留检测方法的研究进展[J]. 江苏农业科学, 2013, 41(8): 307-308. DOI:10.3969/j.issn.1002-1302.2013.08.116.
[8] 张苏珍, 耿志明, 王道营, 等. 固相萃取-高效液相色谱法检测肉鸭表皮组织中的松香酸[J]. 食品科学, 2014, 35(4): 82-85. DOI:10.7506/spkx1002-6630-201404017.
[9] KERSTEN P J, KOPPER B J, RAFFA K F, et al. Rapid analysis of abietanes in conifers[J]. Journal of Chemical Ecology, 2006, 32(12): 2679-2685. DOI:10.1007/s10886-006-9191-2.
[10] NILSSON U, BERGLUND N, LINDAHL F, et al. SPE and HPLC/UV of resin acids in colophonium-containing products[J]. Journal of Separation Science, 2008, 31(15): 2784-2790. DOI:10.1002/jssc.200800210.
[11] LEE B L, KOH D, ONG H Y, et al. High performance liquid chromatographic determination of dehydroabietic and abietic acids in traditional Chinese medications[J]. Journal of Chromatography A, 1997, 763(1): 221-226. DOI:10.1016/S0021-9673(96)00901-6.
[12] 肖敬川, 王顺兰, 曹卉. 血清碳酸酐酶Ⅱ抗体ELISA方法的建立及应用评价[J]. 国际检验医学杂志, 2018, 39(8): 953-955. DOI:10.3969/j.issn.1673-4130.2018.08.016.
[13] YANG Fan, WANG Huan, YANG Juan, et al. An indirect competitive immunoassay for analysis of carminic acid in meat products[J]. Food Analytical Methods, 2017, 10(11): 3687-3693. DOI:10.1007/S12161-017-0947-6.
[14] LIN Lu, JIANG Wei, XU Liguang, et al. Development of IC-ELISA and immunochromatographic strip assay for the detection of flunixin meglumine in milk[J]. Food and Agricultural Immunology, 2018, 29(1): 193-203. DOI:10.1080/09540105.2017.1364710.
[15] 布冠好, 朱婷伟, 陈复生, 等. 大豆球蛋白间接竞争ELISA检测方法的建立[J]. 河南工业大学学报(自然科学版), 2014, 35(4): 1-5; 11. DOI:10.16433/j.cnki.issn1673-2383.2014.04.005.
[16] 张泽英. 酶联免疫分析技术在兽药残留检测中的应用[J]. 湖北畜牧兽医, 2013, 34(10): 59-61. DOI:10.16733/j.cnki.issn1007-273x.2013.10.027.
[17] 赵芮, 刘磊, 刘丽, 等. 酶联免疫吸附法和液相色谱-质谱联用法分析海洋生物中记忆缺失性贝毒[J]. 分析实验室, 2015, 34(8): 882-885. DOI:10.13595/j.cnki.issn1000-0720.2015.0191.
[18] LI Yanshen, SHI Weimin, SHEN Jianzhong, et al. Development of a rapid competitive indirect ELISA procedure for the determination of deoxynivalenol in cereals[J]. Food and Agricultural Immunology, 2012, 23(1): 41-49. DOI:10.1080/09540105.2011.589046.
[19] 杨小康, 张绘艳, 顾建红, 等. 拉沙里菌素单克隆抗体的研制及间接竞争ELISA检测方法的建立[J]. 中国畜牧兽医, 2017, 44(10): 3049-3056. DOI:10.16431/j.cnki.1671-7236.2017.10.031.
[20] 姚闽娜, 杨旭, 孙远明, 等. 食品中重要有害物残留快速检测技术的研究进展[J]. 热带生物学报, 2016, 7(3): 395-401. DOI:10.15886/j.cnki.rdswxb.2016.03.021.
[21] 卞欢, 仇新媛, 李鹏鹏, 等. 松香人工抗原的合成及多克隆抗体的制备[J]. 食品科学技术学报, 2018, 36(6): 51-57. DOI:10.3969/j.issn.2095-6002.2018.06.008.
[22] GURMIT S, LIGIA V, ANNE-CATHERINE H, et al. Development of a polyclonal antibody-based indirect competitive ELISA for determination of sterigmatocystin in wheat and corn flours[J]. Food Additives and Contaminants: Part A, 2019, 36(2): 327-335. DOI:10.10 80/19440049.2019.1567943.
[23] 张苏珍, 耿志明, 王道营, 等. 肉鸭表皮组织中脱氢枞酸残留的SPEHPLC检测方法[J]. 食品科学, 2014, 35(16): 101-104. DOI:10.7506/spkx1002-6630-201416019.
[24] ZHU Yongzhi, ZHANG Suzhen, GENG Zhiming, et al. Simultaneous determination of abietic acid and dehydroabietic acid resdues in duck meat by HPLC-PAD-FLD[J]. Food Analytical Methods, 2014, 7(8): 1627-1633. DOI:10.1007/s12161-014-9798-6.
[25] 刁开盛, 尹显洪, 王海军. 松香枞酸结构和性质的理论研究[J]. 林业科学, 2009, 45(8): 117-123. DOI:10.3321/j.issn:1001-7488.2009.08.021.
[26] 崔国友, 莫炳荣, 陈文纳. 脱氢枞酸的应用研究进展[J]. 精细与专用化学品, 2006, 14(20): 6-8. DOI:10.3969/j.issn.1008-1100.2006.20.002.
[27] 段文贵, 陈小鹏, 王琳琳, 等. 氢化松香主要化学组成的研究[J]. 林产化学与工业, 2001, 21(1): 1-6. DOI:10.3321/j.issn:0253-2417.2001.01.001.
[28] 张妤琳, 曹玲, 谭力, 等. 液质联用技术用于沉香中非法掺入含松香酸类物质的检测[J]. 中成药, 2011, 33(5): 844-847. DOI:10.3969/j.issn.1001-1528.2011.05.032.
[29] 苏运胜, 吕立盈, 聂少姬. 环境温度对去氢枞酸检测结果的研究[J]. 化工技术与开发, 2012, 41(4): 32-33. DOI:10.3969/j.issn.1671-9905.2012.04.010.
[30] ZHU Yongzhi, ZHANG Suzhen, GENG Zhiming, et al. Analysis of abietic acid and dehydroabietic acid residues in raw ducks and cooked ducks[J]. Poultry Science, 2014, 93(10): 2663-2667. DOI:10.3382/ps.2014-04045.