盐池滩羊是宁夏的特色羊种,2000年被农业部列入国家二级保护品种,由于羊种、饲养方式和饲养水草等的差异,赋予滩羊肉良好的风味[1-2]。近年来,随着羊肉消费人群的增加,羊肉消费量逐年上升,高品质羊肉也越来越受到消费者的推崇。采用盐池滩羊制作的产品口感细腻、味道鲜美,给予消费者良好的口感,但是滩羊肉相关产品仍然主要以餐厅供应为主,还没有完全实现工业化,仅有少数企业生产的少数几种产品在市场上流通,且仍然存在品质不稳定等问题,严重阻碍盐池滩羊加工产业的发展壮大。
盐池滩羊产品口感细腻,具有良好的质构特性,但是工业化生产的产品品质发生很大变化,严重降低了产品的口感和风味,这主要是由于在加工过程中蛋白质和脂肪发生氧化和降解等化学变化[3-4]。目前,随着盐池滩羊产业的逐渐壮大,对盐池滩羊的研究逐渐增加。杨文婷等[5]采用固相微萃取结合气相色谱-质谱法(solid-phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)检测手抓羊肉中挥发性风味物质的种类和含量,结果表明,高温高压杀菌严重破坏了手抓羊肉的风味。权海涛等[6]采用SPME-GC-MS分别对3 月龄和6 月龄宁夏滩羊背最长肌的挥发性风味成分进行分析,发现随着宁夏滩羊月龄的增长,背最长肌内风味化合物种类增多,含量也发生了变化。张同刚等[7]采用SPMEGC-MS测定香辛料对手抓羊肉挥发性风味物质的影响,并对风味成分进行主成分分析。但是对盐池滩羊的研究主要集中在滩羊及其产品的风味方面,对盐池滩羊产品质构品质的研究还比较少。肉制品质构的形成主要与蛋白质的变化有关[8-10],肌原纤维蛋白是羊肉制品中最重要也是含量最高的蛋白质,主要由肌球蛋白、肌动蛋白和肌钙蛋白等组成,这些蛋白质对产品的质构特性具有重要影响[11-13]。适度的加工处理可以使肌原纤维蛋白发生良性变化,从而赋予产品良好的凝胶特性和感官品质,而过度热加工等处理方式会破坏肌原纤维蛋白的结构和特性[14-16], 肌原纤维蛋白变性过程中形成的凝胶体系是决定产品良好质构特性的根本因素。在不同的加热温度下,肌原纤维蛋白逐渐发生变性,从而形成逐渐稳定的凝胶结构,赋予产品良好的质构和口感[17-20]。
本研究以滩羊后腿肉为研究对象,研究不同加热温度对滩羊肉剪切力、蒸煮损失、蛋白质降解指数、肌原纤维蛋白凝胶强度和二级结构的影响,从而为滩羊肉加工产业的发展提供基础支持。
1 材料与方法
1.1 材料与试剂
滩羊后腿肉 宁夏盐池县鑫海食品有限公司;盐酸和三氯乙酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Nicoleti S10傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;TA-XT Plus质构仪 英国Stable Micro Systems公司;UDK 159全自动凯氏定氮仪 意大利 Velp公司;AM-3高速匀浆机 日本精机制作所。
1.3 方法
1.3.1 蒸煮损失测定
将冷冻滩羊去骨后腿肉在4 ℃环境中解冻,分割为形状相似的42 块,质量均为(100±10) g,准确记录质量。用蒸煮袋包装后,分为7 组,每组6 个样品,其中1 组为对照组,室温(20 ℃)放置30 min,其余6 组分别在40、50、70、90、100、121 ℃的水浴中加热30 min后,立即取出,流水冷却至室温,吸干肉表面的水分,称质量。滩羊肉蒸煮损失率按式(1)计算。
1.3.2 剪切力测定
取1.3.1节称质量后的样品,沿肌肉纤维方向取大小为1 cm×1 cm×5 cm的肉块,采用HDP/BSW探头进行检测,测试速率为1.0 mm/s,每个样品重复测定6 次,结果取平均值。
1.3.3 蛋白质降解指数测定
不同温度(40、50、70、90、100、121 ℃)水浴加热后的样品根据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》测定蛋白质含量,以总氮(total nitrogen,TN)含量表示。
将不同温度(40、50、70、90、100、121 ℃)水浴加热后的样品切碎后称取5 g左右(精确到0.001 g),然后加入20 mL 50 mmol/L pH 6.0的柠檬酸缓冲溶液,采用高速匀浆机在冰浴中22 000 r/min匀浆3 次,每次10 s,间隔10 s,离心15 min(12 000×g,4 ℃);快速滤纸过滤,在滤液中加入20 mL 10 g/100 mL三氯乙酸溶液,混合均匀后4 ℃过夜,然后离心5 min(5 000×g,4 ℃);取上清液用柠檬酸缓冲液定容至25 mL,然后根据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》测定非蛋白氮(non-protein nitrogen,NPN)含量[21]。 蛋白质降解指数按式(2)计算。
1.3.4 肌原纤维蛋白凝胶强度测定
肌原纤维蛋白的提取:取滩羊后腿肉于4 ℃解冻,切碎后加入匀浆杯,然后再加入5 倍体积的提取缓冲溶液(含0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L乙二胺四乙酸、10 mmol/L K2HPO4,pH 7.0),10 000 r/min高速匀浆,然后使用冷冻离心机5 000×g离心10 min,提取步骤重复4 次,直到离心洗出的上清液清澈,然后用4 层纱布过滤匀浆后的混合物料,并用0.1 mol/L HCl调节pH值至6.0,最后离心取沉淀即为所需的肌原纤维蛋白,贮藏备用[22-23]。
蛋白凝胶的制备:将肌原纤维蛋白加入到直径20 mm、高50 mm的小玻璃杯中,分为7 组,每组6 个平行,其中1 组为对照组,室温放置30 min,其余6 组分别在40、50、70、90、100、121 ℃条件下加热30 min后,立即取出,流水冷却至室温,形成的肌原纤维蛋白凝胶在4 ℃条件下贮藏过夜,测定样品凝胶强度前室温放置1 h,采用TA-XT Plus型质构仪测定凝胶强度[24-25]。
质构仪参数设定:采用弱凝胶强度模式采集数据,探头型号为P/0.5,测前速率1.0 mm/s,触发力5.0 g,测试速率0.5 mm/s,返回速率10.0 mm/s,测试循环次数1 次,测试距离10 mm。
1.3.5 傅里叶变换红外光谱测定蛋白质二级结构
将1.3.4节制备的肌原纤维蛋白凝胶进行冷冻干燥,然后采用傅里叶变换红外光谱仪对冷冻干燥后的样品进行测定,将测定结果采用Omnic软件进行傅里叶去卷积处理,分析肌原纤维蛋白中α-螺旋、β-折叠、β-转角和无规卷曲等蛋白质二级结构含量的变化[26-27]。
1.4 数据处理
采用Excel软件绘图,利用SPSS Statistics 21.0软件对原始数据进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 不同加热温度对滩羊肉蒸煮损失的影响
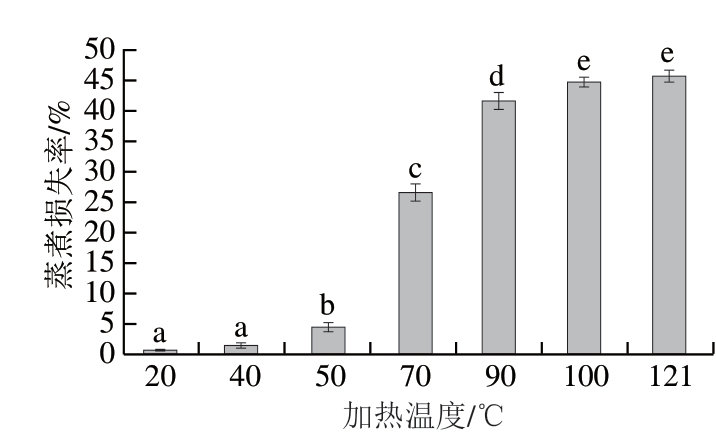
图 1 不同加热温度对滩羊肉蒸煮损失的影响
Fig. 1 Effect of heating temperature on cooking loss of Tan sheep meat
小写字母不同,表示差异显著(P<0.05)。图2~4同。
由图1可知,随着加热温度的升高,滩羊肉蒸煮损失率逐渐增加,在50 ℃以下加热时,滩羊肉的蒸煮损失率很小,且变化不显著,从50 ℃开始,滩羊肉的蒸煮损失率快速增加,当加热温度达100 ℃后,蒸煮损失率的变化开始变缓,100 ℃和121 ℃加热对滩羊肉蒸煮损失率的影响无显著性差异。这可能主要与滩羊肉蛋白质的变性有关。蛋白质具有一定保水性能,但是随着加热温度的升高,蛋白质逐渐发生变性,加热温度40 ℃左右时,肌浆蛋白逐渐发生变性,随后,肌球蛋白、肌动蛋白等蛋白质逐步发生变性,变性作用使蛋白质的疏水基团暴露,蛋白质的稳定结构被破坏,保水性降低,从而使蒸煮损失率逐渐增加。加热温度超过100 ℃时蛋白质已经基本全部变性,因此,蒸煮损失率的变化逐渐平缓。
2.2 不同加热温度对滩羊肉剪切力的影响
由图2可知,随着加热温度的升高,滩羊肉剪切力先升高,在100 ℃达到最大值,随后显示出降低趋势。加热是肉制品的重要加工步骤,对肉制品的品质具有重要影响,剪切力可以反映羊肉嫩度,嫩度是肉制品品质的重要指标[28-29],而加热是改变肉制品嫩度的重要手段。肉制品的嫩度主要与肌原纤维蛋白的热变性有关,从50 ℃左右开始,肌球蛋白、肌动蛋白依次发生变性,肌纤维收缩,肌纤维直径和肌节长度逐渐发生变化;而随着加热温度的升高,加热温度121 ℃时,肌纤维结构遭到破坏,肌丝结构弱化,从而使滩羊肉的剪切力降低。
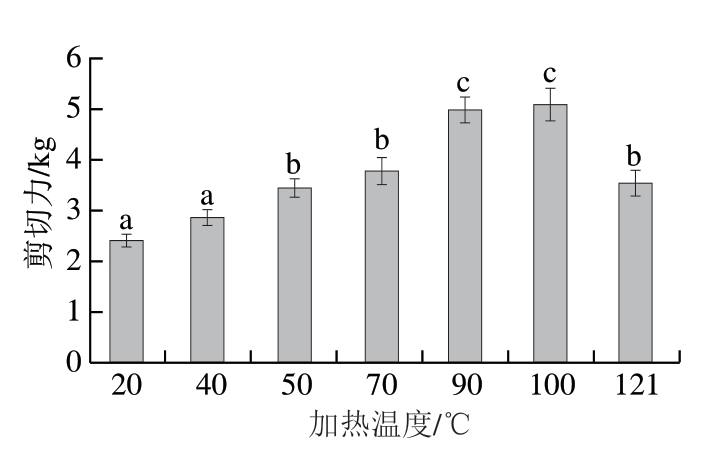
图 2 不同加热温度对滩羊肉剪切力的影响
Fig. 2 Effect of heating temperature on shearing stress of Tan sheep meat
2.3 不同加热温度对滩羊肉蛋白质降解指数的影响
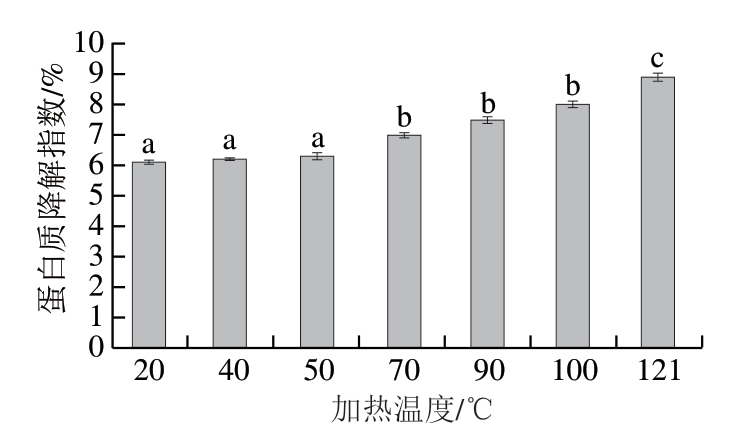
图 3 不同加热温度对滩羊肉蛋白质降解指数的影响
Fig. 3 Effect of heating temperature on protein degradation index of Tan sheep meat
由图3可知,随着加热温度的升高,滩羊肉的蛋白质降解指数逐渐升高,从50 ℃开始显示出显著性差异 (P<0.05),这是由于不同温度加热处理对蛋白质的破坏程度不同,加热处理使蛋白质发生降解,形成多肽、小肽、氨基酸等物质,这些物质对于产品的滋味、香味都有一定影响[30-31]。蛋白质降解指数可以反映肉制品蛋白质的水解程度,蛋白质水解程度较低时,形成的氨基酸、小肽等呈味物质较少,对风味的形成不利,造成肉制品风味不足,降低产品品质;但是蛋白质的过度水解也会影响肉制品品质,造成产品质构软化、滋味变差等问题。因此,蛋白质降解指数是肉制品品质调控的重要指标[32-33]。
2.4 不同加热温度对滩羊肉肌原纤维蛋白凝胶强度的影响
蛋白质凝胶强度可以反映蛋白质热诱导变性形成的凝胶与水的结合能力,是蛋白质的重要凝胶特性之一[34-37]。 由图4可知,随着加热温度的上升,滩羊肉肌原纤维蛋白的凝胶强度逐渐增加,且在50 ℃之后快速上升。肌原纤维蛋白是蛋白质凝胶形成的核心蛋白质,加热温度50 ℃左右时肌球蛋白的变性代表着稳定的蛋白凝胶逐渐形成,当肌动蛋白变性后,稳定的蛋白凝胶结构形成,此时,水与蛋白质形成稳定的相互作用,维持肌原纤维蛋白凝胶结构的稳定;当加热温度继续上升时,肌原纤维蛋白凝胶的强度进一步增加,一方面可能是由于肌球蛋白不断发生变性,另一方面是由于高温作用使部分水分溢出,进一步强化了凝胶强度。
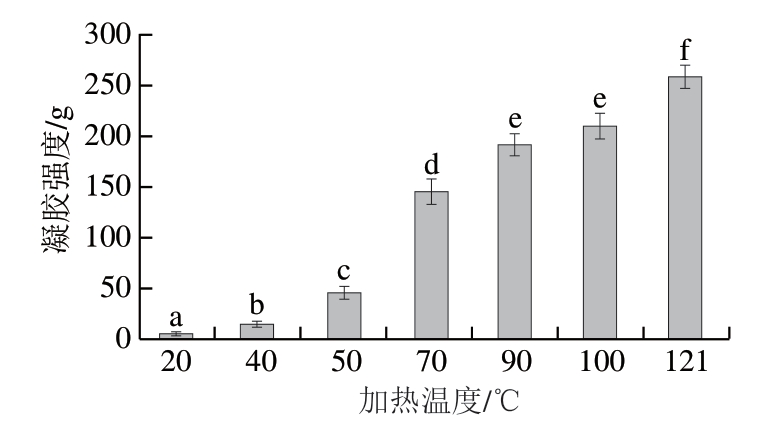
图 4 不同加热温度对滩羊肉肌原纤维蛋白凝胶强度的影响
Fig. 4 Effect of heating temperature on myofibrillar protein gel strength of Tan sheep meat
2.5 不同加热温度对滩羊肉肌原纤维蛋白二级结构的影响
蛋白质的二级结构在红外光谱区域有特征性的吸收带,其中酰胺Ⅰ带在1 600~1 700 cm-1范围内,这也是蛋白质二级结构的代表性区域,α-螺旋位于1 650~1 658 cm-1范围内,β-折叠位于1 600~1 640 cm-1范围内,β-转角位于1 660~1 695 cm-1范围内,无规卷曲位于1 640~1 650 cm-1范围内[38],这也是可以直接反映蛋白质二级结构变化的几个区域。
表 1 不同加热温度对滩羊肉肌原纤维蛋白二级结构的影响
Table 1 Effects of heating temperature on secondary structure of myofibrillar protein in Tan sheep meat%

注:同列小写字母不同,表示差异显著(P<0.05)。
加热温度/℃ α-螺旋 β-折叠 β-转角 无规卷曲20 13.65±0.31e 44.32±0.55d 23.33±0.33c 16.14±0.33a 40 12.31±0.25d 41.36±0.57c 25.31±0.54d 18.33±0.38b 50 9.32±0.61b 37.62±0.38ab 29.14±0.51e 22.74±0.31e 70 13.31±0.21e 43.87±0.74d 22.87±0.65bc 19.32±0.28cd 90 11.28±0.35c 41.35±0.58c 20.44±0.81a 18.85±0.42bc 100 9.21±0.14b 38.31±0.52b 22.38±0.22b 20.34±0.45d 121 7.32±0.25a 36.22±0.65a 25.98±0.37d 22.21±0.28e
由表1可知,随着加热温度的升高,滩羊肉肌原纤维蛋白中α-螺旋和β-折叠的含量显示出先降低后升高再降低的趋势,而β-转角和无规卷曲含量显示出先上升后下降再上升的趋势。蛋白质的二级结构主要依靠非共价键,如氢键、范德华力、静电相互作用等维持结构的稳定性,α-螺旋结构的稳定性主要依靠多肽链上的羰基和氨基端之间的氢键维持,β-折叠表征蛋白质分子间的有序排列,主要通过分子间氢键维持稳定性[25,39]。随着加热温度的上升,滩羊肉肌原纤维蛋白的稳定结构遭到破坏,蛋白质发生变性,在50 ℃左右发生的肌球蛋白变性使α-螺旋和β-折叠结构遭到破坏,结构展开,形成不稳定的β-转角和无规卷曲;随着加热温度的进一步上升,α-螺旋和β-折叠含量回升,这可能是由于加热温度超过70 ℃以后,肌球蛋白、肌动蛋白等发生部分聚合,引起α-螺旋和β-折叠含量上升;随着加热温度的继续升高,α-螺旋和β-折叠含量则进一步下降,β-转角和无规卷曲含量逐渐上升,这可能是由于肌原纤维蛋白的结构在高温下遭到严重破坏,蛋白质的二级结构由稳定向不稳定转变。Tornberg等[40]认为,加热温度的升高会破坏维持蛋白质稳定结构的氢键和静电相互作用,从而导致更大的分子自由能随机分配。因此,加热过程中肌原纤维蛋白二级结构的变化说明,在熵的驱动下肌原纤维蛋白的二级结构不断发生相互转化,变性、聚合等一系列反应造成α-螺旋、β-折叠与β-转角和无规则卷曲结构之间的相互转化。
3 结 论
以滩羊肉为研究对象,研究不同加热温度对滩羊肉嫩度、保水性和肌原纤维蛋白凝胶特性等品质的影响。结果表明,随着加热温度的上升,滩羊肉的蒸煮损失、蛋白质降解指数、肌原纤维蛋白凝胶强度逐渐增加,剪切力先升高再降低,肌原纤维蛋白二级结构显示出从有序到无序的变化趋势,这也与肉制品生产加工过程中品质的变化趋势相一致,适度的热加工可以改善产品的嫩度、口感等品质,但是过度热加工,如121 ℃的高温杀菌严重破坏了蛋白质的结构,造成产品保水性、口感等品质的严重下降。
[1] 张同刚, 苏春霞, 李俊丽, 等. 气相色谱-质谱法分析冷鲜滩羊肉微生物差异代谢物[J]. 食品科学, 2017, 38(10): 291-296. DOI:10.7506/spkx1002-6630-201710047
[2] 徐薇薇, 姚瑞基, 袁维新, 等. 宁夏滩羊后腿肉营养评价及挥发性风味物质分析[J]. 肉类研究, 2017, 31(10): 41-45. DOI:10.7506/rlyj1001-8123-201710008.
[3] 张同刚, 刘敦华, 周静. 顶空固相微萃取气质联用检测手抓羊肉挥发性风味成分[J]. 中国调味品, 2014, 39(9): 111-115. DOI:10.3969/j.issn.1000-9973.2014.09.030.
[4] 牛佳, 陈辉, 罗瑞明. 不同减菌方式对滩羊肉制品货架期的影响[J]. 肉类研究, 2017, 31(7): 34-43. DOI:10.7506/rlyj1001-8123-201707007.
[5] 杨文婷, 柏霜, 牛佳, 等. 不同杀菌方式对手抓羊肉挥发性风味物质的影响[J]. 中国调味品, 2017, 42(6): 109-113; 127. DOI:10.3969/j.issn.1000-9973.2017.06.023.
[6] 权海涛, 杨晓燕, 陈海燕, 等. 不同月龄宁夏滩羊背最长肌挥发性风味成分比较[J]. 养殖与饲料, 2011(11): 1-3. DOI:10.3969/j.issn.1671-427X.2011.11.001.
[7] 张同刚, 刘敦华, 周静. 香辛料对手抓羊肉挥发性风味成分的影响[J]. 中国调味品, 2014, 39(10): 45-49. DOI:10.3696//j.issn.1000-9973.2014.10.011.
[8] BAO Y, BOEREN S, ERTBJERG P. Myofibrillar protein oxidation affects filament charges, aggregation and water-holding[J]. Meat Science, 2017, 135: 102-108. DOI:10.1016/j.meatsci.2017.09.011.
[9] GUO Xijuan, WANG Ruiqi. Changes in secondary structure of myofibrillar protein and its relationship with water dynamic changes during storage of battered and deep-fried pork slices[J]. Food Science and Biotechnology, 2018, 27(6): 1667-1673. DOI:10.1007/s10068-018-0395-0.
[10] PETRÁŠOVÁ M, KRÁL M, POSPIECH M, et al. Pork protein addition effect on structural and qualitative parameters of frankfurtertype sausage[J]. Journal of the Science of Food and Agriculture, 2018, 99(4): 1888-1897. DOI:10.1002/jsfa.9384.
[11] JIA Na, WANG Letian, SHAO Junhua, et al. Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J]. Meat Science, 2017, 127: 45-50. DOI:10.1016/j.meatsci.2017.01.004.
[12] LI Chengliang, PENG An, HE Lichao, et al. Emulsifying properties development of pork myofibrillar and sacroplasmic protein irradiated at different dose: a combined FT-IR spectroscopy and low-field NMR study[J]. Food Chemistry, 2018, 252: 108-114. DOI:10.1016/j.foodchem.2018.01.104.
[13] XIONG Y L. Thermally induced interactions and gelation of combined myofibrillar protein from white and red broiler muscles[J]. Journal of Food Science, 1992, 57(3): 581-585. DOI:10.1111/j.1365-2621.1992.tb08047.x.
[14] UYTTERHAEGEN L, CLAEYS E, DEMEYER D. The effect of electrical stimulation on beef tenderness, protease activity and myofibrillar protein fragmentation[J]. Biochimie, 1992, 74(3): 275-281. DOI:10.1016/0300-9084(92)90126-Y.
[15] SUN X D, ARNTFIELD S D. Gelation properties of chicken myofibrillar protein induced by transglutaminase crosslinking[J]. Journal of Food Engineering, 2012, 107(2): 226-233. DOI:10.1016/j.jfoodeng.2011.06.019.
[16] 吕彤, 林俊杰, 周昌瑜, 等. 热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J]. 农业工程学报, 2016, 32(8): 285-291. DOI:10.11975/j.issn.1002-6819.2016.08.040.
[17] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation[J]. Meat Science, 2006, 70(2): 293-299. DOI:10.1016/j.meatsci.2005.01.015.
[18] WU Mangang, XIONG YoulingL., CHEN Jie, et al. Rheological and microstructural properties of porcine myofibrillar protein-lipid emulsion composite gels[J]. Journal of Food Science, 2009, 74(4): 207-217. DOI:10.1111/j.1750-3841.2009.01140.x.
[19] BERTRAM H C, KOHLER A, BÖCKER U, et al. Heat-induced changes in myofibrillar protein structures and myowater of two pork qualities: a combined FT-IR spectroscopy and low-field NMR relaxometry study[J]. Journal of Agricultural and Food Chemistry, 2006, 54(5): 1740-1746. DOI:10.1021/jf0514726.
[20] XIA Tianlan, CAO Yingying, CHEN Xing, et al. Effects of chicken myofibrillar protein concentration on protein oxidation and water holding capacity of its heat-induced gels[J]. Journal of Food Measurement and Characterization, 2018, 12(4): 2302-2312. DOI:10.1007/s11694-018-9847-8.
[21] 赵冰, 李素, 成晓瑜, 等. 乳酸菌对羊肉风干香肠的影响[J]. 食品科学, 2015, 36(5): 109-114. DOI:10.7506/spkx1002-6630-201505021.
[22] WANG L, ZHANG M, BHANDARI B, et al. Effects of malondialdehyde-induced protein modification on water functionality and physicochemical state of fish myofibrillar protein gel[J]. Food Research International, 2016, 86: 131-139. DOI:10.1016/j.foodres.2016.06.007.
[23] XIONG Y L, BLANCHARD S P. Myofibrillar protein gelation: viscoelastic changes related to heating procedures[J]. Journal of Food Science, 1994, 59(4): 734-738. DOI:10.1111/j.1365-2621.1994.tb08115.x.
[24] 赵冰, 李素, 张顺亮, 等. 蛋白氧化对肌原纤维蛋白凝胶构效关系的影响[J]. 食品科学, 2018, 39(3): 55-61. DOI:10.7506/spkx1002-6630-201803009.
[25] 李清正, 张顺亮, 罗永康, 等. 温度对复合肌原纤维蛋白结构及其表面疏水性的影响[J]. 肉类研究, 2017, 31(2): 6-10. DOI:10.7506/rlyj1001-8123-201702002.
[26] 赵冰, 张顺亮, 李素, 等. 脂肪氧化对肌原纤维蛋白氧化及其结构和功能性质的影响[J]. 食品科学, 2018, 39(5): 40-46. DOI:10.7506/spkx1002-6630-201805007.
[27] 杨玉玲, 游远, 彭晓蓓, 等. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J]. 中国农业科学, 2014, 47(10): 2013-2020. DOI:10.3864/j.issn.0578-1752.2014.10.015.
[28] 达迪拉·买买提, 李芳, 张文, 等. 梯度加热对羊肉嫩度的影响[J]. 肉类研究, 2016, 30(4): 11-16. DOI:10.15922/j.cnki.rlyj.2016.04.003.
[29] 李桂霞, 李欣, 李铮, 等. 宰后僵直及成熟过程中羊背最长肌理化性质的变化[J]. 食品科学, 2017, 38(21): 112-118. DOI:10.7506/spkx1002-6630-201721018.
[30] 李静. 不同氧化程度的脂肪对四川香肠成熟过程中品质影响的 研究[D]. 雅安: 四川农业大学, 2016: 5-7.
[31] KIM Y H, HUFF-LONERGAN E, SEBRANEK J G, et al. Highoxygen modified atmosphere packaging system induces lipid and myoglobin oxidation and protein polymerization[J]. Meat Science, 2010, 85(4): 759-767. DOI:10.1016/j.meatsci.2010.04.001.
[32] 马志方. 低钠传统金华火腿加工过程中脂质和蛋白质水解及氧化的研究[D]. 南京: 南京农业大学, 2016: 41-43.
[33] 马志方, 张雅玮, 惠腾, 等. 低钠传统金华火腿加工过程中理化特性的变化[J]. 食品工业科技, 2016, 37(14): 118-123. DOI:10.13386/j.issn1002-0306.2016.14.015.
[34] 王苑. 不同处理方式对肌原纤维蛋白和大豆分离蛋白混合凝胶特性的影响[D]. 南京: 南京农业大学, 2007: 1-8.
[35] YUANPEI G, HIDETO F, SHANGGUI D, et al. Effect of emulsifying stability of myofibrillar protein on the gel properties of emulsified surimi gel[J]. Food Science and Nutrition, 2018, 6(5): 1229-1237. DOI:10.1002/fsn3.663.
[36] XIA Tianlan, ZHAO Xue, YU Xiaoling, et al. Negative impacts of in vitro oxidative stress on the quality of heat-induced myofibrillar protein gelation during refrigeration[J]. International Journal of Food Properties, 2018, 21(1): 2205-2217. DOI:10.1080/10942912.2018.1505754.
[37] TONG Qunyi, CHEN Long, WANG Weijun, et al. Effects of konjac glucomannan and acetylated distarch phosphate on the gel properties of pork meat myofibrillar proteins[J]. Journal of Food Science and Technology, 2018, 55(8): 2899-2909. DOI:10.1007/s13197-018-3208-9.
[38] 吴伟. 蛋白质氧化对大豆蛋白结构和凝胶性质的影响[D]. 无锡: 江南大学, 2010: 3-6.
[39] 耿蕊. pH偏移结合温和热处理对大豆分离蛋白结构及功能性的影响及其与肌原纤维蛋白的互作[D]. 哈尔滨: 东北农业大学, 2015: 4-9.
[40] TORNBERG E, EDIRIWEERA N. Coalescence stability of proteinstabilized emulsions[J]. Food Emulsions and Foams, 2005: 52-63. DOI:10.1533/9781845698300.52.