伊维菌素(ivermectin,IVM),又名22,23-二氢阿巴美丁或依维菌素[1-2],化学式为C48H74O14,是由链霉菌(Streptomyces avermitilis)发酵产生的十六元大环内酯化合物[3-5],对体内外寄生虫,特别是线虫和节肢动物具有良好的驱杀功效,是一种高效、广谱、低毒抗生素类抗寄生虫药物[6-8],广泛用于治疗家畜的胃肠线虫病、牛皮蝇蛆、纹皮蝇蛆、羊鼻蝇蛆和猪、羊疥螨病[9-11]。我国农业部规定IVM在牛肾脏组织中的最高残留限量(maximum residue limit,MRL)为30 μg/kg;欧盟(EU)No.418/2014号法规规定IVM在动物源性食品中的MRL为30~100 μg/kg;日本“食品中残留农业化学品肯定列表制度”规定IVM在牛、猪、马、羊等畜肉中的MRL为10~100 μg/kg[6-7,9]。但IVM会通过动物饲料中添加、动物寄生虫预防和治疗等途径导致家畜体内IVM残留,经食物链进入人体,若长期误食含有IVM残留的家畜肉,将导致人体神经系统及生殖系统紊乱[12-14],甚至威胁人类健康。因此,研究畜肉中IVM残留量检测方法对于指导IVM的安全及合理使用具有重要意义。
目前,IVM残留量的测定方法有酶联免疫吸附法[15-16]、液相色谱法[17-19]和高效液相色谱-质谱联用法[20-22],其中酶联免疫吸附法仪器简单易携、灵敏度高,但易出现假阳性,液相色谱-荧光法样品前处理繁琐,需衍生化,且灵敏度不高[23-24],高效液相色谱-质谱联用法具有高灵敏度、高选择性、抗干扰能力强等优点,已成为药物残留分析研究中不可或缺的技术[25-26]。QuEChERS(quick, easy, cheap, effective, rugged, safe)是一种样品快速前处理技术[27-29],具有回收率高、精确度高、操作简便等优势[30]。本研究采用QuEChERS技术提取牛肉、猪肉、马肉、山羊肉和绵羊肉中的IVM,经碱性氧化铝固相萃取柱净化后氮吹浓缩,以乙腈和2.5 mmol/L乙酸铵水溶液为流动相,经Kinetex C18色谱柱洗脱分离,采用电喷雾离子源(electron spray ionization,ESI),多反应监测(multiple reaction monitoring,MRM)正离子模式进行分析,建立超高效液相色谱-串联质谱(ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法测定畜肉中IVM含量的分析方法,提供准确度高、灵敏度好的检测技术,为畜牧养殖和畜肉质量安全提供保障。
1 材料与方法
1.1 材料与试剂
IVM标准物质(纯度大于99%) 美国AccuStandard公司;甲醇、乙腈、丙酮、正己烷、乙酸乙酯、二氯甲烷、乙酸铵(均为色谱纯) 美国Tedia公司;其余试剂均为分析纯 天津市科密欧化学试剂有限公司;牛肉、猪肉、马肉、山羊肉、绵羊肉(各6 份)乌兰察布四子王旗农贸市场。
1.2 仪器与设备
UPLC Xevo TQ MS超高效液相色谱-三重四极杆串联质谱仪 美国Waters公司;S10高速匀浆机 宁波新芝生物科技股份有限公司;CPA324S电子天平、Arium confort Ⅱ超纯水器 德国Sartorius公司;5810R高速冷冻离心机 德国Eppendorf公司;WH-12水浴氮吹仪杭州佑宁仪器有限公司;碱性氧化铝固相萃取柱(规格500 mg/6 mL) 天津博纳艾杰尔科技有限公司。
1.3 方法
1.3.1 样品前处理
取新鲜或解冻的畜肉组织,剪碎,10 000 r/min匀浆1 min;准确称取5.0 g匀浆后的畜肉,置于50 mL离心管中,依次加入20 mL纯乙腈、5 g无水硫酸镁、2 g氯化钠和150 mg乙二胺-N-丙基硅烷(ethylenediamine-N-propyl silane,PSA),8 000 r/min匀浆10 min后,10 000 r/min离心5 min;上清液经碱性氧化铝柱净化,收集流出液;用5 mL乙腈淋洗小柱,合并流出液,45 ℃氮吹近干,用乙腈定容至1 mL,0.22 μm微孔有机滤膜过滤,供UPLC-MS/MS测定。
1.3.2 溶液配制
标准储备液:准确称取IVM标准品10 mg,用乙腈溶解并定容至100 mL,配制成质量浓度为100 μg/mL的标准储备液。
1.3.3 液相色谱条件
色谱柱为Kinetex C18(150 mm×2.1 mm,1.7 µm);流动相A为乙腈,流动相B为2.5 mmol/L乙酸铵水溶液;流速0.2 mL/min;进样量10.0 μL;柱温35 ℃。梯度洗脱程序:0~2.0 min,10%流动相A;2.0~4.0 min,10%~90%流动相A;4.0~5.0 min,90%流动相A;5.0~7.0 min,90%~10%流动相A;7.0~10.0 min,10%流动相A。
1.3.4 质谱条件
离子化模式:ESI,采用正离子扫描模式;采集模式:MRM;离子源温度200 ℃;脱溶剂气温度600 ℃;毛细管电压2.2 kV;碰撞气:氩气(纯度>99.99%);雾化气:氮气(纯度>99.99%),流速3 mL/min;驻留时间0.05 s;定性离子对:m/z 890.3/305.1;定量离子对:m/z 890.3/567.4;锥孔电压50 V;碰撞能量35 eV。
1.4 数据处理
每组实验重复6 次,结果取平均值,采用SPSS 16.0软件进行数据分析。
2 结果与分析
2.1 QuEChERS提取溶剂和净化柱的选择
根据IVM的理化性质,结合QuEChERS方法,分析甲醇、乙腈、丙酮、乙酸乙酯、二氯甲烷和正己烷6 种溶剂以及混合型阳离子柱(MCX)、混合型阴离子柱(MAX)、中性氧化铝柱(AluN)、酸性氧化铝柱(AluA)和碱性氧化铝柱(AluB)5 种固相萃取柱对畜肉中IVM的提取和净化效果。结果表明:乙腈、丙酮和乙酸乙酯对畜肉中IVM均具有较好的提取效果,提取回收率为85.7%~98.6%,但甲醇和乙酸乙酯提取液杂质峰较多,后续固相萃取净化效果不理想,这可能是由于畜肉中高含量的脂肪和蛋白质对IVM吸附所致;乙腈提取液杂质峰较少,后续固相萃取净化完全,这可能是由于乙腈极性较大,对畜肉中蛋白质沉淀效果好,提取回收率为98.6%;碱性氧化铝柱对IVM的净化效果最好,加标回收率最高,达99.3%。因此选择乙腈作为提取溶剂,选择碱性氧化铝作为净化柱。
2.2 UPLC色谱柱的选择
在相同流动相条件下,以色谱柱的IVM色谱响应值、分离度和重复性为指标,分析安捷伦Eclipse XDB C18、迪马Endeavorsil C18、沃特世BEH C18、飞诺美Kinetex C18等不同商品化UPLC柱对畜肉中IVM的分离效果。
表1 不同色谱柱对畜肉中IVA的分离效果
Table 1 Separation efficiencies of IVA with different chromatographic columns
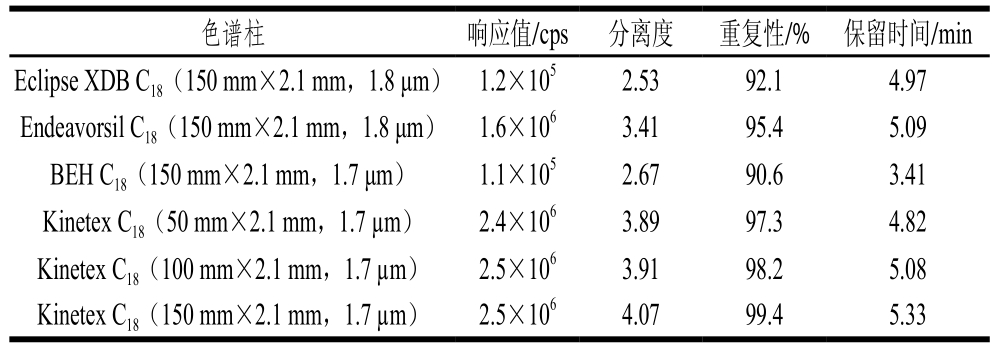
色谱柱 响应值/cps 分离度 重复性/% 保留时间/min Eclipse XDB C18(150 mm×2.1 mm,1.8 μm) 1.2×105 2.53 92.1 4.97 Endeavorsil C18(150 mm×2.1 mm,1.8 μm) 1.6×106 3.41 95.4 5.09 BEH C18(150 mm×2.1 mm,1.7 μm) 1.1×105 2.67 90.6 3.41 Kinetex C18(50 mm×2.1 mm,1.7 µm) 2.4×106 3.89 97.3 4.82 Kinetex C18(100 mm×2.1 mm,1.7 µm) 2.5×106 3.91 98.2 5.08 Kinetex C18(150 mm×2.1 mm,1.7 µm) 2.5×106 4.07 99.4 5.33
由表1可知:采用Kinetex C18色谱柱不仅可以有效分离IVM,而且目标峰响应值高、重复性好;采用相同粒径(1.7 µm)和内径(2.1 mm)的Kinetex C18色谱柱时,短柱(50、100 mm)分析时间较短,但个别复杂基质样品中目标物的峰形较差,而150 mm柱分析时间适中、重复性好,可有效提高复杂基质样品中共提取基质成分与IVM的分离效果,有效提高IVM的测定准确度和重复性。故分析柱选择Kinetex C18色谱柱(150 mm×2.1 mm,1.7 µm)。
2.3 流动相的选择
以Kinetex C18色谱柱(150 mm×2.1 mm,1.7 µm)为分析柱,分析甲醇/乙腈-水、甲醇/乙腈-0.1%甲酸水溶液、甲醇/乙腈-不同浓度(1.5~3.0 mmol/L)乙酸铵溶液等作为流动相对畜肉中IVM的分离效果及质谱响应情况。
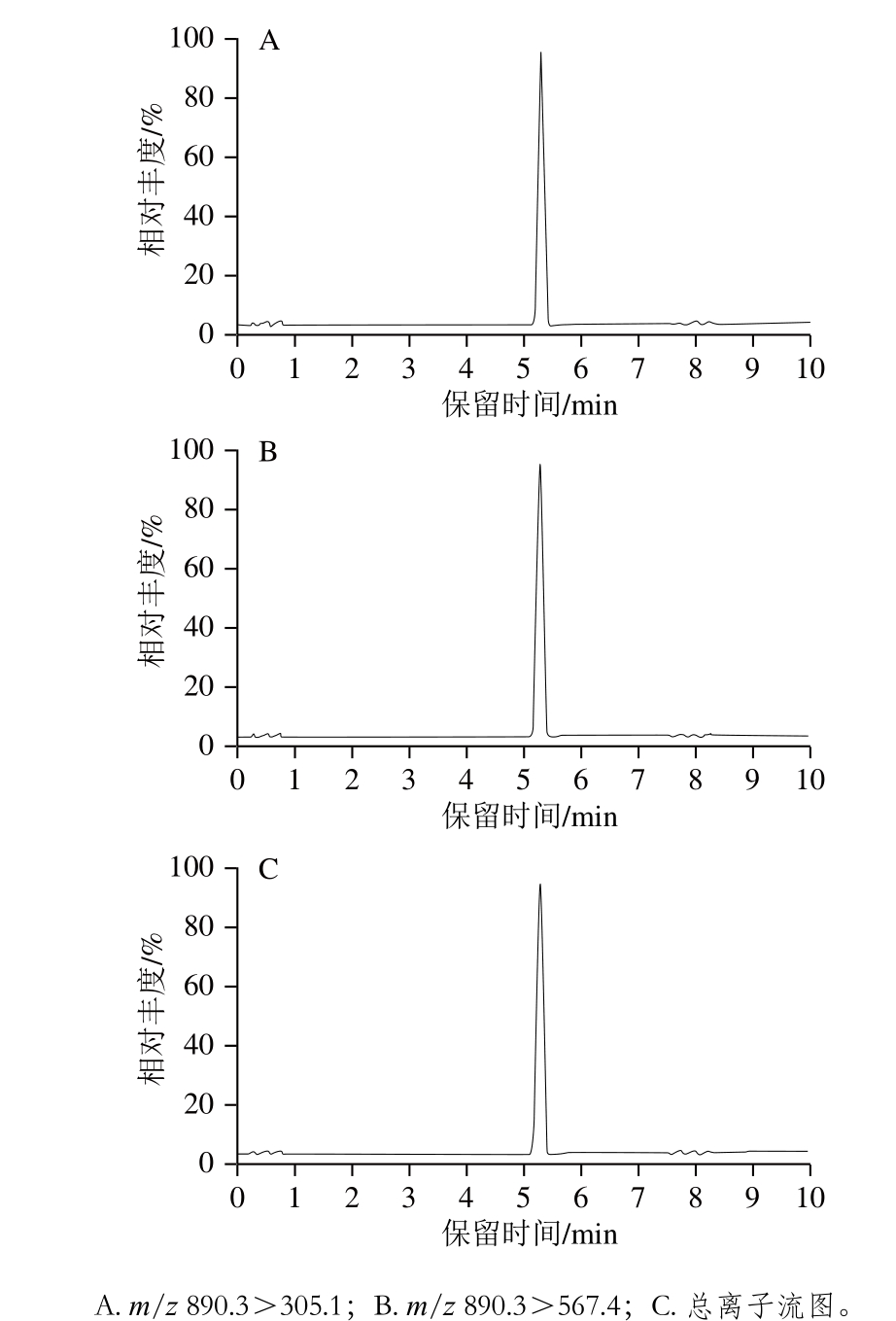
图1 乙腈-2.5 mmol/L乙酸铵水溶液为流动相时IVM的总离子流图(50.0 ng/mL)
Fig. 1 Total ion current chromatogram of IVM (50.0 ng/mL)with acetonitrile-2.5 mmol/L ammonium acetate aqueous solution as mobile phase
由图1可知:有机相选用乙腈比选用甲醇具有更良好的峰形和响应值;水相选用乙酸铵水溶液比纯水、0.1%甲酸水溶液更容易使IVM形成带正电荷的分子离子峰[M+NH4]+,且质谱响应值良好,尤其是采用2.5 mmol/L乙酸铵水溶液时,IVM的分离效果良好,保留时间适中,且色谱峰峰形尖锐、对称。故选择乙腈-2.5 mmol/L乙酸铵水溶液作为流动相。
2.4 质谱条件的优化

图2 IVM二级质谱图
Fig. 2 Tandem mass spectrum of IVM
以在线流动注射方式将质量浓度1.0 μg/mL IVM标准溶液注入ESI离子源中,分别在ESI+和ESI-模式下进行质谱分析(母离子扫描)。结果表明:在ESI+模式下可产生带正电荷的分子离子峰[M+H]+、[M+NH4]+、[M+Na]+和[M+H+H2O]+,其中[M+NH4]+分子离子峰响应值高、抗干扰,故选择[M+NH4]+作为母离子(m/z 890.3)(一级质谱分析);对母离子[M+NH4]+进行子离子扫描,优化锥孔电压和碰撞能量,获得相对强度较大的碎片离子m/z 305.1、m/z 307.1和m/z 567.4,其中m/z 305.1结构式可能为C14H25O7,m/z 567.4结构式可能为C34H47O7(二级质谱分析)。结果表明,选择ESI+模式,母离子为m/z 890.3,定性子离子为m/z 305.1;定量子离子为m/z 567.4。
2.5 基质效应(matrix effect,ME)评估
为提高本研究所建立的UPLC-MS/MS法测定畜肉中IVM的特异性,降低样品基质对IVM测定的干扰,采用标准添加法,用IVM在畜肉和纯乙腈2 种不同基质中的响应值比值(ME=A/B×100%,其中A为畜肉中IVM的响应值,B为纯乙腈中IVM的响应值)来评估ME。若90%<ME<110%,表明不存在基质效应;若ME<90%或ME>110%,表明存在基质减弱或基质增强效应。
表2 IVM在畜肉中的基质效应
Table 2 Matrix effects of IVM in pure acetonitrile and livestock meat
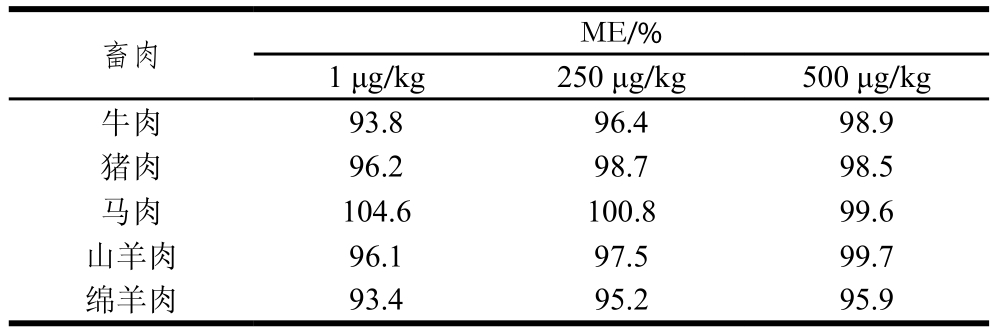
畜肉 ME/%1 μg/kg 250 μg/kg 500 μg/kg牛肉 93.8 96.4 98.9猪肉 96.2 98.7 98.5马肉 104.6 100.8 99.6山羊肉 96.1 97.5 99.7绵羊肉 93.4 95.2 95.9
由表2可知,采用本研究所建立的UPLC-MS/MS法测定畜肉中IVM,ME为93.4%~104.6%,即不存在基质效应。
2.6 线性范围、检出限与定量限
用不含目标物的空白基质依次配制IVM质量浓度分别为1.0、5.0、50.0、250.0、500.0 ng/mL的标准溶液,按本研究所建立的UPLC-MS/MS法测定,以IVM质谱相对丰度(y)为纵坐标,以IVM质量浓度(x)为横坐标,绘制标准曲线。结果表明,在1.0~500.0 ng/mL质量浓度范围内,IVM质谱相对丰度与质量浓度呈良好的线性关系,线性回归方程为y=3.24×105x+2.25×103(r=0.999 7)。在不含目标物的空白畜肉基质中加入低添加量的IVM标准物质,采用国际纯粹与应用化学联合会规定的检出限和定量限测定方法,平行测定20 次,以信噪比(RS/N)=3为检出限,RS/N=10为定量限。结果表明,检出限为0.3 μg/kg,定量限为1.0 μg/kg。
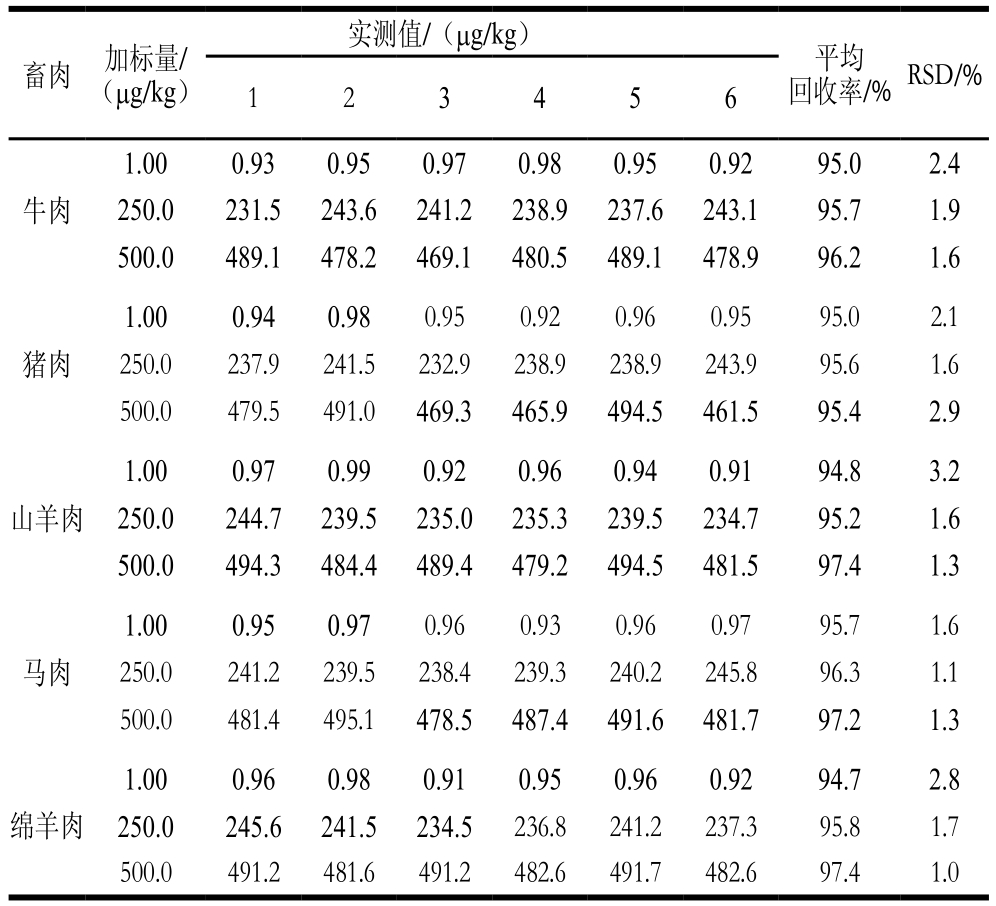
2.7 加标回收率和精密度
在不含目标物的空白牛肉、猪肉、马肉、山羊肉、绵羊肉中分别加入IVM标准物质,每种畜肉中IVM添加量分别为1.0、250.0、500.0 μg/kg,按本研究所建立的UPLC-MS/MS法测定加标回收率和精密度。
表3 回收率和精密度(n=6)
Table 3 Recovery and precision (n= 6)
注:RSD. 相对标准偏差(relative standard deviation)。
畜肉 加标量/(μg/kg)实测值/(μg/kg) 平均回收率/%RSD/%1 2 3 4 5 6牛肉1.00 0.93 0.95 0.97 0.98 0.95 0.92 95.0 2.4 250.0 231.5 243.6 241.2 238.9 237.6 243.1 95.7 1.9 500.0 489.1 478.2 469.1 480.5 489.1 478.9 96.2 1.6猪肉1.00 0.94 0.98 0.95 0.92 0.96 0.95 95.0 2.1 250.0 237.9 241.5 232.9 238.9 238.9 243.9 95.6 1.6 500.0 479.5 491.0 469.3 465.9 494.5 461.5 95.4 2.9山羊肉1.00 0.97 0.99 0.92 0.96 0.94 0.91 94.8 3.2 250.0 244.7 239.5 235.0 235.3 239.5 234.7 95.2 1.6 500.0 494.3 484.4 489.4 479.2 494.5 481.5 97.4 1.3马肉1.00 0.95 0.97 0.96 0.93 0.96 0.97 95.7 1.6 250.0 241.2 239.5 238.4 239.3 240.2 245.8 96.3 1.1 500.0 481.4 495.1 478.5 487.4 491.6 481.7 97.2 1.3 1.00 0.96 0.98 0.91 0.95 0.96 0.92 94.7 2.8 250.0 245.6 241.5 234.5 236.8 241.2 237.3 95.8 1.7 500.0 491.2 481.6 491.2 482.6 491.7 482.6 97.4 1.0绵羊肉
由表3可知,在1.0~500.0 μg/kg添加量范围内,IVM的平均加标回收率为94.7%~97.4%,RSD为1.0%~3.2%。
2.8 实际样品测定与分析

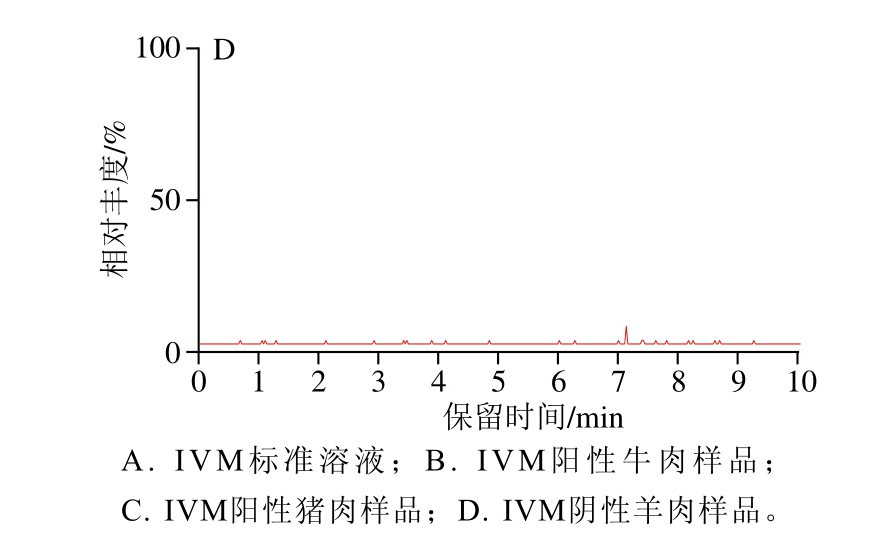
图3 典型畜肉样品中IVM的总离子流图
Fig. 3 Total ion current chromatogram of IVM in real samples
针对随机选购的30 份畜肉,按本研究所建立的UPLC-MS/MS法测定畜肉中IVM含量。由图3可知,30 份被检畜肉中,2 份畜肉检出IVM残留(其余28 份样品检测结果为阴性),检出量分别为5.8、13.7 μg/kg,说明目前所售畜肉中存在IVM残留风险。鉴于IVM在禽畜体内吸收、分布、转化和消除均需要一段时间,为避免畜肉中IVM残留量超标,必须严格执行休药期。
2.9 与现有方法的比较
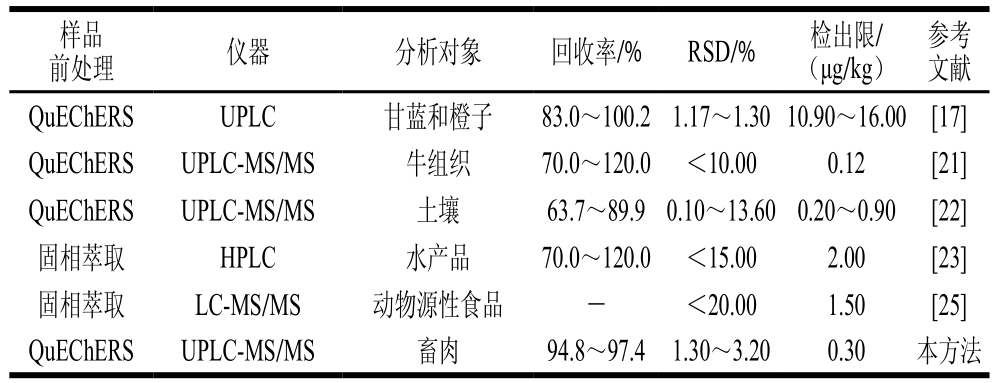
以使用仪器、分析对象、检出限、回收率和精密度为评估指标,将本研究所建立的UPLC-MS/MS法与现有国家标准及文献报道中的测定方法进行比较。
表4 与现有方法的比较
Table 4 Comparison of the developed method with existing methods
注:-. 文献中未提及。
参考文献QuEChERS UPLC 甘蓝和橙子 83.0~100.21.17~1.3010.90~16.00 [17]QuEChERS UPLC-MS/MS 牛组织 70.0~120.0 <10.00 0.12 [21]QuEChERS UPLC-MS/MS 土壤 63.7~89.90.10~13.600.20~0.90 [22]固相萃取 HPLC 水产品 70.0~120.0 <15.00 2.00 [23]固相萃取 LC-MS/MS 动物源性食品 - <20.00 1.50 [25]QuEChERS UPLC-MS/MS 畜肉 94.8~97.4 1.30~3.20 0.30 本方法前处理 仪器 分析对象 回收率/% RSD/% 检出限/(μg/kg)样品
由表4可知,不同方法适用于不同基质样品,本研究所建立的UPLC-MS/MS法在回收率、RSD、检出限等方面均符合方法学要求,且该方法准确度高、精密度好。
3 结 论
采用QuEChERS技术提取畜肉中的IVM,经碱性氧化铝固相萃取柱净化,Kinetex C18色谱柱洗脱分离,建立UPLC-MS/MS法测定畜肉中IVM残留量的分析方法。该方法样品前处理简单、准确度高、精密度好,可为畜牧养殖和畜肉质量安全监控提供检测方法。
[1] 林诗宇, 赵谨, 李霞辉, 等. 注射用伊维菌素混合胶束的急性毒性试验[J]. 四川农业大学学报, 2016, 34(1): 106-109. DOI:10.16036/j.issn.1000-2650.2016.01.019.
[2] GAMBOA G V U, PALMA S D, LIFSCHITZ A, et al. Ivermectinloaded lipid nanocapsules: toward the development of a new antiparasitic delivery system for veterinary applications[J].Parasitology Research, 2016, 115(5): 1945-1953. DOI:10.1007/s00436-016-4937-1.
[3] HEDAYATI M, SADEGHI A, MAROUFPOOR M, et al.Transgenerational sublethal effects of abamectin and pyridaben on demographic traits of Phytonemus pallidus (Banks) (Acari:Tarsonemidae)[J]. Ecotoxicology, 2019, 28(4): 467-477. DOI:10.1007/s10646-019-02040-2.
[4] GOBBI F, DORA B, FRANCESCA T, et al. Efficacy of high-dose albendazole with ivermectin for treating imported loiasis, Italy[J].Emerging Infectious Diseases, 2019, 25(8): 1574-1576. DOI:10.3201/eid2508.190011.
[5] 毕然. 各种氮源物质对阿维链霉菌GB-156发酵生产阿维菌素的影响[J]. 食品与发酵工业, 2006, 37(11): 116-118. DOI:10.3321/j.issn:0253-990X.2006.11.029.
[6] BALKHAIR A, TAHER H B, AL BUSAIDI I, et al. Disseminated strongyloidiasis complicated by alveolar hemorrhage, meningitis, and septic shock treated with albendazole and subcutaneous ivermectin[J].International Journal of Infectious Diseases, 2019, 86(9): 44-46.DOI:10.1016/j.ijid.2019.06.026.
[7] ISHIKAWA I, IWASA M. Toxicological effect of ivermectin on the survival, reproduction, and feeding activity of four species of dung beetles (Coleoptera: Scarabaeidae and Geotrupidae) in Japan[J].Bulletin of Entomological Research, 2019, 13(6): 1-9. DOI:10.1017/S0007485319000385.
[8] 冶海珍, 李艳. 羔羊伊维菌素中毒的防治[J]. 养殖与饲料, 2019,18(6): 97-98. DOI:10.13300/j.cnki.cn42-1648/s.2019.06.046.
[9] 陈吉香, 谢体波, 冯才伟. 阿维菌素、埃比菌素的残留检测[J].食品研究与开发, 2018, 39(8): 119-124. DOI:10.3969/j.issn.1005-6521.2018.08.021.
[10] 谢成丽. 伊维菌素治疗牦牛疥螨病的疗效试验[J]. 农业工程技术,2018, 38(8): 19-20. DOI:10.16815/j.cnki.11-5436/s.2018.08.014.
[11] 朱庆贺, 陈曦, 王丽坤, 等. 伊维菌素微乳的研制及质量评价[J].动物医学进展, 2018, 39(1): 67-72. DOI:10.16437/j.cnki.1007-5038.2018.01.012.
[12] BRANCATO A, BROCCA D, CABRERA L C, et al. Modification of the existing maximum residue level for abamectin in citrus fruits[J].EFSA Journal, 2018, 16(4): 5254-5264. DOI:10.2903/j.efsa.2018.5254.
[13] JENNINA T W, SENAN A, BERMUDEZ I, et al. Species specific RNA A-to-I editing of mosquito RDL modulates GABA potency and influences agonistic, potentiating and antagonistic actions of ivermectin[J]. Insect Biochemistry and Molecular Biology, 2018,93(2): 1-11. DOI:10.1016/j.ibmb.2017.12.001.
[14] AOYAMA T, UCHIYAMA A, KON K, et al. Ivermectin, an antiparasitic agent, attenuates DDC-induced sclerosing cholangitis with biliary fibrosis in mice[J]. Gastroenterology, 2017, 152(5): S1185.DOI:10.1016/S0016-5085(17)33953-7.
[15] 程茹, 吴玉娥, 陈吉香, 等. ELISA法测定鸡肉和虾肉中阿维菌素类药物的残留[J]. 安徽农业科学, 2018, 46(9): 157-160. DOI:10.13989/j.cnki.0517-6611.2018.09.051.
[16] 李玉立, 陈可心, 唐塔娅, 等. 动物源样品中阿维菌素类药物残留检测方法研究进展[J]. 中国畜牧兽医, 2018, 45(11): 3296-3304.DOI:10.16431/j.cnki.1671-7236.2018.11.038.
[17] 覃国新, 劳水兵, 莫仁甫, 等. 超高效液相色谱法测定甘蓝和橙子中的阿维菌素残留[J]. 现代食品科技, 2018, 34(4): 227-231.DOI:10.13982/j.mfst.1673-9078.2018.04.034.
[18] 周海明. 高效液相色谱-荧光法测定谷物类农产品中阿维菌素、埃玛菌素和伊维菌素的多残留量[J]. 浙江农业科学, 2011(5): 1134-1138. DOI:10.16178/j.issn.0528-9017.2011.05.037.
[19] 宋永青, 郭文萍. 动物组织中伊维菌素残留量的高效液相色谱法测定[J]. 肉类研究, 2009, 23(5): 51-53.
[20] 李光满, 夏明星, 唐璜, 等. 液相色谱-串联质谱法检测食用动物血液中伊维菌素残留[J]. 中国畜牧杂志, 2017, 53(10): 106-109.DOI:10.19556/j.0258-7033.2017-10-106.
[21] DUVAN E H O, YUDY A C O, GUSTAVO A P M. Development and validation of a highly sensitive quantitative/confirmatory method for the determination of ivermectin residues in bovine tissues by UHPLCMS/MS[J]. Food Chemistry, 2017, 221(4): 891-897. DOI:10.1016/j.foodchem.2016.11.077.
[22] 谭华东, 张汇杰, 武春媛. QuEChERS/UPLC-MS/MS法快速测定土壤中吡虫啉、啶虫脒与阿维菌素残留[J]. 农药, 2019, 58(1): 45-49.DOI:10.16820/j.cnki.1006-0413.2019.01.012.
[23] 中华人民共和国农业部, 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 水产品中阿维菌素和伊维菌素多残留的测定高效液相色谱法: GB 29695—2013[S]. 北京: 中国标准出版社, 2013.
[24] 赵莉, 谢显传, 占绣萍. 高效液相色谱-荧光法同时检测蔬菜中阿维菌素、甲氨基阿维菌素苯甲酸盐和伊维菌素的多残留量[J].中国农业科学, 2010, 43(16): 3467-3472. DOI:10.3864/j.issn.0578-1752.2010.16.025.
[25] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 动物源性食品中阿维菌素类药物残留量的测定 液相色谱-串联质谱法: GB/T 21320—2007[S]. 北京: 中国标准出版社, 2007.
[26] 熊永, 万亚美, 郭聪聪, 等. 螺虫乙酯·伊维菌素在梨和土壤中的残留分析方法[J]. 河北农业大学学报, 2018, 41(4): 82-86. DOI:10.13320/j.cnki.jauh.2018.0083.
[27] 李丽春, 刘书贵, 尹怡, 等. QuECHRS结合UPLC-MS/MS法测定水产品中酰胺醇类抗生素残留及基质效应[J]. 中国渔业质量与标准,2018, 8(6): 32-39. DOI:10.3969/j.issn.2095-1833.2018.06.005.
[28] 方从容, 高洁, 王雨昕, 等. QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中125 种兽药残留[J]. 色谱, 2018, 36(11): 1119-1131.DOI:10.3724/SP.J.1123.2018.06007.
[29] ARCHIBOLD B K, MARC S H. Validation of a modified QuEChERS method for the analysis of organochlorine pesticides in fatty biological tissues using two-dimensional gas chromatography[J].Journal of Chromatography B, 2019, 1105(1): 85-92. DOI:10.1016/j.jchromb.2018.12.010.
[30] 王文兰, 刘艳辉, 祖岫杰, 等. 鱼肌肉中阿维菌素和伊维菌素药物残留测定的样品前处理[J]. 分析试验室, 2015, 34(4): 475-479.DOI:10.13595/j.cnki.issn1000-0720.2015.0107.