牦牛是一种生长在海拔3 000 m以上高寒缺氧地带的特有物种,能够适应高原恶劣环境,享有“高原之舟”的美誉[1]。特殊的生活环境使牦牛肉肉质鲜美,同时具有高蛋白、低脂肪、低热量、氨基酸种类与胡萝卜素含量丰富等特点[2]。牦牛生长的独特地理环境赋予牦牛肉得天独厚的品质,但因其屠宰时年龄较大,导致牦牛肉肉质比普通牛肉嫩度差,从而使牦牛肉产品的开发和牦牛产业化发展受到一定影响[3]。肉的食用品质和化学组成会随着动物年龄的增长而改变,年龄因素引起的嫩度差异可能与动物成熟过程中肌肉组织结构和化学组成,特别是结缔组织的变化有关。嫩度一般用剪切力来表示,可溶性蛋白含量、剪切力和纤维直径等与肉的嫩度呈强相关性。Mills等[4]将剪切力小于3.0 kg、3.0~4.6 kg和大于4.6 kg的牛肉分别定义为嫩牛肉、中等嫩度牛肉和低嫩度牛肉。徐瑛等[5]研究发现,3 岁龄以下的牦牛肉(剪切力3.59 kg)属于中等嫩度牛肉,3 岁龄以上的牦牛肉均属于低嫩度牛肉。杨玉莹等[6]研究表明,同一年龄段的黄牛肉嫩度较好,其次为水牛肉,而牦牛肉嫩度最差。嫩度是决定牦牛肉食品品质的重要因素,也是制约其市场竞争力的主要因素。对于加工者而言,牛肉原料的嫩度决定了最终产品的档次与价值,因此需要运用科学的手段对牦牛肉进行嫩化,改善其食用品质,使产品进一步增值。
肉的嫩度主要由肌原纤维和结缔组织2 个因素决定。在屠宰和酮体冷却成熟过程中,由于肌肉发生一系列变化,结缔组织结构松散,肌原纤维发生断裂,使肌肉变得柔软鲜嫩,适口性得到改善[7]。肌原纤维直径越小,肌节长度越大,肉的嫩度越好[8];肉中结缔组织含量越高,肉的嫩度越差[9]。目前,已报道的牦牛肉嫩化方法主要有电刺激嫩化法[10]、蛋白酶嫩化法[11]、无机盐嫩化法[12]和有机酸嫩化法[13]等。大量研究表明,弱有机酸,如乳酸或醋酸能通过弱化肌原纤维和结缔组织改善肉嫩度[14-16]。目前的研究集中在注射弱有机酸调节pH值嫩化牛肉,但是弱有机酸在肌肉中扩散较慢,浸渍周期长,效果不理想[17]。通过乳酸菌发酵也是产生大量乳酸的一个途径,向牦牛肉中添加植物乳杆菌、戊糖片球菌等益生菌,利用菌种的发酵作用将糖类分解成乳酸,较低的pH值环境和由益生菌产生的蛋白酶能使肉中蛋白质降解,使肌肉结构蛋白完整性遭到破坏,从而改善肉的嫩度[18]。而目前有关植物乳杆菌和戊糖片球菌复合发酵对牦牛肉嫩度影响的研究报道极少。
本研究以新鲜牦牛肉为原料,选用植物乳杆菌和戊糖片球菌作为复合发酵剂,通过测定发酵后牦牛肉的pH值、蒸煮损失率、剪切力和可溶性蛋白含量,利用单因素试验和L9(34)正交试验优化牦牛肉的发酵工艺参数,改善牦牛肉的嫩度,为提高牦牛肉食用品质、利用现代食品发酵技术改善牦牛肉生产工艺提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
牦牛肉:随机选取由四川省阿坝州红原县永源肉业提供的10 头健康无病3 岁龄成年公牦牛,集中屠宰后现场采集背最长肌,于24 h内进行冷却排酸处理后于-20 ℃下急速冷冻,0~4 ℃运输至实验室。
植物乳杆菌(Lactobacillus plantarum)、戊糖片球菌(Pediococcus pentosaceus) 中国工业微生物菌种保藏管理中心;MRS肉汤、MRS培养基 杭州微生物试剂有限公司;牛血清白蛋白(bovine serum albumin,BSA) 上海如吉生物科技有限公司;NaCl、KCl、KH2PO4、K2HPO4、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)-2Na、MgCl2、NaOH、C4H4KNaO6·4H2O、CuSO4·5H2O、NaNO、C6H12O6(均为分析纯) 成都科龙化工试剂厂;食盐(食品级)成都市武侯区红旗超市。
1.2 仪器与设备
DHP-9162D恒温培养箱 上海齐欣科学仪器有限公司;MP511 pH计 上海三信仪表厂;Centrifuge 5804离心机 德国Eppendorf公司;UV1810S紫外分光光度计上海佑科仪器仪表有限公司;TA-XT Plus质构仪 英国Stable Micro Systems公司。
1.3 方法
1.3.1 菌种活化
将植物乳杆菌和戊糖片球菌菌种从-80 ℃冰箱中取出,加入MRS肉汤中,于30 ℃培养箱中恒温培养24 h,重复此操作2 次,当培养基呈明显混浊时,活化完成,保存于4 ℃冰箱。应用MRS培养基对活化好的菌种进行平板活菌计数。
1.3.2 发酵牦牛肉制作工艺

操作要点:将-20 ℃条件下冷冻的牦牛肉取出至4 ℃冰箱中进行解冻,剔除牦牛肉上的筋膜和可见脂肪块后洗去血污,然后切成5 cm×3 cm×3 cm、形状规整、厚薄均匀的肉条;置于含3 g/100 mL食盐、5 mg/100 mL亚硝酸钠的腌制液中,4 ℃腌制12 h;腌制完成后的肉条沥干水分,分组并称质量,置于超净工作台紫外线照射40 min后,将活化好的植物乳杆菌和戊糖片球菌按1∶1的比例通过注射的方式接种到牦牛肉中;用保鲜膜封口,置于恒温培养箱中发酵。
1.3.3 单因素试验设计
针对发酵剂添加量、发酵温度和发酵时间开展单因素试验,试验设计为:1)选择发酵剂添加量分别为0.0、0.5×106、1.0×106、1.5×106、2.0×106 CFU/g,在30 ℃条件下发酵24 h;2)发酵温度分别为20、25、30、35、40 ℃,发酵剂添加量为1.0×106 CFU/g,发酵24 h;3)发酵剂添加量1.0×106 CFU/g,在30 ℃条件下分别发酵16、18、20、22、24 h。以pH值、蒸煮损失率和剪切力为指标,筛选适宜的发酵条件。
1.3.4 正交试验设计
以发酵剂添加量、发酵温度和发酵时间作为3 个主要因素,依据单因素试验结果确定正交试验的因素水平,采用L9(34)正交表,进行3因素3水平的正交试验,在正交表中增加空白列,以pH值、剪切力和可溶性蛋白含量为评定指标,重复进行3 次平行试验,筛选出最优发酵工艺。L9(34)因素水平表如表1所示。
表1 发酵牦牛肉工艺优化正交试验设计因素与水平
Table 1 Coded values s and corresponding actual values of independent variables used in orthogonal array design
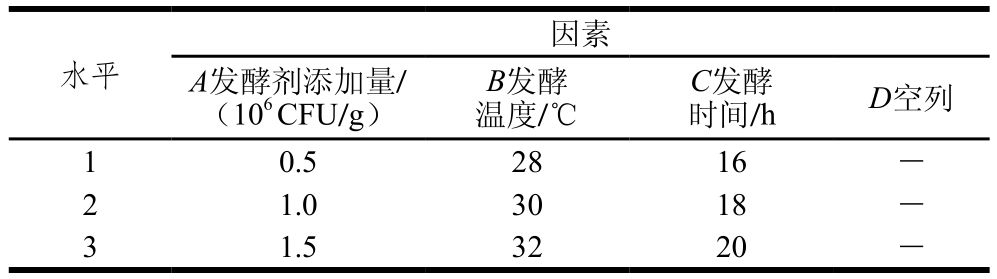
水平因素A发酵剂添加量/(106 CFU/g)B发酵温度/℃C发酵时间/h D空列1 0.5 28 16 -2 1.0 30 18 -3 1.5 32 20 -
1.3.5 指标测定
1.3.5.1 pH值测定
按照王德宝等[19]的方法,将肉样充分绞碎,称取3 g左右,加入27 mL蒸馏水,混合均匀后,静置30 min,每次使用前先将pH计进行校正,将已校正的pH计插入样品中,待读数稳定后,记录读数。每组样品做3 个平行。
1.3.5.2 蒸煮损失率测定
参考卢智等[20]的方法,并稍作修改。将嫩化好的牦牛肉切成均匀的长条,擦干表面水分并称质量,放入蒸煮袋中,在95 ℃水浴锅中加热30 min,使牦牛肉中心温度达到85 ℃,取出样品,冷却至常温,用滤纸擦干表面水分,然后称质量。每组样品做3 个平行。蒸煮损失率按下式计算。
式中:m1表示蒸煮前肉质量/g;m2表示蒸煮后肉质量/g。
1.3.5.3 剪切力测定
参考赵立等[21]的方法,并稍作修改。将嫩化后的牦牛肉于95 ℃水浴锅中煮制30 min后,使牦牛肉中心温度达到85 ℃,取出沥干水分并冷却至室温,将肉样切成2 cm×1 cm×1 cm的长条,用质构分析仪的HDP/BSW探头测定肉样剪切力,测前速率2.0 mm/s,测中速率2.0 mm/s,测后速率10.0 mm/s,下行距离30 mm,负载类型Auto-20g。每组样品做3 个平行。
1.3.5.4 可溶性蛋白含量测定
可溶性蛋白提取:参考孔令明等[22]的方法。取肉样4.00 g,切碎,加入40 mL提取液(含100 mmol/L KCl、20 mmol/L K3PO4(7 mmol/L KH2PO4、18 mmol/L K2HPO4)、1 mmol/L EDTA和1 mmol/L MgCl2),用HCl调至pH 7.0,4 ℃保存;用匀浆机捣碎均匀,将匀浆倒入50 mL离心管中,10 000 r/min离心15 min(0~4 ℃),将上清液倒入小烧杯中,待测。
可溶性蛋白含量测定:参考王兆明[23]的双缩脲法。用10 mg/mL的BSA标准溶液配制质量浓度分别为0、2、4、5、6、8、10 mg/mL的溶液各10 mL,然后取各质量浓度的BSA溶液1 mL于试管中,加入缩二脲试剂4 mL,25 ℃放置60 min,以空白试剂凋零,在540 nm波长处测定不同质量浓度BSA溶液的吸光度(A540 nm)。通过Microsoft Excel 2010软件作回归分析,建立线性回归方程y=0.044x+0.002(R2=0.999 7),其中,x为BSA质量浓度(mg/mL),y为相应样品A540 nm,根据标准曲线方程计算样品的蛋白质量浓度。
1.4 数据处理
采用SPSS V19.0软件进行数据分析,结果用平均值±标准差表示,并进行单因素方差分析和Duncan’s显著性检验,显著性水平为P<0.05。
2 结果与分析
2.1 牦牛肉发酵单因素试验结果
2.1.1 发酵剂添加量对牦牛肉嫩化效果的影响
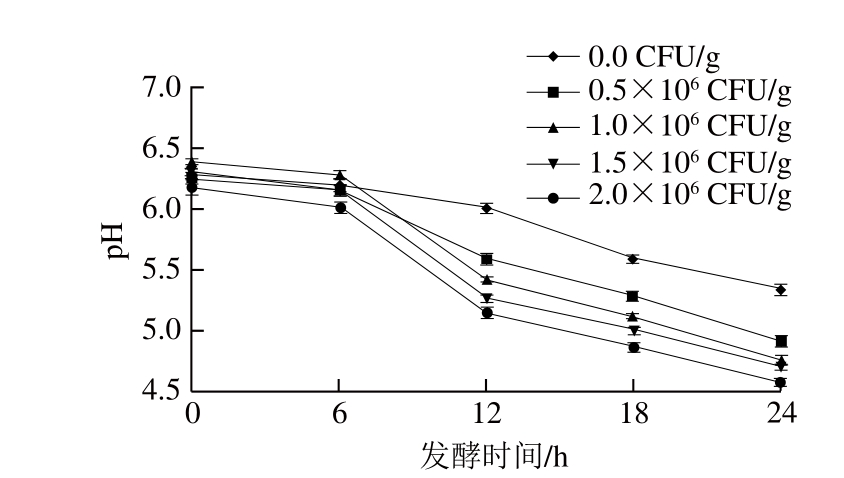
图1 发酵剂添加量对牦牛肉pH值的影响
Fig. 1 Effect of inoculum size on pH value of fermented yak meat
由图1可知,随着发酵时间延长,发酵剂添加量不同的牦牛肉pH值均呈下降趋势。发酵0~6 h时,微生物开始生长繁殖,pH值下降较缓慢,发酵6 h后pH值下降明显,这是由于乳酸菌大量繁殖,分解碳水化合物产生乳酸,导致pH值下降[24];发酵剂添加量越大,牦牛肉pH值下降速率越快,相同发酵时间内pH值越低;发酵18 h后,发酵剂添加量为1.5×106、2.0×106 CFU/g的牦牛肉pH值已降至5.0左右,24 h发酵结束后,添加发酵剂的牦牛肉pH值均降至5.0以下。
蒸煮损失率和剪切力都是表征肉嫩度的指标,蒸煮损失率和剪切力越低,表明肉越嫩[25]。由表2可知,添加发酵剂能显著降低牦牛肉的蒸煮损失率(P<0.05),但不同添加量对蒸煮损失率影响不显著。发酵24 h后,发酵剂添加量为1.0×106、1.5×106 CFU/g的牦牛肉剪切力显著降低(P<0.05),由于戊糖片球菌和植物乳杆菌能够产生蛋白酶,提高肉中蛋白质的降解程度,使肌肉结构蛋白完整性被破坏,从而使牦牛肉剪切力变小,影响牦牛肉嫩度,同时pH值降低有利于肌原纤维蛋白的降解,并且在一定范围内,pH值越低,肌原纤维蛋白降解程度越大[26]。发酵剂添加量过高,牦牛肉的pH值快速降低,口感过酸,食用品质不高,发酵剂添加量过低,牦牛肉pH值降低缓慢,发酵时间过久,会有杂菌生长。综合考虑,选择发酵剂添加量为1.0×106 CFU/g为宜。
表2 发酵剂添加量对牦牛肉蒸煮损失率和剪切力的影响
Table 2 Effect of inoculum size on cooking loss and shear force of fermented yak meat
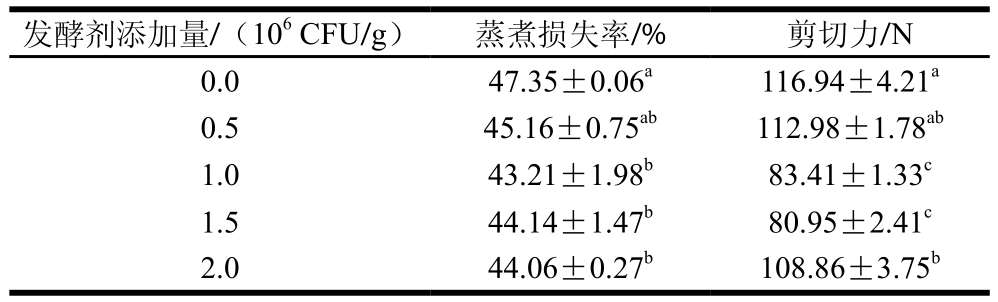
注:同列小写字母不同,表示差异显著(P<0.05)。表3、4、7同。
发酵剂添加量/(106 CFU/g) 蒸煮损失率/% 剪切力/N 0.0 47.35±0.06a 116.94±4.21a 0.5 45.16±0.75ab 112.98±1.78ab 1.0 43.21±1.98b 83.41±1.33c 1.5 44.14±1.47b 80.95±2.41c 2.0 44.06±0.27b 108.86±3.75b
2.1.2 发酵温度对牦牛肉嫩化效果的影响
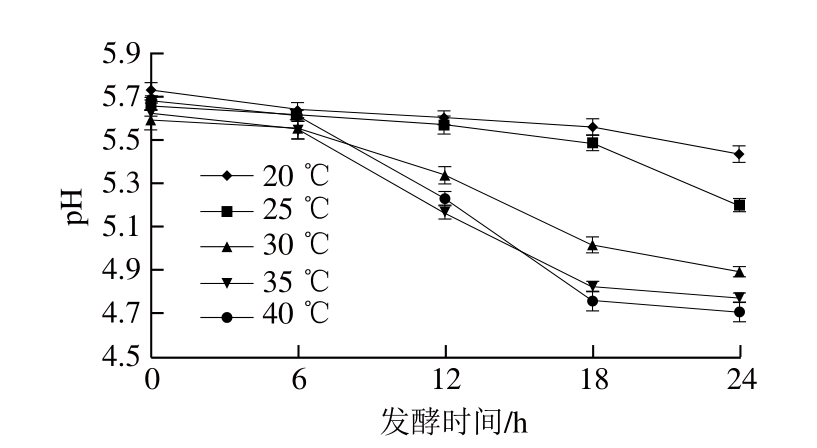
图2 发酵温度对牦牛肉pH值的影响
Fig. 2 Effect of fermentation temperature on pH value of yak meat
发酵温度对微生物生长繁殖、发酵进程和产品安全性均有很大影响。由图2可知:20 ℃发酵时,牦牛肉pH值下降缓慢,24 h发酵结束时pH值只降低0.2~0.3;25 ℃发酵时,牦牛肉pH值的下降存在一定滞缓期,18 h后开始明显降低,24 h降至5.3以下;高温(30、35、40 ℃)条件下发酵时,牦牛肉pH值于发酵6 h后迅速下降,24 h后均降至5.0以下,且发酵同一时间段温度越高,牦牛肉pH值越低。当发酵温度过高时,发酵速率加快,最终pH值过低,产品酸度过高,影响肉品质,而且过高的温度使肉中有害微生物在发酵初期大规模增殖,产品安全性无法得到保障[27]。
由表3可知,发酵24 h后,发酵温度越高,各组牦牛肉的剪切力和蒸煮损失率越低,表明发酵牦牛肉嫩度越好。综合考虑,发酵温度为30 ℃时,可使牦牛肉的pH值达到较理想的效果,且剪切力降至79.77 N,蒸煮损失率为40.13%,嫩度得到改善。
表3 发酵温度对牦牛肉蒸煮损失率和剪切力的影响
Table 3 Effect of fermentation temperature on cooking loss and shear force of yak meat

发酵温度/℃ 蒸煮损失率/% 剪切力/N
2.1.3 发酵时间对牦牛肉嫩化效果的影响
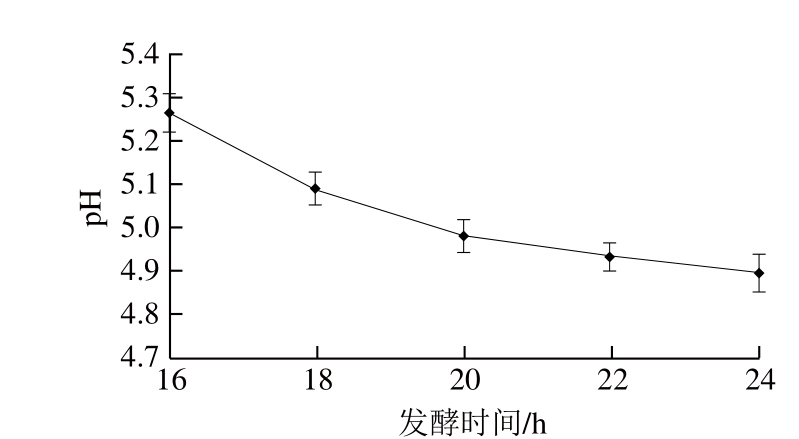
图3 发酵时间对牦牛肉pH值的影响
Fig. 3 Effect of fermentation time on pH value of yak meat
由图3可知,随着发酵时间的延长,牦牛肉pH值呈下降趋势,发酵16 h,pH值从5.62降至5.27,发酵18 h后,牦牛肉pH值降至5.2以下,这一范围可有效抑制腐败菌和致病菌的生长[28]。发酵至20 h时,牦牛肉pH值下降速率减慢,随着发酵时间的延长,微生物发酵产生的副产物会影响微生物的生长,使pH值下降速率趋于缓慢,此时牦牛肉pH值低于5.0,酸味较重,气味较差。
表4 发酵时间对牦牛肉蒸煮损失率和剪切力的影响
Table 4 Effect of fermentation time on cooking loss and shear force of yak meat

发酵时间/h 蒸煮损失率/% 剪切力/N 16 43.31±0.02a 90.71±4.02b 18 43.88±1.72a 76.76±3.19d 20 43.13±1.45a 83.51±2.80c 22 44.44±0.24a 84.87±1.65bc 24 44.74±1.08a 100.01±4.55a
由表4可知,发酵时间对牦牛肉的蒸煮损失率影响不显著,剪切力随发酵时间的延长先降低后升高,发酵18 h时剪切力显著降低(P<0.05),表明此时牦牛肉的嫩度得到改善。发酵时间过长,牦牛肉中水分含量减少,肉质变硬。综合考虑,发酵时间为18 h较为合适。
2.2 牦牛肉发酵正交试验优化结果
2.2.1 正交试验结果与分析
根据单因素试验结果,以发酵剂添加量(A)、发酵温度(B)及发酵时间(C)为自变量,以pH值、剪切力和可溶性蛋白含量为评价指标,进行3因素3水平的正交试验。
表5 正交优化试验设计及结果
Table 5 Orthogonal array design with response variables

试验号 A发酵剂添加量/(106 CFU/g)B发酵温度/℃C发酵时间/h D空列 pH 剪切力/N 可溶性蛋白含量/(mg/g)1 1(0.5) 1(28) 1(16) 1 5.27±0.01 101.49±1.68 42.80±0.58 2 1 2(30) 2(18) 2 5.15±0.02 97.07±1.67 44.88±0.35 3 1 3(32) 3(20) 3 5.02±0.02 88.80±2.21 42.92±0.23 4 2(1.0) 1 2 3 5.11±0.01 77.46±1.27 50.90±0.58 5 2 2 3 1 4.92±0.02 78.61±2.16 51.13±0.81 6 2 3 1 2 5.09±0.01 72.34±2.07 48.36±0.34 7 3(1.5) 1 3 2 4.82±0.01 82.79±2.59 43.96±0.81 8 3 2 1 3 4.93±0.01 87.27±3.75 43.73±0.58 2 1 4.86±0.01 71.09±2.60 43.26±0.12 k1 5.15 5.06 5.09 5.01 k2 5.04 5.00 5.04 5.02 k3 4.87 4.99 4.92 5.02极差(R) 0.28 0.08 0.18 0.01 pH 主次顺序 A>C>B 最优水平 A2B2C2 k1 95.79 87.25 87.04 83.73 k2 76.14 87.65 81.87 84.07 k3 80.39 77.41 83.40 84.51 R 19.65 10.24 5.16 0.78剪切力 主次顺序 A>B>C 最优水平 A2B3C2 k1 43.53 45.89 44.96 45.73 k2 50.13 46.58 46.35 45.73 k3 43.65 44.85 46.00 45.85 R 6.60 1.74 1.39 0.12可溶性蛋白含量 主次顺序 A>B>C 最优水平 A2B2C2 9 3 3
由表5可知:9 个试验组中,试验组1的发酵剂添加量最少、发酵温度最低、发酵时间最短,牦牛肉pH值下降缓慢,剪切力最大,可溶性蛋白含量较低,嫩化效果最差;试验组9牦牛肉的pH值已经低至4.86,剪切力最低,嫩化效果最明显,但低pH值使牦牛肉发酵过度,出现严重酸味,影响感官品质,且牦牛肉在较高温度下长时间发酵会出现腐败变质现象,发酵过度使肉中蛋白质变性,导致可溶性蛋白含量降低;试验组5牦牛肉可溶性蛋白含量最高,可能是由于发酵产生的蛋白酶或pH值降低能水解肉中肌浆蛋白和肌原纤维蛋白,从而产生许多低分子质量蛋白[29]。
由表6可知,发酵剂添加量、发酵温度和发酵时间对牦牛肉的pH值、剪切力和可溶性蛋白含量影响均极显著(P<0.01)。通过对比各因素的R和F值可知,影响牦牛肉pH值的因素主次顺序为A>C>B,即发酵剂添加量对牦牛肉pH值影响最大,其次为发酵时间和发酵温度;影响牦牛肉剪切力和可溶性蛋白含量的因素主次顺序均为A>B>C,即发酵剂添加量影响最大,其次为发酵温度,发酵时间影响最小。一般认为发酵肉制品终点pH值为5.0~5.3为宜,考虑到人们对酸度的接受度[30],筛选出以pH值为评定指标的最优组合为A2B2C2,即发酵剂添加量1.0×106 CFU/g、发酵温度30 ℃、发酵时间18 h;以剪切力为评定指标,最优组合为A2B3C2,即发酵剂添加量1.0×106 CFU/g、发酵温度32 ℃、发酵时间18 h;以可溶性蛋白含量为评定指标,最优组合也为A2B2C2。因2 种优化组合未包含在正交试验设计中,对2 种优化组合进行对比验证实验。
表6 正交试验结果方差分析表
Table 6 Analysis of variance of the experimental results of orthogonal array design
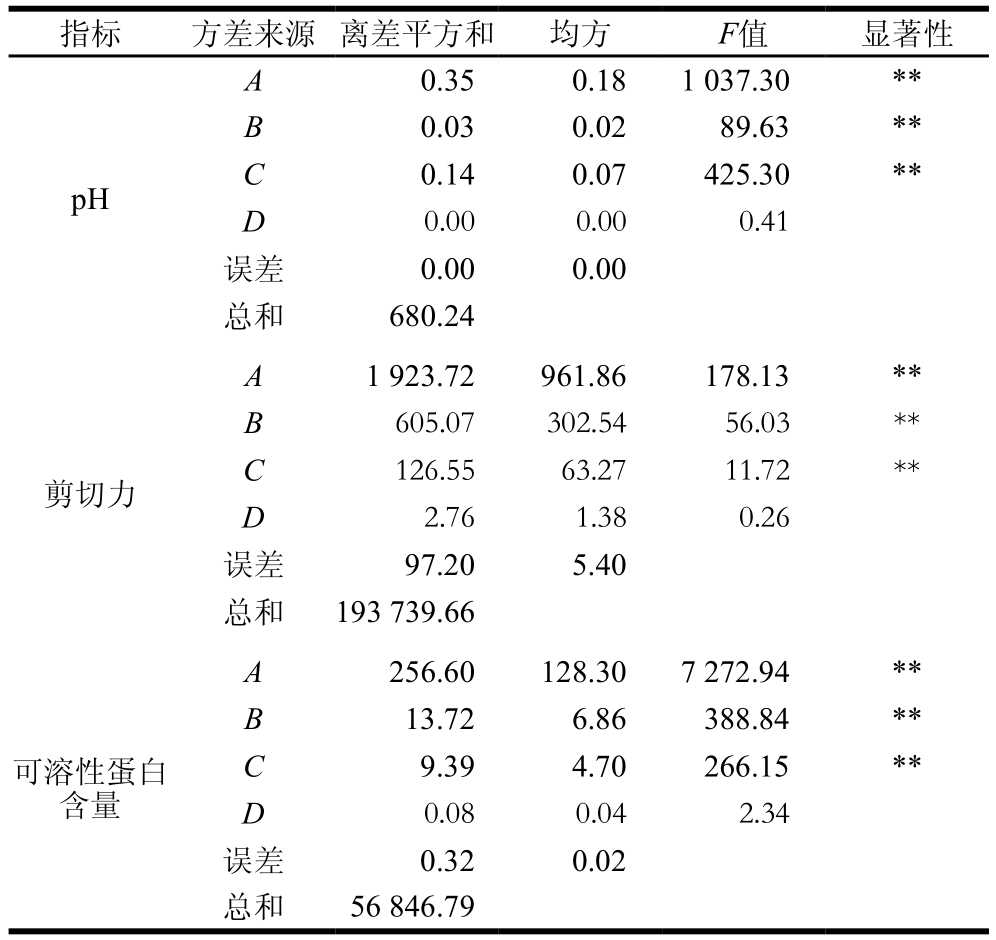
注:**. 差异极显著(P<0.01)。
指标 方差来源 离差平方和 均方 F值 显著性pH 0.35 0.18 1 037.30 **B 0.03 0.02 89.63 **C 0.14 0.07 425.30 **D 0.00 0.00 0.41误差 0.00 0.00总和 680.24 A剪切力A 1 923.72 961.86 178.13 **B 605.07 302.54 56.03 **C 126.55 63.27 11.72 **D 2.76 1.38 0.26误差 97.20 5.40总和 193 739.66 A 256.60 128.30 7 272.94 **B 13.72 6.86 388.84 **C 9.39 4.70 266.15 **D 0.08 0.04 2.34误差 0.32 0.02总和 56 846.79可溶性蛋白含量
2.2.2 验证实验结果
表7 对比验证实验结果
Table 7 Comparative validation of optimized combination of conditions

实验组合 pH 剪切力/N 可溶性蛋白含量/(mg/g)
A2B3C2与A2B2C2组的发酵剂添加量均为1.0×106 CFU/g,分别在32、30 ℃条件下发酵18 h。由表7可知,32 ℃条件下发酵牦牛肉pH值为4.98,剪切力为75.93 N,30 ℃条件下发酵牦牛肉的pH值为5.02,剪切力为76.76 N。两组牦牛肉的pH值和剪切力均无显著差异(P>0.05),嫩度均得到改善,但A2B2C2组的可溶性蛋白含量显著高于A2B3C2组(P<0.05)。发酵温度较高时,牦牛肉pH值过低,酸味过大,食用品质不佳,从牦牛肉发酵后的pH值、嫩度和食用品质等方面综合考虑,选择最优发酵工艺组合为A2B2C2,即发酵剂接种量1.0×106 CFU/g、发酵温度30 ℃、发酵时间18 h,在此条件下发酵的牦牛肉具有较适宜的pH值,剪切力较低,可溶性蛋白含量较高,牦牛肉嫩度得到一定程度的改善。
3 结 论
通过单因素试验和L9(34)正交试验筛选植物乳杆菌和戊糖片球菌发酵牦牛肉的最佳工艺参数,其中发酵剂接种量为1.0×106 CFU/g、发酵温度为30 ℃、发酵时间为18 h,这3 个因素是影响牦牛肉嫩度和食用品质的重要因素,对牦牛肉pH值、剪切力和可溶性蛋白含量影响均显著。在最佳工艺条件下发酵的牦牛肉pH值为5.02,剪切力为76.76 N,可溶性蛋白含量为52.02 mg/g,有效改善了牦牛肉嫩度。
[1] 杨斌, 陈峰, 魏彦杰, 等. 牦牛肉加工与发展现状[J]. 肉类研究, 2010,24(6): 3-5. DOI:10.3969/j.issn.1008-5467.2010.05.017.
[2] 刘亚娜, 郎玉苗, 包高良, 等. 甘南牦牛肉与中国西门塔尔牛肉营养特性对比分析[J]. 食品工业科技, 2016, 37(15): 360-364.DOI:10.13386/j.issn1002-0306.2016.15.062.
[3] 万红玲, 雒林通, 吴建平. 牦牛肉品质特性研究进展[J]. 畜牧兽医杂志, 2012, 31(1): 36-40. DOI:10.3969/j.issn.1004-6704.2012.01.014.
[4] MILLS E W, COMERFORD J W, HOLLENDER R, et al. Meat composition and palatability of Holstein and beef steers as influenced by forage type and protein source[J]. Journal of Animal Science, 1992, 70(8):2446-2451. DOI:10.2527/1992.7082446x.
[5] 徐瑛, 文鹏程, 梁琪, 等. 不同岁龄牦牛肉肉用品质的变化规律[J]. 食品工业科技, 2014, 35(20): 121-124. DOI:10.13386/j.issn1002-0306.2014.20.017.
[6] 杨玉莹, 张一敏, 董鹏程, 等. 不同品种牛肉品质特性概述[J]. 食品与发酵工业, 2018, 44(6): 271-276. DOI:10.13995/j.cnki.11-1802/ts.015719.
[7] PURSLOW P P. Contribution of collagen and connective tissue to cooked meat toughness; some paradigms reviewed[J]. Meat Science,2018, 144: 127-134. DOI:10.1016/j.meatsci.2018.03.026.
[8] MARINO R, DELLA M A, ALBENZIO M. Proteolytic changes of myofibrillar proteins in Podolian meat during aging: focusing on tenderness[J]. Journal of Animal Science, 2015, 93(3): 1376-1387.DOI:10.2527/jas.2014-8351.
[9] VAN WEZEMAEL L, DE SMET S, UELAND Ø, et al. Relationships between sensory evaluations of beef tenderness, shear force measurements and consumer characteristics[J]. Meat Science, 2014, 97(3):310-315. DOI:10.1016/j.meatsci.2013.07.029.
[10] 王莉, 王玉涛, 郭丽君, 等. 电刺激对宰后牦牛肉成熟过程中肌钙蛋白-T和肌间线蛋白及嫩度的影响[J]. 食品工业科技, 2017, 38(11): 65-70. DOI:10.13386/j.issn1002-0306.2017.11.004.
[11] 朱秀娟, 余群力, 李儒仁, 等. 采用响应面优化法研究木瓜蛋白酶嫩化牦牛肉的条件[J]. 食品工业科技, 2013, 34(20): 230-234.DOI:10.13386/j.issn1002-0306.2013.20.066.
[12] 杨敏, 刘洋, 杨富民, 等. 不同盐类对牦牛肉嫩化效果的影响研究[J]. 食品工业科技, 2014, 35(8): 290-294. DOI:10.13386/j.issn1002-0306.2014.08.057.
[13] 汤高奇, 王彦平, 周志强, 等. 醋渍处理对牛肉嫩化效果的影响研究[J]. 食品科技, 2016, 41(7): 126-130. DOI:10.13684/j.cnki.spkj.2016.07.024.
[14] LEE N, SHARMA V, BROWN N, et al. Functional properties of bicarbonates and lactic acid on chicken breast retail display properties and cooked meat quality[J]. Poultry Science, 2015, 94(2): 302-310.DOI:10.3382/ps/peu063.
[15] GRAJALES A, RIVERA C, RUIZ M, et al. Effect of lactic acid on the meat quality properties and the taste of pork Serratus ventralis muscle[J].Agricultural and Food Science, 2015, 21(2): 171-181. DOI:10.23986/afsci.6082.
[16] NARAYAN R, MENDIRATTA S K, MANE B G. Effects of citric acid,cucumis powder and pressure cooking on quality attributes of goat meat curry[J]. Journal of Food Science and Technology, 2015, 52(3): 1772-1777. DOI:10.1007/s13197-013-1023-x.
[17] 李林强, 昝林森, 张宝珣. 秦川牛肉在乳酸发酵过程中品质变化研究[J]. 食品科学, 2009, 30(7): 131-134. DOI:10.3321/j.issn:1002-6630.2009.07.030.
[18] 王可, 祝超智, 赵改名, 等. 乳酸嫩化牦牛肉的工艺优化[J]. 肉类研究, 2019, 33(4): 13-18. DOI:10.7506/rlyj1001-8123-20190322-066.
[19] 王德宝, 靳烨, 其艳娟, 等. 发酵剂对羊肉干理化指标的影响及其分析研究[J]. 食品工业, 2015, 36(1): 74-76.
[20] 卢智, 柳青山, 朱俊玲. 几种蛋白酶与氯化钙对鸡肉系水力的影响[J]. 食品研究与开发, 2018, 39(5): 24-27. DOI:10.3969/j.issn.1005-6521.2018.05.005.
[21] 赵立, 周振, 贺倩倩, 等. 超声波与菠萝蛋白酶协同作用对鸭肉嫩化的影响[J]. 食品科学, 2018, 39(12): 93-100. DOI:10.7506/spkx1002-6630-201812015.
[22] 孔令明, 李芳, 张文, 等. 不同电刺激处理时间对宰后马肉成熟过程中嫩度的影响[J]. 食品科学, 2018, 39(9): 76-81. DOI:10.7506/spkx1002-6630-201809012.
[23] 王兆明. 兔肉滚揉腌制工艺及品质特性变化研究[D]. 重庆: 西南大学, 2016: 28-29.
[24] 张波, 李开雄, 卢士玲, 等. 发酵剂对风干羊肉理化特性变化和蛋白质降解的影响[J]. 食品工业科技, 2013, 34(14): 197-200.DOI:10.13386/j.issn1002-0306.2013.14.063.
[25] 王晶, 田莹俏, 张艳花. 菠萝蛋白酶和超声波对羊肉嫩度的影响[J].肉类工业, 2015(3): 14-18. DOI:10.3969/j.issn.1008-5467.2015.03.006.
[26] 樊明明, 郇延军, 翁梅芬, 等. 添加发酵剂对猪肉脯品质的影响[J].食品工业科技, 2015, 36(15): 122-125; 129. DOI:10.13386/j.issn1002-0306.2015.15.018.
[27] 杨秀娟, 王艳梅, 马俪珍. 以植物乳杆菌和戊糖片球菌为发酵剂的发酵香肠工艺研究[J]. 肉类研究, 2007, 21(8): 22-26. DOI:10.3969/j.issn.1001-8123.2007.08.008.
[28] 王新惠, 李俊霞, 谭茂玲, 等. 复合发酵剂对发酵猪肉干品质的影响[J]. 食品工业科技, 2015, 36(17): 165-169. DOI:10.13386/j.issn1002-0306.2015.17.025.
[29] 谭汝成, 欧阳加敏, 卢晓莉, 等. 接种植物乳杆菌和戊糖片球菌发酵对鱼鲊品质的影响[J]. 食品科学, 2007, 28(12): 268-272. DOI:10.3321/j.issn:1002-6630.2007.12.062.
[30] 张飞, 路洪艳, 刘哲, 等. 两种乳酸菌协同发酵冷鲜调理牛肉的工艺优化[J]. 食品科技, 2016, 41(1): 100-104. DOI:10.13684/j.cnki.spkj.2016.01.021.