斑点叉尾鮰(Letaurus punetaus),属鲶形目、鮰科,原产于美国,是美国最主要的淡水养殖食用鱼类[1],其肉质鲜嫩,富含多种人体必需氨基酸、不饱和脂肪酸和维生素等,营养价值高,同时还具有降血脂、增强免疫力、益智健脑、补肾明目、减肥及抗衰老等保健功效,深受消费者喜爱。
目前国内市场上的斑点叉尾鮰仍以鲜活销售为主,加工包装销售产品相对较少,尤其缺少适应现代快节奏城市生活、既营养又食用方便的调理鱼产品[2]。
水产品贮藏期间,除了感官品质、理化性质会随着贮藏时间发生变化外,同时也伴随着肌肉氧化,肌肉氧化包括脂肪氧化和蛋白变性[3],均会造成产品品质下降。作为鱼肉的主要成分,蛋白质在微生物和酶的作用下发生水解、变性等是鱼肉腐败变质的主要原因,尤其在低温冻藏过程中。研究表明,蛋白质变性是影响鱼肉冻藏品质的最主要因素[4]。在冷冻和冻藏时,鱼体中水分形成的冰晶会破坏肌肉细胞,导致机械损伤,加速鱼肉蛋白的氧化和变性[5]。蛋白质的完整性与鱼体肌肉组织的各种功能特性密切相关,其中最主要的是肌原纤维蛋白,宋丽丽[6]、曾名勇[7]等分别在鮰鱼和鲈鱼的研究中发现,降低冻藏温度能很好地维持鱼肉肌原纤维蛋白的完整性,有效保持鱼肉的贮藏品质。
目前,虽然通过冷冻贮藏能有效延长鱼肉贮藏时间,但是在贮藏过程中,低温冷冻会对鱼肉蛋白造成一系列损坏,影响贮藏品质。本研究通过提取慢速 (-18 ℃)、中速(-30 ℃)、快速(-80 ℃)冷冻斑点叉尾鮰调味鱼不同贮藏时间的肌原纤维蛋白,对其氧化相关指标进行测定,分析不同冷冻方式对调味鱼冻藏期间肌原纤维蛋白变性的影响,并结合电子鼻测定3 种冷冻处理调味鱼贮藏期间的气味变化,进一步明确不同冷冻方式对调味鱼贮藏品质的影响,旨在提高斑点叉尾鮰调味鱼的冻藏品质,为工业化生产提供技术支持。
1 材料与方法
1.1 材料与试剂
鲜活的斑点叉尾鮰购于天津市红旗农贸水产批发市场,选择大小均一、质量1 000~1 500 g的无病伤活鱼,在20 min内运回食品加工车间。
溴酚蓝、十二烷基硫酸钠(s o d i u m d o d e c y l sulfate,SDS)、硫酸铜、酒石酸钾钠、甘氨酸 天津市风船化学试剂科技有限公司;乙二胺四乙酸、尿素、5,5’-二硫代双(2-硝基苯甲酸)、盐酸胍、乙酸乙酯 国药集团化学试剂有限公司。
1.2 仪器与设备
BZSQ-Ⅱ盐水注射机、BVRJ-40真空滚揉机 杭州 艾博机械工程有限公司;DZ400/2S真空包装机 诸城 市美川机械有限公司;Heracles Ⅱ气相色谱电子鼻 天津埃文森科技有限公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;ST 40R离心机 美国Thermo公司;FA25匀浆机 上海鲁克流体机械制造有限公司。
1.3 方法
1.3.1 原料处理
将运回的鲜活斑点叉尾鮰敲晕后开背,去除内脏和鳃部,流动自来水快速清洗3 遍,然后将鱼放入冰水中,在4 ℃环境下浸泡降温,待鱼体中心温度降至10 ℃后,再转移至3 g/100 mL柠檬酸溶液中浸泡20 min进行抑菌保鲜处理,然后将预先配制好的冷却五香风味腌制液(食盐质量浓度10 g/100 mL)用盐水注射机注入鱼体中,注入量为鱼体质量的12%,真空滚揉30 min,滚揉时正转与逆转间歇进行,每转动5 min静止30 s,滚揉结束后真空包装,即得到开背调味鱼产品。
将包装好的调味鱼随机分成3 份,分别放入 -18、-30、-80 ℃进行慢速、中速和快速冷冻处理,待鱼体中心温度降至-18 ℃以后,取出统一置于-18 ℃贮藏。在贮藏过程中每4 周进行取样测定,3 种处理每次均随机取出3 条鱼,流水解冻后,将鱼肉去皮、去骨、绞碎混匀后测定指标,各指标均重复测定3 次。
1.3.2 肌原纤维蛋白的提取及含量测定
参考Yang Fang等[8]的方法提取调味鱼肌原纤维蛋白,将提取好的蛋白放置在4 ℃冰箱保存,为了不影响指标测定结果,提取的蛋白在72 h内使用。
蛋白质质量浓度测定参考Bradford[9]的方法,采用双缩脲法进行测定,以牛血清蛋白为标准蛋白制作标准曲线。
1.3.3 羰基含量测定
采用2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH) 法,参考Oliver等[10]的方法,并略作修改。测量蛋白质质量浓度之后,在280 nm波长处以6 mol/L盐酸胍调零,测定加入盐酸后样品的吸光度,代入盐酸胍标准曲线计算蛋白质质量浓度;再以加入盐酸的样品做空白调零,在370 nm波长处测定加入DNPH后样品的吸光度。调味鱼肌原纤维蛋白羰基含量按式(1)计算。
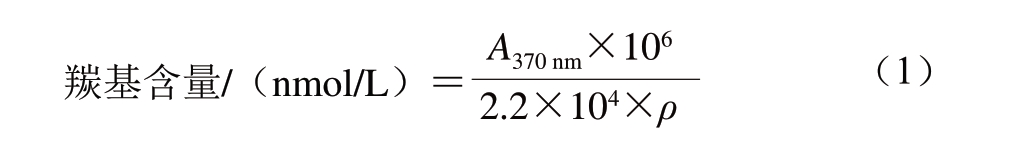
式中:A 3 7 0 n m为3 7 0 n m 波长处的吸光度; 2.2×104 L/(mol·cm)为摩尔吸光系数;ρ为以6 mol/L盐酸胍作空白调零后,在280 nm波长处测得的加入盐酸后样品的蛋白质质量浓度/(mg/mL)。
1.3.4 活性巯基含量测定
采用Benjakul等[11]的方法。
1.3.5 表面疏水性测定
参考Chelh等[12]的方法,取1 mL质量浓度为5 mg/mL的调味鱼肌原纤维蛋白溶液,与200 μL 1 mg/mL的溴酚蓝溶液混合,在室温下搅拌10 min后于4 ℃、10 000×g条件下离心15 min,取上清液稀释10 倍,在595 nm波长处测定吸光度。以磷酸盐缓冲液为空白对照,表面疏水性以肌原纤维蛋白结合溴酚蓝的量来表示。调味鱼肌原纤维蛋白表面疏水性按式(2)计算。
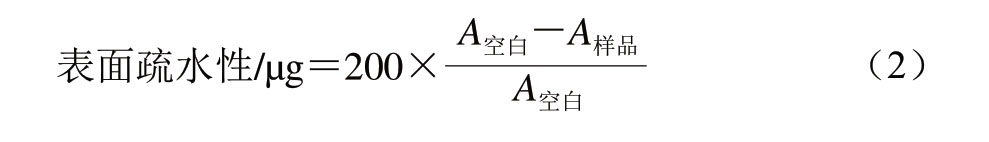
式中:200为肌原纤维蛋白溶液中加入溴酚蓝的总 质量/μg。
1.3.6 乳化性及乳化稳定性测定
参考樊雪静[13]的方法。
1.3.7 浊度测定
取5 mL 1 mg/mL的调味鱼肌原纤维蛋白溶液,在不同温度(40、50、60、70、80 ℃)条件下水浴加热30 min,取出冷却至室温后测定其在600 nm波长处的吸光度。浊度用吸光度表示。
1.3.8 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electropheresis,SDS-PAGE)测定
采用Laemmli[14]的方法。
1.3.9 电子鼻测定
参考宋敏[15]的方法,并略作修改,准确称取5 g绞碎的调味鱼肉样,放入20 mL进样瓶中,密封40 ℃水浴加热10 min后立即测定。Heraclese Ⅱ实验条件:载气(H2)流量30 mL/min,进样量5 000 μL,进样速率125 μL/s,进样口温度200 ℃;捕集阱温度40 ℃,解析温度240 ℃;柱温50 ℃,先以1 ℃/s升至80 ℃,再以3 ℃/s升至250 ℃;检测器温度260 ℃,采集时间110 s。每组样品重复测定5 次,舍弃差异较大值。
1.4 数据处理
采用Excel软件进行数据处理,采用Statistix 8.1软件进行数据差异显著性分析,采用Sigmaplot 10.0软件作图。
2 结果与分析
2.1 调味鱼贮藏过程中肌原纤维蛋白羰基含量的变化
研究表明,鲶鱼贮藏过程中,肽键断裂和氨基酸侧链基团氧化是羰基及其衍生物产生的主要原因[16],羰基的产生是鱼肉蛋白质分子被氧化修饰的重要标志,因此通过测定鱼肉中蛋白质的羰基含量可以反映出蛋白质的氧化程度[17]。
由图1可知:-18 ℃冷冻调味鱼整个贮藏期间的肌原纤维蛋白羰基含量明显高于其他2 组,且增长较快,由贮藏初期的1.59 nmol/L上升到贮藏末期的5.19 nmol/L;-30、-80 ℃冷冻调味鱼贮藏前12 周的肌原纤维蛋白羰基含量变化不明显,直至贮藏后期,-30 ℃冷冻调味鱼肌原纤维蛋白羰基含量上升较快,贮藏末期其羰基含量为4.35 nmol/L,明显高于 -80 ℃冷冻处理组;-80 ℃冷冻处理调味鱼的肌原纤维蛋白羰基含量在整个贮藏期间上升趋势较平缓,仅由初始值1.90 nmol/L增长到贮藏末期的3.34 nmol/L,表明 -30、-80 ℃冷冻处理可以有效延缓调味鱼肌原纤维蛋白的氧化,且冷冻温度越低,效果越明显。李学鹏等[18]在大黄鱼-18、-80 ℃冻藏过程中也有类似发现。
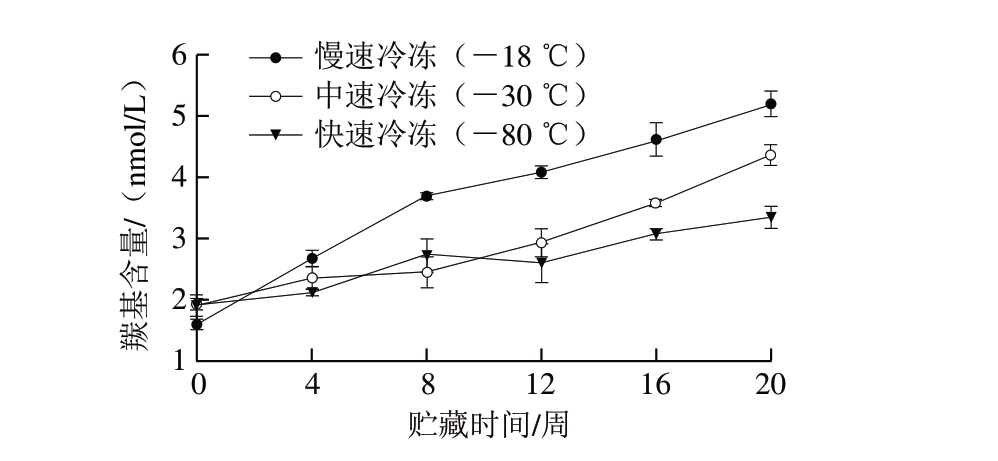
图 1 不同冷冻方式调味鱼贮藏期间肌原纤维蛋白羰基含量的变化
Fig. 1 Changes in carbonyl group content of myofibrillar proteins from prepared fish with different freezing treatments
2.2 调味鱼贮藏过程中肌原纤维蛋白活性巯基含量的变化
蛋白质分子中的总巯基包括其表面的活性巯基和深埋于分子内部的巯基,巯基氧化会造成多肽间形成二硫键和磺酸类等氧化产物,从而导致蛋白质分子间产生交联、聚合,同时巯基含量的变化也会引起蛋白质空间结构的改变及蛋白质溶解性的降低[19],巯基含量越低,说明蛋白质变性程度越高,活性巯基含量的变化可以很好地表征蛋白质的氧化情况。

图 2 不同冷冻方式调味鱼贮藏期间肌原纤维蛋白活性巯基含量的变化
Fig. 2 Changes in active sulfhydryl group content of myofibrillar proteins from prepared fish with different freezing treatments
由图2可知,3 种处理调味鱼贮藏期间肌原纤维蛋白活性巯基含量的变化均为下降趋势。贮藏初期,鱼肉较新鲜,蛋白质变性程度低,活性巯基含量高;随着贮藏时间的延长,位于蛋白质分子外侧的活性巯基先被氧化形成二硫键,造成活性巯基含量明显下降。-18 ℃冷冻调味鱼贮藏期间肌原纤维蛋白活性巯基含量由初始值169.4 nmol/mg降至86.8 nmol/mg,下降幅度较大; -30 ℃冷冻调味鱼的肌原纤维蛋白活性巯基含量虽然在整个贮藏期间均高于-18 ℃冷冻调味鱼,但是贮藏期间其肌原纤维蛋白活性巯基含量的下降幅度稍大于 -18 ℃冷冻处理组,从贮藏初期到末期下降84 nmol/mg; -80 ℃冷冻处理调味鱼贮藏期间肌原纤维蛋白活性巯基含量下降幅度最小,仅下降54 nmol/mg,变化趋势平缓,这可能是由于-80 ℃冷冻调味鱼冻结时鱼体内水分形成的冰晶较小,不易刺破细胞,防止细胞汁液外流,从而减缓了蛋白质的变性。
2.3 调味鱼贮藏过程中肌原纤维蛋白表面疏水性的变化
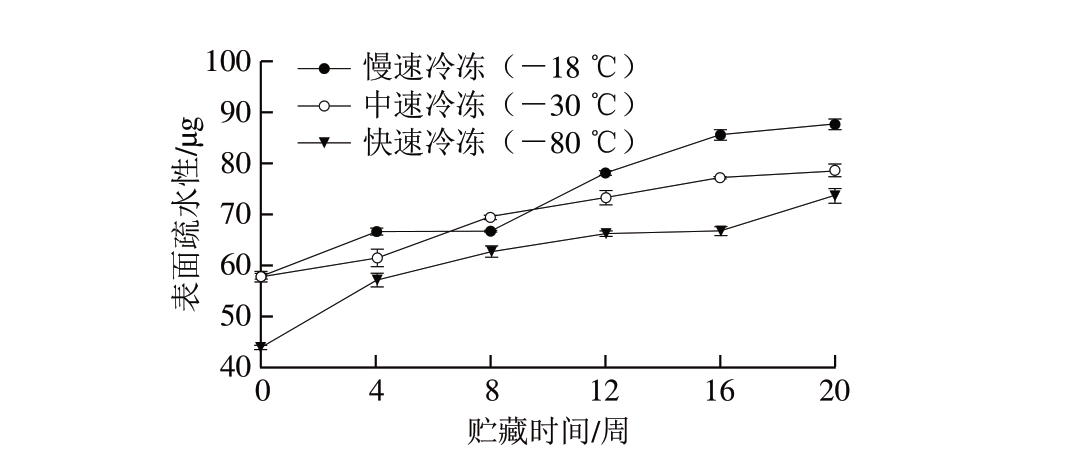
图 3 不同冷冻方式调味鱼贮藏期间肌原纤维蛋白表面疏水性的变化
Fig. 3 Changes in surface hydrophobicity of myofibrillar proteins from prepared fish with different freezing treatments
蛋白质的降解和变性会使埋藏在蛋白质分子内部的疏水基团暴露出来[20],疏水集团暴露的越多,蛋白质表面疏水性越高。由图3可知:随着贮藏时间的延长,调味鱼肌原纤维蛋白表面疏水性均不断增加, -18、-30 ℃冷冻调味鱼贮藏前4 周的肌原纤维蛋白表面疏水性增长趋势均不明显,贮藏4 周以后增长变快,且 -18 ℃冷冻调味鱼比-30 ℃冷冻调味鱼增长幅度更大;与 -18、-30 ℃冷冻调味鱼相比,-80 ℃冷冻调味鱼肌原纤维蛋白表面疏水性一直维持在较低水平,贮藏前16 周增长趋势较平缓,贮藏末期增长速率明显加快,这可能是由于-80 ℃冷冻处理对调味鱼的细胞破坏较小,疏水性氨基酸保存在细胞内,暴露较少,减少了促氧化因子对蛋白质的修饰作用,随着冻藏时间延长,细胞破坏较多,疏水基团也暴露较多。
2.4 调味鱼贮藏过程中肌原纤维蛋白乳化性及乳化稳定性的变化
乳化性和乳化稳定性主要反映蛋白质与油脂间的作用力[21],蛋白质具有良好的溶解性、表面活性和抗凝聚能力,常作为乳化剂应用在食品中[22]。由图4A可知,3 种冷冻处理调味鱼贮藏期间肌原纤维蛋白的乳化性均随贮藏时间的延长不断下降,这是由于鱼肉肌原纤维蛋白分子不断发生氧化、交联、变性以及分子内侧疏水基团的暴露,降低了蛋白质的溶解性,使得其在乳化过程中乳化粒子减少,从而乳化性随之降低[23]。乳化性的降低与羰基、活性巯基、表面疏水性的变化具有相关性, -80 ℃冷冻处理调味鱼肌原纤维蛋白的乳化性在贮藏前4 周低于-30 ℃冷冻处理组,之后均高于其他2 组, -30 ℃冷冻处理组调味鱼肌原纤维蛋白乳化性波动较大,但整体大于-18 ℃冷冻处理组,小于-80 ℃冷冻处理组,可以看出速冻处理确实能有效减缓调味鱼的肌原纤维蛋白变性,从而减缓肌原纤维蛋白乳化性的下降。
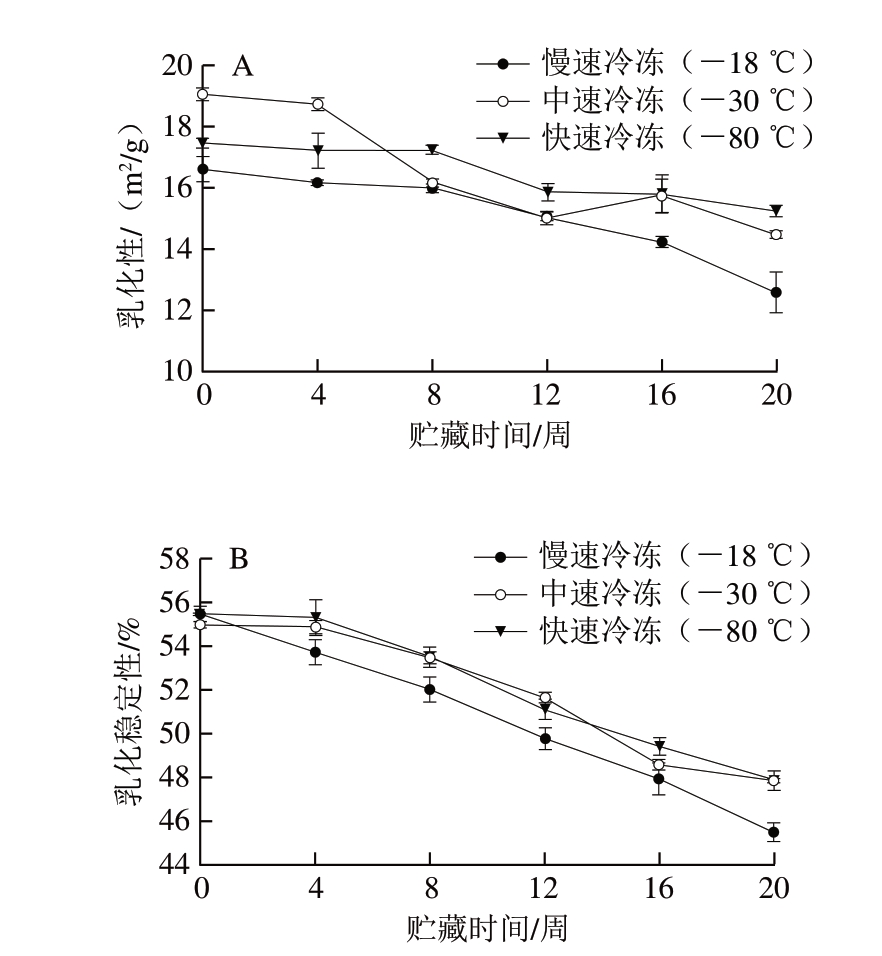
图 4 不同冷冻方式调味鱼贮藏期间肌原纤维蛋白乳化性(A)和 乳化稳定性(B)的变化
Fig. 4 Changes in emulsifying capacity (A) and emulsion stability (B) of myofibrillar proteins from prepared fish with different freezing treatments
乳化稳定性是指蛋白质维持乳状液稳定状态的一种能力,可以与乳化性一起反映蛋白质的氧化程度。由图4B可知,3 种冷冻处理调味鱼贮藏期间肌原纤维蛋白的乳化稳定性均明显下降,-80、-30 ℃冷冻处理组之间差异不明显,均高于-18 ℃冷冻处理组,与乳化性的变化趋势相似。
2.5 调味鱼贮藏过程中肌原纤维蛋白浊度的变化

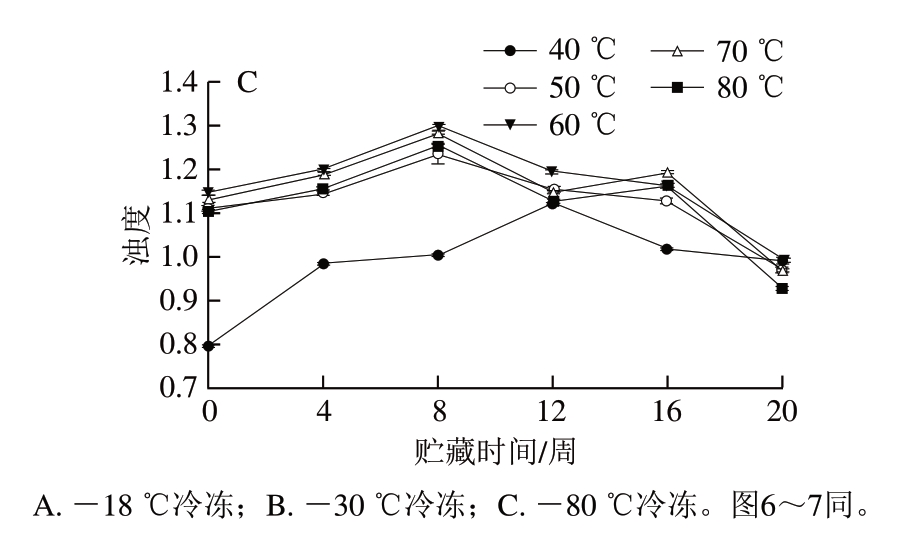
图 5 不同冷冻方式调味鱼贮藏期间肌原纤维蛋白在不同加热 温度下浊度的变化
Fig. 5 Changes in turbidity of myofibrillar proteins from prepared fish with different freezing treatments
浊度是指光透过物质后被散射或吸收成为不透射光的一种变化程度[24]。由图5可知,总体来看,3 种冷冻处理调味鱼肌原纤维蛋白的浊度均随贮藏时间的延长先上升后下降。贮藏前期,肌原纤维蛋白不断氧化变性,分子间疏水性相互作用变大,导致肌原纤维蛋白溶解度降低,光透过时发生散射,从而浊度不断上升[25];贮藏后期浊度下降可能是由于随着肌原纤维蛋白溶解度的继续降低,在悬浊液中形成较大的聚集体而发生沉淀,引起浊度下降。3 种冷冻处理调味鱼肌原纤维蛋白的浊度均在加热温度40 ℃时较小,加热温度50~80 ℃时浊度明显升高,说明调味鱼肌原纤维蛋白在50 ℃及以上温度时可以形成良好的悬浊液体系。-18 ℃冷冻调味鱼贮藏期间肌原纤维蛋白浊度平均值为1.21,-30 ℃冷冻处理组为1.10, -80 ℃冷冻处理组为1.07,综合来看,速冻处理可以提高调味鱼贮藏期间肌原纤维蛋白的溶解度,从而降低其浊度。
2.6 调味鱼贮藏过程中肌原纤维蛋白的SDS-PAGE分析
由图6可知,调味鱼贮藏过程中肌原纤维蛋白SDS-PAGE 图谱中从上到下的条带分别表示肌球蛋白重链、肌动蛋白、原肌球蛋白和肌钙蛋白,与Jiang等[26]研究报道一致,其中主要的蛋白条带是肌球蛋白重链和肌动蛋白[27]。随着贮藏时间的延长,3 种处理调味鱼的肌原纤维蛋白条带均发生不同程度的变淡、变细,说明贮藏期间肌原纤维蛋白发生降解。-18 ℃冷冻处理调味鱼肌原纤维蛋白条带在整个贮藏期间明显比-80、-30 ℃冷冻处理组条带细且颜色较浅;-30 ℃冷冻处理调味鱼的肌球蛋白重链和肌动蛋白条带随着贮藏时间的延长明显变浅,但整体优于-18 ℃冷冻处理组;-80 ℃冷冻处理组调味鱼的肌原纤维蛋白条带在整个贮藏期间都清晰可辨,颜色较深,直至贮藏末期(第20周),肌球蛋白重链条带才明显变浅,说明-80 ℃冷冻处理能有效延缓调味鱼肌原纤维蛋白的氧化。
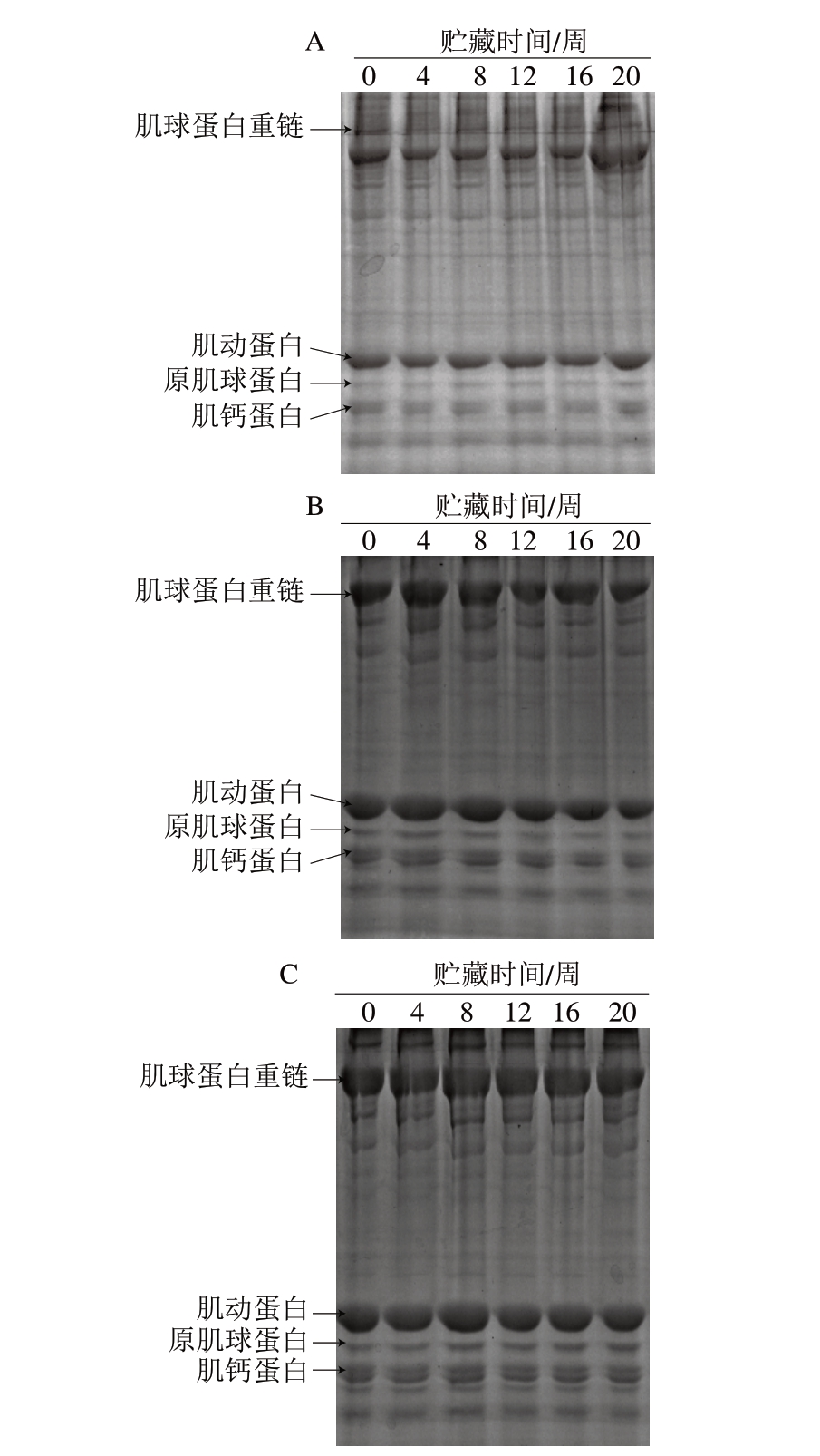
图 6 不同冷冻方式调味鱼贮藏期间肌原纤维蛋白的SDS-PAGE图谱
Fig. 6 SDS-PAGE patterns of myofibrillar proteins from prepared fish with different freezing treatments
2.7 调味鱼贮藏过程中电子鼻响应值的主成分分析
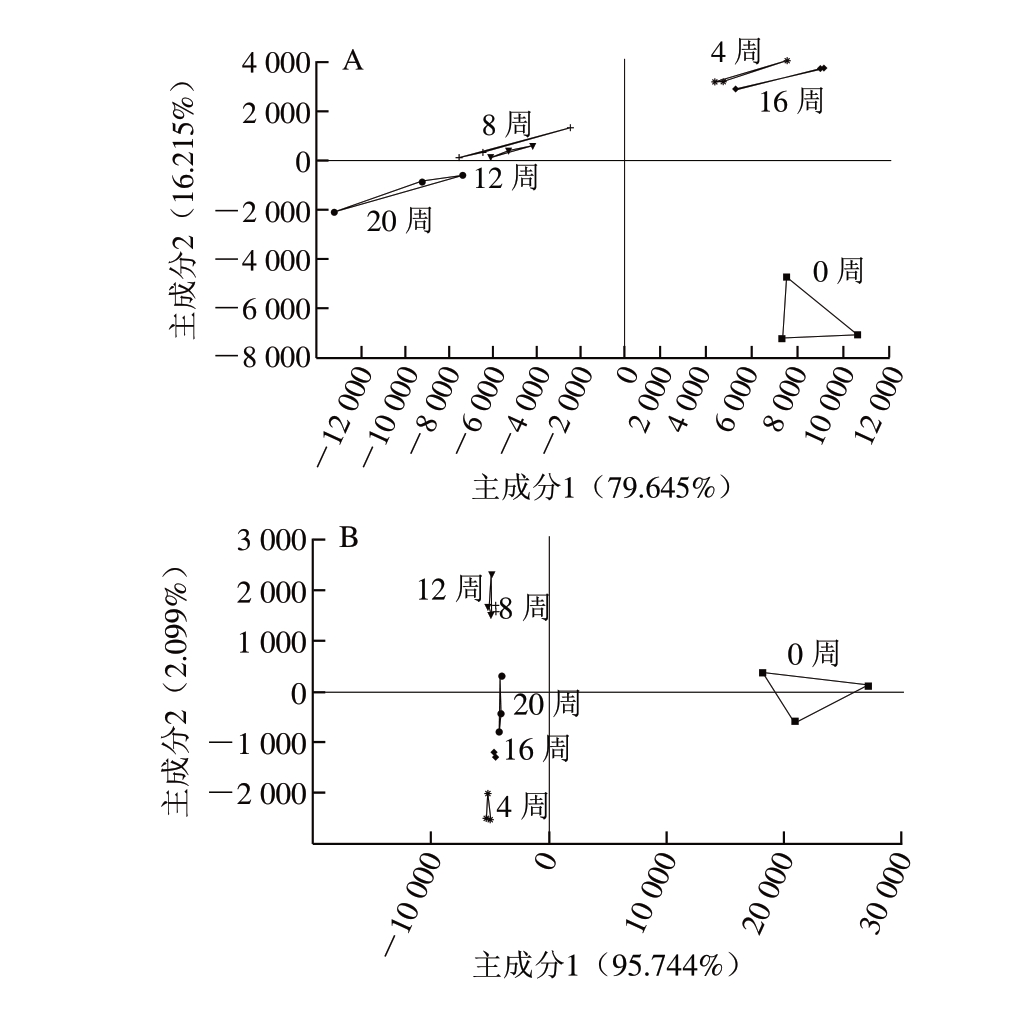
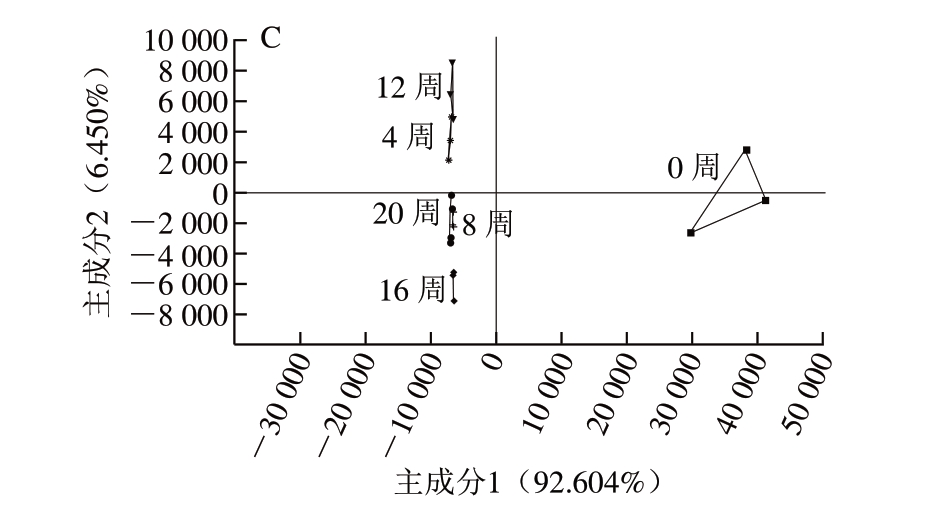
图 7 不同冷冻方式的调味鱼贮藏期间电子鼻响应值主成分分析
Fig. 7 Principal component analysis of electronic nose response values for odor changes of prepared fish with different freezing treatments
-18 ℃、-30 ℃、-80 ℃冷冻处理调味鱼贮藏期间的电子鼻识别指数分别为87、86、86,置信度较好,能很好地区分出不同冷冻方式调味鱼贮藏期间的气味变化情况[28]。由图7可知,-18 ℃冷冻调味鱼贮藏期间的气味变化较大,分布较分散,而-30、-80 ℃冷冻处理调味鱼除贮藏0周外,其余贮藏时间的气味变化均较小,分布集中,说明-30、-80 ℃冷冻能很好地延缓调味鱼贮藏期间的风味变化。
3 结 论
鱼肉贮藏过程中肌原纤维蛋白容易发生氧化,这种氧化随着贮藏时间的延长会加剧,具体表现为肌原纤维蛋白羰基含量上升,活性巯基含量下降,表面疏水性上升,乳化性及乳化稳定性下降,浊度上升,且随着肌原纤维蛋白的氧化降解,其SDS-PAGE条带也逐渐变细、变模糊。不同冷冻方式对调味鱼肌原纤维蛋白变性的抑制效果为-80 ℃(快速冷冻)>-30 ℃(中速冷 冻)>-18 ℃(慢速冷冻)。不同冷冻方式对调味鱼贮藏期间的气味也会产生影响,-18 ℃冷冻处理组气味变化较大,-30、-80 ℃冷冻处理组除贮藏初期外气味变化均较小,很好维持了鱼肉原有的气味。
[1] 彭欢欢, 刘小莉, 张金振, 等. 不同冷冻方式对斑点叉尾鮰鱼片品质的影响[J]. 食品研究与开发, 2017, 38(8): 177-182. DOI:10.3969/j.issn.1005-6521.2017.08.042.
[2] 钟立强, 王明华, 陈校辉, 等. 世界斑点叉尾鮰产业近况Ⅱ: 中国斑点叉尾鮰产业发展与展望[J]. 水产养殖, 2018, 39(9): 7-11. DOI:10.3969/j.issn.1004-2091.2018.09.003.
[3] DECKER E, XIONG Y L, CALVERT T, et al. Chemical, physical, and functional properties of oxidized turkey white muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1993, 41(2): 186-189.
[4] 赵启蒙, 许澄, 黄雯, 等. 不同冻藏温度下镀冰衣处理对鲶鱼品质的影响[J]. 食品工业科技, 2015, 36(12): 307-310. DOI:10.13386/j.issn1002-0306.2015.12.056.
[5] UTRERA M, MORCUENDE D, RUI G, et al. Role of phenolics extracting from Rosa canina L. on meat protein oxidation during frozen storage and beef patties processing[J]. Food and Bioprocess Technology, 2015, 8(4): 854-864. DOI:10.1007/s11947-014-1450-3.
[6] 宋丽丽, 毛金林, 陈杭君, 等. 冻藏对斑点叉尾鮰鱼片蛋白质冷冻变性和肌原纤维超微结构的影响[J]. 中国食品学报, 2013, 13(1): 61-67. DOI:10.16429/j.1009-7848.2013.01.017.
[7] 曾名勇, 黄海, 李八方. 不同冻藏温度对鲈鱼肌肉蛋白质生化特性的影响[J]. 青岛海洋大学学报(自然科学版), 2003(4): 525-530. DOI:10.16441/j.cnki.hdxb.2003.04.005.
[8] YANG Fang, RUSTAD T, XU Yanshun, et al. Endogenous proteolytic enzymes: a study of their impact on cod (Gadus morhua) muscle proteins and textural properties in a fermented product[J]. Food Chemistry, 2015, 172: 551-558. DOI:10.1016/j.foodchem.2014.09.086.
[9] BRADFORD M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[10] OLIVER C, AHN B, MOERMAN E, et al. Aged-related changes in oxidized proteins[J]. Journal of Biological Chemistry, 1987, 262: 5488-5491.
[11] BENJAKUL S, SUTTHIPAN N. Muscle changes in hard and soft shell crabs during frozen storage[J]. LWT-Food Science and Technology, 2009, 42(3): 723-729. DOI:10.1016/j.lwt.2008.10.003.
[12] CHELH I, GATELLIER P, SANTE-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[13] 樊雪静. 大豆分离蛋白-寡糖复合体系乳化性及乳化稳定性研究[D]. 哈尔滨: 东北农业大学, 2018: 13.
[14] LAEMMLI U. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[15] 宋敏. 冻结方式和低盐腌制对鮰鱼片品质影响研究[D]. 无锡: 江南大学, 2018: 14.
[16] BUTTERFIELD D, STADMAN E. Protein oxidation processes in aging brain[J]. Advances in Cell Aging Gerontology, 1997(2): 161-191. DOI:10.1016/S1566-3124(08)60057-7.
[17] 文镜, 张春华, 董雨, 等. 蛋白质羰基含量与蛋白质氧化损伤[J]. 食品科学, 2003, 24(10): 153-157.
[18] 李学鹏, 周明言, 周凯, 等. 大黄鱼冻藏过程中肌原纤维蛋白变性及其功能性质的变化[J]. 中国食品学报, 2018, 18(7): 171-179. DOI:10.16429/j.1009-7848.2018.07.022.
[19] 邓思杨, 王博, 李海静, 等. 冻融次数对镜鲤鱼肌原纤维蛋白功能和结构特性变化的影响[J]. 食品科学, 2019, 40(11): 95-101. DOI:10.7506/spkx1002-6630-20180606-079.
[20] 刘小莉, 彭欢欢, 李莹, 等. 冻藏温度对斑点叉尾鮰鱼片蛋白质特性和感官品质的影响[J]. 中国食品学报, 2019, 19(1): 141-147. DOI:10.16429/j.1009-7848.2019.01.019.
[21] 莫重文. 蛋白质化学与工艺学[M]. 北京: 化学工业出版社, 2007: 82-90.
[22] WILLIAMS P, PHILLIPS G, WALSTRA P. The roles of proteins and peptides in formation and stabilisation of emulsions[J]. Plant Species Biology, 2002, 26(3): 254-258.
[23] 杜洪振, 孙钦秀, 杨振, 等. 转谷氨酰胺酶对鲤鱼肌原纤维蛋白乳化活性和凝胶特性的影响[J]. 食品工业科技, 2019, 40(6): 126-130; 278. DOI:10.13386/j.issn1002-0306.2019.06.021.
[24] GLASSER L, PAULSON A, SPEERS R, et al. Foaming behavior of mixed bovine serum albumin-protamine systems[J]. Food Hydrocolloids, 2007, 21(4): 495-506. DOI:10.1016/j.foodhyd.2006.05.008.
[25] 付璐璐, 黄建联, 赵建新, 等. 葡萄糖氧化酶对金线鱼鱼糜凝胶特性的影响[J]. 中国食品学报, 2016, 16(8): 59-64. DOI:10.16429/j.1009-7848.2016.08.009.
[26] JIANG S T, HWANG D C, CHEN C S. Denaturation and change in SH group of actomyosin from milkfish (Chanoschanos) during storage at -20 ℃[J]. Journal of Agricultural and Food Chemistry, 1988, 36: 433-437.
[27] MINGINO L, PAREDI M. Physico-chemical and functional properties of myofibrillar proteins from different species of molluscs[J]. LWTFood Science and Technology, 2006, 39(1): 35-42. DOI:10.1016/j.lwt.2004.12.004.
[28] 申朝文. 基于电子鼻的鱼肉新鲜度评价方法的研究[D]. 广州: 广东工业大学, 2008: 19.