鱼糜凝胶在形成过程中主要经历3 个阶段:凝胶化、凝胶劣化和鱼糕化[1]。而在实际生产中,为避免凝胶劣化的产生,常采用二段式凝胶化方式,即40 ℃、60 min凝胶化,90 ℃、30 min鱼糕化[2]。凝胶化是鱼糜制品加工过程中的重要步骤之一,肌原纤维蛋白具有受热凝胶的性质,可以形成具有弹性的产品[3]。凝胶特性和水分特性通常与所形成鱼糜凝胶的空间网络结构有关,鱼糜蛋白在加热变性过程中发生解螺旋、伸展和聚合,形成空间三维网状结构,捕获更多的水分,增加了鱼糜制品的凝胶强度和持水性能[4]。鱼糜的主要成分是水和蛋白质,水分子既是质子供体又是质子受体,能够通过氢键与蛋白质的极性部位或非极性部位结合,从而影响蛋白质的结构及生物学功能[5]。水分作为鱼糜制品中含量最高且非常重要的化学组分,其含量和分布状态在鱼糜制品整个加工过程中的变化情况是决定鱼糜制品质量的重要因素[6]。
利用低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)及核磁共振成像(magnetic resonance imaging,MRI)技术的无损检测特点,研究产品加工过程中水分分布和存在状态具有较大优势[7-10]。 程沙沙[11]、张文杰等[12]采用LF-NMR及MRI研究干制虾和海参复水过程中的水分分布及水分状态变化,为干制虾和海参复水加工物性参数的研究提供了有效方法。
研究[13-16]表明,不同的鱼种,其鱼糜的凝胶性存在很大差别,白肉鱼和红肉鱼由于物性不同,所形成凝胶的弹性亦存在差异;一般来说,白肉鱼比红肉鱼凝胶性好,海水鱼比淡水鱼凝胶性好。目前,国内外对于不同鱼种之间鱼糜凝胶性能的研究主要集中在盐溶性蛋白方面[17-18],而对于凝胶过程中水分状态变化的研究则鲜有报道。本研究拟应用LF-NMR技术对鲣鱼、鲐鱼(均为红肉鱼)、草鱼和金鲳鱼(均为白肉鱼)4 种不同鱼糜盐擂、凝胶化和鱼糕化阶段的水分状态进行测定,揭示鱼糜凝胶形成过程水分的状态和迁移规律,比较不同食盐添加量(1%、2%、3%)对4 种鱼糜凝胶过程中水分状态及迁移的影响,为鱼糜制品凝胶化过程中水分状态变化的研究提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
新鲜金鲳鱼、草鱼(平均体质量1.0 kg)购于海南省三亚市荔枝沟市场,保藏运至实验室,冰浴条件下宰杀、去皮及内脏后(0.5 h内处理完毕),4 ℃放置备用。冷冻鲣鱼(平均体质量1.5 kg)、鲐鱼(平均体质量0.2 kg)购于文昌海缘水产有限公司,贮藏于-80 ℃超低温冰箱中。
食盐 海南晶辉盐业有限公司。
1.2 仪器与设备
MesoMR23-060H-I核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司;XOGDH-1006高精度低温恒温槽 南京先欧仪器制造有限公司;HWS-26恒温水浴槽 金坛市盛蓝仪器制造有限公司;FM100雪花制冰机 北京长流有限公司;DZ-500/1S真空包装机 深圳市晟枫包装机械有限公司;SE1501F电子天平 奥豪斯仪器(上海)有限公司;HX-J3011绞肉机 佛山市海迅电器有限公司。
1.3 方法
1.3.1 原料预处理
新鲜的金鲳鱼、草鱼用冰水洗去血污。冷冻鲣鱼、鲐鱼置于4 ℃冰箱,解冻至中心温度为(4±1) ℃,去内脏。用剖刀垂直将鱼头切下,沿脊椎骨水平方向至鱼尾,剖成完整的鱼肉,除去鱼刺,放入冰水中待用。其中,金鲳鱼和草鱼取白肉部分,切块(5 mm);鲣鱼和鲐鱼直接切块(5 mm)。采用0.2 g/100 mL盐水漂洗,漂洗用水量(质量)为鱼肉质量的3~4 倍,温度控制在10 ℃以内,漂洗2~3 次。漂洗后将鱼肉盛于镂肉篮内沥去多余水分并用滤纸擦干表面。
1.3.2 鱼糜样品制备
取预处理好的鱼肉适量,置于绞肉机,确保绞肉机置于冷水中,空擂5 min后,加入不同添加量(1%、2%、3%)的食盐,继续盐擂2 min;将盐擂好的鱼糜脱气2 次,制成20.0 g左右的鱼丸,套袋隔水置于冰水混合物中待用。
1.3.3 鱼糜凝胶化
凝胶化采用二段式,40 ℃、60 min凝胶化,90 ℃、30 min鱼糕化。
1.3.4 低场核磁设备参数设定
将样品表面水分吸干,称取约20.00 g,置于32 ℃永磁场的射频线圈中心测定,采用的射频线圈直径为60 mm,脉冲序列:采集频率200 kHz,采样参数21 MHz,射频延时0.002 ms,模拟增益20.0 dB,90°脉冲时间16.00 μs,数字增益3 dB,前置放大增益0 dB,重复采样等待时间3 500 ms,累加次数8,180°脉冲时间30.00 μs,延时1.000 ms,回波个数1 000。反演:采用联合迭代重建反演算法,弛豫时间点量数为200,迭代次数为100 000 次。
1.4 数据处理
运用SPSS 19.0软件比较数据间的差异显著性,用Origin 8.0及Microsoft Excel软件作图。
2 结果与分析
2.1 4 种鱼肉中水分状态的分布情况
弛豫时间T21(0.1~10 ms)代表结合水,主要通过化学作用力结合到蛋白质分子上,T21对应的峰面积为S21; 弛豫时间T22(10~100 ms)代表不易流动水,是指被束缚在凝胶致密空间网络结构内部的水,T22对应的峰面积为S22;弛豫时间T23(100~1 000 ms)代表自由水,是凝胶空间网络结构外部可以自由移动的水分,T23对应的峰面积为S23[19-20]。
表 1 4 种鱼肉的LF-NMR参数(n=3)
Table 1 LF-NMR parameters of four surimi gels (n= 3)

注:同列小写字母不同,表示差异显著(P<0.05)。
组别 T21/ms S21/% T22/ms S22/% T23/ms S23/%金鲳鱼肉 1.211±0.371a 0.020±0.010b 58.732±0.000b 0.971±0.012b 682.981±27.683b 0.010±0.000a草鱼肉 1.232±0.362a 0.033±0.010a 67.643±6.633a 0.973±0.010b 768.193±75.303a 0.004±0.000b鲣鱼肉 0.860±0.172c 0.011±0.000c 38.724±0.000d 0.992±0.000a鲐鱼肉 0.984±0.111b 0.014±0.000c 44.492±0.000c 0.990±0.011a
由表1可知,4 种鱼肉的水分分布存在一定差异性,金鲳鱼肉和草鱼肉中存在弛豫时间T21、T22、T23对应的3 种水分,鲣鱼肉和鲐鱼肉存在弛豫时间T21、T22对应的2 种水分。这可能是由于白肉鱼(金鲳鱼、草鱼)和红肉鱼(鲣鱼、鲐鱼)在组织结构上存在一定差异性[16]。不同鱼肉的弛豫时间T21和T22存在差异性(P<0.05),且金鲳鱼和草鱼大于鲣鱼和鲐鱼,即水分自由度高,这可能与鱼种及其生长环境(深度、水中盐度)有关。
2.2 鱼糜凝胶过程中水分的迁移状态
2.2.1 食盐添加量对鱼糜盐擂阶段水分迁移的影响
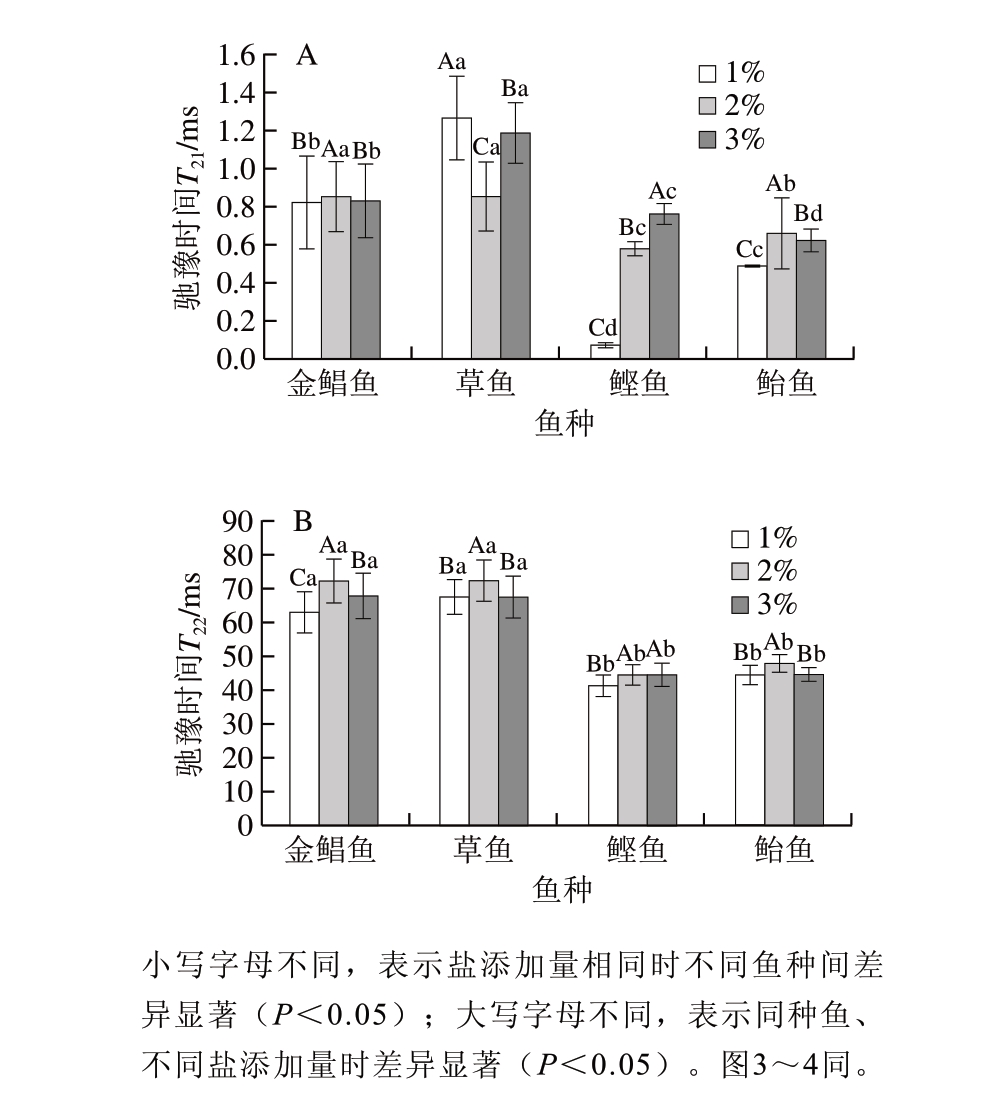
图 1 鱼糜盐擂阶段食盐添加量对弛豫时间T21(A)、T22(B)的影响
Fig. 1 Effect of salt addition on relaxation time T21 (A) and T22 (B) of surimi
盐擂后,鲣鱼和鲐鱼鱼糜水分分布没有发生变化,仍然存在弛豫时间T21、T22对应的2 种水分,但是金鲳鱼和草鱼鱼糜水分分布发生变化,弛豫时间T23消失,只存在弛豫时间T21、T22,这可能是由于盐擂溃过程中鱼肉组织结构发生改变,盐溶性蛋白溶出形成溶胶,将T23束缚转化为T22。
由图1可知,经不同食盐添加量(1%、2%、3%)盐擂后,金鲳鱼和草鱼鱼糜的弛豫时间T21、T22均显著大于鲣鱼和鲐鱼鱼糜(P<0.05),即金鲳鱼和草鱼鱼糜的结合水和不易流动水自由度显著高于鲣鱼和鲐鱼鱼糜。鲣鱼和鲐鱼鱼糜的弛豫时间T21、T22均较小,说明结合水和不易流动水的自由度低,该部分水的稳定性较高。2%食盐添加量下,4 种鱼糜的弛豫时间T22均相对较高,即不易流动水的自由度较好,这可能是由于2%的食盐添加量更有利于盐溶性蛋白的溶出,结合较多的水分子。
表 2 鱼糜盐擂阶段不同食盐添加量对LF-NMR峰面积的影响(n= 3)
Table 2 Effect of salt addition on relaxation peak area of surimi (n= 3)
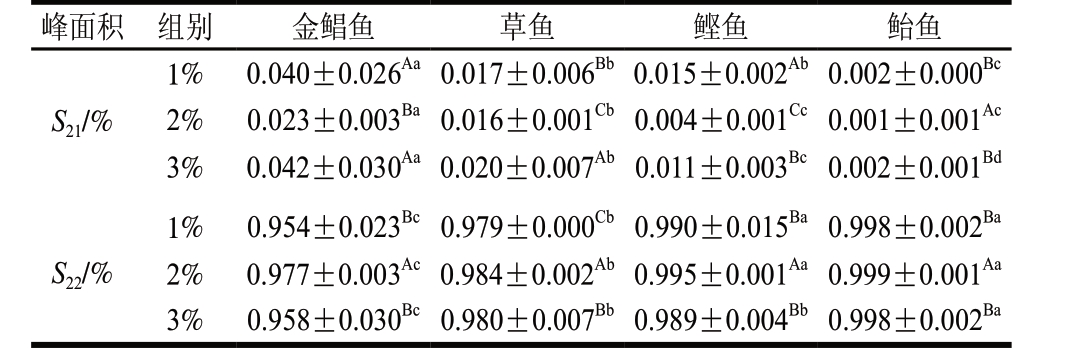
注:同行小写字母不同,表示盐添加量相同时不同鱼种间差异显著 (P<0.05);同列大写字母不同,表示同种鱼、不同盐添加量时差异显著(P<0.05)。表3~4同。
峰面积 组别 金鲳鱼 草鱼 鲣鱼 鲐鱼S21/%1% 0.040±0.026Aa 0.017±0.006Bb 0.015±0.002Ab 0.002±0.000Bc 2% 0.023±0.003Ba 0.016±0.001Cb 0.004±0.001Cc 0.001±0.001Ac 3% 0.042±0.030Aa 0.020±0.007Ab 0.011±0.003Bc 0.002±0.001Bd S22/%1% 0.954±0.023Bc 0.979±0.000Cb 0.990±0.015Ba 0.998±0.002Ba 2% 0.977±0.003Ac 0.984±0.002Ab 0.995±0.001Aa 0.999±0.001Aa 3% 0.958±0.030Bc 0.980±0.007Bb 0.989±0.004Bb 0.998±0.002Ba
由表2可知,添加2%食盐擂溃后,4 种鱼糜的S22均显著增加(P<0.05)。原因可能为较高食盐添加量时蛋白质变性,导致肌原纤维蛋白聚合,刚性增加,这些基团与结合能力强的水分产生交叉弛豫现象,导致能量交换加快,弛豫时间缩短[21-23]。
2.2.2 食盐添加量对鱼糜凝胶化阶段水分迁移的影响
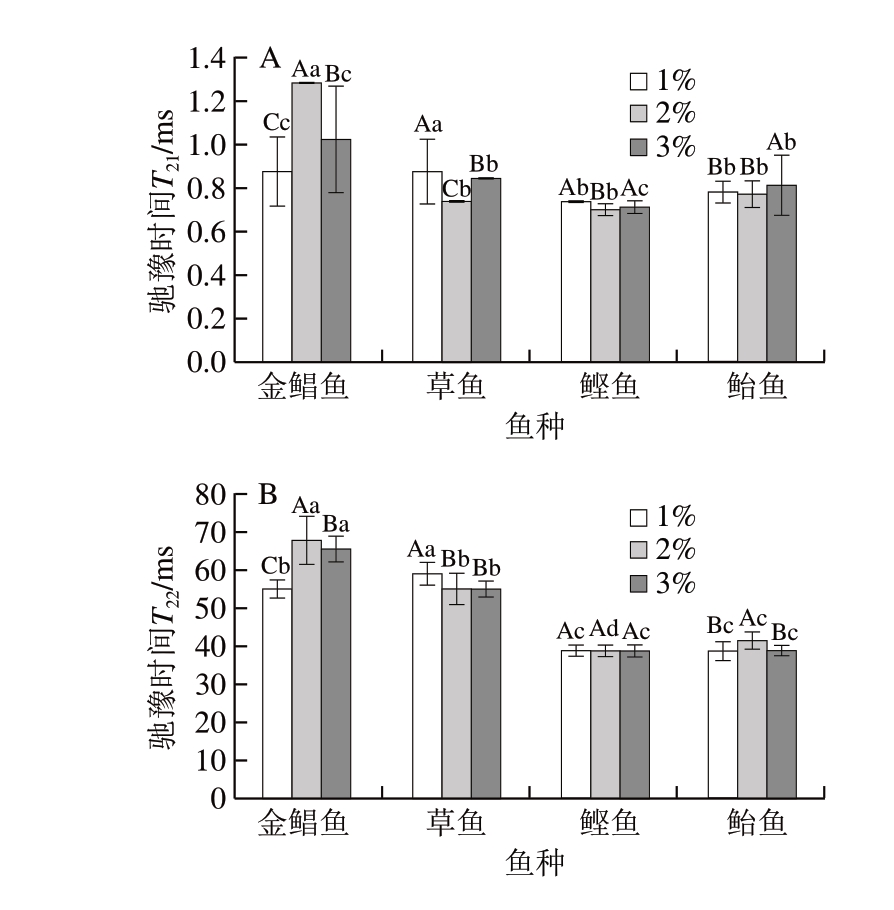
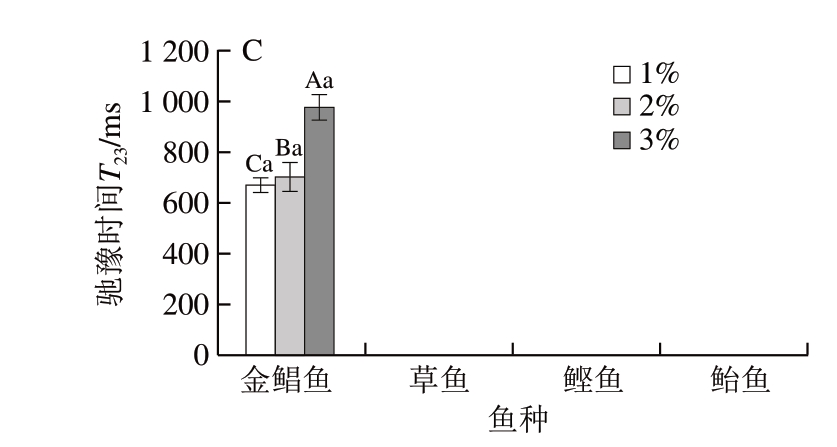
图 2 鱼糜凝胶化阶段不同食盐添加量对弛豫时间T2的影响
Fig. 2 Effect of salt addition on relaxation times T2 of surimi gel
由图2可知,凝胶化后,只有金鲳鱼鱼糜凝胶出现弛豫时间T23对应的水分分布。原因可能为金鲳鱼为海水白肉鱼,鱼肉组织间隙存在弛豫时间T23对应的水分,在盐擂过程中鱼肉组织结构发生改变,盐溶性蛋白溶出形成溶胶,将弛豫时间T23束缚转化为弛豫时间T22,金鲳鱼鱼糜蛋白质的变性温度相对较低[24-26],鱼糜凝胶化后开始有孔状结构形成,蛋白质变性导致凝胶结构改变,弛豫时间T22脱离束缚转化为弛豫时间T23,而鲣鱼和鲐鱼则为海水红肉鱼,蛋白质的变性温度也相对较低,但是可能由于红肉鱼含有较多的肌浆蛋白[27],对自由水存在影响。
表 3 鱼糜凝胶化阶段不同食盐添加量对LF-NMR峰面积 的影响(n= 3)
Table 3 Effect of salt addition on relaxation peak area of surimi gel (n= 3)
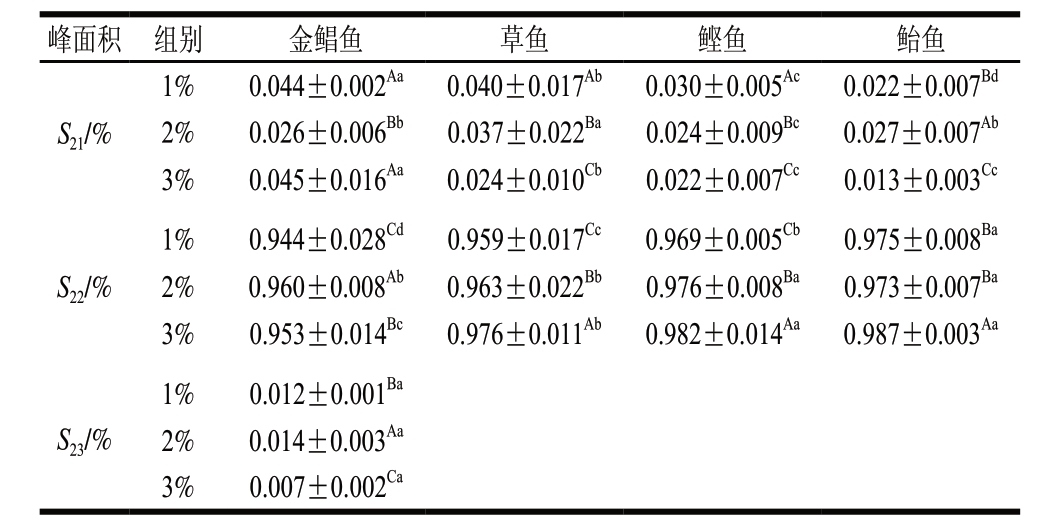
峰面积 组别 金鲳鱼 草鱼 鲣鱼 鲐鱼S21/% 1% 0.044±0.002Aa 0.040±0.017Ab 0.030±0.005Ac 0.022±0.007Bd 2% 0.026±0.006Bb 0.037±0.022Ba 0.024±0.009Bc 0.027±0.007Ab 3% 0.045±0.016Aa 0.024±0.010Cb 0.022±0.007Cc 0.013±0.003Cc S22/% 1% 0.944±0.028Cd 0.959±0.017Cc 0.969±0.005Cb 0.975±0.008Ba 2% 0.960±0.008Ab 0.963±0.022Bb 0.976±0.008Ba 0.973±0.007Ba 3% 0.953±0.014Bc 0.976±0.011Ab 0.982±0.014Aa 0.987±0.003Aa S23/% 1% 0.012±0.001Ba 2% 0.014±0.003Aa 3% 0.007±0.002Ca
由图2和表3可知:金鲳鱼、鲣鱼、鲐鱼3 种鱼糜凝胶化后的弛豫时间T21均增大(P<0.05),草鱼鱼糜凝胶化后弛豫时间T21减少(P<0.05),可能是由于金鲳鱼、鲣鱼、鲐鱼为海水鱼,草鱼为淡水鱼,海水鱼的蛋白质变性温度相对较低,蛋白质变性后暴露的极性基团与水的亲和能力增强,形成结合水[14-15];弛豫时间T21逐渐增大,S21增大,弛豫时间T22和S22均减小。在凝胶化阶段,鲣鱼和鲐鱼鱼糜的弛豫时间T21、T22均较小,说明结合水和不易流动水的自由度低,该部分水的稳定性高。
2.2.3 食盐添加量对鱼糜鱼糕化阶段水分迁移的影响
由图3和表4可知,4 种鱼糜鱼糕化后均出现弛豫时间T21、T22和T23对应的3 种水分,这可能是由于高温使凝胶化后的鱼糜中肌动球蛋白加热变性,形成的高级结构发生松散,分子间产生架桥形成的三维网状结构[28],自由水被锁于网状结构中无法流动,故4 种鱼糜鱼糕化后S23均呈现上升趋势。鱼糜鱼糕化后,弛豫时间T21均增加,说明结合水的自由度增大,这可能是由于蛋白质变性后暴露的极性基团增多,水亲和能力增强。鱼糕化阶段,鲣鱼和鲐鱼鱼糜的弛豫时间T21、T22均较小,说明结合水和不易流动水的自由度低,该部分水的稳定性高。
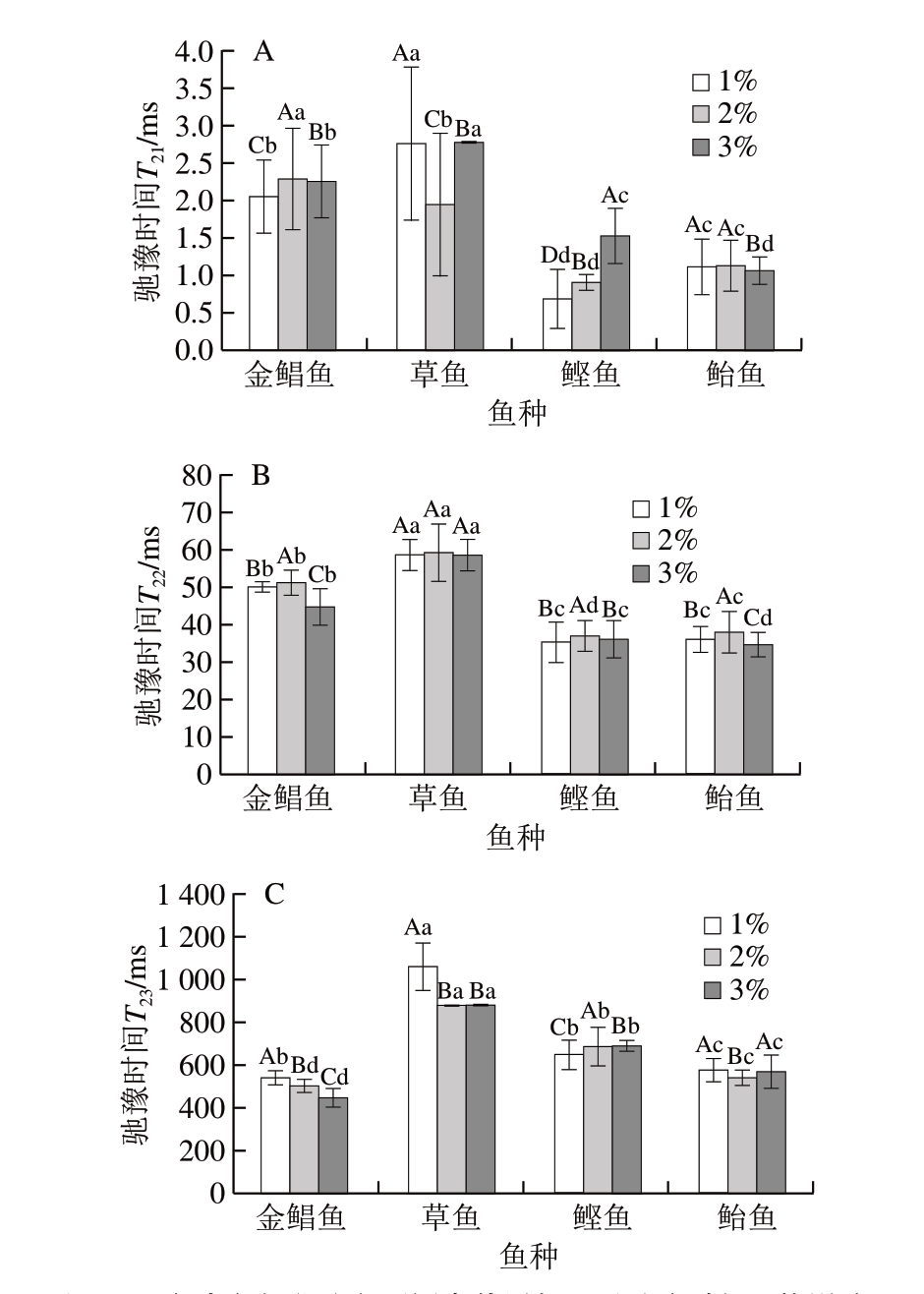
图 3 鱼糜鱼糕化阶段不同食盐添加量对弛豫时间T2的影响
Fig. 3 Effect of salt addition on relaxation time T2 of surimi fish cake
表 4 鱼糜鱼糕化阶段不同食盐添加量对LF-NMR峰面积 的影响(n=3)
Table 4 Effect of salt addition on relaxation peak area of surimi fish cake (n= 3)

峰面积 组别 金鲳鱼 草鱼 鲣鱼 鲐鱼S21/%1% 0.030±0.014Abc 0.023±0.003Bc 0.032±0.002Bb 0.038±0.003Aa 2% 0.011±0.005Cd 0.040±0.017Aa 0.025±0.014Cc 0.030±0.015Bb 3% 0.018±0.010Bc 0.029±0.012Bb 0.038±0.010Aa 0.028±0.017Cb S22/% 1% 0.909±0.014Bd 0.969±0.002Ab 0.974±0.021Aa 0.943±0.000Cc 2% 0.902±0.010Bd 0.949±0.016Bc 0.963±0.014Ba 0.953±0.017Bb 3% 0.915±0.018Ac 0.960±0.013ABa 0.951±00014Cbc 0.956±0.018Ab S23/%1% 0.059±0.002Ca 0.008±0.002Bd 0.015±0.002Bc 0.019±0.002Ab 2% 0.086±0.005Aa 0.010±0.00Ac 0.012±0.002Cc 0.016±0.002Bb 3% 0.067±0.013Ba 0.013±0.001Ac 0.023±0.003Ab 0.015±0.000Bc
与鱼糜凝胶化阶段的峰面积相比较,鱼糜鱼糕化阶段,除1%食盐添加量草鱼外,草鱼、鲣鱼、鲐鱼的峰面积变化趋势一致,均为S21增大、S22减小;金鲳鱼S21、S22均下降,这可能与鱼种有一定关联。在盐擂、凝胶化、鱼糕化过程中,鲣鱼和鲐鱼(红肉鱼)的弛豫时间T21、T22均小于金鲳鱼和草鱼(白肉鱼)。Qu Nan[29]研究认为,红肉鱼的凝胶性低于白肉鱼,这可能与鱼肉对结合水和不易流动水的束缚强弱存在一定的关系。
2.3 鱼糜凝胶过程中水分状态的迁移情况
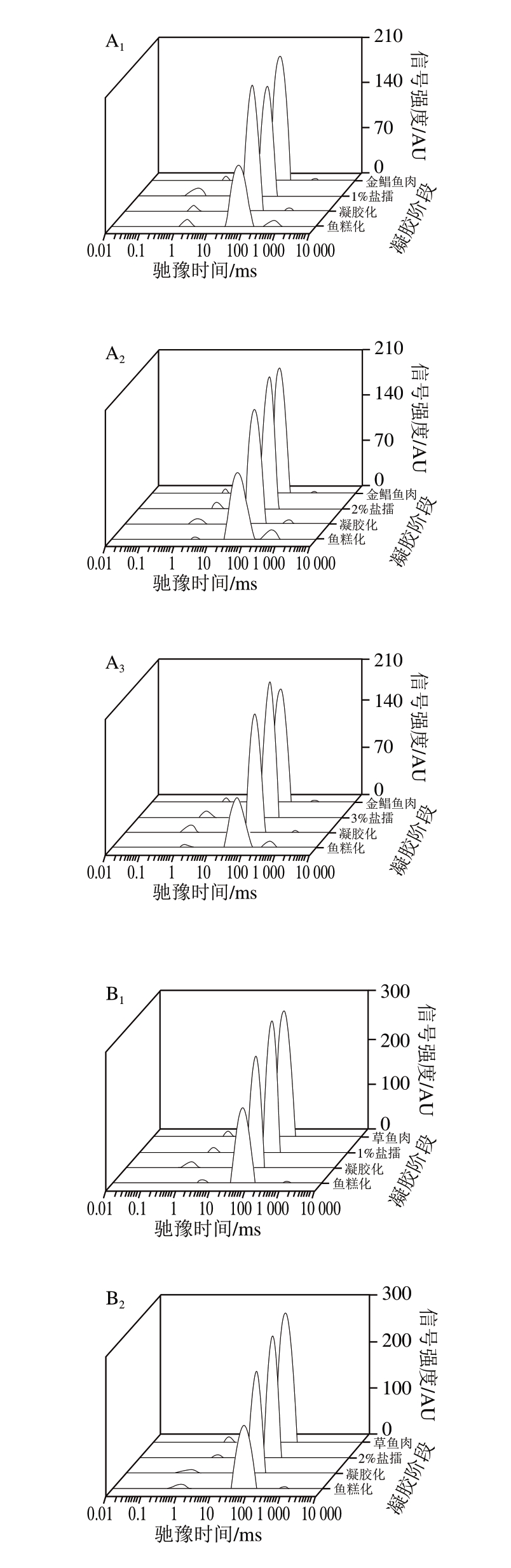
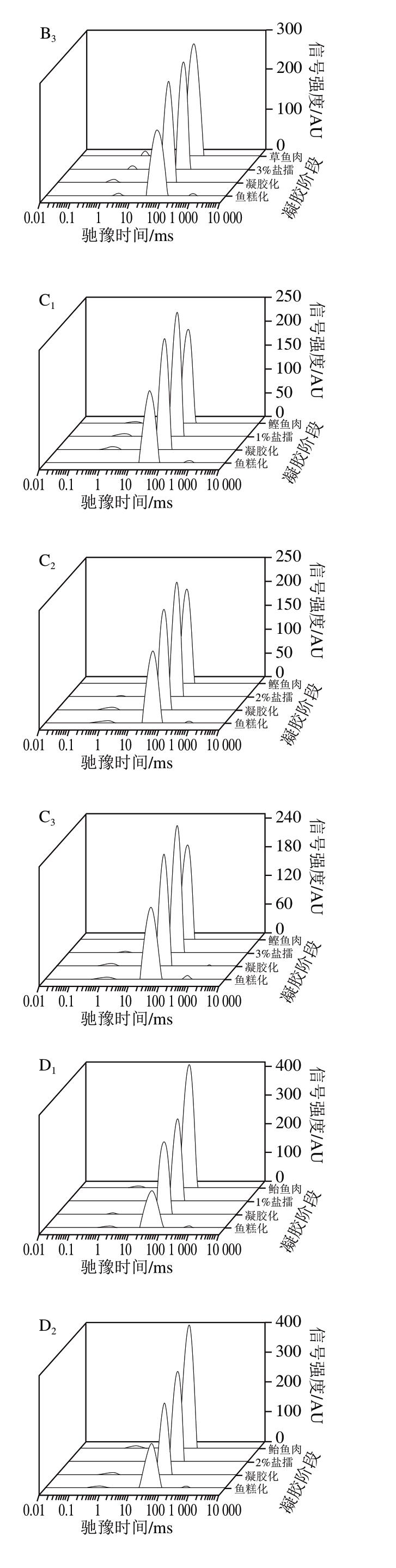
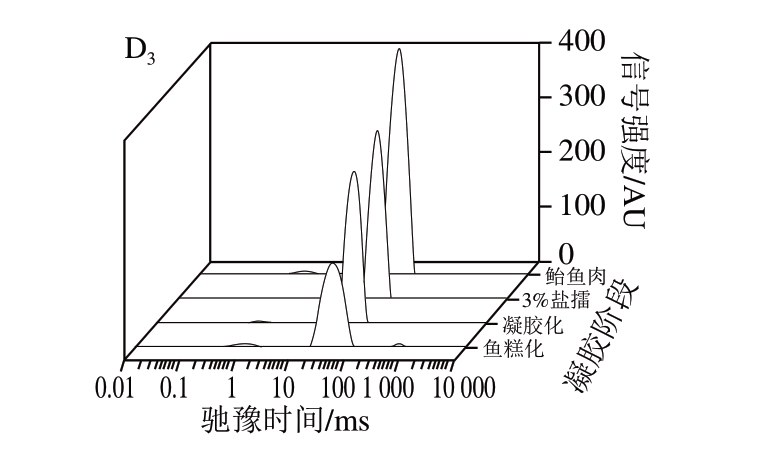
图 4 4 种鱼糜凝胶过程中T2弛豫图谱
Fig. 4 T2 relaxation spectra of four surimi gels
A. 金鲳鱼;B. 草鱼;C. 鲣鱼;D. 鲐鱼。 下标1~3分别表示食盐添加量1%、2%、3%。
由图4可知:食盐添加量对同种鱼糜凝胶的影响主要是水分弛豫时间的影响,不影响水分分布状态,这可能与食盐添加量对鱼糜凝胶强度的形成有关;食盐添加量对不同种鱼糜凝胶的影响则主要是水分状态的影响,包括水分的弛豫时间和水分分布,这可能与不同种鱼糜凝胶强度的差异性有关。
鲣鱼和鲐鱼的鱼糜凝胶过程相似,初始鱼糜、盐擂、凝胶化、鱼糕化过程水分的分布状态相似。这可能是由于鲣鱼和鲐鱼均为海水红肉鱼种;而金鲳鱼和草鱼鱼糜的凝胶过程存在一定差异性,凝胶化状态时金鲳鱼糜出现弛豫时间T23,这可能是由于金鲳鱼为海水白肉鱼,而草鱼为淡水白肉鱼,海水鱼的蛋白质变性温度相对于淡水鱼要低,故导致凝胶化状态时弛豫时间T23的出现。而海水红肉鱼(鲣鱼和鲐鱼)在凝胶化状态时没有出现弛豫时间T23,可能是由于海水白肉鱼与海水红肉鱼凝胶形成过程中肌浆蛋白存在差异性[30-32]。
3 结 论
利用LF-NMR测定4 种鱼糜凝胶过程中水分状态的变化。结果表明:金鲳鱼和草鱼(白肉鱼)与鲣鱼和鲭鱼(红肉鱼)的水分状态存在差异性;金鲳鱼肉和草鱼肉中存在结合水、不易流动水和自由水,鲣鱼肉和鲐鱼肉中存在结合水和不易流动水;4 种鱼糜凝胶过程中水分状态的存在形式及水分弛豫时间和食盐添加量有一定关联,盐擂过程中,4 种鱼糜均只含有2 种水分,即结合水和不易流动水,鱼糕化后,4 种鱼糜中均存在结合水、不易流动水和自由水,凝胶化状态中,金鲳鱼鱼糜中存在结合水、不易流动水和自由水,草鱼、鲣鱼和鲐鱼鱼糜中存在结合水和不易流动水;与鱼肉的初始状态相比,鱼糕化后,4 种鱼糜的S22均下降,S23均上升。
食盐添加量对同种鱼糜凝胶形成过程中水分状态的影响趋势一致,对不同种鱼糜凝胶形成过程中水分状态的影响存在差异性,这与鱼种有一定关系。由于鱼种生产环境及种类的差别,使鱼肉之间的水分状态存在差异性,形成凝胶的盐溶性蛋白间的差异可能导致其凝胶结构对水分的束缚能力不同,进而影响凝胶结构的稳定性及质量。
[1] 钱娟. 罗非鱼低盐鱼糜的凝胶特性及其制品的研究[D]. 上海: 上海海洋大学, 2013: 2.
[2] 贾丹. 青鱼肌肉蛋白质及其凝胶特性的研究[D]. 武汉: 华中农业大学, 2016: 34.
[3] 郝磊勇, 李汴生, 阮征, 等. 高压与热结合处理对鱼糜凝胶质构特性的影响[J]. 食品与发酵工业, 2005, 31(7): 35-38. DOI:10.3321/j.issn:0253-990X.2005.07.010.
[4] DEUMIER F, BOHUON P, TRYSTRAM G, et al. Pulsed vacuum brining (PVB) of poultry meat: experimental study on the impact of vacuum cycles on mass transfers[J]. Journal of Food Engineering, 2003, 58(1): 75-83. DOI:10.1016/S0260-8774(02)00366-7.
[5] 姚瑶, 赵林. 水分子与蛋白质分子的相互作用[J]. 化学通报, 2006, 69(4): 1-7. DOI:10.3969/j.issn.0441-3776.2006.04.004.
[6] 张涛, 张莉莉, 张金昂, 等. 保水剂及冷风干燥对鱼糜溶胶水分状态的影响研究[J]. 食品工业科技, 2013, 34(10): 97-100. DOI:10.13386/j.issn1002-0306.2013.10.035.
[7] 宋平. 基于低场核磁共振技术的水稻浸种过程种子水分检测研究[D]. 沈阳: 沈阳农业大学, 2016: 13-14.
[8] 李睿智, 王鬼, 仪淑敏, 等. 白鲢鱼鱼糜凝胶过程中水分及凝胶特性的变化[J]. 现代食品科技, 2016, 32(5): 91-97. DOI:10.13982/j.mfst.1673-9078.2016.5.015.
[9] 朱学伸, 黄雪方, 鲁小讯, 等. 结合低场核磁共振分析反复冻融处理对肉鸡不同部位肌肉品质的影响[J]. 食品科学, 2016, 37(9): 23-28. DOI:10.7506/spkx1002-6630-201609005.
[10] SLVA C, MARSICO E, DE OLIVEIRA RESENDE RIBEIRO R, et al. Quality attributes in shrimp treated with polyphosphate after thawing and cooking: a study using physicochemical analytical methods and low-field 1H NMR[J]. Journal of Food Process Engineering, 2013, 36(4): 492-499. DOI:10.1111/jfpe.12011.
[11] 程沙沙, 唐英强, 章坦, 等. LF-NMR和MRI对干制虾仁复水过程水分状态及品质变化的研究[J]. 分析测试学报, 2017, 36(10): 1224-1229. DOI:10.3969/j.issn.1004-4957.2017.10.010.
[12] 张文杰, 薛长湖, 丛海花, 等. 低场核磁共振及成像技术对海参复水过程水分状态变化的研究[J]. 食品工业科技, 2012, 33(23): 90-93. DOI:10.13386/j.issn1002-0306.2012.23.077.
[13] DING Yuqin, LIU Ru, RONG Jianhua, et al. Rheological behavior of heat-induced actomyosin gels from yellowcheek carp and grass carp[J]. European Food Research and Technology, 2012, 235: 245-251. DOI:10.1007/s00217-012-1750-7.
[14] LUO Y K, KUWAHARA R, KANENIWA M, et al. Comparison of gelproperties of surimi from alaska pollock and three freshwater fish fpecies: effects of thermal processing and protein concentration[J]. Journal of Food Science, 2001, 66: 548-554. DOI:10.1111/j.1365-2621.2001.tb04600.x.
[15] 刘海梅, 严著, 熊善柏, 等. 淡水鱼肉蛋白质组成及其在鱼糜制品加工中的变化[J]. 食品科学, 2007, 28(2): 40-44.
[16] OTTESTAD S, SØRHEIM O, HEIA K, et al. Effects of storage atmosphere and heme state on the color and visible reflectance spectra of salmon (Salmo salar) fillets[J]. Journal of Agricultural and Food Chemistry, 2011, 59(14): 7825-7831. DOI:10.1021/jf201150x.
[17] CHANARAT S, BENJAKUL S, H-KITTIKUN A. Comparative study on protein cross linking and gel enhancing effect of microbial transglutaminase on surimi from different fish[J]. Journal of the Science of Food and Agriculture, 2012, 92(4): 844-852. DOI:10.1002/jsfa.4656.
[18] 王艳霞, 张金丽, 张瑞婷, 等. 鱼种和亲水胶体对鱼糜制品凝胶性质的影响[J]. 食品工业科技, 2016, 37(2): 143-147. DOI:10.13386/j.issn1002-0306.2016.02.020.
[19] 赵婷婷, 王欣, 刘宝林, 等. 煎炸猪油掺杂比例对猪油低场核磁共振弛豫特性及脂肪酸组成的影响[J]. 食品科学, 2015, 36(1): 6-12. DOI:10.7506/spkx1002-6630-201501002.
[20] 邵俊花. 猪肉蛋白质构象变化与保油保水性关系研究[D]. 南京: 南京农业大学, 2012: 23-39.
[21] 于楠楠. 盐和多糖对鱼糜凝胶形成的影响与机制[D]. 无锡: 江南 大学, 2017: 31-33.
[22] 陈海华, 薛长湖. 热处理条件对竹荚鱼鱼糜凝胶特性的影响[J]. 食品科学, 2010, 31(1): 6-13. DOI:10.7506/spkx1002-6300-201001002.
[23] 杨芳. 阿根廷鱿鱼肌原纤维蛋白特性及其加工的研究[D]. 厦门: 集美大学, 2009: 39-44.
[24] OGAWA M, EHARA T, TAMIYA T, et al. Thermal stability of fish myosin[J]. Comparative Biochemistry and Physiology, 1993, 106(3): 517-521. DOI:10.1016/0305-0491(93)90126-p.
[25] 通威. 金鲳鱼网箱养殖技术[J]. 农家之友, 2016(2): 52-53. DOI:10.3969/j.issn.1671-8143.2016.02.037.
[26] 宋文华. 养殖密度和温度对草鱼(Ctenopharyngodonidellus)生长和生理生化指标的影响[D]. 青岛: 中国海洋大学, 2012.
[27] 刘书成. 水产食品加工学[M]. 郑州: 郑州大学出版社, 2011: 235-238.
[28] 王嵬, 仪淑敏, 李学鹏, 等. 鱼糜凝胶的形成机制及混合鱼糜研究 进展[J]. 食品安全质量检测学报, 2016, 7(1): 231-237.
[29] QU Nan. Research progress on gel properties of surimi[J]. 肉类研究, 2009, 23(12): 92-95.
[30] BRISKEY E J, CASSENS R G, TEAUTMAN J C. The physiology and biochemistry of muscle as a food[J]. The American Journal of the Medical Sciences, 1967, 253(5): 151. DOI:10.1097/00000441-196705000-00028.
[31] PIYADHAMMAVIBOON P, YONGSAWATDIGUL J. Protein crosslinking ability of sarcoplasmic proteins extracted from threadfin bream[J]. LWT-Food Science and Technology, 2009, 42(1): 37-43. DOI:10.1016/j.lwt.2008.06.011.
[32] KIM Y S, YONGSAWATDIGUL J, PARK J W, et al. Characteristics of sarcoplasmic proteins and their interaction with myofibrillar proteins[J]. Journal of Food Biochemistry, 2005, 29(5): 517-532. DOI:10.1111/j.1745-4514.2005.00023.x.