鱼糜是鱼肉肌原纤维蛋白的加工产物,因其良好的口感与营养价值深受消费者喜爱[1]。传统的鱼糜制品加工以海洋鱼类为原料,但由于近年来海洋渔业资源的匮乏以及淡水鱼养殖业的迅速发展,以淡水鱼为原料的鱼糜制品开发与研究得到广泛关注[2-3]。鲢鱼,又称白鲢、水鲢等,2016年世界总产量约为530 万t,在世界鱼类产量中排名第2位[4]。鲢鱼由于具有产量高、价格低廉及营养丰富等特点,被视为良好的鱼糜加工替代品[5]。鱼糜加工通常以鱼肉为原料,约50%~60%的副产物,如鱼头、鱼骨、鱼鳞、鱼鳍等往往被弃去,造成大量的资源浪费和环境污染问题[6]。这些副产物作为廉价且优质的蛋白质来源,可以通过酶解等生物技术进行深加工,得到的蛋白质酶解物能够添加至鱼糜中,改善鱼糜制品的品质和营养价值[7-9]。因此,鱼糜加工副产物酶解物的开发具有良好的研究价值和发展前景。
为延缓肌原纤维蛋白的降解及氧化,鱼糜的贮藏一般以冻藏为主,然而由于冷链监控的不健全及鱼糜贮运等环节的温度波动,鱼糜极易发生多次冻融循环,最终影响鱼糜的品质及凝胶形成能力[10-11],因此,如何控制鱼糜在冻藏及冻融过程中的品质劣变是当今的研究热点之一。目前的研究主要关注植物源的抗冻及抗氧化剂开发,如魔芋葡甘聚糖[12]、苹果多酚[13]等已被证实具有减缓水产品蛋白质冷冻变性及抑制蛋白质氧化的效果;通过生物酶解技术得到动物源蛋白质酶解物,如太平洋无须鳕鱼肌肉酶解物[14]、欧洲鳇鱼鱼皮酶解物[15]等同样具有抗冻及抗氧化作用,然而,淡水鱼中相关研究很少[7]。本研究以鲢鱼鱼糜加工副产物(鱼头、鱼骨、鱼鳞、鱼鳍等)为研究对象,通过酶解技术(碱性蛋白酶、胰蛋白酶)制得鱼糜加工副产物酶解物,探讨酶解物的体外抗氧化活性(1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、亚铁离子螯合能力)并将酶解物加入鱼糜中,了解酶解物对反复冻融鱼糜的蛋白质降解、氧化、凝胶形成能力、持水性等的影响,以期为鱼糜加工副产物的高值化利用及鱼糜制品的品质控制技术提供有效思路。
1 材料与方法
1.1 材料与试剂
36 条新鲜鲢鱼(体长(55.05±1.15) cm,体质量(1 947±90) g)购于北京健翔桥水产市场。
胰蛋白酶(205 000 U/g)、碱性蛋白酶(280 000 U/g)、 胃蛋白酶(42 500 U/g)、木瓜蛋白酶(245 000 U/g)、中性蛋白酶(135 000 U/g)及风味蛋白酶(26 000 U/g) 丹麦Novozymes公司;DPPH、啡啰嗪 美国Sigma 公司;其余试剂购于北京化学试剂公司;所有试剂均为分析纯。
1.2 仪器与设备
UV-2600紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;T18高速分散均质机 美国IKA公司;CT-3质构仪 美国Brookfield公司;KDY-9820半自动凯氏定氮仪 北京通润源机电仪器设备公司。
1.3 方法
1.3.1 鲢鱼预处理
鲢鱼经敲击头部致晕后,去鳞、头、内脏,取鱼片清洗后备用。鱼头、鱼骨(含部分鱼肉)、鱼尾、鱼鳞、鱼皮等鱼糜加工副产物收集后斩成小块,置于 -20 ℃冰箱备用。
1.3.2 鱼糜加工副产物酶解物的制备
鲢鱼鱼糜加工副产物称质量后,加入4 倍体积的蒸馏水,于121 ℃条件下加热2 h提取蛋白质。待蛋白质提取液冷却至室温后过3 层滤网,收集上清液旋蒸浓缩后冻干,冻干粉的蛋白质含量采用凯氏定氮法测定[16]。将已知蛋白质含量的冻干粉与去离子水混合(1∶20,m/V),调节底物溶液温度及pH值至蛋白酶最适条件后,添加质量分数2%的蛋白酶进行酶解,酶解1 h后取上清液90 ℃加热20 min灭酶、离心(5 000 r/min,15 min)后收集上清液并冷冻干燥,得到的粉末即为鱼糜加工副产物酶解物。实验前期对6 种鲢鱼鱼糜加工副产物酶解物(所用酶分别为胃蛋白酶、胰蛋白酶、木瓜蛋白酶、风味蛋白酶、中性蛋白酶及碱性蛋白酶)的抗氧化活性进行测定,最终选择抗氧化性最强的2 种酶解物:胰蛋白酶及碱性蛋白酶酶解物添加至鱼糜中。
1.3.3 鱼糜加工副产物酶解物抗氧化活性测定
DPPH自由基清除能力及亚铁离子螯合能力的测定参考Li Xue等[17]的方法。
1.3.4 鱼糜制备及冻融循环
鱼糜的制备参考Zhang Longteng等[5]的方法并稍作改动。取鱼片上的鱼肉并绞碎,称质量后加入4 倍体积的冷却蒸馏水(4 ℃),于低温条件下搅拌1 h进行第1次漂洗,漂洗时间为30 min;第2次漂洗将漂洗液更换为3 g/L氯化钠溶液,漂洗液体积和漂洗时间与第1次相同。漂洗后,利用3 层80 目筛网过滤漂洗液,取滤网上层鱼糜,通过挤压鱼糜调整其水分含量至78%,分装。CK组鱼糜不添加抗冻剂;S组鱼糜添加质量分数4%的蔗糖;TS及AS组鱼糜分别将体外抗氧化性最好的鱼糜加工副产物胰蛋白酶及碱性蛋白酶酶解物添加至鱼糜中部分替代蔗糖(TS组:2%鱼糜加工副产物胰蛋白酶酶解物+2%蔗糖;AS组:2%鱼糜加工副产物碱性蛋白酶酶解物+2%蔗糖)。所有组别鱼糜置于-18 ℃条件下冻藏,每隔1 周冻融1 次(置于4 ℃冰箱至中心温度达到4 ℃),共冻融6 次,取冻融第0、2、4、6次的鱼糜进行各项指标测定。
1.3.5 鱼糜肌原纤维蛋白提取及盐溶性蛋白含量测定
鱼糜肌原纤维蛋白的提取参考Lu Han等[18]的方法。2 g鱼糜经2 次15 mL冷却蒸馏水及15 mL 3 g/L氯化钠溶液均质离心除去水溶性蛋白质后,所得沉淀溶解于30 mL 0.6 mol/L氯化钠、20 mmol/L三羟甲基氨基甲烷(Tris)、马来酸(pH 7.0)混合溶液中并置于4 ℃冰箱中提取1 h。所得提取液量取体积后,使用双缩脲法测定蛋白质质量浓度,按式(1)计算盐溶性蛋白含量。
式中:ρ为提取液盐溶性蛋白质量浓度/(mg/mL);V为提取液体积/mL;m为鱼糜质量/g。
取8 mL提取液加入32 mL蒸馏水中再次洗涤,所得沉淀用15 mmol/L磷酸盐缓冲液(含0.6 mol/L氯化钠,pH 7.0)溶解,即为肌原纤维蛋白溶液,使用双缩脲法测定肌原纤维蛋白质量浓度,并将肌原纤维蛋白质量浓度调整至4 mg/mL。
1.3.6 巯基含量及Ca2+-ATP酶活性测定
巯基含量采用5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)法[5]测定。取0.5 mL肌原纤维蛋白溶液,加入4.5 mL缓冲液A(含8 mol/L尿素、3 mmol/L乙二胺四乙酸、1 g/100 mL十二烷基硫酸钠、0.2 mol/L Tris,pH 8.0)中,混合均匀后取4 mL混合液,加入0.5 mL 10 mmol/L DTNB溶液,于40 ℃水浴锅中反应25 min,412 nm波长处测定吸光度,按式(2)计算巯基含量。
式中:A412 nm为412 nm波长处的吸光度;n为稀释倍数(11.25);ρ为肌原纤维蛋白质量浓度(4 mg/mL);ε为摩尔吸光系数(13 600 L/(mol·cm))。
Ca2+-ATP酶活性测定采用钼酸铵法[19]。将4 mL反应混合液(含0.2 mL Tris-马来酸(pH 7.0)、0.2 mL 0.1 mol/L氯化钙溶液、0.4 mL肌原纤维蛋白溶液、3 mL蒸馏水及0.2 mL 20 mmol/L三磷酸腺苷溶液)加入3 mL Tris-氯化镁缓冲液(pH 7.5)及3 mL定磷试剂(20 g/100 mL抗坏血酸、3 mol/L硫酸及3 g/100 mL钼酸铵等体积混合),于45 ℃水浴锅发色30 min,在640 nm波长处测定吸光度。Ca2+-ATP酶活力表示为1 mg蛋白质1 min内生成无机磷的物质的量(μmol),按式(3)计算。
式中:A640 nm为640 nm波长处的吸光度。
1.3.7 表面疏水性测定
采用溴酚蓝(chromophore bromphenol blue,BPB)结合法[20]。向4 mL 4 mg/mL肌原纤维蛋白溶液中加入100 μL 1 mg/mL BPB溶液,混合均匀后置于摇床上振摇30 min。10 000 r/min离心10 min后,取上清液在595 nm波长处测定吸光度。肌原纤维蛋白表面疏水性表示为结合溴酚蓝的量(μg),按式(4)计算。
式中:A0为空白溶液的吸光度;A1为样品溶液的吸光度;100为肌原纤维蛋白溶液中加入溴酚蓝的总质量/μg。
1.3.8 鱼糜凝胶制备及凝胶特性测定
将鱼糜(约25 g)均匀灌入聚偏氯乙烯肠衣(长度20 cm,直径2 cm)中,采用两段加热法(40 ℃、1 h;90 ℃、30 min)制备鱼糜凝胶。凝胶冷却至室温后,切成2 cm的小段,利用Brookfield CT-3质构仪进行凝胶特性(破断力、凹陷度)测定[5],测定速率1 mm/s,总形变设定为30%。凝胶强度按式(5)计算。
1.3.9 鱼糜凝胶持水性及色泽测定
鱼糜凝胶的持水性由可压榨水分含量表示,测定方法参照Zhang Longteng等[5]的方法。0.5 cm厚的鱼糜片称质量(m1)后,上下各加入2 层滤纸后放上5 kg的标准砝码;2 min后,取出挤压后的鱼糜称质量(m2)。可压榨水分含量按式(6)计算。
鱼糜凝胶色泽的测定参照Zhang Longteng等[5]的方法,结果用亮度值(L*)、红度值(a*)和黄度值(b*)表示,凝胶白度按式(7)计算。
1.4 数据处理
实验数据均为3 次平行测定的平均值±标准差,采用Excel 2013软件进行数据处理,Origin 9.0软件作图,采用SPSS 18.0软件进行单因素方差分析,差异显著性水平为P<0.05。
2 结果与分析
2.1 鱼糜加工副产物酶解物的抗氧化活性
脂质及蛋白质氧化是引起肉类贮藏与加工过程中品质及营养特性劣变的重要因素,过渡金属离子 (Fe2+、Cu2+等)及活性氧自由基(reactive oxygen species,ROS)是引发肉类制品氧化反应的必要条件[21]。
由表1可知:鱼糜加工副产物胃蛋白酶酶解物的抗氧化活性最弱;与木瓜蛋白酶、中性蛋白酶、风味蛋白酶相比,经碱性蛋白酶及胰蛋白酶处理的鱼糜加工副产物酶解物具有良好的体外抗氧化活性,碱性蛋白酶酶解物的DPPH自由基清除率最高,达60.41%,而胰蛋白酶酶解物的亚铁离子螯合率最大(93.82%),表明2 种酶解物均能够通过打断自由基的链式反应及螯合过渡金属离子,从而有效抑制氧化反应。通过生物酶解技术,一些疏水性氨基酸,如苯丙氨酸、亮氨酸、异亮氨酸等从天然蛋白质中暴露出来,它们能够作为质子供体终止自由基传递,打断氧化反应;酸性或碱性氨基酸,如谷氨酸、赖氨酸等则通过螯合过渡金属离子起到抗氧化作用[22]。Wiriyaphan等[23]同样发现,金线鱼鱼糜加工副 产物酶解物(所用酶为碱性蛋白酶、胰蛋白酶、胃蛋白酶及Virgibacillus sp. SK33蛋白酶)具有清除自由基及螯合金属离子的抗氧化作用。
表 1 鱼糜加工副产物酶解物的体外抗氧化活性
Table 1 In vitro antioxidant activities of hydrolysates of surimi processing by-products
%

注:同行小写字母不同,表示差异显著(P<0.05)。
抗氧化活性 胰蛋白酶 碱性蛋白酶 胃蛋白酶 木瓜蛋白酶 中性蛋白酶 风味蛋白酶DPPH自由基清除率 51.74±1.17d 60.41±1.07e 39.86±1.01a 48.08±0.19b 50.04±0.57c 58.98±0.80e亚铁离子螯合率 93.82±0.48f 90.61±0.00e 17.26±0.18a 88.32±0.81d 81.56±0.41c 73.43±0.66b
2.2 鱼糜加工副产物酶解物对反复冻融鱼糜盐溶性蛋白含量的影响
鱼肉的蛋白质主要由水溶性肌浆蛋白、盐溶性肌原纤维蛋白及不溶性肌基质蛋白组成,其中肌原纤维蛋白占鱼肉蛋白质含量的50%~60%,是决定鱼糜制品品质和加工特性的最重要蛋白质[24]。
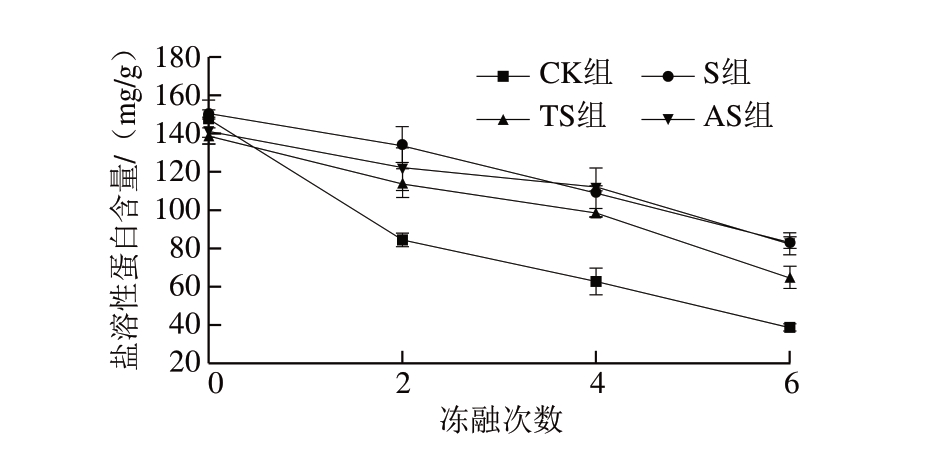
图 1 反复冻融鱼糜盐溶性蛋白含量的变化
Fig. 1 Changes in salt soluble protein content of surimi after different freeze-thaw cycles
由图1可知,各组鱼糜的盐溶性蛋白含量初始值约为140 mg/g。随着冻融次数的增加,各组鱼糜的盐溶性蛋白含量呈现不断降低的趋势,冻融6 次后,CK组鱼糜盐溶性蛋白含量仅为38.76 mg/g,与初始值相比下降约73.76%。鱼糜冻融过程中因冰晶生成导致蛋白质空间结构的变化及疏水性氨基酸暴露,加速了蛋白质之间的氧化交联、变性聚集及蛋白质溶解性的降低,因此盐溶性蛋白含量呈现下降趋势[15,19]。4%蔗糖的添加有效抑制了肌原纤维蛋白的冷冻变性,与初始值相比,S组鱼糜盐溶性蛋白含量仅降低44.58%。与CK组相比,鱼糜加工副产物胰蛋白酶及碱性蛋白酶酶解物的加入(TS、AS组)同样减缓了肌原纤维蛋白冷冻变性的速率,冻融6 次后,盐溶性蛋白含量分别为64.85、82.25 mg/g。鱼糜加工副产物酶解物中的亲水性氨基酸,如谷氨酸、赖氨酸等能够通过与鱼糜中水分以非共价键结合,减少冰晶的形成,从而阻碍蛋白质的冷冻变性进程[7]。
2.3 鱼糜加工副产物酶解物对反复冻融鱼糜巯基含量的影响
蛋白质中半胱氨酸的巯基很容易受到ROS的攻击发生氧化,其氧化产物包括二硫键及磺酸类物质(次磺酸、亚磺酸、磺酸)等,其中二硫键的生成是肉品蛋白质氧化最重要的变化[21]。
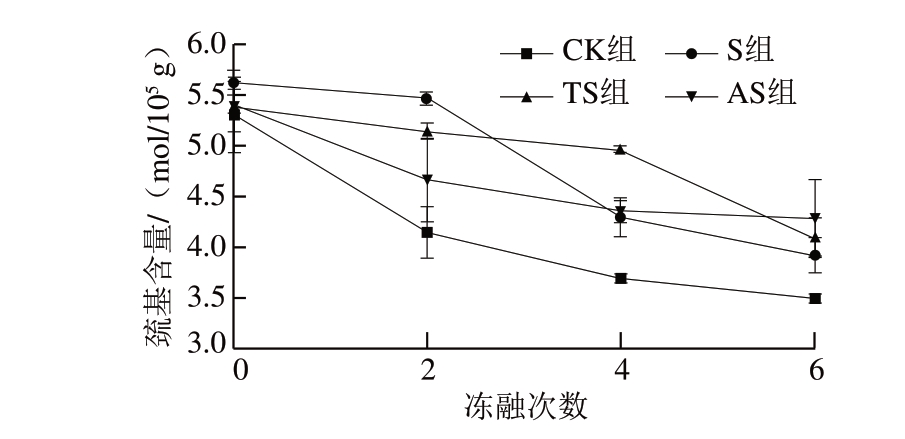
图 2 反复冻融鱼糜巯基含量的变化
Fig. 2 Changes in protein sulfhydryl groups content of surimi after different freeze-thaw cycles
由图2可知:冻融处理显著影响鱼糜肌原纤维蛋白中巯基含量的变化,冻融次数越多,巯基含量的下降越明显;6 次冻融循环后,CK组鱼糜肌原纤维蛋白中的巯基含量仅为3.50 mol/105 g,仅为初始巯基含量的65.94%。巯基含量的下降导致蛋白质分子内、分子间二硫键的形成与蛋白质分子内及分子间的交联聚集,是盐溶性蛋白溶解度降低的重要原因[25]。蔗糖与鱼糜加工副产物酶解物(胰蛋白酶、碱性蛋白酶酶解物)的加入均能够减缓巯基转化为二硫键的速率,冻融6 次后,S、TS及AS组鱼糜的巯基含量分别为3.92、4.09、4.29 mol/105 g,均高于CK组。由于鱼糜加工副产物酶解物具有自由基清除能力,能够有效终止硫自由基(S·)之间的反应(S·+S·→二硫键),因此能够有效抑制二硫键的形成及后续的蛋白质氧化进程[22]。Yasemi[15]同样发现,欧洲鳇鱼鱼皮酶解物能够减缓肌原纤维蛋白中巯基含量的下降,从而起到抗氧化效果。
2.4 鱼糜加工副产物酶解物对反复冻融鱼糜Ca2+-ATP酶活性的影响
鱼肉的肌原纤维蛋白由肌球蛋白、肌动蛋白、原肌球蛋白和肌钙蛋白等组成,其中肌球蛋白约占肌原纤维蛋白含量的60%。肌球蛋白由球状的头部和长链状的杆部组成,其头部具有Ca2+-ATP酶活性,因此Ca2+-ATP酶活性是评判肌球蛋白变性的重要指标[19]。

图 3 反复冻融鱼糜Ca2+-ATP酶活力的变化
Fig. 3 Changes in Ca2+-ATPase activity of surimi after different freeze-thaw cycles
由图3可知:随着冻融次数的增加,CK组鱼糜的肌球蛋白变性情况最为严重,冻融第6次时,其Ca2+-ATP酶活力降至0.08 μmol/(mg·min),与初始值相比下降约69.27%;第2次冻融后,S、TS及AS组鱼糜的Ca2+-ATP酶活性均高于CK组;6 次冻融后,S、TS及AS组鱼糜的Ca2+-ATP酶活力分别下降至0.21、0.22、 0.24 μmol/(mg·min),其中AS组最高,表明鱼糜加工副产物碱性蛋白酶酶解物具有良好的肌球蛋白冷冻变性保护效果。鱼糜加工副产物酶解物的抗冻作用可能来源于由酶解物中的甘氨酸及脯氨酸等亲水氨基酸组成的肽段,如甘氨酸-脯氨酸-X(X为其余氨基酸),这些肽段已被发现具有抑制冰晶形成的抗冻作用[26]。
2.5 鱼糜加工副产物酶解物对反复冻融鱼糜表面疏水性的影响
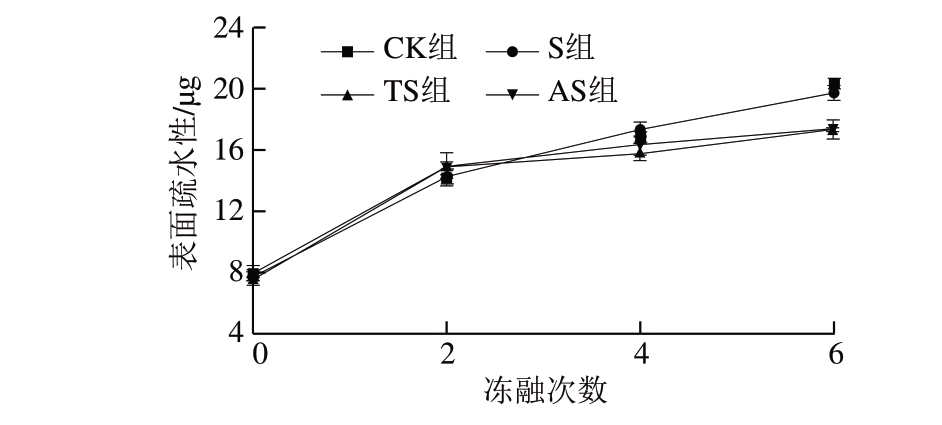
图 4 反复冻融鱼糜表面疏水性的变化
Fig. 4 Changes in surface hydrophobicity of surimi after different freeze-thaw cycles
在天然蛋白质中,疏水性氨基酸被包裹在蛋白质内部,但蛋白质变性引起的结构变化会导致疏水性氨基酸暴露,引起表面疏水性的改变[20]。由图4可知:4 组鱼糜肌原纤维蛋白表面疏水性的初始值无明显差异,随着冻融次数的增加,4 组鱼糜肌原纤维蛋白的表面疏水性呈上升趋势,且均在第6次冻融后达到最大值;其中,CK组和S组鱼糜肌原纤维蛋白的表面疏水性较高,分别达20.32、19.68 μg,而TS及AS组能够有效维持冻融过程中肌原纤维蛋白的结构稳定性,因此蛋白质变性及氧化程度较低,表面疏水性明显低于CK组和S组。Li Yanqing等[27] 认为,表面疏水性的变化能够反映蛋白质氧化的程度,蛋白质氧化程度越剧烈,表面疏水性越高。此外,表面疏水性的升高往往会导致基于疏水相互作用的蛋白质聚集,从而影响鱼肉肌原纤维蛋白的凝胶特性[25]。
2.6 鱼糜加工副产物酶解物对反复冻融鱼糜凝胶特性的影响
鱼糜的凝胶形成能力主要来源于鱼糜中的肌球蛋白,肌球蛋白加热后,长链状的尾部变性展开后发生相互交联,形成三维网状结构,最终成为具有一定强度的鱼糜凝胶[24]。
表 2 鱼糜加工副产物酶解物对反复冻融鱼糜凝胶特性的影响
Table 2 Changes in gelation properties of frozen-thawed surimi gels with addition of surimi processing byproducts hydrolysates
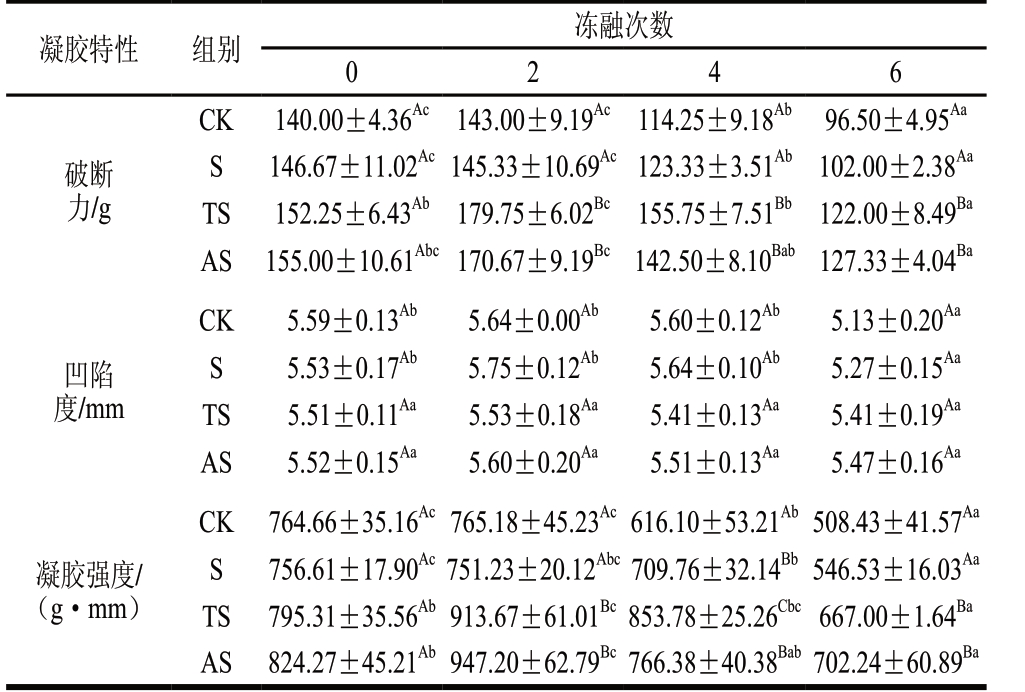
注:同行小写字母不同,表示不同冻融次数差异显著(P<0.05);同列大写字母不同,表示在相同冻融次数下各组间同一指标差异显著 (P<0.05)。表3同。
凝胶特性 组别 冻融次数0 2 4 6破断力/g CK 140.00±4.36Ac 143.00±9.19Ac 114.25±9.18Ab 96.50±4.95Aa S 146.67±11.02Ac 145.33±10.69Ac 123.33±3.51Ab 102.00±2.38Aa TS 152.25±6.43Ab 179.75±6.02Bc 155.75±7.51Bb 122.00±8.49Ba AS 155.00±10.61Abc 170.67±9.19Bc 142.50±8.10Bab 127.33±4.04Ba凹陷度/mm CK 5.59±0.13Ab 5.64±0.00Ab 5.60±0.12Ab 5.13±0.20Aa S 5.53±0.17Ab 5.75±0.12Ab 5.64±0.10Ab 5.27±0.15Aa TS 5.51±0.11Aa 5.53±0.18Aa 5.41±0.13Aa 5.41±0.19Aa AS 5.52±0.15Aa 5.60±0.20Aa 5.51±0.13Aa 5.47±0.16Aa凝胶强度/(g·mm)CK 764.66±35.16Ac 765.18±45.23Ac 616.10±53.21Ab 508.43±41.57Aa S 756.61±17.90Ac 751.23±20.12Abc 709.76±32.14Bb 546.53±16.03Aa TS 795.31±35.56Ab 913.67±61.01Bc 853.78±25.26Cbc 667.00±1.64Ba AS 824.27±45.21Ab 947.20±62.79Bc 766.38±40.38Bab 702.24±60.89Ba
由表2可知,鱼糜加工副产物酶解物的加入可以有效提高鱼糜凝胶的破断力和凝胶强度,这可能由酶解物与肌球蛋白的相互作用引起。酶解物能够与鱼糜蛋白质通过非共价键聚合,使凝胶的蛋白质网络结构更加紧密,因此能够提高鱼糜的初始凝胶特性[25]。Korzeniowska等[28] 同样发现,添加鱼肉蛋白酶解物能够增强肌动球蛋白的凝胶形成能力。随着冻融次数的增加,鱼糜的凝胶特性(破断力、凹陷度、凝胶强度)呈现先升高后降低的趋势,且在冻融第2次时达到最大值,这可能与蛋白质变性及氧化有关,适当的蛋白质结构变性展开、半胱氨酸及疏水性氨基酸的暴露能够有效促进蛋白质间基于疏水相互作用及二硫键的交联,使鱼糜凝胶三维网络结构更加紧密,因此增强凝胶特性;然而,多次冻融循环引起的蛋白质降解及蛋白质冷冻变性聚集反而阻止了凝胶的形成,造成凝胶特性的劣变[5,29]。冻融6 次后,除鱼糜凝胶的凹陷度无显著差异外,TS及AS组的破断力及凝胶强度均显著高于CK组及S组(P<0.05),其中AS组的破断力及凝胶强度最高,分别达到127.33 g及702.24 g·mm,表明鱼糜加工副产物碱性蛋白酶酶解物具有良好的抗蛋白质变性效果。鱼糜加工副产物酶解物的加入可能促进了蛋白质-水分-酶解物之间的紧密结合,更大程度地延缓了蛋白质的变性趋势,因而较好地保持了鱼糜的凝胶特性[28]。
2.7 鱼糜加工副产物酶解物对反复冻融鱼糜凝胶持水性的影响
鱼糜中的水分主要由结合水、不易流动水及自由水3 部分组成,其中结合水的含量相对稳定,而自由水及不易流动水易受到外界力的作用,从而溢出凝胶网络结构,形成可压榨水分[30]。

图 5 反复冻融鱼糜凝胶可压榨水分含量的变化
Fig. 5 Changes in expressible water content of surimi gel after different freeze-thaw cycles
由图5可知:AS组鱼糜的初始可压榨水分含量最低,仅为11.33%;随着冻融次数的增加,各组鱼糜的可压榨水分含量均呈现显著增加的趋势(P<0.05),冻融6 次后,CK组鱼糜的可压榨水分含量最高,达23.60%,表明鱼糜凝胶的网络结构发生破坏,凝胶已经无法维持水分,导致在外力作用下水分的大量流失。S、TS及AS组由于延缓了蛋白质的冷冻变性,均能够有效延缓鱼糜凝胶持水性劣变的趋势,其中AS组效果最好,冻融6 次后,鱼糜的可压榨水分含量仅为19.55%。Korzeniowska等[28]同样发现,鱼肉酶解物的加入能够改善 鱼糜凝胶的持水性,且效果显著优于添加抗冻剂组及空白组(P<0.05)。
2.8 鱼糜加工副产物酶解物对反复冻融鱼糜凝胶色泽的影响
色泽及白度是影响鱼糜制品消费者可接受程度的重要指标[5]。由表3可知:S组鱼糜凝胶的L*最高,达77.59;鱼糜中添加鱼糜加工副产物酶解物引起L*的略微下降,此外b*有所升高,这可能是由酶解物本身具有一定的淡黄色引起。随着冻融次数的增加,鱼糜中蛋白质及脂肪氧化加剧,氧化产生的羰基化合物可能引发色素蛋白的氧化或加速美拉德反应,产生暗色物质[31],因此4 组鱼糜凝胶的L*均呈现显著降低的趋势(P<0.05)且伴随着b*的显著升高(P<0.05),然而,a*却呈现波动性变化。4 组鱼糜凝胶白度的初始值无显著差异,表明鱼糜加工副产物酶解物的加入对鱼糜的白度无明显影响,随着冻融次数的增加,鱼糜白度呈现显著降低的趋势(P<0.05),这同样与冻融过程中色素蛋白的氧化或美拉德反应有关。Zaghbib等[31]也发现,沙丁鱼(Sardina pilchardus)鱼糜的白度随冻藏时间的延长不断降低。
表 3 鱼糜加工副产物酶解物对反复冻融鱼糜凝胶色泽的影响
Table 3 Changes in color and whiteness of frozen-thawed surimi gels with addition of surimi processing byproducts hydrolysates
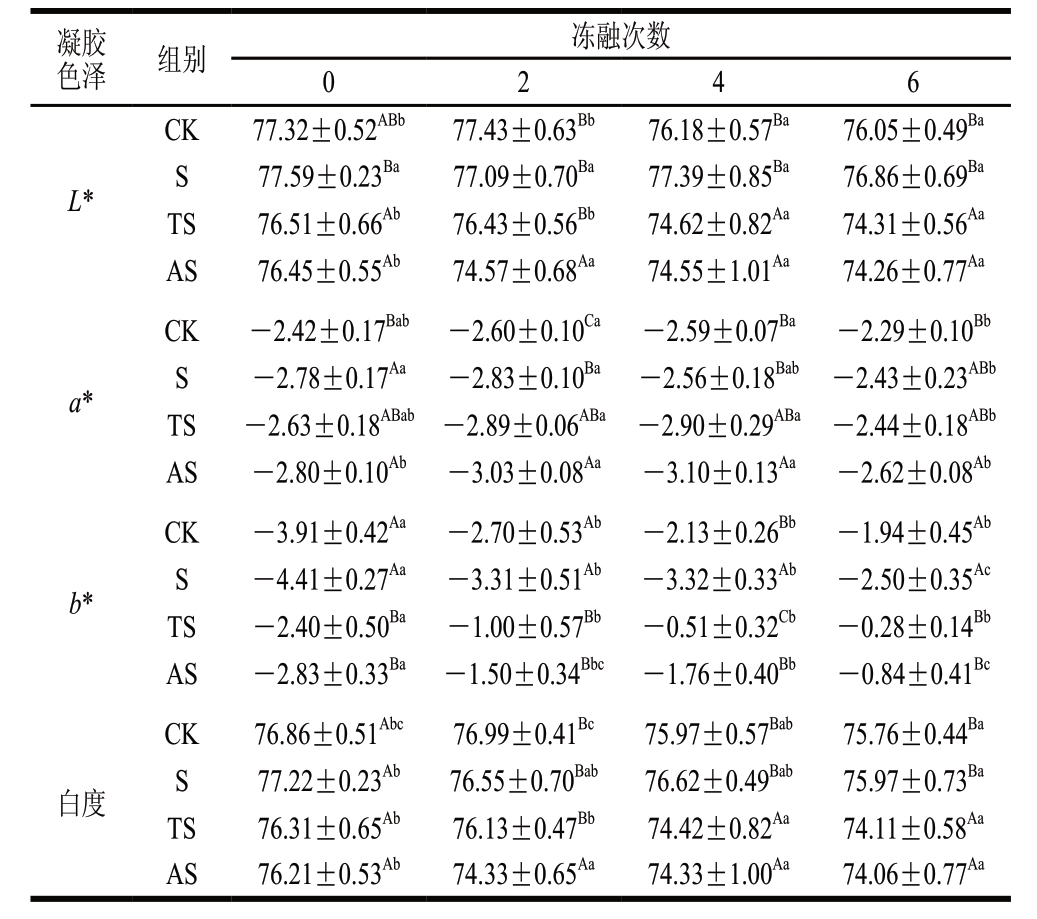
凝胶色泽 组别 冻融次数0 2 4 6 L*CK 77.32±0.52ABb 77.43±0.63Bb 76.18±0.57Ba 76.05±0.49Ba S 77.59±0.23Ba 77.09±0.70Ba 77.39±0.85Ba 76.86±0.69Ba TS 76.51±0.66Ab 76.43±0.56Bb 74.62±0.82Aa 74.31±0.56Aa AS 76.45±0.55Ab 74.57±0.68Aa 74.55±1.01Aa 74.26±0.77Aa a*CK -2.42±0.17Bab -2.60±0.10Ca -2.59±0.07Ba -2.29±0.10Bb S -2.78±0.17Aa -2.83±0.10Ba -2.56±0.18Bab -2.43±0.23ABb TS -2.63±0.18ABab -2.89±0.06ABa -2.90±0.29ABa -2.44±0.18ABb AS -2.80±0.10Ab -3.03±0.08Aa -3.10±0.13Aa -2.62±0.08Ab b*CK -3.91±0.42Aa -2.70±0.53Ab -2.13±0.26Bb -1.94±0.45Ab S -4.41±0.27Aa -3.31±0.51Ab -3.32±0.33Ab -2.50±0.35Ac TS -2.40±0.50Ba -1.00±0.57Bb -0.51±0.32Cb -0.28±0.14Bb AS -2.83±0.33Ba -1.50±0.34Bbc -1.76±0.40Bb -0.84±0.41Bc白度CK 76.86±0.51Abc 76.99±0.41Bc 75.97±0.57Bab 75.76±0.44Ba S 77.22±0.23Ab 76.55±0.70Bab 76.62±0.49Bab 75.97±0.73Ba TS 76.31±0.65Ab 76.13±0.47Bb 74.42±0.82Aa 74.11±0.58Aa AS 76.21±0.53Ab 74.33±0.65Aa 74.33±1.00Aa 74.06±0.77Aa
3 结 论
随着冻融循环次数的增加,鲢鱼鱼糜发生明显的蛋白质氧化及变性,其巯基含量、盐溶性蛋白含量 及Ca2+-ATP酶活性呈现降低趋势,蛋白质结构遭到破坏,表面疏水性逐渐增强;鱼糜凝胶形成能力(破断力、凹陷度、凝胶特性)随冻融循环次数的增加呈现先升高后降低的趋势,且伴随持水性的快速下降。与商业抗冻剂蔗糖相比,鱼糜加工副产物胰蛋白酶及碱性蛋白酶酶解物的加入能够有效延缓蛋白质变性、氧化及结构破坏的趋势,同时能够延缓鱼糜凝胶形成能力及持水性的劣变且对鱼糜的色泽没有不利影响。因此,鱼糜加工副产物胰蛋白酶、碱性蛋白酶酶解物可以作为天然的抗氧化剂、抗冻剂及凝胶增强剂使用,具有良好的潜力及应用价值。
[1] MORENO H M, HERRANZ B, PEREZ-MATEOS M, et al. New alternatives in seafood restructured products[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(2): 237-248. DOI:10.1080/1040 8398.2012.719942.
[2] MARTIN-SANCHEZ A M, NAVARRO C, PEREZ-ALVAREZ J A, et al. Alternatives for efficient and sustainable production of surimi: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2009, 8(4): 359-374. DOI:10.1111/j.1541-4337.2009.00087.x.
[3] YONGSAWATDIGUL J, PIVISAN S, WONGNGAM W, et al. Gelation characteristics of mince and washed mince from small-scale mud carp and common carp[J]. Journal of Aquatic Food Product Technology, 2013, 22(5): 460-473. DOI:10.1080/10498850.2012.664251.
[4] FAO. FAO yearbook of fishery statistics: aquaculture production[M]. Rome: Food and Agriculture Organization of the United Nations, 2017: 30.
[5] ZHANG Longteng, LI Qian, SHI Jing, et al. Changes in chemical interactions and gel properties of heat-induced surimi gels from silver carp (Hypophthalmichthys molitrix) fillets during setting and heating: effects of different washing solutions[J]. Food Hydrocolloids, 2018, 75: 116-124. DOI:10.1016/j.foodhyd.2017.09.007.
[6] JAYATHILAKAN K, SULTANA K, RADHAKRISHNA K, et al. Utilization of byproducts and waste materials from meat, poultry and fish processing industries: a review[J]. Journal of Food Science and Technology-Mysore, 2012, 49(3): 278-293. DOI:10.1007/s13197-011-0290-7.
[7] NIKOO M, BENJAKUL S, RAHMANIFARAH K. Hydrolysates from marine sources as cryoprotective substances in seafoods and seafood products[J]. Trends in Food Science and Technology, 2016, 57: 40-51. DOI:10.1016/j.tifs.2016.09.001.
[8] ATEF M, OJAGH S M. Health benefits and food applications of bioactive compounds from fish byproducts: a review[J]. Journal of Functional Foods, 2017, 35: 673-681. DOI:10.1016/j.jff.2017.06.034.
[9] CHALAMAIAH M, KUMAR B D, HEMALATHA R, et al. Fish protein hydrolysates: proximate composition, amino acid composition, antioxidant activities and applications: a review[J]. Food Chemistry, 2012, 135(4): 3020-3038. DOI:10.1016/j.foodchem.2012.06.100.
[10] CHEN Hongsheng, KONG Baohua, GUO Yuanyuan, et al. The effectiveness of cryoprotectants in inhibiting multiple freeze-thawinduced functional and rheological changes in the myofibrillar proteins of common carp (Cyprinus carpio) surimi[J]. Food Biophysics, 2013, 8(4): 302-310. DOI:10.1007/s11483-013-9305-4.
[11] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Cryoprotective effect of gelatin hydrolysate from blacktip shark skin on surimi subjected to different freeze-thaw cycles[J]. LWTFood Science and Technology, 2012, 47(2): 437-442. DOI:10.1016/j.lwt.2012.02.003.
[12] LIU Jianhua, FANG Chuhua, LUO Yahong, et al. Effects of konjac oligo-glucomannan on the physicochemical properties of frozen surimi from red gurnard (Aspitrigla cuculus)[J]. Food Hydrocolloids, 2019, 89: 668-673. DOI:10.1016/j.foodhyd.2018.10.056.
[13] SUN L J, SUN J J, THAVARAJ P, et al. Effects of thinned young apple polyphenols on the quality of grass carp (Ctenopharyngodon idellus) surimi during cold storage[J]. Food Chemistry, 2017, 224: 372-381. DOI:10.1016/j.foodchem.2016.12.097.
[14] JENKELUNAS P J, LI-CHAN E C Y. Production and assessment of Pacific hake (Merluccius productus) hydrolysates as cryoprotectants for frozen fish mince[J]. Food Chemistry, 2018, 239: 535-543. DOI:10.1016/j.foodchem.2017.06.148.
[15] YASEMI M. Prevention of denaturation of freshwater crayfish muscle subjected to different freeze-thaw cycles by gelatin hydrolysate[J]. Food Chemistry, 2017, 234: 199-204. DOI:10.1016/j.foodchem.2017.04.183.
[16] Association of Official Chemists (AOAC). Official methods of analysis of AOAC[M]. 17th ed. Washington DC: AOAC, 2002.
[17] LI Xue, LUO Yongkang, SHEN Huixing, et al. Antioxidant activities and functional properties of grass carp (Ctenopharyngodon idellus) protein hydrolysates[J]. Journal of the Science of Food and Agriculture, 2012, 92(2): 292-298. DOI:10.1002/jsfa.4574.
[18] LU Han, LIU Xiaochang, ZHANG Yuemei, et al. Effects of chilling and partial freezing on rigor mortis changes of bighead carp (Aristichthys nobilis) fillets: cathepsin activity, protein degradation and microstructure of myofibrils[J]. Journal of Food Science, 2015, 80(12): C2725-C2731. DOI:10.1111/1750-3841.13134.
[19] KONG Chunli, WANG Huiyi, LI Dapeng, et al. Quality changes and predictive models of radial basis function neural networks for brined common carp (Cyprinus carpio) fillets during frozen storage[J]. Food Chemistry, 2016, 201: 327-333. DOI:10.1016/j.foodchem.2016.01.088.
[20] CHELH I, GATELLIER P, SANTE-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[21] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition and Food Research, 2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[22] ZAMORA-SILLERO J, GHARSALLAOUI A, PRENTICE C. Peptides from fish by-product protein hydrolysates and its functional properties: an overview[J]. Marine Biotechnology, 2018, 20: 118-130. DOI:10.1007/s10126-018-9799-3.
[23] WIRIYAPHAN C, CHITSOMBOON B, YONGSAWADIGUL J. Antioxidant activity of protein hydrolysates derived from threadfin bream surimi byproducts[J]. Food Chemistry, 2012, 132(1): 104-111. DOI:10.1016/j.foodchem.2011.10.040.
[24] SUN X D, HOLLEY R A. Factors influencing gel formation by myofibrillar proteins in muscle foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(1): 33-51. DOI:10.1111/j.1541-4337.2010.00137.x.
[25] ZHANG Longteng, GUI Ping, ZHANG Yuqi, et al. Assessment of structural, textural, and gelation properties of myofibrillar protein of silver carp (Hypophthalmichthys molitrix) modified by stunning and oxidative stress[J]. LWT-Food Science and Technology, 2019, 102: 142-149. DOI:10.1016/j.lwt.2018.12.030.
[26] DAMODARAN S, WANG S Y. Ice crystal growth inhibition by peptides from fish gelatin hydrolysate[J]. Food Hydrocolloids, 2017, 70: 46-56. DOI:10.1016/j.foodhyd.2017.03.029.
[27] LI Yanqing, KONG Baohua, XIA Xiufang, et al. Inhibition of frozen storage-induced oxidation and structural changes in myofibril of common carp (Cyprinus carpio) surimi by cryoprotectant and hydrolysed whey protein addition[J]. International Journal of Food Science and Technology, 2013, 48(9): 1916-1923. DOI:10.1111/ijfs.12171.
[28] KORZENIOWSKA M, CHEUNG I W Y, LI-CHAN E C Y. Effects of fish protein hydrolysate and freeze-thaw treatment on physicochemical and gel properties of natural actomyosin from Pacific cod[J]. Food Chemistry, 2013, 138(2/3): 1967-1975. DOI:10.1016/j.foodchem.2012.09.150.
[29] LU Han, ZHANG Longteng, LI Qingzheng, et al. Comparison of gel properties and biochemical characteristics of myofibrillar protein from bighead carp (Aristichthys nobilis) affected by frozen storage and a hydroxyl radical-generation oxidizing system[J]. Food Chemistry, 2017, 223: 96-103. DOI:10.1016/j.foodchem.2016.11.143.
[30] PEARCE K L, ROSENVOLD K, ANDERSEN H J, et al. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes: a review[J]. Meat Science, 2011, 89(2): 111-124. DOI:10.1016/j.meatsci.2011.04.007.
[31] ZAGHBIB I, FELIX M, ROMERO A, et al. Effects of whitening agents and frozen storage on the quality of sardine (Sardina pilchardus) surimi: physicochemical and mechanical properties[J]. Journal of Aquatic Food Product Technology, 2016, 26(1): 29-42. DOI:10.1080/10498850.2015.1089526.