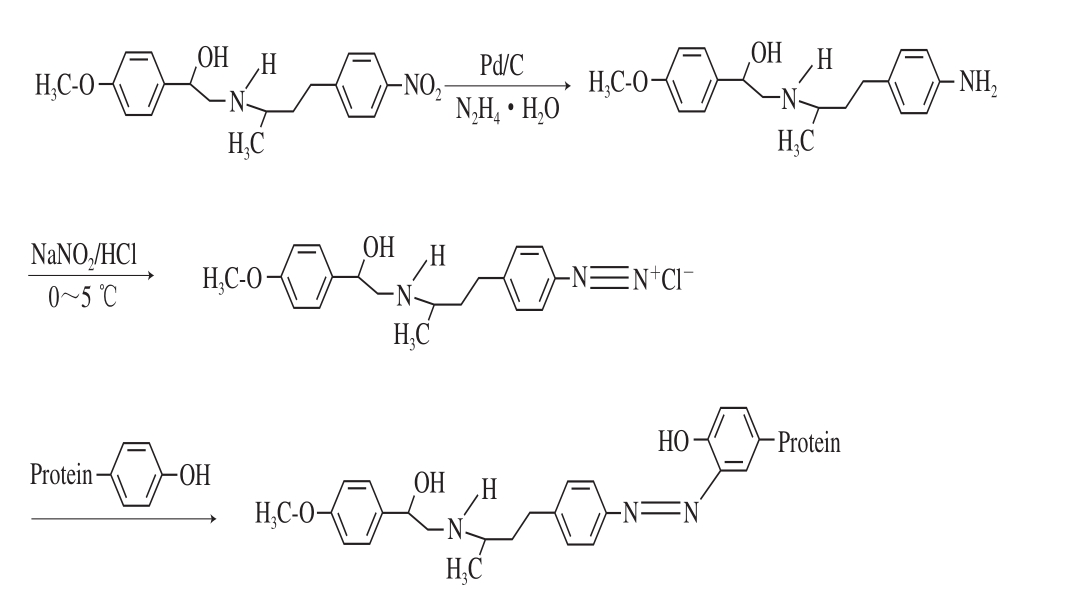
图 1 重氮化法合成PEAA-BSA
Fig. 1 Synthesis of PEAA-BSA by diazotization
苯乙醇胺A(phenylethanolamine A,PEAA)又称为克伦巴胺,其分子式为C19H24N2O4,一般以盐酸盐的形式存在,属于人工合成化学物质。PEAA与莱克多巴胺和盐酸克仑特罗属于同类物质,均属于β2-激动剂的一种,长期使用可以增加瘦肉率并缩短出栏周期。PEAA在体内具有蓄积性,人长期食用可出现肌肉震颤、头晕等症状,可诱发高血压、心脏病等[1-3]。
农业部第1519号公告《禁止在饲料和动物饮用水中使用的物质》[4]宣布,PEAA被列入禁止添加剂,并应加强市场监管,严厉打击非法滥用瘦肉精类物质。PEAA属于一类新型的化学物质,关于PEAA的研究报道较少,对于PEAA的检测方法目前还不成熟。目前,PEAA的常用检测方法主要有气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)法[5-7]、高效液相色谱(high performance liquid chromatography,HPLC)法[8-10]和酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法[11-13],这些方法虽然灵敏度高、准确性好,但是需要精密的仪器设备和专业的操作人员,且检测成本高,适合用于验证实验[14-16],不适合基层的初筛工作。近年来,随着荧光免疫层析技术的不断成熟,再加上其灵敏度高、准确性好、能够定量的特点,被广泛用于各类兽药残留的检测研究中[17-19]。李丹妮等[20]制备β-受体激动剂荧光免疫层析试纸条,克伦特罗、莱克多巴胺和沙丁胺醇试纸条的检测下限分别可达0.2、0.4、0.5 μg/L。李静宇等[21]制备克伦特罗荧光免疫层析试纸条,检测限可达0.35 μg/L。而PEAA作为一种新型的β2-激动剂,目前的研究还处于初期阶段,尚未见关于PEAA荧光免疫层析法的研究报道。
本研究采用重氮化法合成PEAA人工抗原,通过免疫BALB/c小鼠,融合筛选得到高特异性、高效价的抗PEAA单克隆抗体,并建立PEAA荧光免疫层析方法,通过对其灵敏度、特异性和准确度进行评价,建立一种高灵敏度、高特异性、快速、准确测定PEAA的荧光免疫层析方法。
BALB/c小鼠来自河北省科学院生物研究所。
PEAA(纯度≥98.0%)、牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司;甲醇、盐酸、氨基磺酸、亚硝酸钠、N,N-二甲基苯胺、锌粉、水合肼、尿素、钯碳催化剂(均为分析纯) 天津大茂化学试剂厂。
722紫外-可见分光光度计 上海光学仪器厂;TDZ4-WS台式低速自动离心机 湖南湘仪仪器有限公司;T-Meter Ⅰ荧光免疫分析仪 河北特温特生物科技发展有限公司。
1.3.1 重氮化法制备免疫抗原
重氮化法[22]制备免疫抗原PEAA-BSA:1)将6 mg PEAA溶于15 mL乙醇,持续搅拌,当温度升至80 ℃时,加入28 μL水合肼和10 mg钯碳催化剂,还原反应10 h,用硅胶薄层色谱法(thin-layer chromatography,TLC)监测,之后真空抽滤去除溶剂,得到黄色粗品,即PEAA-NH2;2)称取上述PEAA-NH2 9.6 mg,溶于300 μL水中,加入3.1 mg/100 μL的NaNO2溶液300 μL,溶液用0.2 mol/L HCl调节pH值至1.5,4 ℃暗处反应7 h;3)反应过程用N,N-二甲基苯胺进行监测,用质量浓度为55 mg/mL的尿素溶液中止反应;4)将90 mg BSA溶于1.5 mL PBS中,边加边搅拌,溶液pH值用1 mol/L NaOH调至7.5,反应3 h,得到偶联物PEAA-BSA;5)偶联物PEAA-BSA经低浓度PBS透析72 h,期间换液6 次,3 000 r/min离心即得PEAA-BSA。PEAA-BSA的合成路线图如图1所示。

图 1 重氮化法合成PEAA-BSA
Fig. 1 Synthesis of PEAA-BSA by diazotization
1.3.2 免疫抗原的鉴定
1.2.2.1 紫外扫描
在200~700 nm波长范围内扫描PEAA、BSA及偶联物PEAA-BSA,以确定是否成功偶联。
1.2.2.2 偶联比测定
BSA和PEAA质量浓度测定均采用标准曲线法,偶联比按照公式(1)计算[23]。
式中:A为吸光度;ρ为质量浓度/(mg/mL)。
1.2.2.3 免疫
采用传统免疫方法,用合成的PEAA人工抗原免疫BALB/c小鼠。共进行4 次免疫,断尾取血,测定效价,选取效价高的小鼠采用传统方法进行融合,制备抗PEAA单克隆抗体。
1.3.3 荧光微球(quantum dot submicrobeads,QBs)标记PEAA单克隆抗体
采用1-乙基-3-(3’-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐-N-羟基丁二酰亚胺(1-ethyl-3-(3’-dimethylaminopropyl)-3-ethyl-carbodiimide-N-hydroxysuccinimide,EDC-NHS)法偶联QBs和PEAA抗体[24]:取20 mg QBs加入到5 mL 2-(N-吗啉)甲磺酸水合物(2-(N-morpholino) ethanesulfonic acid hydrate,MES)缓冲液(0.1 mol/L,pH 5.5)中,混匀后10 000 r/min离心30 min;收集沉淀,加入1 mL MES缓冲液重悬,分别加入40 μg EDC和50 μg Sulfo-NHS溶液,37 ℃振荡反应1 h后,10 000 r/min离心30 min;收集沉淀,加入1 mL 4-(2-羟乙基)-1-哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)缓冲液重悬;将PEAA抗体加入到上述溶液中,37 ℃反应2 h,然后加入含有10% BSA的PBS溶液封闭2 h,得到用QBs标记的PEAA抗体产物,简称QBs探针,4 ℃贮存,备用。
1.3.4 QBs荧光免疫标记试纸条的组装
QBs荧光免疫试纸条由5 个部分组成,分别为样品垫、结合垫、硝化纤维素(nitrocellulose,NC)膜、吸水垫及聚氯乙烯(polyvinyl chloride,PVC)底板。将样品垫、结合垫、NC膜、吸水垫依次黏贴在PVC底板上,将适当浓度的PEAA和羊抗鼠二抗喷涂在NC膜上,分别作为检测线(T线)和质控线(C线),结合垫上包被QBs探针。
1.3.5 PEAA荧光免疫层析试纸条性能测试1.3.5.1 检测范围和检测限测定
将PEAA标准品用阴性尿液稀释成质量浓度分别为0.5、1.5、4.5、13.5、40.5 μg/L的系列标准溶液,采用本研究中的荧光免疫层析试纸条和荧光免疫分析仪进行测定,每个质量浓度重复测定10 次,取其平均值。以PEAA的质量浓度为横坐标,以B/B0(B为不同质量浓度PEAA测定所得T/C值,B0为质量浓度0 μg/L时测得的T/C值)为纵坐标,绘制拟合曲线。测定20 份阴性尿液,将“平均值+3 倍标准差”作为荧光免疫层析试纸条的检测限[25]。
1.3.5.2 准确度测定
通过添加回收实验测定荧光免疫层析试纸条的准确度[26-28]。取9 份阴性尿液样本,加入质量浓度分别为0.5、4.5、13.5 μg/L的PEAA,用荧光免疫层析试纸条和荧光免疫分析仪进行测定,计算回收率的平均值和变异系数(coefficient of variation,CV),分析准确度。样品均重复测定10 次。
1.3.5.3 精密度测定
通过批内和批间差来测试本研究中荧光免疫层析试纸条的精密度[29-31]。取阴性尿液样本,加入不同量的PEAA标准品,配制成PEAA质量浓度分别为4.5、13.5 μg/L的尿液,取同一批次荧光免疫层析试纸条10 条,分别对2 个质量浓度的样本进行重复测定;再取3 个不同批次荧光免疫层析试纸条各10 条,分别对2 个质量浓度的样本进行测定,计算CV平均值,分析批内和批间的测定精密度。
1.3.5.4 特异性测定
在阴性尿液中分别添加克伦特罗、沙丁胺醇、莱克多巴胺、福莫特罗和PEAA,使其终质量浓度为100 μg/L,用PEAA荧光免疫层析试纸条进行测定。交叉反应率按照公式(2)计算。
式中:ρ为实测质量浓度/(μg/L);ρ0为添加质量浓度/(μg/L)。
采用SPSS统计软件进行数据处理,Origin制图软件绘制标准曲线[32-33]。
2.1.1 紫外扫描鉴定合成的人工抗原
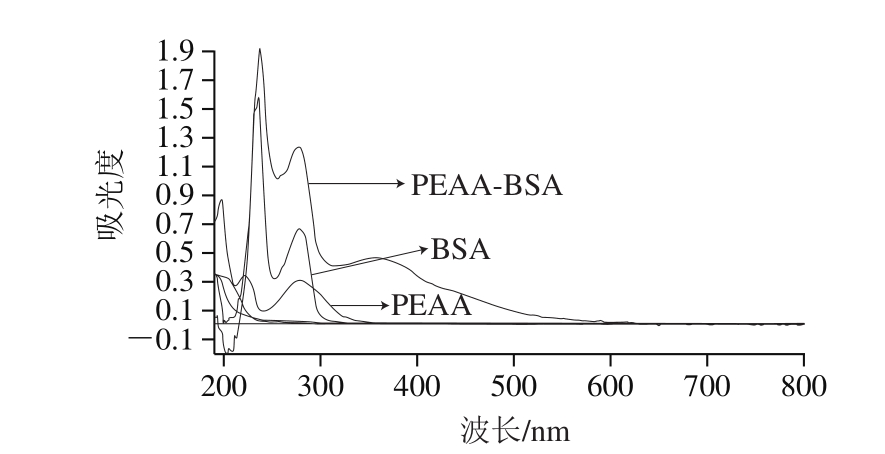
图 2 PEAA、BSA和PEAA-BSA的紫外扫描图
Fig. 2 UV absorption spectra of PEAA, BSA and PEAA-BSA
将PEAA、BSA和偶联物PEAA-BSA分别稀释到同一质量浓度,进行紫外扫描。由图2可知:BSA含有酪氨酸,决定了其特征吸收峰在278 nm波长处;PEAA的特征吸收峰也在278 nm波长处;基于叠加原理,二者的偶联物PEAA-BSA的特征吸收峰也在278 nm波长处,且在320 nm处有氮氮双键(-N=N-)特征吸收峰,且溶液颜色变为黄色,表明偶联成功。
2.1.2 偶联比测定
2.1.2.1 PEAA标准曲线的制作
PEAA的最大吸收波长为278 nm,在220~525 nm波长范围内对PEAA倍比稀释溶液进行紫外扫描,得到PEAA的标准曲线方程为y=1.099 2x+0.020 5(r=0.996)。
2.1.2.2 BSA标准曲线的制作
BSA的最大吸收波长为278 nm,对BSA倍比稀释后,分别在220~525 nm波长范围内进行紫外扫描,得到扫描曲线。经测定,合成的PEAA-BSA质量浓度为2.7 mg/mL,故BSA质量浓度为0.278 8 mg/mL。带入BSA的标准曲线方程y=0.141 0x+0.007 2(r=0.995),得到吸光度为0.046 5。
2.1.2.3 PEAA-BSA偶联比计算
由图3可知,重氮化法得到的PEAA-BSA的最大吸收波长为278 nm,对应的吸光度为0.372,带入PEAA的标准曲线方程,得出PEAA的质量浓度为0.277 5 mg/mL,偶联比=19.1∶1.0。Erlanger[34]认为,PEAA和偶联蛋白的结合比在8~25之间是比较适合的。
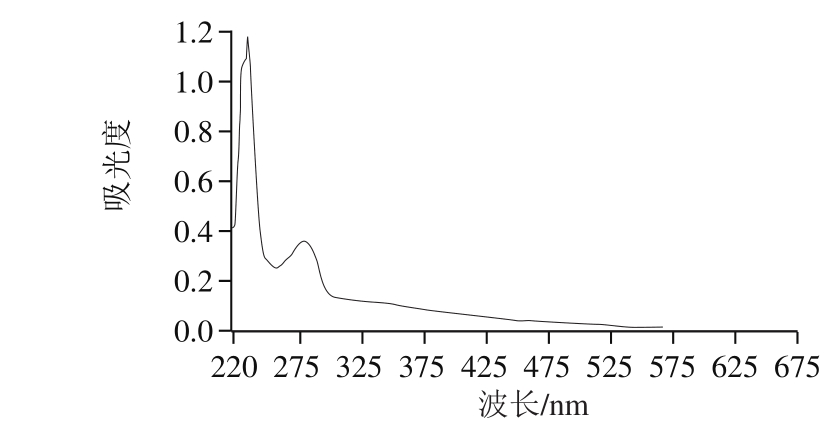
图 3 PEAA-BSA的紫外扫描图
Fig. 3 UV absorption spectrum of PEAA-BSA
表 1 间接ELISA法的效价测定结果
Table 1 Titer determination by indirect ELISA

小鼠编号空白对照400 1 600 6 400 12 800 25 600 51 200102 400204 800409 600抗血清稀释倍数 阴性对照1 3.058 12.745 11.633 41.469 60.833 90.627 30.396 10.167 60.056 50.060 50.057 6 2 3.080 32.516 81.904 61.174 10.507 30.571 60.336 20.193 40.073 50.074 70.062 5 3 2.103 71.509 11.206 70.874 90.363 80.153 50.093 60.073 40.067 70.061 80.056 5 4 1.406 50.997 90.570 10.415 60.271 60.231 40.089 00.066 70.073 90.068 20.054 3
通过间接ELISA法测定小鼠的血清效价,评价抗体和抗原的特异性结合情况。由表1可知,采用人工合成的PEAA抗原免疫小鼠后,效价最高达1∶204 800,特异性良好。
2.3.1 标准曲线的建立
绘制得到的标准曲线方程为y=-1.444 5x+2.495 2(R²=0.992 9),线性关系良好。20 份阴性尿液的测定结果平均值为0.426 μg/L,标准差为0.02,因此尿液样本的检测限为0.496 μg/L。
2.3.2 准确度
表 2 回收率实验结果
Table 2 Recovery of the method
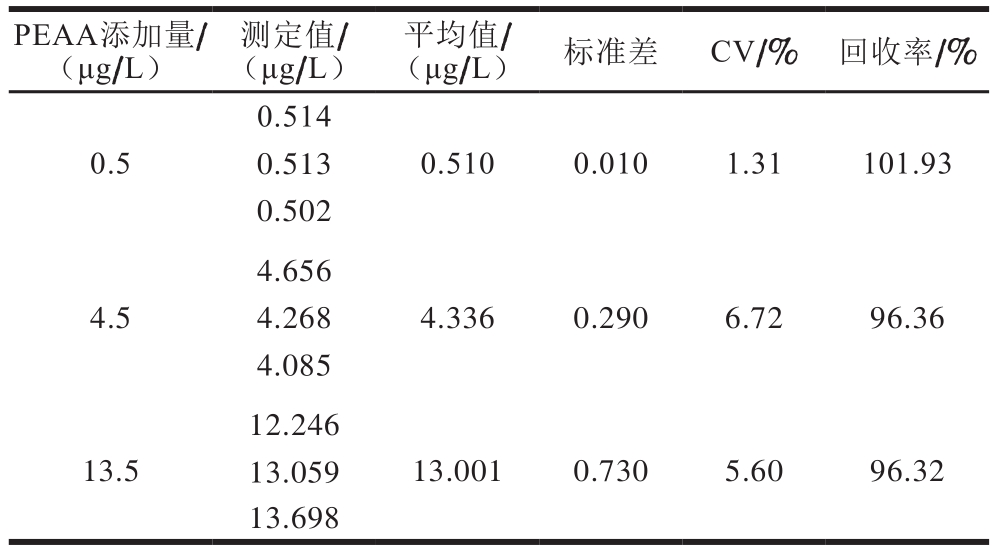
PEAA添加量/(μg/L)测定值/(μg/L)平均值/(μg/L) 标准差 CV/% 回收率/%0.514 0.50.513 0.502 0.510 0.010 1.31 101.93 4.656 4.54.268 4.085 4.336 0.290 6.72 96.36 12.246 13.513.001 0.730 5.60 96.32 13.059 13.698
由表2可知,测定回收率在90%~120%之间,CV在10%以内,能满足试剂盒的测定性能要求。
2.3.3 精密度
由表3可知,批内CV均在4.0%~8.0%之间,小于10%,批间CV也在10%以内,能满足试剂盒的测定性能要求。
表 3 批内及批间精密度测定结果
Table 3 Intra-batch and inter-batch precision

浓度/(μg/L)批次平均值/(μg/L)添加质量 批内 批间标准差 CV/% 标准差 CV/%20180601 4.068 0.280 6.93 4.520180701 3.695 0.190 5.12 20180703 4.496 0.280 6.21 0.400 9.81 20180601 12.069 0.760 6.33 13.5 0.760 6.22 20180701 11.568 0.530 4.56 20180703 13.064 0.680 5.19
2.3.4 特异性
表 4 交叉反应实验结果
Table 4 Cross-reactivity
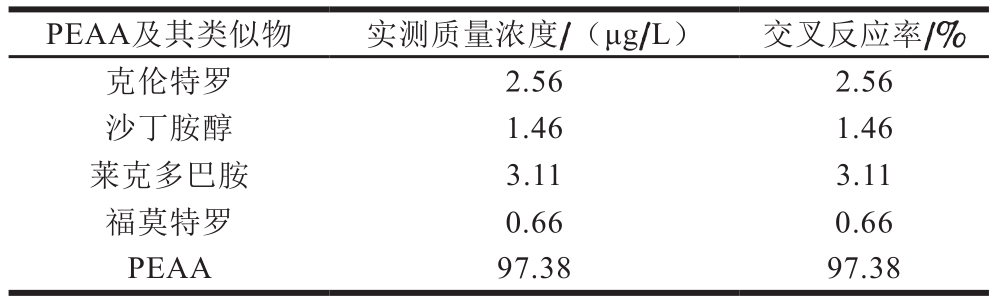
PEAA及其类似物 实测质量浓度/(μg/L) 交叉反应率/%克伦特罗 2.56 2.56沙丁胺醇 1.46 1.46莱克多巴胺 3.11 3.11福莫特罗 0.66 0.66 PEAA 97.38 97.38
由表4可知,各类似物的添加质量浓度为100 μg/L时,用PEAA荧光免疫层析试纸条测定,PEAA与其他类似物的交叉反应率均小于5.00%,表明PEAA荧光免疫层析试纸条的特异性良好。
PEAA已经成为研究比较热门的一种新型瘦肉精,建立检测PEAA的快速检测方法,有助于进行基层检测,保障肉类食品安全,从源头把控食品质量。荧光微球作为一种新型标记物,能够直接标记抗体,反应时间短,灵敏度高,因此在免疫层析技术中被广泛应用。
抗原-抗体的结合特异性是实现免疫学检测的关键,抗原决定簇决定了免疫产生抗体的基本特性,而制备的抗体效价对检测方法灵敏度的影响十分重要。本研究通过重氮化法合成PEAA人工抗原,通过效价检测,得到高效价PEAA抗体。在此基础上以QBs为探针,成功将QBs与PEAA抗体偶联,制备得到PEAA荧光免疫层析试纸条,该试纸条的检测限为0.496 μg/L,灵敏度高于胶体金免疫层析法,且在荧光免疫法定量检测尿液中的PEAA物质中取得了突破性进展,该试纸条的灵敏度和特异性都很好,能够为免疫技术的开发提供参考。
[1] 孙志文, 闫小峰. 猪肌肉组织中苯乙醇胺A残留液相色谱-串联质谱检测方法[J]. 中国兽医杂志, 2011, 47(4): 72-74. DOI:10.3969/j.issn.0529-6005.2011.04.033.
[2] 孙武勇, 赵冰琳, 张守杰, 等. 超高效液相色谱-串联质谱法测定饲料中苯乙醇胺A的残留量[J]. 色谱, 2012, 30(10): 1008-1011.DOI:10.3724/SP.J.1123.2012.08023.
[3] 王瑞国, 苏晓鸥, 王培龙, 等. 超高效液相色谱法测定饲料中苯乙醇胺A[J]. 分析化学研究报告, 2013, 41(3): 389-393. DOI:10.3724/SP.J.1096.2013.20773.
[4] 中华人民共和国农业部. 中华人民共和国农业部公告 第1519号[EB/OL]. (2010-12-27) [2018-11-25]. http://www.moa.gov.cn/govpublic/XMYS/201101/t20110113_1806088.htm.
[5] ZHANG Mingxia, LI Cun, WU Yinliang. Determination of phenylethanolamine A in animal hair, tissues and feeds by reversed phase liquid chromatography tandem mass spectrometry with QuEChERS[J]. Journal of Chromatogrephy B, 2012, 900: 94-99.DOI:10.1016/j.jchromb.2012.05.030.
[6] 李军, 刘莲娜, 孟晓璐, 等. 硝基呋喃类药物胶体金免疫层析试纸条的研制[J]. 畜牧与兽医, 2014, 4(1): 74-77.
[7] 何方洋, 冯才伟, 孙震, 等. 饲料中硝基呋喃类药物免疫胶体金检测试纸条的研制[J]. 饲料工业, 2012, 33(23): 35-38.
[8] 方琦, 黄锡荣, 李凯, 等. 降钙素原荧光免疫层析定量检测方法的建立及性能评估[J]. 中华检验医学杂志, 2012, 35(12): 1102-1107.DOI:10.3760/cma.j.issn.1009-9158.2012.12.011.
[9] 李春生, 刘静静, 杜顺丰, 等. 呋喃唑酮代谢物单克隆抗体和胶体金免疫层析试纸条的研制[J]. 现代食品科技, 2017, 33(6): 326-331.DOI:10.13982/j.mfst.1673-9078.2017.6.048.
[10] 丁桥棋, 李丽, 范文韬, 等. 基于新型量子点荧光微球的氯霉素免疫层析试纸条的制备和应用[J]. 分析化学研究报告, 2017, 45(11):1686-1693. DOI:10.11895/j.issn.0253-3820.170300.
[11] 解泉源, 赖卫华, 刘春梅, 等. 大肠杆菌O157:H7荧光微球免疫层析试纸条的研制[J]. 食品科学, 2013, 34(16): 353-357. DOI:10.7506/spkx1002-6630-201316072.
[12] 王丽娜, 刘凯, 杜柏林, 等. UPLC/MS/MS测定动物尿液中9 种β-受体激动剂残留量[J]. 现代畜牧兽医, 2013, 43(8): 42-46.DOI:10.3969/j.issn.1672-9692.2013.08.018.
[13] 范放, 朱海, 洪小柳, 等. 氯霉素荧光纳米颗粒免疫层析法的建立[J].现代农业科学, 2009, 16(9): 13-14.
[14] 姜艳彬, 孙冠如, 王海, 等. 盐酸克伦特罗胶体金快速检测试纸条的研制[J]. 中国畜牧兽医, 2010, 37(10): 109-113.
[15] 唐海波, 齐维, 唐诗幸, 等. 荧光定量快速检测鲜奶中四环素总量残留[J]. 现代食品科技, 2012, 28(11): 1600-1602.
[16] 葛怀礼, 王莲, 李金卿, 等. 盐酸克伦特罗荧光定量检测试剂盒质量评价[J]. 中国畜牧兽医, 2014, 41(10): 285-289.
[17] 朱海, 范放, 洪小柳, 等. 氯霉素荧光纳米颗粒免疫层析法的建立[J].现代农业科学, 2009, 16(9): 13-14.
[18] 郭艳宏, 李飞, 邹明强, 等. 用于检测氯霉素类残留物的荧光免疫检测试纸条的研制[J]. 化学试剂, 2010, 32(6): 496-498. DOI:10.3969/j.issn.0258-3283.2010.06.005.
[19] 胡华军, 付涛, 张明洲, 等. CdTe/ZnSe壳核量子点免疫层析试纸条检测克伦特罗的研究[J]. 分析化学, 2010, 38(12): 1727-1731.DOI:10.3724/SP.J.1096.2010.01727.
[20] 李丹妮, 黄华, 张婧, 等. 3 种β2-受体激动剂荧光免疫层析试纸条的制备及特性研究[J]. 中国畜牧兽医, 2017, 44(8): 2437-2442.DOI:10.16431/j.cnki.1671-7236.2017.08.031.
[21] 李静宇, 何小维, 刘晓云, 等. 克伦特罗荧光免疫层析试纸条的制备及特性研究[J]. 中国畜牧兽医, 2015, 42(10): 2606-2611.DOI:10.16431/j.cnki.1671-7236.2015.10.014.
[22] 李春生, 李君华, 吴萌, 等. 苯乙醇胺A人工抗原的合成及鉴定[J]. 畜牧与兽医, 2016, 48(2): 90-93.
[23] 蔡齐超, 胡骁飞, 侯玉泽, 等. 苯乙醇胺A人工抗原的制备与鉴定[J]. 河南农业科学, 2014, 43(7): 150-155. DOI:10.3969/j.issn.1004-3268.2014.07.033.
[24] 张文琪, 何小维, 李凯, 等. 白细胞介素-6快速定量荧光免疫层析试纸条的制备及特性研究[J]. 检验医学与临床, 2018, 15(7): 958-961.DOI:10.3969/j.issn.1672-9455.2018.07.021.
[25] 段宏, 陈雪岚, 江湖, 等. 量子点荧光微球免疫层析试纸条定量检测恶性恶性疟原虫[J]. 分析化学, 2015, 43(3): 338-343. DOI:10.11895i ssn.0253-3820.140848.
[26] 王建军, 熊雅婷, 秦誉, 等. 同时检测动物性食品中6 种β-受体激动剂的化学发光免疫分析方法的建立[J]. 肉类研究, 2017, 31(10):36-40. DOI:10.7506/rlyj1001-8123-201710007.
[27] 郭诗静, 唐海波, 齐维, 等. 免疫荧光层析法快速检测猪尿中克伦特罗含量[J]. 现代食品科技, 2013, 29(5): 1154-1156.
[28] KE Yan, FU Lilan, HONG Xiafei, et al. Acute clenbuterol induces hypotension, atrioventricular block and cardiacasystole in the rabbit[J].Cardiovascular Toxicology, 2013, 13(1): 85-90. DOI:10.1007/sl2012-012-9185-8.
[29] JIANG Danni, CAO Biyun, WANG Meiyu, et al. Development of a highly sensitive and specific monoclonal antibody based enzymelinked immunosorbent assay for the detection of a new β-agonist,phenylethanolamine A, in food samples[J]. Journal of the Science of Food and Agriculture, 2017, 97(3): 1001-1009. DOI:10.1002/jsfa.7826.
[30] XU Subin, ZHAO Lijun, BAI Lin, et al. Determination of phenylethanolamine A in livestock urine by high performance liquid chromatography tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2013, 41(5): 776-780. DOI:10.3724/SP.J.2013.20963.
[31] 胡佳丽, 于东升, 刘小雷, 等. 荧光免疫层析法快速测定牛奶中头孢氨苄残留量[J]. 中国食品卫生杂志, 2014, 26(4): 362-366.DOI:10.13590/j.cjfh.2014.04.015.
[32] 邵彪, 周小兰, 王琳琳, 等. 肉制品中植源性转基因成分多重荧光定量PCR检测方法的建立[J]. 肉类研究, 2018, 32(1): 41-45.DOI:10.7506/rlyj1001-8123-201801007.
[33] 贝亦江, 王扬, 朱凝瑜, 等. 高效液相色谱-串联质谱法检测鱼肉中5 种头孢类药物[J]. 肉类研究, 2018, 32(2): 28-32. DOI:10.7506/rlyj1001-8123-201802005.
[34] ERLANGER B F. The preparation of antigenic hapten-carrier conjugate a survey in methods in enzymology[M]. Salt Lake City:Academic Press, 1980: 85-106.
Preparation and Properties of Fluorescent Immunochromatographic Test Strip for Detection of Phenylethanolamine A
郭会灿, 李君华, 王丽君, 等. 苯乙醇胺A荧光免疫层析试纸条的制备及特性[J]. 肉类研究, 2019, 33(1): 55-59.DOI:10.7506/rlyj1001-8123-20181126-220. http://www.rlyj.pub
GUO Huican, LI Junhua, WANG Lijun, et al. Preparation and properties of fluorescent immunochromatographic test strip for detection of phenylethanolamine A[J]. Meat Research, 2019, 33(1): 55-59. DOI:10.7506/rlyj1001-8123-20181126-220.http://www.rlyj.pub