发酵牛肉调味基料(fermented beef flavoring,FBF)以冷冻牛胴体电锯分割过程中产生的牛骨肉末为原料[1],在传统工艺(热压浸提、酶解、美拉德反应)基础上增加发酵工艺,此工艺制得的调味基料营养丰富、赋香效果明显,且具有很强的抗氧化性[2],能够明显改善腌肉制品的风味[3],可广泛应用于肉制品加工中。通过乳酸菌发酵[4]提高FBF的抑菌性,使其在肉制品中的应用前景更加广阔。
乳酸菌的抑菌特性已被证实,学者们对乳酸菌的抑菌机制开展了广泛的研究[5-6]。乳酸菌的抑菌作用主要体现在两方面:首先,乳酸菌能够发酵糖类产生有机酸、双乙酰、过氧化氢等多种代谢产物[7-8],通过降低环境pH值和氧化还原电位,形成不利于有害菌的生存环境,抑制食品中病原菌和腐败菌的生长;另一方面,乳酸菌代谢产生的细菌素能够阻止病原菌在机体内定植,提高宿主对外来菌的抵抗力[9]。FBF加工过程涉及到乳酸菌的热灭活,研究表明,灭活乳酸菌对有害菌仍能起到很好的抑制作用。灭活乳酸菌通过自身与黏膜的吸附作用[10-11]可以抑制人和动物体内大肠埃希菌[12]、白色假丝酵母[13]等病原微生物的侵染,改善生物体内肠道菌群的组成[14],提高机体的非特异性免疫能力[15-16]。
前期实验中,本课题组以4 株商业复合菌萨科WBL-45(木糖葡萄球菌+肉葡萄球菌+清酒乳杆菌)、WBX-43(木糖葡萄球菌+肉葡萄球菌)、B0M-13(清酒乳杆菌)、THM-17(木糖葡萄球菌+戊糖片球菌)为研究对象,发现利用THM-17制得的FBF赋香效果最好,且对大肠杆菌有较好的抑制效果,为了验证和提高FBF的抑菌性,本研究将发酵剂扩大到15 株复合或单株乳酸菌,研究FBF在不同发酵剂和工艺条件下的抑菌特性差异,以筛选出抑菌效果较好的发酵剂,应用于FBF的生产。
1.1.1 原料
电锯分割冷冻牛胴体时产生的牛骨肉末(骨、肉质量比3∶7),由顶兴(天津)食品科技发展有限公司提供。
1.1.2 菌种
THM-17(木糖葡萄球菌+戊糖片球菌)、WBX43(木糖葡萄球菌+肉葡萄球菌)、VHI-41(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)、WBL-45(木糖葡萄球菌+肉葡萄球菌+清酒乳杆菌)、PRO-MIX5(木糖葡萄球菌+类植物乳杆菌+清酒乳杆菌)、VBM-60(木糖葡萄球菌+肉葡萄球菌+戊糖片球菌+乳酸片球菌)、SHI-59(木糖葡萄球菌+戊糖片球菌+植物乳杆菌) 意大利萨科公司;弯曲乳杆菌(Lactobacillus curvatus,LC)、清酒乳杆菌1(Lactobacillus sake 1,LS1)、戊糖乳杆菌(Lactobacillus pentosus,LPe) 东北农业大学微生物实验室;植物乳杆菌(Lactobacillus plantarum,LPl)、戊糖片球菌(Pediococcus pentosaceus,PP)、木糖葡萄球菌(Staphylococcus xylosus,SX)、清酒乳杆菌2(Lactobacillus sake 2,LS2)、肉葡萄球菌(Staphylococcus carnosus,SC),从萨科商业复合菌中分离得到。上述菌粉于-18 ℃冷冻贮藏,商业复合菌粉使用前于含质量分数1.5%葡萄糖的灭菌乳培养基中活化2 h;单菌接种于MRS液体培养基,37 ℃连续活化3 代,于4 ℃贮藏备用。
金黄色葡萄球菌(Staphylococcus aureus)、鼠伤寒沙门氏菌(Salmonella typhimurium)、铜绿假单胞菌(Pseudomonas aeruginosa)、大肠杆菌(Escherichia coli)、乙型副伤寒沙门氏菌(Salmonella paratyphi B),由中国农业大学微生物实验室提供。使用前接种于LB培养基,于37 ℃连续活化2~3 代,于4 ℃贮藏备用。
1.1.3 培养基
MRS液体培养基:北京索莱宝科技有限公司。
LB培养基:蒸馏水1 L、酵母提取物5 g、胰蛋白胨10 g、氯化钠10 g,NaOH溶液调节pH值至7.0,121 ℃灭菌20 min。
1.1.4 试剂
风味蛋白酶(500 LAPU/g)、复合蛋白酶(1.5 AU/g)丹麦诺维信公司;木糖、葡萄糖、半胱氨酸、甘氨酸、丙氨酸、VB1 顶兴(天津)食品科技发展有限公司;酵母浸提物、胰蛋白胨、氯化钠、氢氧化钠 天津市风船化学试剂科技有限公司。
SX-500高压蒸汽灭菌锅 日本Tomy公司;恒温振荡摇床 香港Blue Pand公司;Friocell 22恒温恒湿培养箱 艾力特国际贸易有限公司;3001-1339 VarioskanFlash酶标仪 美国Thermo公司。
1.3.1 实验设计
设计3 个处理组:1)CK组(热压浸提-酶解-美拉德反应);2)反应Ⅰ组(热压浸提-酶解-发酵),在发酵环节分别接种15 种商业复合菌或单株菌,即THM-17、WBX-43、VHI-41、WBL-45、PRO-MIX5、VBM-60、SHI-59、LPl、PP、SX、LS1、SC、LC、LS2及LPe;3)反应Ⅱ组(热压浸提-酶解-发酵-美拉德反应),在反应Ⅰ组的基础上继续进行美拉德反应。
所有处理均制备2 份。以P. aeruginoosa、E. coli、S. typhimurium、S. paratyphi B、S. aureus为目标菌,将经以上3 种处理制得的FBF作用于目标菌液,通过测定600 nm波长处的光密度(optical density,OD)(OD600 nm),对其抑菌性进行研究。
1.3.2 样品制备
1.3.2.1 热压浸提
在250 mL三角烧瓶中,称取23 g牛骨肉末和92 mL蒸馏水(牛骨肉末和蒸馏水的质量比1∶4),搅拌后于高压灭菌锅中热压浸提,0.1 MPa、121 ℃条件下浸提4 h,以充分提取牛骨肉末中的蛋白质[4]。此环节共制备62 瓶热压浸提液。
1.3.2.2 酶解
将62 瓶热压浸提液冷却至室温,分别添加质量分数0.06%的风味蛋白酶和质量分数0.03%的复合蛋白酶,于50 ℃摇床中同步酶解4.5 h,酶解结束后沸水浴灭酶20 min,冷却至室温,得到62 瓶酶解液。
1.3.2.3 发酵
取2 瓶酶解液作为CK组,不进行发酵,直接进行下一步的美拉德反应。将其余60 瓶酶解液进行发酵,在酶解液中接种活化好的发酵剂,7 种商业复合发酵剂依照产品推荐量添加,添加量为牛骨酶解液质量的0.02%,8 种单菌接种量为106 CFU/mL,每种发酵剂接种4 瓶,在30 ℃、130 r/min条件下振摇发酵16 h,发酵结束后沸水浴灭菌20 min,冷却至室温,此时取接种不同发酵剂的发酵液各2 瓶(30 瓶),作为反应Ⅰ样品,其余发酵液(30 瓶)继续进行美拉德反应。
1.3.2.4 美拉德反应
向2 瓶CK组酶解液和剩余30 瓶发酵液中分别添加1.2%木糖、1.2%葡萄糖、0.9%半胱氨酸、0.45%甘氨酸、0.45%丙氨酸和1.8% VB1,搅拌均匀后在110 ℃条件下进行美拉德反应60 min,冷却得到2 瓶CK组和30 瓶反应Ⅱ组样品。
1.3.2.5 离心
所有样品均在2 ℃、5 000×g条件下离心1 min,取上清液,4 ℃冷藏备用。
1.3.3 抑菌率测定
参考阮关强[17]的方法,并对其进行修改。取活化好的E. coli悬浊液100 µL,用LB液体培养基定容至10 mL,使其细菌浓度达到107 CFU/mL,备用;将10 µL经过0.22 µm滤膜过滤除菌后的样液加入到无菌96孔板中,然后加入上述细菌浓度为107 CFU/mL的细菌悬浊液90 µL,以100 µL菌悬液为阳性对照,以100 µL LB液体培养基为100 µL菌悬液的空白对照,以10 µL样液+90 µL LB液体培养基为10 µL样液+90 µL菌悬液的空白对照,混合均匀后,在37 ℃恒温恒湿培养箱中培养。采用酶标仪测定OD600 nm。各样品对E. coli的抑制率按照下式计算。
式中:ODLB为100 µL LB液体培养基的OD值;ODE. coli为100 µL E. coli菌悬液的OD值;ODLB+FBF为10 µL FBF+90 µL LB液体培养基的OD值;ODE. coli+FBF为10 µL FBF+90 µL E. coli菌悬液的OD值。
各样品对P. aeruginoosa、S. typhimurium、S. paratyphi B和S. aureus目标菌的抑制率实验操作及其抑制率计算方法同上。
使用Excel 2016软件进行数据处理,用Sigma Plot 10.0软件绘图,用Statistix 8.1软件中的Tukey HSD进行显著性检验(P<0.05)。所有组别数据均测定5 次,去掉最大值和最小值后取平均值。

图 1 不同处理组FBF对S. aureus的抑制率
Fig. 1 Percentage inhibition of S. aureus in different treatment groups
由图1可知:CK组FBF未经发酵,其对S. aureus的抑制效果较弱,抑制率仅为21%;而15 株发酵剂中,除了THM-17和WBX-43制得的FBF在反应Ⅱ中对S. aureus的抑制率有所降低外,其他处理组FBF在反应Ⅱ中对S. aureus的抑制率均明显高于反应Ⅰ。其中,WBL-45处理组FBF,不论是反应Ⅰ样品还是反应Ⅱ样品,对S. aureus的抑制率均高于其他处理组,反应Ⅰ中该处理组FBF对S. aureus的抑制率为51%,反应Ⅱ则上升至58%,抑菌效果较好。
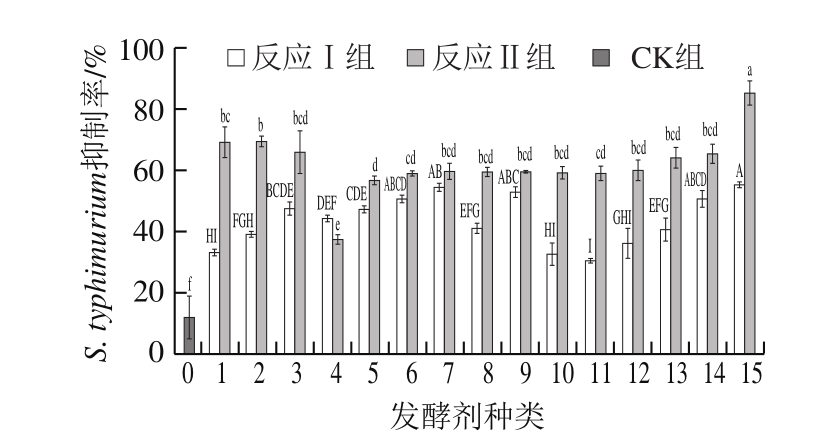
图 2 不同处理组FBF对S. typhimurium的抑制率
Fig. 2 Percentage inhibition of S. typhimurium in different treatment groups
由图2可知,反应Ⅰ和反应Ⅱ制得的FBF对S. typhimurium的抑制率均优于CK组。CK组FBF对S. typhimurium的抑制率为12%,增加了发酵处理的反应Ⅰ制得的FBF对S. typhimurium的抑制率在30%~50%范围内,反应Ⅱ在反应Ⅰ的基础上增加了美拉德反应,FBF的抑制率多处于55%~70%范围内。其中,以LS2(清酒乳杆菌)为发酵剂制得的FBF在反应Ⅰ和反应Ⅱ 2 种体系中对S. typhimurium的抑制率分别为55%和85%,显著高于其他处理组(P<0.05)。此外,THM-17在反应Ⅱ中抑菌性大大提高,经THM-17发酵制得的FBF对S. typhimurium的抑制率从反应Ⅰ中的33%上升至69%。
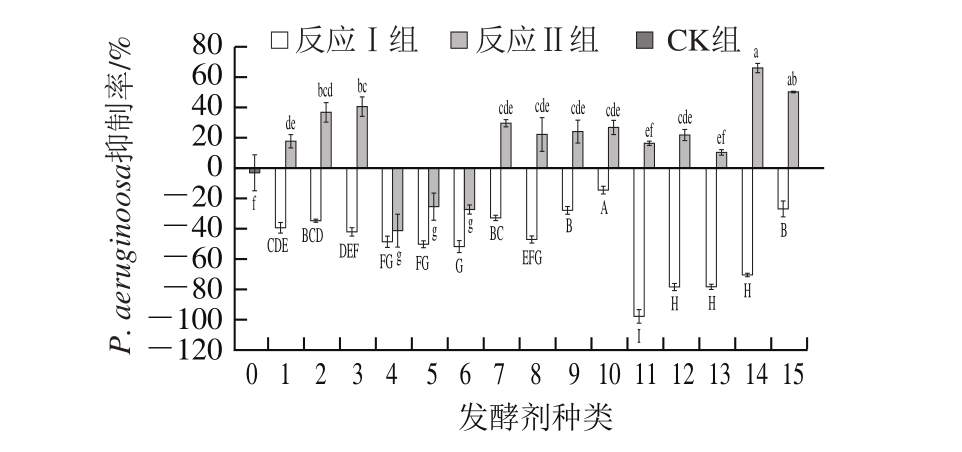
图 3 不同处理组FBF对P. aeruginoosa的抑制率
Fig. 3 Percentage inhibition of P. aeruginoosa in different treatment groups
由图3可知,FBF对P. aeruginoosa的抑制效果较弱,在3 种反应体系中,CK组和反应Ⅰ组制得的FBF对P. aeruginoosa不仅没有抑制作用,反而能促进P. aeruginoosa的生长,采用LC(弯曲乳杆菌)发酵制得的FBF对P. aeruginoosa的促生长率甚至可达97%。经美拉德反应后,FBF对P. aeruginoosa的抑制率才有所体现,其中对P. aeruginoosa抑制效果较好的是LPl(植物乳杆菌)(66%)和LS2(清酒乳杆菌)(50%)。
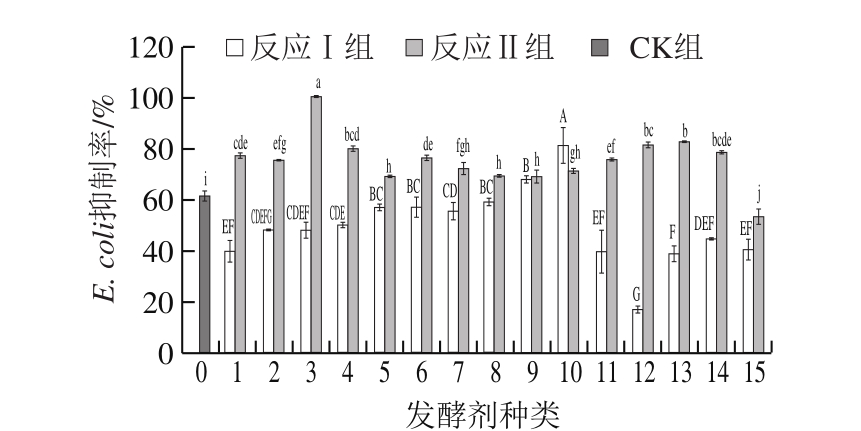
图 4 不同处理组FBF对E. coli的抑制率
Fig. 4 Percentage inhibition of E. coli in different treatment groups
由图4可知,CK组对E. coli的抑制率为61%。整体来看,反应Ⅱ组各样品对E. coli的抑制率均比反应Ⅰ组有大幅度提高,其中变化最大的是以LPe(戊糖乳杆菌)为发酵剂制得的FBF,抑制率由17%提高到81%,增幅377%。从15 种不同的发酵剂来看,反应Ⅰ组FBF对E. coli的抑制率大多为40%~60%,反应Ⅱ组FBF对E. coli的抑制率提高到70%~80%。反应Ⅱ组各FBF中对E.coli抑制率最高的是以商业复合菌WBL-45为发酵剂制得的FBF,其对E.coli的抑制率可高达100%。
由图5可知,反应Ⅱ制得的FBF抑菌效果显著优于反应Ⅰ和CK组制得的FBF。CK组不仅对S. paratyphi B无抑制作用,反而能促进该致病菌的生长。反应Ⅰ制得的FBF对S. paratyphi B的抑制率大多为25%~50%,其中抑制效果最好的是以SC(肉葡萄球菌)为发酵剂制得的FBF,其抑制率高达89%,以PP(戊糖片球菌)和SX(木糖葡糖球菌)为发酵剂制得的FBF对S. paratyphi B的抑制率也分别高达50%和58%。经过美拉德反应后的反应Ⅱ组FBF对S. paratyphi B的抑制率大多上升至60%~80%,经VBM-60发酵剂制得的FBF,其抑制率由反应Ⅰ组中的26%上升至99%,是反应Ⅱ组中对S. paratyphi B抑制效果最好的。
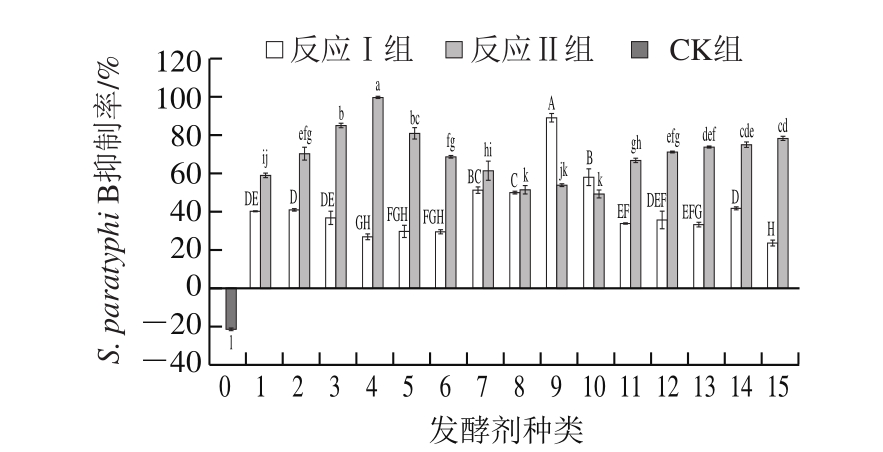
图 5 不同处理组FBF对S. paratyphi B的抑制率
Fig. 5 Percentage inhibition of S. paratyphi B in different treatment groups
在不同处理组FBF对5 株致病菌的抑菌差异研究中,复合发酵剂发酵FBF的抑菌效果多优于单菌。这是由于复合发酵剂在混合发酵时具有协同效应,会通过各自的代谢产物互相促进,提高代谢产物的产量,扩大抑菌范围,从而提高抑菌效果[18]。本研究所用发酵剂主要为乳杆菌属、片球菌属及葡萄球菌属三大类。处理筛选出的发酵剂主要有3 种:WBL-45(SX+SL+LS2)、VHI-41(SX+PP+LPl)及LS2。葡萄球菌可使蛋白质和脂肪降解,尤其是肉葡萄球菌和木糖葡萄球菌,它们作为肉品常用发酵剂,主要用于产香,可延缓肉制品酸败,形成风味和气味[19]。乳球菌属、片球菌属在代谢过程中能产生有机酸、过氧化氢及细菌素等活性物质,抑制病原菌和腐败菌的生长[20-21]。研究表明,清酒乳杆菌素热稳定性好[22],可增大细胞膜通透性,使细胞内核酸、蛋白质类物质外泄,从而引起细胞死亡[23]。
对不同处理组FBF在反应Ⅰ和反应Ⅱ中的抑菌效果进行比较,结果表明,美拉德反应能提高FBF的抑菌性。目前,美拉德反应的抑菌性已逐渐被人们认识并应用[17,24]。美拉德反应后期会形成一种棕黑色物质——类黑精[25-26],这类物质有一定的抗氧化、抗诱变功能,对某些微生物也具有较好的抑菌活性[27-28];Kim等[29]研究发现,在含有还原糖和胰蛋白胨的培养基中,部分菌的生长会受到抑制,而培养基中额外添加美拉德反应产物会导致菌死亡。此外,不同发酵剂在反应Ⅱ中的抑菌性存在差异,这是由于不同发酵剂生长繁殖过程中积累的代谢产物不同,因此即使FBF制作过程中仅发酵剂的种类存在差异,但其作为美拉德反应的底物[30-31],也会使FBF的抑菌效果存在较大差异。
本研究发现,同一发酵剂对不同致病菌的抑菌效果存在差异。通过对比可以发现,实验组FBF对P. aeruginoosa的抑制效果最差。一方面,可能是由于P. aeruginoosa为G-菌,而乳酸菌发酵剂对G+菌(尤其是亲缘性较近的细菌)的抑制作用更强[32];另一方面,P. aeruginoosa具有分泌胞外多糖形成生物被膜的能力,对环境的耐受性较强[33];同时,P. aeruginoosa能够产生哌嗪类色素,这些色素对外界环境有较强的抵抗能力[34],而美拉德反应在碱性条件下会产生大量的哌嗪类物质[35],P. aeruginoosa与FBF某些产物发生协同作用,从而促进P. aeruginoosa的生长。
反应Ⅱ组(热压浸提-酶解-发酵-美拉德反应)制得的FBF抑菌性最好,其次是反应Ⅰ组(热压浸提-酶解-发酵)制得的FBF,而CK组(热压浸提-酶解-美拉德反应)制得的FBF虽然也有一定的抑菌性,但在3 种处理中对致病菌的抑制效果最弱。在反应Ⅱ组中:以WBL-45和清酒乳杆菌为发酵剂制得的FBF抑菌性较好;以WBL-45为发酵剂制得的FBF对金黄色葡萄球菌和大肠杆菌的抑制率显著高于其他处理组,分别为58%和100%(P<0.05);以清酒乳杆菌为发酵剂制得的FBF对鼠伤寒沙门氏菌的抑制效果是所有处理组中最好的,抑制率可达85%,综合来看,WBL-45和清酒乳杆菌是适合制备FBF的发酵剂,热压浸提-酶解-发酵-美拉德反应工艺制得的FBF抑菌效果最好。
[1] 唐宏刚, 肖朝耿, 叶梦迪, 等. 猪骨蛋白酶解液美拉德反应产物的抗氧化活性研究[J]. 浙江农业学报, 2016, 28(8): 1396-1400.DOI:10.3969/j.issn.1004-1524.2016.08.18.
[2] 樊晓盼, 张伯男, 张甜, 等. 响应面法优化热压浸提牛骨蛋白提取工艺[J]. 天津农学院学报, 2017, 24(2): 58-62. DOI:10.3969/j.issn.1008-5394.2017.02.015.
[3] 樊晓盼, 吴晨燕, 王蕊, 等. 牛肉调味基料的工艺优化及其应用[J]. 肉类研究, 2017, 31(10): 18-24. DOI:10.7506/rlyj1001-8123-201710004.
[4] 樊晓盼, 马俪珍, 张伯男, 等. 微生物发酵对牛肉调味基料的增香作用[J]. 食品工业科技, 2018, 39(7): 64-69. DOI:10.13386/j.issn1002-0306.2018.07.014.
[5] 樊星, 张昊, 郭慧媛, 等. 乳酸菌抑菌功能的研究进展[J]. 中国乳业,2012(9): 52-54.
[6] SIRICHOKCHATCHAWAN W, PUPA P, PRAECHANSRI P, et al.Autochthonous lactic acid bacteria isolated from pig faeces in Thailand show probiotic properties and antibacterial activity against enteric pathogenic bacteria[J]. Microbial Pathogenesis, 2018, 119: 208-215.DOI:10.1016/j.micpath.2018.04.031.
[7] 王凤婷, 靳盼盼, 刘芳, 等. 乳酸对粪肠球菌的抑菌作用及作用机制[J]. 江苏农业学报, 2018(1): 200-206. DOI:10.3969/j.issn.1000-4440.2018.01.029.
[8] 郭夏蕾, 张健, 杨贞耐. 抑制口腔变异链球菌的乳酸菌筛选及其抑菌机理[J]. 食品科学, 2016, 37(19): 117-122. DOI:10.7506/spkx1002-6630-201619020.
[9] 李平兰, 张篪, 郑海涛. 乳酸菌及其生物工程研究新进展[J]. 中国乳品工业, 2000(4): 50-53. DOI:10.3969/j.issn.1001-2230.2000.04.019.
[10] 费翅鲲. 灭活益生菌制剂的保健功效研究进展[C]//上海市预防医学会第二届学术年会论文汇编. 上海: 上海市预防医学会, 2006: 5.
[11] 朱秀敏, 曹萌. 灭活益生菌的研究进展[J]. 中国微生态学杂志, 2010,22(2): 175-178. DOI:10.13381/j.cnki.cjm.2010.02.011.
[12] CHAUVIÈRE G, COCONNIER M, KERNEIS S, et al. Competitive exclusion of diarrheagenic Escherichia coli (ETEC) from human enterocyte-like Caco-2 cells by heat-killed Lactobacillus[J]. FEMS Microbiology Letters, 1992, 91(3): 213-217. DOI:10.1016/0378-1097(92)90700-X.
[13] WAGNER R D, PIERSON C, WARNER T, et al. Probiotic effects of feeding heat-killed Lactobacillus acidophilus and Lactobacillus casei to Candida albicans-colonized immunodeficient mice[J]. Entrez Pubmed, 2000, 63(5): 638-644. DOI:10.4315/0362-028X-63.5.638.
[14] 夏汉钦. 活性和热灭活益生菌对斜带石斑鱼生长性能、肠道菌群和免疫基因表达的影响[D]. 厦门: 集美大学, 2013: 2-5.
[15] WATANABE T, HOTTA C. Enhancement of host resistance to microbial infections in mice fed a high fat diet by Lactobacillus casei cells[J]. Hiroshima Journal of Medical Sciences, 1996, 45(2): 63.DOI:10.1016/j.palaeo.2008.04.033.
[16] GILL H S, RUTHERFURD K J. Viability and dose-response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice[J]. British Journal of Nutrition, 2001,86(2): 285-289. DOI:10.1079/BJN2001402.
[17] 阮关强. 黄鲫蛋白抗菌肽美拉德修饰反应及其产物应用[D]. 舟山:浙江海洋学院, 2015: 22-26.
[18] 蒋欣容, 瞿恒贤, 陈大卫, 等. 乳酸菌混合发酵对抑菌作用的影响研究[J]. 中国乳品工业, 2017, 45(9): 11-16. DOI:10.3969/j.issn.1001-2230.2017.09.002.
[19] 温婷婷. 风干肠中挥发性化合物分析及产香菌的筛选鉴定[D]. 哈尔滨: 黑龙江大学, 2012: 5-7.
[20] 王永霞. 肉品发酵剂的菌种筛选及在发酵香肠中的应用[D]. 北京:中国农业大学, 2004: 4-8.
[21] 白菊红. 乳酸菌发酵牦牛肉灌肠过程中主要物质变化规律的研究[D].成都: 西南民族大学, 2017: 4-8.
[22] 沈雷, 赵乙桢, 刘晴, 等. 清酒乳杆菌ZJ220产细菌素的研究[J]. 中国食品学报, 2015(7): 39-45. DOI:10.16429/j.1009-7848.2015.07.006.
[23] 柯芳芳, 李蕾. 清酒乳杆菌素LSJ618的抑菌方式[J]. 赤峰学院学报(自然科学版), 2013(15): 24-27. DOI:10.3969/j.issn.1673-260X.2013.15.010.
[24] 周永生, 周文娟. 美拉德反应及其对食品加工过程的影响[J].安徽农业科学, 2010, 38(27): 15092-15095. DOI:10.13989/j.cnki.0517-6611.2010.27.069.
[25] 龚平, 阚建全. 美拉德反应产物性质的研究进展[J]. 食品与发酵工业, 2009(4): 141-146.
[26] CHANDRA R, BHARAGAVA R N, RAI V. Melanoidins as major colourant in sugarcane molasses based distillery effluent and its degradation[J]. Bioresource Technology, 2008, 99(11): 4648-4660.DOI:10.1016/j.biortech.2007.09.057.
[27] 庄名扬. 中国白酒的非酶褐变反应的应用[J]. 酿酒科技, 2005(10):21-22. DOI:10.3969/j.issn.1001-9286.2005.10.002.
[28] JOSÉA R, FRANCISCOJ M. Microtiter plate-based assay for screening antimicrobial activity of melanoidins against E. coli and S. aureus[J]. Food Chemistry, 2008, 111(4): 1069-1074. DOI:10.1016/j.foodchem.2008.05.027.
[29] KIM K W, LEE S B. Inhibitory effect of Maillard reaction products on growth of the aerobic marine hyperthermophilic archaeon aeropyrum pernix[J]. Applied and Environmental Microbiology, 2003, 69(7):4325-4328. DOI:10.1128/AEM.69.7.4325-4328.2003.
[30] 杨珮瑜, 刘冬梅, 阮关强, 等. 黄鲫蛋白水解液美拉德反应物的抑菌性及抗氧化性研究[J]. 中国食品学报, 2016, 16(4): 51-57.DOI:10.16429/j.1009-7848.2016.04.008.
[31] 陈金斌, 奚秀秀. 花蟹肉酶解多肽美拉德反应产物的抑菌性研究[J]. 食品工业科技, 2017, 38(5): 88-92. DOI:10.13386/j.issn1002-0306.2017.05.008.
[32] 权春善, 徐洪涛, 王军华, 等. 乳酸菌素: 安全、天然的食品防腐剂[J]. 微生物学杂志, 2006(3): 86-89. DOI:10.3969/j.issn.1005-7021.2006.03.024.
[33] 朱军莉, 王慧敏, 王桂洋, 等. 茶多酚和葡萄籽提取物对假单胞菌抗生物被膜的抑制作用[J]. 中国食品学报, 2016, 16(1): 84-90.DOI:10.16429/j.1009-7848.2016.01.012.
[34] 龚良玉, 王修林, 李雁宾, 等. 铜绿假单胞菌产吩嗪类色素的分离纯化及其对赤潮生物生长的影响[J]. 复旦学报(自然科学版), 2004(4):494-499; 506. DOI:10.15943/j.cnki.fdxb-jns.2004.04.006.
[35] 孙丽平, 汪东风, 徐莹, 等. pH和加热时间对美拉德反应挥发性产物的影响[J]. 食品工业科技, 2009(4): 122-125. DOI:10.13386/j.issn1002-0306.2009.04.035.
Effect of Different Starter Cultures and Processing Stages on Bacteriostatic Properties of Fermented Beef Flavoring
吴晨燕, 樊晓盼, 李秀明, 等. 不同发酵剂和工艺环节对发酵牛肉调味基料抑菌性的影响[J]. 肉类研究, 2019, 33(1):25-30. DOI:10.7506/rlyj1001-8123-20181026-201. http://www.rlyj.pub
WU Chenyan, FAN Xiaopan, LI Xiuming, et al. Effect of different starter cultures and processing stages on bacteriostatic properties of fermented beef flavoring[J]. Meat Research, 2019, 33(1): 25-30. DOI:10.7506/rlyj1001-8123-20181026-201.http://www.rlyj.pub