
肌原纤维蛋白(myofibril protein,MP)是一类具有重要生物学功能特性的盐溶性蛋白群,是肉制品中最重要的功能性蛋白质,主要包括肌球蛋白、肌动蛋白和肌钙蛋白等[1]。加热是肉制品加工中的常用工序,能使MP发生变性,也是蛋白质结构发生改变后重新交联形成凝胶的重要条件。Lanier等[2]认为,MP对肉中蛋白质结构和理化性质起到决定性作用。在肉制品热加工中,MP会发生一系列物理化学变化,形成稳定的三维网络结构,赋予肉制品良好的凝胶特性和感官特性[3-4]。三聚磷酸钠(sodium tripolyphosphate,STP)是一种常见食品添加剂,具有较高水溶解性。肉制品中添加STP会影响其质构、色泽等特性,降低产品蒸煮损失,增加产品出品率[5]。STP可以与蛋白质中的氨基酸或羟基反应,使蛋白质引入磷酸基团而改变蛋白质的二级结构[6]。在蛋白质溶液中添加STP,可有效改善其凝胶强度及保水性。Fukazawa等[7]研究表明,STP能够弱化肌动球蛋白中肌动蛋白和肌球蛋白之间的作用力,增大肌动球蛋白的解离程度。Eilert等[8]研究发现,磷酸盐能提高产品保水性和乳化稳定性。
近年来,有关肉制品的研究主要是通过使用添加物或改变加工工艺条件来改善其品质,而对改善MP功能性质的研究相对较少。本研究以猪肉MP为研究对象,探讨5 种不同质量浓度STP对MP功能特性的影响,并进行相关性分析,旨在为STP改善肉制品质构的作用机理提供基础数据,为肉制品加工提供理论依据和技术支持。
猪4号肉(从最后腰椎与荐椎间垂直切下并除去后肘的部分猪后腿部位肌肉) 北京市丰台区永辉超市;乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、NaCl、MgCl2、三氯乙酸、Na2HPO4、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、戊二醛、三氯甲烷、叔丁醇、溴酚蓝、尿素(均为分析纯) 国药集团化学试剂有限公司;BCA试剂盒 北京索莱宝科技有限公司。
LYNX 4000冷冻离心机 北京科德远扬科技有限公司;XH-C旋涡混合器 江苏省金坛市白塔新宝仪器厂;WFZ UV-20紫外-可见分光光度计 上海尤尼柯仪器有限公司;AM-3均质机 日本Nihonseiki Kaisha公司;PMT 49984酶标仪 美国Biotek Instruments公司;TA-XT plus质构仪 英国Stable Micro Systems公司。
1.3.1 MP提取
参考Xiong[9]的方法,并有所改动。取冷冻猪4号肉于4 ℃解冻后,用5 倍体积提取缓冲液(含0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EDTA-2Na和10 mmol/L Na2HPO4,pH 7.4)高速匀浆(10 000 r/min),7 600 r/min离心10 min,重复2 次得到粗MP;用5 倍体积pH 7.4的0.1 mol/L NaCl溶液高速匀浆(10 000 r/min),7 600 r/min离心10 min,重复3 次,最后1 次用4 层纱布过滤浆液,并用0.1 mol/L HCl溶液调节pH值至6.0,最后7 600 r/min离心10 min得到沉淀,即为纯化MP,4 ℃冰箱贮藏,备用。
用BCA试剂盒测定MP浓度。将提取的MP溶于0.6 mol/L NaCl溶液中,分别添加质量浓度为0.1、0.2、0.3、0.4、0.5 g/100 mL的STP,以未添加STP的MP溶液为对照组,测定MP的乳化性、乳化稳定性、起泡性、起泡稳定性、表面疏水性、凝胶强度和凝胶保水性。所有实验均平行测定3 次。
1.3.2 MP乳化性及乳化稳定性的测定
参考Agyare等[10]的方法,并有所改动。将MP溶解在0.6 mol/L、pH 6.5的NaCl溶液中,配制成MP质量浓度为1 mg/mL的溶液;将2.0 mL大豆油和8.0 mL MP溶液在转速10 000 r/min条件下高速匀浆1 min,立即从距杯底0.5 cm处取100 μL匀浆液加入到5 mL 0.1% SDS溶液中,振荡混匀后用紫外分光光度计在500 nm波长处测定吸光度,记作A0;匀浆后10 min再次在相同位置取匀浆液100 μL,加入到5 mL 0.1% SDS溶液中,振荡混匀后测定吸光度,记作A10,用0.1% SDS溶液作为空白对照组。MP匀浆液的乳化性和乳化稳定性按照公式(1)~(2)计算。

式中:A500 nm为样品在500 nm波长处的吸光度;φ为油相体积分数(φ=0.25);ρ为蛋白质质量浓度/(g/mL)。
1.3.3 MP起泡性及起泡稳定性的测定
参考Wang Guang等[11]的方法,并有所改动,测定MP的起泡性和起泡稳定性。取10 mL 5 mg/mL的MP溶液,在10 000 r/min条件下均质2 min,迅速倒入50 mL量筒,读取泡沫体积,静置30 min后,再次读取泡沫体积。起泡性和起泡稳定性按照公式(3)~(4)计算。
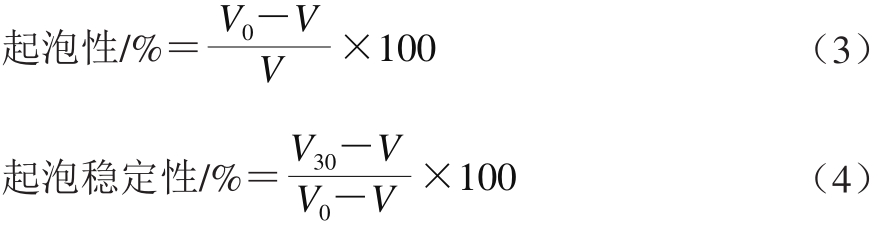
式中:V为MP溶液体积/mL;V0为均质2 min后泡沫体积/mL;V30为静置30 min后泡沫体积/mL。
1.3.4 MP表面疏水性的测定
参考Chelh等[12]的方法,测定不同磷酸化程度MP的表面疏水性。取不同磷酸化程度的MP溶液2 mL,加入到10 mL离心管中,加入40 µL 1 mg/mL的溴酚蓝溶液,室温搅拌10 min,然后3 040 r/min离心15 min;取上清液在595 nm波长处测定吸光度,以未添加MP溶液的20 mmol/L、pH 6.0磷酸盐缓冲液为空白对照,以与蛋白质结合的溴酚蓝质量表示蛋白质的表面疏水性。表面疏水性按照公式(5)计算。
式中:40为加入溴酚蓝溶液的质量/µg;A0为空白组吸光度;A为样品吸光度。
1.3.5 MP凝胶强度的测定
参考赵冰等[13]的方法,并有所改动。将STP分别以质量浓度0.1、0.2、0.3、0.4、0.5 g/100 mL添加至MP中,再添加一定量的0.6 mol/L NaCl溶液,使最终溶液体积与MP的质量比为3∶2;搅拌均匀后离心(1 520 r/min、4 ℃、10 min)排除气泡,25 ℃水浴中以1 ℃/min加热至70 ℃后恒温加热30 min,迅速取出,冷水冷却至室温,放入4 ℃冰箱冷藏过夜,测定前将样品在室温条件下放置1 h,采用TA-XT Plus型质构仪进行凝胶强度测定。
质构仪参数设定:在弱凝胶强度模式下采集数据,探头型号选择P/0.5;实验参数为:测试前速率1.0 mm/s,触发力5.0 g,测试速率0.5 mm/s,返回速率10.0 mm/s,测试循环1 次,测试距离10 mm。
1.3.6 MP凝胶保水性的测定
参考赵冰等[14]的方法,并有所改动。将制备好的MP凝胶取出,在室温(22±2) ℃条件下放置30 min;取5 g凝胶样品离心(3 800 r/min、15 min),去除离心后水分,称凝胶质量。凝胶保水性按照公式(6)计算。
式中:ma为离心后凝胶质量/g;mp为离心管质量/g;mb为离心前凝胶质量/g。
统计结果用平均值±标准差表示,以最小显著性差异(least-significant difference,LSD)法(P<0.05)进行数据间的显著性分析,采用SPSS 19.0软件进方差分析和Pearson相关性分析。
蛋白质乳化作用主要是由于蛋白质疏水基团具有亲油性,可作为油和水之间的一个良好介质,降低二者接触时的表面张力,使油与水结合能力增强。乳化性越大,表明MP乳化能力越强,单位质量乳化的油越多[15]。
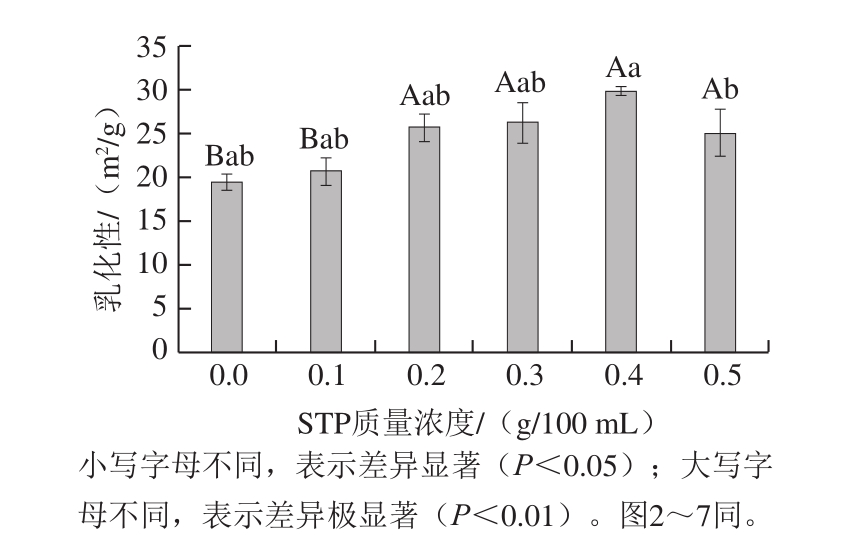
图 1 STP对MP乳化性的影响
Fig. 1 Effect of STP on emulsifying capacity of MP
由图1可知,与对照组相比,添加STP后MP的乳化性显著升高(P<0.01)。STP质量浓度为0.0~0.4 g/100 mL时,MP的乳化性逐渐增强,最高为(29.85±0.51) m2/g;STP质量浓度为0.4~0.5 g/100 mL时,MP乳化性逐渐降低。Zorba等[16]研究磷酸盐浓度对MP乳化性的影响,结果表明,MP的乳化性随磷酸盐含量增加而增强;与对照组相比,磷酸盐添加量为0.50%和0.75%时,MP的乳化性分别提高22.3%和23.0%。本研究结果与其相符,可能是由于添加STP后MP上引入磷酸基团,改变蛋白质构象,使蛋白质分子伸展,大量疏水基团暴露,与非极性油分子相连,而亲水基团则和水分子相连,有利于形成更多较强界面膜,减少油滴聚集能力[17]。
乳化稳定性是判断蛋白质乳化特性的主要指标。乳化稳定性可表征蛋白质油-水混合体系对外界的抗应变能力。乳化稳定性越高,蛋白质的抗应变能力越强。
由图2可知,与对照组相比,添加STP后MP的乳化稳定性显著升高(P<0.01)。STP质量浓度为0.2~0.5 g/100 mL时,随其质量浓度的升高,MP乳化稳定性升高;STP质量浓度为0.5 g/100 mL时,MP乳化稳定性最高,为(38.79±3.02)%。Yapar等[18]研究磷酸盐对鲤鱼鱼肉乳化能力的影响,结果表明,乳化稳定性随磷酸盐的增加极显著增加。本研究结果与其相符。乳浊液中相邻2 个界面膜之间磷酸基的静电作用可以阻止乳浊液聚集,添加STP后,蛋白质水化性增强,有利于液滴间的分散,从而增强体系稳定性[19]。
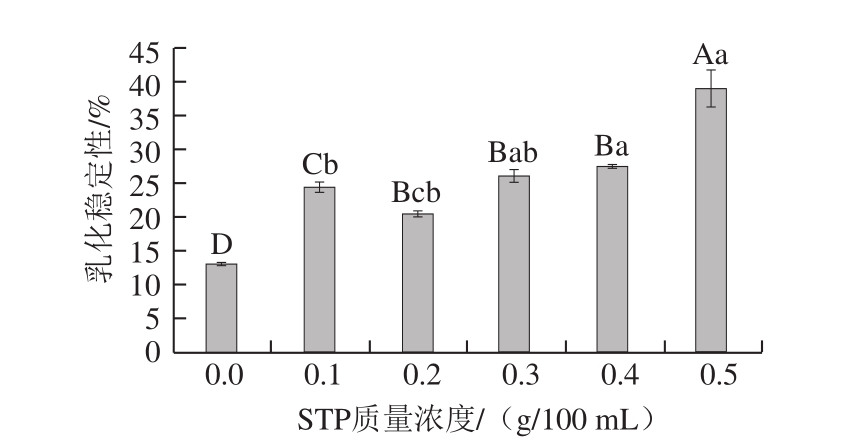
图 2 STP对MP乳化稳定性的影响
Fig. 2 Effect of STP on emulsion stability of MP
图 3 STP对MP起泡性的影响
Fig. 3 Effect of STP on foaming capacity of MP
由图3可知,与对照组相比,添加STP后MP的起泡性极显著增加(P<0.01)。STP质量浓度为0.0~0.3 g/100 mL时,MP的起泡性逐渐增大,最高为(84.85±2.50)%;当STP质量浓度继续增加,MP的起泡性逐渐下降。蛋白质起泡性由蛋白质分子扩散、界面张力及疏水基团含量和分布等决定,随着STP质量浓度的增加,MP上结合的磷酸基团增加,使MP等电点降低,蛋白质附带更多负电荷,溶解度升高,起泡性增强[20-21]。
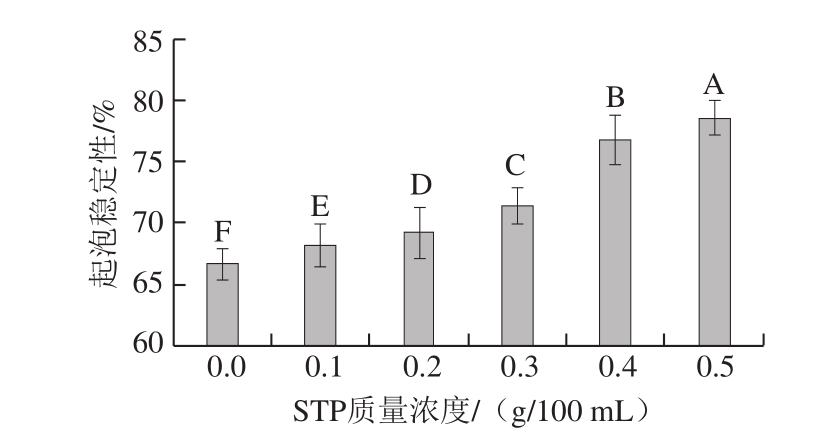
图 4 STP对MP起泡稳定性的影响
Fig. 4 Effect of STP on foam stability of MP
由图4可知,与对照组相比,添加STP后MP的起泡稳定性极显著增加(P<0.01)。随着STP质量浓度的增加,MP的起泡稳定性逐渐增大,当STP质量浓度为0.5 g/100 mL时,MP的起泡稳定性最大,为(78.57±1.40)%。添加STP后MP引入磷酸基团,使蛋白质分子结构展开,泡沫界面黏性增强,蛋白质易于吸附在气泡表面,气泡致密均一、界面膜增厚,阻止了分子扩散[22-23]。
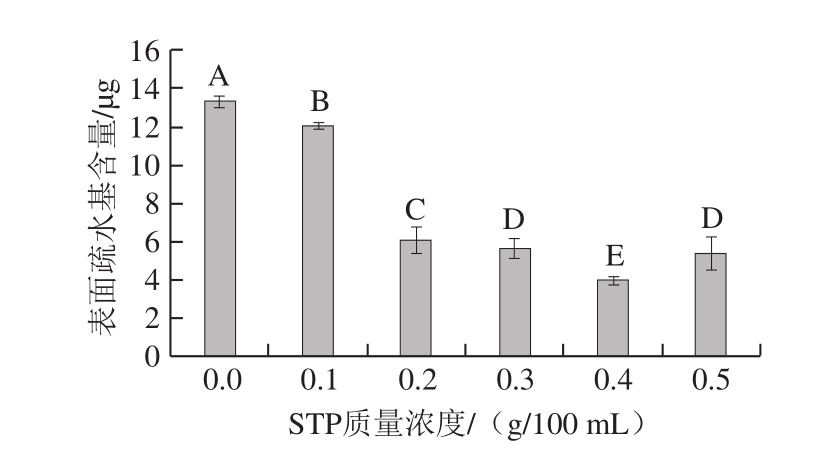
图 5 STP对MP表面疏水性的影响
Fig. 5 Effect of STP on surface hydrophobicity of MP
由图5可知,与对照组相比,添加STP后MP的表面疏水基含量显著降低(P<0.01)。STP质量浓度为0.0~0.4 g/100 mL时,随着STP质量浓度的增大,MP的表面疏水基含量逐渐降低,最低为(3.99±0.20) µg。这是由于磷酸化后MP电负性增加,溶解性增加,使蛋白质分子展开,疏水基团暴露,增强了疏水基团与溴酚蓝的结合能力,所测得的疏水基团含量降低[14]。表明磷酸化对MP结构的改变产生了显著影响,维持蛋白质结构的作用力减弱[24]。
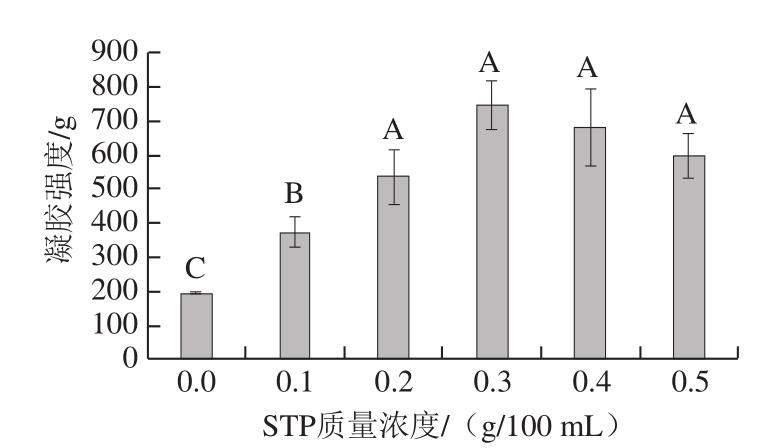
图 6 STP对MP凝胶强度的影响
Fig. 6 Effect of STP on gel strength of MP
由图6可知,与对照组相比,STP质量浓度为0.1~0.5 g/100 mL时,MP的凝胶强度极显著增强(P<0.01)。STP质量浓度为0.1~0.3 g/100 mL时,随其质量浓度升高,MP的凝胶强度增强;STP质量浓度为0.3 g/100 mL时,MP的凝胶强度最大,为745.7 g。邓丽等[25]研究表明,添加STP后MP引入磷酸基团,电负性增强,蛋白质间静电作用增加,蛋白质相互交联作用增强,分子间结合稳定性增高,形成更加致密的网状结构,从而使MP凝胶强度增大。本研究中,STP质量浓度为0.3~0.5 g/100 mL时,随其质量浓度升高,MP凝胶强度降低,这可能是由于未与蛋白质结合的STP较多,使整个体系pH值升高,分子间静电力增大,影响热诱导过程中蛋白质的聚集,导致蛋白质凝胶强度降低[26-27]。
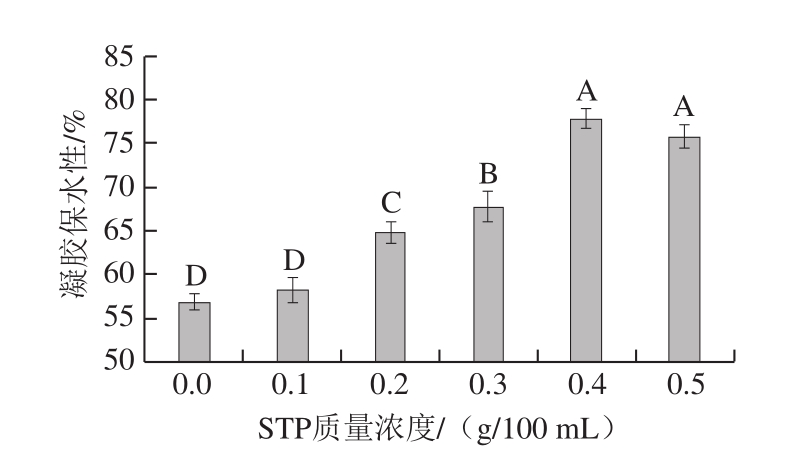
图 7 STP对MP凝胶保水性的影响
Fig. 7 Effect of STP on water-retaining capacity of MP gels
由图7可知,与对照组相比,STP质量浓度为0.2~0.5 g/100 mL时,MP的凝胶保水性极显著增高(P<0.01)。STP质量浓度为0.4 g/100 mL时,MP的凝胶保水性最高,为(77.8±1.10)%。这可能是由于MP引入磷酸基团,增加了蛋白质分子的电负性,肌动球蛋白解离成肌球蛋白和肌动蛋白的速率增大,疏水基团增多,MP凝胶网络结构空间增大,蛋白质与水分子结合位点增加,使更多水分被保留下来[28-29]。STP质量浓度为0.4~0.5 g/100 mL时,随其质量浓度升高,MP的凝胶保水性降低。这可能是由于STP质量浓度过高引起蛋白质凝胶网络结构均一性变差,导致保水性下降[30]。
表 1 MP功能特性的相关性分析
Table 1 Correlation analysis of functional properties of MP
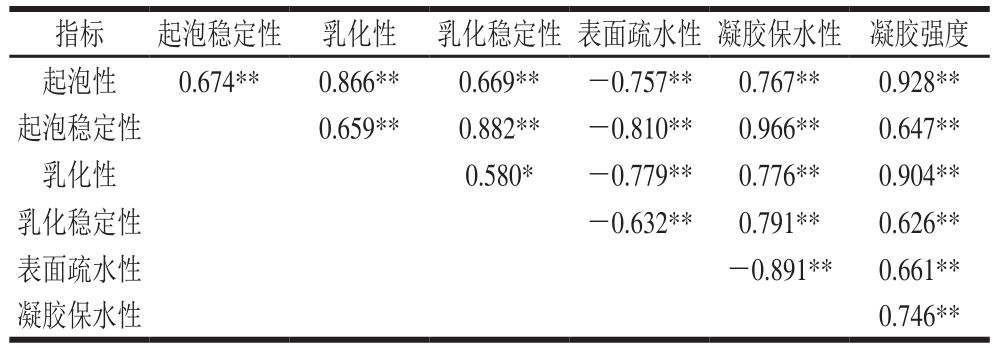
注:*. 显著相关(P<0.05);**. 极显著相关(P<0.01)。
指标 起泡稳定性 乳化性 乳化稳定性 表面疏水性 凝胶保水性 凝胶强度起泡性 0.674** 0.866** 0.669** -0.757** 0.767** 0.928**起泡稳定性 0.659** 0.882** -0.810** 0.966** 0.647**乳化性 0.580* -0.779** 0.776** 0.904**乳化稳定性 -0.632** 0.791** 0.626**表面疏水性 -0.891** 0.661**凝胶保水性 0.746**
由表1可知,MP的起泡性、起泡稳定性和乳化性呈极显著正相关(P<0.01),乳化性与乳化稳定性呈显著正相关(P<0.05)。Rodriguez等[31]认为,表面张力降低是蛋白质乳化和起泡的首要条件,其下降程度能反映蛋白质展开和重排能力的大小。阚健全[32]、Graham[33]等研究表明,蛋白质的表面张力和表面张力变化率与乳化性和乳化稳定性呈正相关,蛋白质表面张力变化率与起泡性、起泡稳定性呈正相关,蛋白质变性会降低溶液表面张力。MP的起泡性、起泡稳定性、乳化性、乳化稳定性与表面疏水性均呈极显著负相关(P<0.01),与凝胶保水性均呈极显著正相关(P<0.01),这可能是由于添加STP后MP的大量疏水基团暴露,使蛋白质快速迁移到界面,形成稳定界面薄膜,有利于乳状液和泡沫形成,这与Nakai[34]的研究结果相符。而郑文彬等[35]研究芸豆蛋白质功能性质的结果表明,乳化稳定性与表面疏水性呈显著负相关,可能是由于蛋白质之间的相互作用降低了蛋白质膜稳定脂肪的能力。MP的表面疏水性与凝胶保水性呈极显著负相关(P<0.01),这可能是由于MP引入磷酸基团,疏水基团增多,MP凝胶网络结构空间增大,蛋白质与水分子结合位点增加,使更多水分被保留下来。周心雅等[36]研究表明,MP的表面疏水性与凝胶硬度和凝胶白度极显著正相关,与MP的溶解度、乳化活性及凝胶保水性极显著负相关,表明疏水基团暴露程度越大,MP的溶解度、乳化活性及凝胶保水性越差。MP的表面疏水性与凝胶强度呈极显著正相关(P<0.01),这可能是由暴露的疏水基团在凝胶形成过程中又被包裹在凝胶网络中导致[37]。因此,改善MP的乳化性、起泡性和表面疏水性等界面性质可增强其凝胶特性。
探讨不同质量浓度STP的添加对MP功能特性的影响,并进行相关性分析。结果表明:STP可以增强MP的功能特性,其质量浓度为0.3~0.4 g/100 mL时效果最佳;改善MP的乳化性、起泡性和表面疏水性等界面性质可增强其凝胶特性。
[1] ASGHAR A, SAMEJIMA K, YASUI T. Functionality of muscle proteins in gelation mechanisms of structured meat products[J].C R C Critical Reviews in Food Technology, 1985, 22(1): 27-106.DOI:10.1080/10408398509527408.
[2] LANIER T C, CARVAJAL P, YONGSAWATDIGUL J, et al. Surimi gelation chemistry[M]. Oxford: Elsevier, 2005: 425-489.
[3] 孔保华, 王宇, 夏秀芳, 等. 加热温度对猪肉肌原纤维蛋白凝胶特性的影响[J]. 食品科学, 2011, 32(5): 50-54. DOI:10.7506/spkx1002-6630-201105011.
[4] BAUBLITS R T, POHLMAN F W, BROWN A H, Jr, et al. Effects of enhancement with varying phosphate types and concentrations, at two different pump rates on beef biceps femoris instrumental color characteristics[J]. Meat Science, 2005, 71(2): 264-276. DOI:10.1016/j.meatsci.2005.03.015.
[5] 段昌圣, 赵双娟, 黄文, 等. 三聚磷酸盐对鸭肉品质的影响[J]. 食品科学, 2013, 34(7): 62-66. DOI:10.7506/spkx1002-6630-201307014.
[6] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of pH rheological properties of porcine myofibrillar protein during heat induced gelation[J]. Meat Science, 2005, 70: 293-299. DOI:10.1016/j.meatsci.2005.01.015.
[7] FUKAZAWA T, HASHIMOTO Y, YASUI T. The relationship between the components of myofibrillar protein and their effect of various phosphates that influence the binding quality of sausage[J].Food Science, 1961, 26(5): 550-555. DOI:10.1111/j.1365-2621.1961.tb00404.x.
[8] EILERT S J, MANDIGO R W, SUMNER S S. Phosphate and modified beef connective tissue effects on reduced fat, high wateradded frankfurters[J]. Journal of Food Science, 1996, 61(5): 1006-1012. DOI:10.1111/j.1365-2621.1996.tb10921.x.
[9] XIONG YoulingL. A comparison of the rheological characteristics of different fraction of chicken myofibrillar proteins[J]. Journal of Food Biochemistry, 1993, 16(4): 217-227. DOI:10.1111/j.1745-4514.1992.tb00447.x.
[10] AGYARE K K, ADDO K, XIONG Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009,23(1): 72-81. DOI:10.1016/j.foodhyd.2007.11.012.
[11] WANG Guang, WANG Tong. Effects of yolk contamination, shearing,and heating on foaming properties of fresh egg white[J]. Journal of Food Science, 2010, 74(2): C147-C156. DOI:10.1111/j.1750-3841.2009.01054.x.
[12] CHELH I, GATELLIER P, SANTE-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[13] 赵冰, 李素, 张顺亮, 等. 蛋白氧化对肌原纤维蛋白凝胶构效关系的影响[J]. 食品科学, 2018, 39(3): 55-61. DOI:10.7506/spkx1002-6630-201803009.
[14] 赵冰, 李家鹏, 陈文华, 等. 可得然胶凝胶特性及其在西式火腿中的应用研究[J]. 食品科学, 2014, 35(21): 45-49. DOI:10.7506/spkx1002-6630-201421010.
[15] 常辰曦, 邹玉峰, 曹锦轩, 等. 谷氨酸螯合钙替代部分食盐对兔肉肌原纤维蛋白热凝胶和乳化特性的影响[J]. 食品科学, 2014, 35(7):1-6. DOI:10.7506/spkx1002-6630-201407001.
[16] ZORBA O, GOKALP H Y, YETIM H, et al. Model system evaluations of the effects of different levels of K2HPO4, NaCl and oil temperature on emulsion stability and viscosity of fresh and frozen turkish style meat emulsions[J]. Meat Science, 1993, 34(2): 145-161.DOI:10.1016/0309-1740(93)90024-C.
[17] DICKINSON E. Structure formation in casein-based gels, foams,and emulsions[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 288(1/3): 3-11. DOI:10.1016/j.colsurfa.2006.01.012.
[18] YAPAR A, ATAY S, KAYACIER A, et al. Effects of different levels of salt and phosphate on some emulsion attributes of the common carp (Cyprinus carpio L. 1758)[J]. Food Hydrocolloids, 2006, 20(6):825-830. DOI:10.1016/j.foodhyd.2005.08.005.
[19] SÁNCHEZ C C, PATINO J M R. Interfacial, foaming and emulsifying characteristics of sodium caseinate as influenced by protein concentration in solution[J]. Food Hydrocolloids, 2005, 19(3):407-416. DOI:10.1016/j.foodhyd.2004.10.007.
[20] 荣婧, 仇超颖, 胡晓, 等. 鸢乌贼肌原纤维蛋白糖基化产物功能特性研究[J]. 南方水产科学, 2018, 14(1): 68-76. DOI:10.3969/j.issn.2095-0780.2018.01.009.
[21] O’DONNELL C P, TIWARI B K, BOURKE P, et al. Effect of ultrasonic processing on food enzymes of industrial importance[J].Trends in Food Science and Technology, 2010, 21(7): 358-367.DOI:10.1016/j.tifs.2010.04.007.
[22] 李瑜, 尹春明, 周瑞宝. 三聚磷酸钠改性小麦面筋蛋白研究[J]. 粮食与油脂, 2002(2): 4-5. DOI:10.3969/j.issn.1008-9578.2002.02.002.
[23] RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al. Acidinduced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota)[J]. Food Hydrocolloids, 2009, 23(1):26-39. DOI:10.1016/j.foodhyd.2007.11.010.
[24] DÀVILA E, PARÉS D, CUVELIER G, et al. Heat-induced gelation of porcine blood plasma proteins as affected by pH[J]. Meat Science,2007, 76: 216-225. DOI:10.1016/j.meatsci.2006.11.002.
[25] 邓丽, 芮汉明. Ca2+、Mg2+和磷酸盐对鸡肉盐溶蛋白质凝胶保水性和凝胶特性影响的研究[J]. 现代食品科技, 2005, 21(2): 24-26.DOI:10.3969/j.issn.1673-9078.2005.02.008.
[26] SAGUER E, ALVAREZ P A, SEDMAN J, et al. Study of the denaturation/aggregation behavior of whole porcine plasma and its protein fractions during heating under acidic pH by variabletemperature FTIR spectroscopy[J]. Food Hydrocolloids, 2013, 33(2):402-414. DOI:10.1016/j.foodhyd.2013.04.017.
[27] XIONG YoulingL. Role of myofibrillar proteins in water-binding in brine-enhance dmeats[J]. Food Research International, 2005, 38(3):281-287. DOI:10.1016/j.foodres.2004.03.013.
[28] HAMM R. Muscle As Food: 4-Functional properties of the myofibrillar system and their measurements[J]. Salt Lake City:Academic Press, 1986: 135-199. DOI:10.1016/B978-0-12-084190-5.50009-6.
[29] LI Chunqiang, XIONG YoulingL, CHEN Jie. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry, 2012, 60(32): 8020-8027. DOI:10.1021/jf302150h.
[30] 徐幸莲, 王霞, 周光宏, 等. 磷酸盐对肌球蛋白热凝胶硬度、保水性和超微结构的影响[J]. 食品科学, 2005, 26(3): 42-46. DOI:10.3321/j.issn:1002-6630.2005.03.004.
[31] RODRIGUEZ M R, RODRIGUEZD NINO M R, WILDE P J, et al.Rheokinetic analysis of protein films at the air-aqueous subphase interface. 2. Bovine serum albumin adsorption from sucrose aqueous solutions[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8):3010-3015.
[32] 阚健全, 陈宗道, 杨辉, 等. 蛋白质溶液表面张力及其与功能性质的关系[J]. 中国粮油学报, 1999(5): 30-34. DOI:10.1017/S0266078400010713.
[33] GRAHAM D E, PHILLIPS M C. Proteins at liquid interfaces: Ⅰ.Kinetics of adsorption and surface denaturation[J]. Journal of Colloid and Interface Science, 1979, 70(3): 403-414. DOI:10.1016/0021-9797(79)90048-1.
[34] NAKAI S. Structure-function relationships of food proteins: with an emphasis on the importance of protein hydrophobicity[J]. Journal of Agricultural and Food Chemistry, 1983, 31(4): 676-683. DOI:10.1021/jf00118a001.
[35] 郑文彬, 韩晶, 王颖, 等. 黑龙江省芸豆主栽品种蛋白质功能性质分析[J]. 中国粮油学报, 2017, 32(2): 6-12. DOI:10.3969/j.issn.1003-0174.2017.02.002.
[36] 周心雅, 贺稚非, 李洪军, 等. 酸碱度对兔肉肌原纤维蛋白功能性质的影响[J]. 食品与发酵工业, 2017(11): 176-183. DOI:10.13995/j.cnki.11-1802/ts.014272.
[37] 王静宇, 杨玉玲, 康大成, 等. 超声波对肌原纤维蛋白热诱导凝胶化学作用力与保水性的影响[J]. 中国农业科学, 2017, 50(12): 2349-2358. DOI:10.3864/j.issn.0578-1752.2017.12.015.
Effect of Sodium Tripolyphosphate on Functional Properties of Pork Myofibrillar Protein
叶浪, 李美良, 赵冰, 等. 三聚磷酸钠对猪肉肌原纤维蛋白功能特性的影响[J]. 肉类研究, 2019, 33(1): 1-6. DOI:10.7506/rlyj1001-8123-20181121-218. http://www.rlyj.pub
YE Lang, LI Meiliang, ZHAO Bing, et al. Effect of sodium tripolyphosphate on functional properties of pork myofibrillar protein[J]. Meat Research, 2019, 33(1): 1-6. DOI:10.7506/rlyj1001-8123-20181121-218. http://www.rlyj.pub