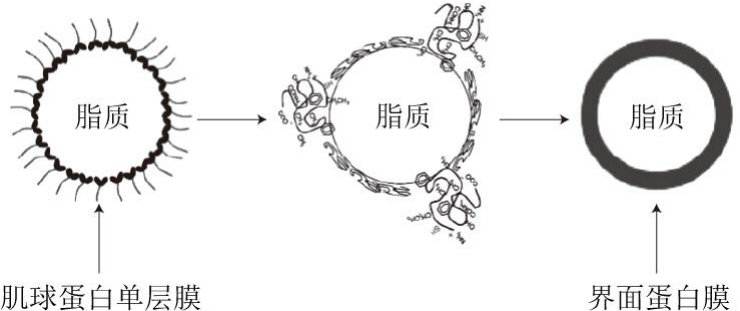
图 1 肉糜乳化体系中界面蛋白膜形成示意图[11]
Fig. 1 A diagram: the formation of interfacial protein membrane in meat batters[11]
李儒仁,杨 鹏,荣良燕,贾 娜,何 青,邵俊花,刘登勇*
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
摘 要:食盐的过量摄入与高血压、心脑血管疾病等慢性疾病之间的矛盾日益加深,而降低乳化型肉制品的盐含量会影响产品品质特性,如何避免减盐引起的质量缺陷是低盐肉制品研究领域的重点。不同离子诱导肌球蛋白分子空间构象产生不同变化,影响肌球蛋白在脂肪球表面的吸附特性,并最终影响产品品质。本文主要论述乳化过程中Chaotropic离子属性对肌球蛋白分子构象、构象变化驱动力的影响,为开发优质低盐肉制品提供新途径。
关键词:肌球蛋白;乳化;盐;脂肪;Chaotropic离子
乳化型肉制品是优质蛋白的良好来源,但其食盐含量远高于植物蛋白制品和乳制品[1]。近年来的科学研究表明,长期摄入高盐食品容易引发高血压等心脑血管疾病[2],而降低食品中的食盐含量会显著降低食品品质及口感,因此在保证食品品质和口感的同时降低食品中的食盐含量是目前食品科学研究的重点。
蛋白质变性过程中离子发挥重要作用,将离子按照它们促使蛋白质变性能力的大小或起变性作用时浓度的大小排序,就构成霍夫梅斯特序列(如SO42->Cl->NO3->I->ClO4->SCN-,即促使蛋白质变性的能力由强到弱)。依据霍夫梅斯特序列,Cl-、L-精氨酸、L-赖氨酸及L-组氨酸等均属于Chaotropic离子,这类离子具有降低蛋白质表面张力、提高蛋白质溶解度以及促使蛋白质变性的能力[3-4]。研究表明,Cl-溶解肌球蛋白所需的浓度远高于L-组氨酸[5]、L-赖氨酸[6]和L-精氨酸[7],且L-赖氨酸、L-组氨酸可以同其他Chaotropic离子协同改变肌球蛋白的二级结构[8-9]。由此可见,Chaotropic离子能够影响肌球蛋白的乳化稳定性,进而影响乳化型肉制品的保油保水性。
目前,我国低盐乳化型肉制品的加工普遍存在保油保水性差的问题[10],主要原因在于减盐会影响肌球蛋白等肌肉蛋白质的乳化凝胶特性。而L-组氨酸等Chaotropic离子能够在低浓度条件下改变肌球蛋白的二级结构,这类在低浓度条件下发挥作用的Chaotropic离子可以为乳化型肉制品减盐提供新的思路。本文结合国内外相关研究进展,以离子和蛋白质的相互作用为出发点,讨论Chaotropic离子影响肌球蛋白乳化稳定性的机理,并对未来的研究方向进行展望。
肉糜是由蛋白质、脂肪、水、盐等组成的混合物,肉糜加工过程中蛋白质和脂肪间发生乳化作用,形成界面蛋白膜,这是维持肉糜乳化稳定性、减少产品汁液流失的关键[11]。界面蛋白膜的形成涉及2 个重要环节:一是两亲性肌球蛋白吸附至脂肪球表面,形成肌球蛋白单分子层,其亲水氨基酸趋向水相,疏水氨基酸趋向油相[12];二是其他盐溶性肌原纤维蛋白通过共价或非共价相互作用与肌球蛋白尾部交联[13],在脂肪球周围形成蛋白质外壳,提供静电斥力和空间位阻,防止乳滴聚集[14](图1)。由此可见,肌球蛋白在脂肪球表面的吸附行为对肉糜的乳化稳定性至关重要。

图 1 肉糜乳化体系中界面蛋白膜形成示意图[11]
Fig. 1 A diagram: the formation of interfacial protein membrane in meat batters[11]
蛋白质在脂肪球表面的吸附行为主要涉及2 个关键的分子活动:蛋白质在脂肪球表面的吸附“定向”以及蛋白质的“构象重排”[15-16]。蛋白质与脂肪球之间的静电相互作用是诱导吸附“定向”的主要驱动力[17],吸附后蛋白质定向排列于脂肪球表面,彼此之间通过共价键(二硫键)连接在一起[15];“构象重排”主要涉及蛋白质空间构象(α-螺旋、β-折叠等)的变化[18-19]。由此可见,蛋白质乳化脂肪的效果取决于蛋白质在脂肪球表面的吸附“定向”和“构象重排”,能够影响这2 个关键活动的因素均有可能影响蛋白质对脂肪的乳化效果。
脂肪球表面形成界面蛋白膜的厚度主要取决于提取的肌原纤维蛋白含量[11]。食盐可以通过改变电荷、水合作用以及水分子的结构,进而影响肌原纤维蛋白的构象,使其产生盐溶或盐析现象[20]。食盐中Cl-易于渗透进入肌原纤维蛋白内部,与正电残基结合,增大蛋白质的膨胀度,提高蛋白质结合水的能力及蛋白质间的静电排斥力,进而达到“盐溶”的目的,并且在食盐的诱导下形成具有构象柔性的蛋白质,能更好地分布于油-水界面[2,21-22]。
不同类型氯化盐制备得到的乳化型肉制品微观结构不同。例如,相比于CaCl2和MgCl2,添加NaCl制备形成的肉糜中包含的脂肪球表面更加光滑[23]。Gravelle等[24]指出,稳定肉糜中存在更多表面光滑的乳滴,形成的界面蛋白膜孔隙较小且更厚,不稳定肉糜中形成的乳滴界面蛋白膜较薄且表面孔洞较大。Gordon等[25]发现,盐的种类影响肌肉蛋白的提取种类和数量,对后期肉糜的稳定性有较大影响。添加一定量KCl、NaCl或LiCl提取出的肌肉蛋白质组分具有一定相似性,含有较多肌动球蛋白和肌球蛋白,这类蛋白质在乳化过程中发挥重要作用,形成的肉糜稳定性较好,而添加CaCl2和MgCl2形成的肉糜孔隙更多,稳定性更差[12,25-26]。通常,单价氯化物能改善肉糜的保水性和质地,二价氯化物则会降低肉糜的保水性[27-28]。由于不同离子对蛋白质的构象具有不同影响,故不同单价氯化物对肌肉蛋白构象的影响及形成肉糜的保水性、质地等存在差异[23,25-26]。
淀粉常作为增稠剂改善肉制品的结构组织、外观形状和出品率等[29]。淀粉能吸收一定量水分,通过物理挤压的方式挤压蛋白质,与其形成紧密的网状结构[30],但过多的淀粉会导致肉糜制品出现软塌现象。另外,淀粉分解得到的糖类物质能与蛋白质发生糖基化作用,改变蛋白质的功能特性,如溶解度、持水力和乳化性能[31]。Katayama等[32]的研究表明:糖基化作用使还原糖与肌球蛋白(尾部)表面带正电的赖氨酸残基结合,导致肌球蛋白尾部正电荷减少,负电荷相对增多,肌球蛋白分子间可以通过静电排斥作用分散到水相中;另外,结合在肌球蛋白表面的还原糖形成物理屏障,抑制肌球蛋白纤维聚集,有利于发挥其功能特性。Youssef等[33]利用糖基化反应将蛋白质改性,有效提高了减盐条件下肌原纤维蛋白的溶解度和热稳定性。此外,糖基化可以增强肌原纤维蛋白的构象柔性,还原糖的结合又提供了空间位阻,从而提升了肌原纤维蛋白的乳化性能[34]。
脂肪属性影响乳化型肉制品品质的研究主要集中于饱和脂肪的替代对肌肉蛋白质乳化性能的影响[33-36]。采用液态植物油替代动物脂肪后形成不稳定肉糜,造成严重的蒸煮损失[34],表明油脂类型不同时,蛋白质的乳化模式不同;但是,将植物油凝胶化替代动物脂肪可以有效改善乳化型肉制品的质地和蒸煮损失[36]。例如,Barbut等[35]用含有8%乙基纤维素和1.5%或3.0%山梨醇单硬脂酸酯制备得到的菜籽油胶体替代牛脂肪,结果表明,替代前后的产品具有相似的感官品质和质地。由此可见,固态脂肪有利于蛋白质发挥功能特性。另外,将植物油预乳化后添加到肉糜中也可以改善直接添加植物油进行乳化造成的缺陷[37-38]。
在完整的肉糜体系中,肌原纤维蛋白通过二硫键的连接形成凝胶网络,包裹脂肪球[13,39]。在流变学意义上,这些脂肪球可以作为填充物增强凝胶网络的强度,但是肌肉蛋白如何强烈吸附在脂肪球表面还未被明确界定。另外,脂肪属性和蛋白质构象变化的关系仍有待深入研究。
斩拌是稳定肉糜体系的关键步骤,斩拌时间、温度和速率的控制在肉糜制品生产过程中至关重要[40]。适宜的斩拌时间不仅能增加盐溶性蛋白的溶出率,还能提高蛋白质的乳化凝胶特性。斩拌时间过短,肌原纤维蛋白不能充分发挥乳化作用;斩拌时间过长,部分蛋白质过度变性,降低肌原纤维蛋白在脂肪球表面的黏着力[41],易造成产品脂肪流失。斩拌过程中的温度与产品的质构、感官品质和保油保水性等均有直接关系,适当升温可以加速盐溶性蛋白的溶出;但温度过高不仅使蛋白质变性,失去乳化特性,加速蛋白质凝固,还会增加脂肪的流动性,导致产生蒸煮损失[42-43]。斩拌速率对肉糜稳定性的影响趋势与斩拌时间和斩拌温度类似。随着斩拌速率的提高,脂肪颗粒逐渐减小,相对面积增大,此时需要更多盐溶性蛋白将其乳化。斩拌的目的之一是打破结缔组织对肌纤维的束缚,因此调控斩拌速率可以优化溶出蛋白和脂肪的比例,提高肉糜保油保水性[44]。随着斩拌的进行(即能量增加),蛋白质-溶剂系统的自由能图谱变得相对平坦,蛋白质逐渐失去二级和三级结构,导致蛋白质变性,解折叠的蛋白质能在平坦的自由能表面“游荡”,最终形成大量无规卷曲结构;在能量变化过程中,蛋白质可呈现多种状态,如熔球态、转换态及玻璃态[45]。因此,建立蛋白质状态-斩拌参数之间的相互关系对控制肉糜稳定性具有重要作用。
盐离子是蛋白质乳化特性的重要影响因素之一,盐离子如何影响蛋白质分子空间构象的相关机理仍存在争议。Chaotropic离子(K+、Cl-、L-精氨酸、L-赖氨酸及L-组氨酸等)能够影响蛋白质的空间构象,但不同离子对其空间构象的影响存在很大差异[3,5-8]。Chen Xin等[5]研究发现,在“Chaotropic离子-肌球蛋白”混合体系中,高盐浓度条件下(0.6 mol/L KCl),肌球蛋白以单体形式存在,并保持其天然构象,而在低浓度条件下(1 mmol/L KCl),肌球蛋白发生聚集,溶解度较低。然而,当该体系中加入L-组氨酸(5 mmol/L)时,溶解度增高,并且L-组氨酸中的咪唑环会诱导肌球蛋白轻链部分解螺旋(α-螺旋含量下降),同时使其疏水基团和活性巯基数量增加。Chaotropic离子对蛋白质空间构象的调控途径存在3 种可能[3,46]:Chaotropic离子与蛋白质不发生直接相互作用,而是与蛋白质周围的水分子发生相互作用,间接影响蛋白质的构象;Chaotropic离子通过改变维持蛋白质空间构象的作用力(氢键、静电吸引力及疏水作用等),进而影响蛋白质的构象;Chaotropic离子与蛋白质氨基酸残基发生特异或非特异性结合,影响蛋白质的构象。
近年来,Chaotropic离子与蛋白质相互作用的机理被不断揭示[8-9,47-50],其中L-组氨酸与肌球蛋白之间的相互作用成为食品领域的主要研究对象之一,目前主要包括以下几个理论。
低离子强度条件下(含5 mmol/L L-组氨酸),肌球蛋白溶解度显著提高(>80%)[48,51]。Hayakawa等[48]研究L-组氨酸如何影响肌球蛋白在低离子强度溶液中的溶解度,通过扫描电镜发现,低离子强度溶液(含5 mmol/L L-组氨酸)中,肌球蛋白尾部延长(图2~3)。肌球蛋白杆状部分(尾部)的氨基酸序列具有高度周期性,尾部的螺旋线圈式结构由多个7肽重复区构成[51-53]。杆状部分中存在以28 个残基为单位形成的重复区,其中均匀分布着带电残基,并且负电残基多于正电残基,而疏水残基相对较少,疏水性较弱[8,54],这在肌球蛋白的聚集过程中发挥着重要作用。当然,肌球蛋白的聚集需要另一个肌球蛋白分子C-端有限个残基构成的ACD域参与,以平行或反平行的形式聚集[55-56]。因此,Hayakawa等[48]认为,L-组氨酸的添加使肌球蛋白的尾部伸长,破坏了肌球蛋白尾部带电残基肽段的电荷平衡,从而抑制了肌球蛋白的聚集,提高了溶解度。
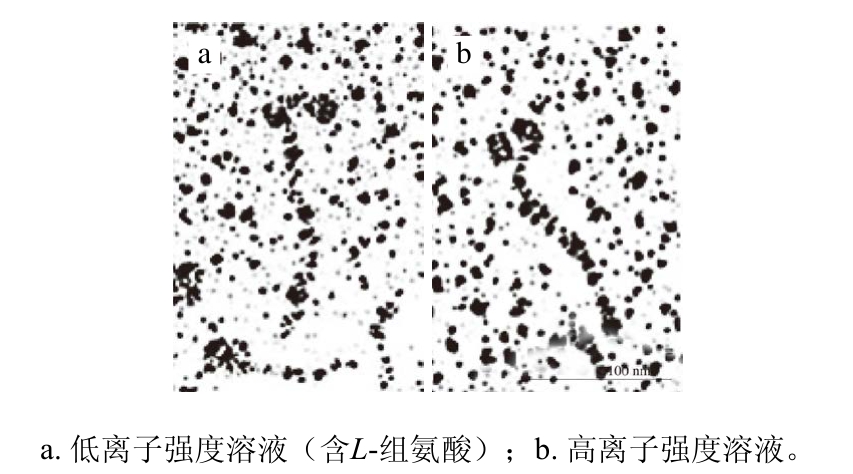
图 2 L-组氨酸对肌球蛋白形态的影响[48]
Fig. 2 Effect of L-histidine on myosin morphology[48]
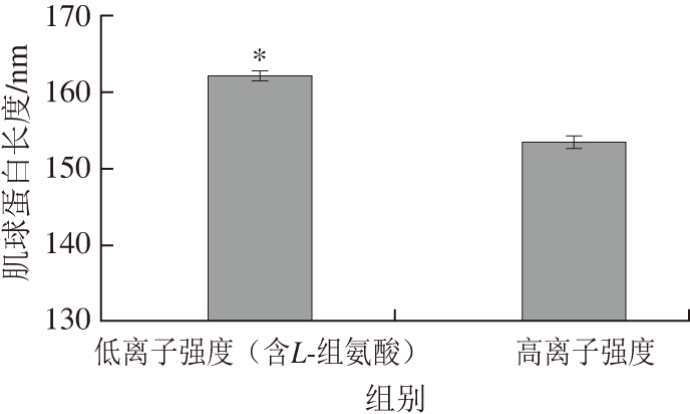
图 3 L-组氨酸对肌球蛋白长度的影响[48]
Fig. 3 Effect of L-histidine on myosin morphology length[48]
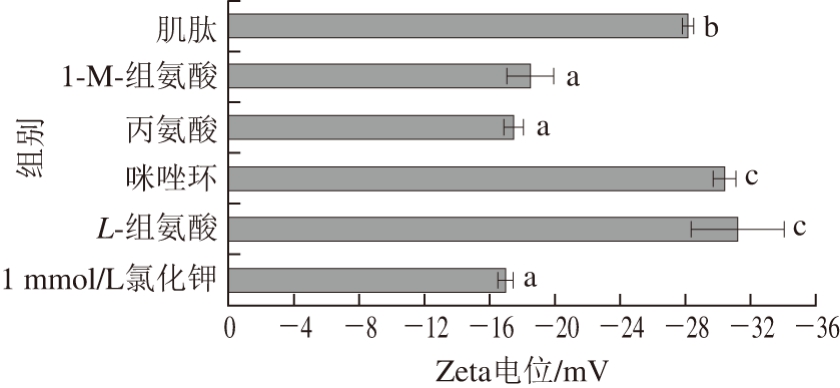
图 4 低离子强度条件下肌球蛋白溶液(pH 7.5)的Zeta电位[5]
Fig. 4 Zeta potential of myosin (pH 7.5) at low ionic strength[5]
Chen Xin等[5]测得低离子强度条件下添加L-组氨酸增大了肌球蛋白表面的绝对Zeta电位值(图4),并指出L-组氨酸中的咪唑环发挥了主要作用。L-组氨酸的存在使肌球蛋白发生构象重排,这种构象重排方式改变了肌球蛋白表面带电残基的分布,导致表面绝对Zeta电位值升高。
低离子强度条件下(pH 7.5),肌球蛋白表面绝对Zeta电位值相对较低,因此容易聚集形成纤维态,溶解度降低;当添加5 mmol/L L-组氨酸时,肌球蛋白尾部解折叠,α-螺旋含量降低(可能是亲核的咪唑环破坏了蛋白质残基间的氢键),但L-组氨酸(或咪唑环)以何种形式改变肌球蛋白的构象并不明确。内源性荧光的测定结果表明,L-组氨酸的添加使荧光光谱发生红移,说明天然肌球蛋白变性后部分埋藏的色氨酸残基暴露在极性环境中[57]。但无法确定三级结构的变化源自肌球蛋白头部还是尾部。另外,L-组氨酸的存在使肌球蛋白表面绝对Zeta电位值显著增大,带负电的肌球蛋白通过静电排斥作用以单分子形式分布于水相(图5)。Chen Xin等[5]认为,肌球蛋白尾部固有的正电和负电结构域是造成肌球蛋白聚集的主要原因。L-组氨酸中的咪唑环通过某种方式破坏了肌球蛋白原有的平衡结构,改变了肌球蛋白表面带电残基的分布,使肌球蛋白解聚及单体间通过静电排斥溶解于低浓度盐溶液。
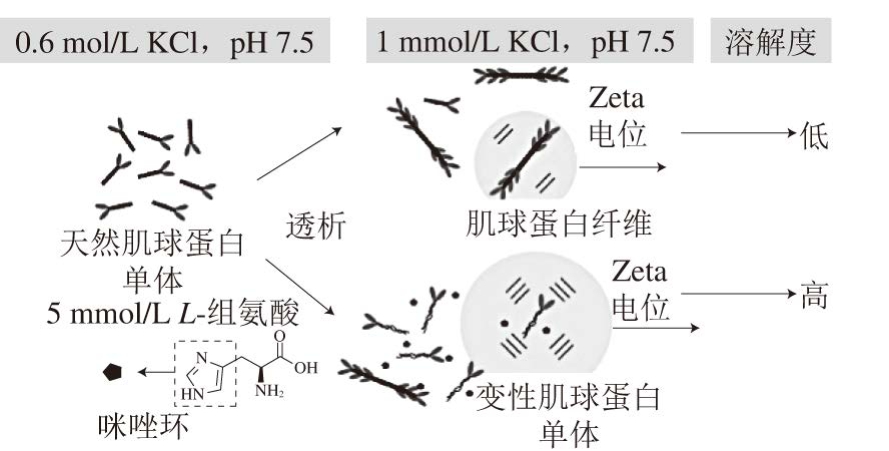
图 5 低离子强度条件下L-组氨酸(5 mmol/L)促进肌球蛋白溶解的原理示意图(1 mmol/L KCl,pH 7.5)[5]
Fig. 5 Proposed mechanism of solubilisation of myosin at low ionic solution (1 mmol/L KCl, pH 7.5) in the presence of 5 mmol/L L-histidine[5]

图 6 L-组氨酸与肌球蛋白相互作用的原理示意图[47]
Fig. 6 Proposed mechanism of interaction between L-histidine and myosin[47]
Guo等[6]认为,pH 6.5时L-组氨酸带正电,而肌球蛋白带负电,二者优先通过静电吸引力相互作用,随后L-组氨酸破坏肌球蛋白负电残基,导致肌球蛋白α-螺旋结构含量下降,并伴随着β-折叠、β-转角和无规卷曲结构含量的增加。不仅如此,肌球蛋白构象变化导致疏水基团和部分活性巯基暴露。崔艳飞[44]的研究表明,表面疏水性会随着α-螺旋结构含量的下降而增强,随后的构象转变诱导肌球蛋白聚集体解聚,因此肌球蛋白溶解性提高。盐离子与蛋白质的特异性和非特异性结合扰乱了静电相互作用可能是导致α-螺旋减少、促进肌球蛋白溶解的重要因素[58]。但目前对于疏水基团暴露引起的疏水相互作用增加没有使肌球蛋白有效聚集这一现象尚无定论。Gao Ruichang等[47]认为,L-组氨酸能通过静电吸引嵌入肌球蛋白尾部,在疏水基团周围形成“架空层”,屏蔽疏水基团之间的相互作用力,使肌球蛋白在疏水性较强的条件下无法发挥疏水相互作用,并且该状态下肌球蛋白加热后形成的聚集体较小(图6)。以此解释了肌球蛋白疏水性增强却无明显聚集体形成的原因。
肉糜斩拌过程中,随着NaCl添加量的增加,肌原纤维蛋白溶解度增大,表面张力下降,活性巯基含量增加,乳化稳定性逐渐提高[59]。肉糜乳化体系中不同浓度的离子会诱导肉糜中的蛋白质构象发生不同变化,从而导致产品质构和保油保水性出现差异[60-62]。说明肉糜体系的乳化稳定性、蛋白质构象变化、离子属性三者之间存在一定关系,而准确理解三者的关系将有助于构建稳定肉糜体系,达到乳化型肉制品减盐的目的。
目前,离子影响肉糜乳化稳定性的研究主要集中在NaCl、KCl等[59]对肌原纤维蛋白乳化稳定性[60-61]、乳化能力[62-64]和二级结构[65-67]等方面的影响,较少涉及L-组氨酸和L-赖氨酸等Chaotropic离子。虽然低浓度L-组氨酸、L-赖氨酸等Chaotropic离子会影响肌球蛋白的溶解度和空间构象[5,6,9],但具体机理并不清楚。因此,有必要深入研究不同Chaotropic离子与蛋白质相互作用的机理,从而揭示蛋白质构象变化如何影响肉糜稳定性。
Chaotropic离子属于霍夫梅斯特序列离子,与其相对应的还有Kosmotropic离子,前者能够破坏氢键使蛋白质构象改变,后者可以调控氢键使蛋白质结构稳定。Chaotropic离子(L-组氨酸)确实能够与蛋白质发生特异性或非特异性结合,改变其性质,但缺乏对离子所处水环境的考虑。由于霍夫梅斯特序列离子具有破坏/增强氢键的能力[49,68],因此,可能存在新的假设,即离子通过调控水化层结构影响肌球蛋白构象或改变氢键网络驱动离子进入蛋白质内部,改变肌球蛋白的构象。
亲水/疏水物质进入水相,均会与水分子发生强烈相互作用。Collins[68]认为,当Kosmotropic离子分散到体相水中后,溶质过渡层的水分子被Kosmotropic离子“吸引”,与水化层中水分子的相互作用减弱,导致溶质界面水化效应减小,出现盐析现象;当Chaotropic离子进入体相水时,因其极化率高,能够破坏氢键并排斥水分子,有助于过渡层水分子与水化层水分子结合,增强水化效应,促进溶质溶解。另外,不同种类的Chaotropic/Kosmotropic离子与水分子相互作用的程度不同,符合霍夫梅斯特离子序列。Lee等[49]用分子模拟表征霍夫梅斯特序列阴离子与泛素蛋白界面间的相互作用,发现BF4-、SCN-和ClO4-等Chaotropic离子并不直接与蛋白质表面发生作用,而是通过破坏泛素蛋白表面水分子间的氢键网络间接影响蛋白质的构象。由此可见,离子与水分子的相互作用会间接影响溶质的状态。
尽管间接作用机理在一定程度上能够解释霍夫梅斯特离子效应,但仍存在很多疑问。Omta等[69]利用飞秒二色泵浦探测光谱测定盐溶液中水分子的取向迁移相关时间,发现即使在高盐浓度下,本体水的动态也不受影响,说明水分子氢键未发生改变。Chen等[70]运用和频振动光谱研究聚(N-异丙基丙烯酰胺)水溶液表面水分子的羟基伸缩振动随无机盐种类的变化,发现SCN-因其体积大、极化率高而容易发生去水化,去水化后的SCN-可以直接吸附到PNIPAM表面。Willow等[50]运用Born-Oppenheimer分子动态模拟发现,Chaotropic阴离子(ClO4-)与蛋白质肽段上的带电残基直接发生相互作用,通过破坏残基间的氢键进入残基内部,使蛋白质解折叠。以上研究均对间接作用机理提出了质疑,并且越来越多实验证据表明直接作用是离子与溶质相互作用的主要机理。
近年来,随着乳化型肉制品消费的快速增长,肉制品中蛋白质的乳化特性逐渐成为我国肉品科研领域的研究热点。但在食品健康的大背景下,有关肉制品低盐乳化的研究较少,且主要集中在食盐替代对肉糜产品质构、保油保水性等的影响。Chaotropic离子能够影响肌球蛋白的空间构象,改变其乳化特性,进而对乳化型肉制品的保油保水性产生一定影响。因此,明确Chaotrapic离子改变肌球蛋白空间构象及影响肌球蛋白在脂肪球表面吸附的具体机理有助于改善肉糜凝胶基质的保油保水性。
“结构决定功能”,明确离子引起的蛋白质动态变化有助于理解加工过程中影响肉糜稳定性的因素。因此,有必要分析乳化过程中不同Chaotropic离子诱导下肌球蛋白空间构象的变化规律,确定乳化过程中Chaotropic离子属性如何影响肌球蛋白空间构象变化;同时,建立乳化过程中离子属性、肌球蛋白空间构象及构象重排驱动力三者之间的关系;不仅如此,为了更好地描述蛋白质如何变化,可以利用分子模拟等手段实时表征Chaotropic离子驱动肌球蛋白动态变化的过程,可视化Chaotropic离子诱导肌球蛋白重组装的具体方式,深入了解离子与蛋白质相互作用的机理。
传统乳化理论并没有涉及特殊的离子(如L-组氨酸),因此在肉糜中引入新型离子时,明确该条件下蛋白质的乳化机理尤为重要。因此,可以通过改变Chaotropic离子种类和浓度调控肌球蛋白在脂肪球表面的吸附活动,研究Chaotropic离子种类和浓度对肌球蛋白界面吸附动力学、界面扩张流变性质及乳化稳定性等的影响,从而解析Chaotropic离子诱导肌球蛋白重组影响其在脂肪球表面吸附特性转变的机理,并建立离子驱动肌球蛋白界面构象转变与肌球蛋白界面吸附动力学、界面共组装模式的相互关系,深入了解界面蛋白膜形成机理,完善减盐模式下的乳化理论。
如何在保障肉制品品质及色、香、味的基础上降低盐含量是肉品科学领域需要解决的关键问题之一,虽然L-组氨酸、L-精氨酸等Chaotropic离子与肌球蛋白的相互作用可以为解决这一问题提供新思路,然而,“盐离子-蛋白质构象-蛋白质吸附行为-蛋白质乳化特性”之间的相互关系及其相互影响机理仍需要继续探索。
参考文献:
[1] PEREIRA P M, VICENTE A F. Meat nutritional composition and nutritive role in the human diet[J]. Meat Science, 2013, 93(3): 586-592.DOI:10.1016/j.meatsci.2012.09.018.
[2] DESMOND E. Reducing salt: a challenge for the meat industry[J]. Meat Science, 2006, 74(1): 188-196. DOI:10.1016/j.meatsci.2006.04.014.
[3] LO P N, NINHAM B W. Hofmeister phenomena: an update on ion specif i city in biology[J]. Chemical Reviews, 2012, 112(4): 2286-2322.DOI:10.1021/cr200271j.
[4] DÉR A, KELEMEN L, FÁBIÁN L, et al. Interfacial water structure controls protein conformation[J]. Journal of Physical Chemistry B,2007, 111(19): 5344-5350. DOI:10.1021/jp066206p.
[5] CHEN Xin, ZOU Yufeng, HAN Minyi, et al. Solubilisation of myosin in a solution of low ionic strength L-histidine: significance of the imidazole ring[J]. Food Chemistry, 2016, 196(3): 42-49. DOI:10.1016/j.foodchem.2015.09.039.
[6] GUO X Y, PENG Z Q, ZHANG Y W, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015, 170:212-217. DOI:10.1016/j.foodchem.2014.08.045.
[7] QIN Hao, XU Peng, ZHOU Cunliu, et al. Effects of L-arginine on water holding capacity and texture of heat-induced gel of salt-soluble proteins from breast muscle[J]. LWT-Food Science and Technology,2015, 63(2): 912-918. DOI:10.1016/j.lwt.2015.04.048.
[8] HAYAKAWA T, YOSHIDA Y, YASUI M, et al. Role of heavy meromyosin in heat-induced gelation in low ionic strength solution containing L-histidine[J]. Journal of Food Science, 2015, 80(8):C1641. DOI:10.1111/1750-3841.12958.
[9] HAYAKAWA T, YOSHIDA Y, YASUI M, et al. Heat-induced gelation of myosin in a low ionic strength solution containing L-histidine[J]. Meat Science, 2012, 90(1): 77-80. DOI:10.1016/j.meatsci.2011.06.002.
[10] 邵俊花, 吴菊清, 刘登勇, 等. 肌肉蛋白质乳化凝胶及保油保水性机理研究进展[J]. 食品与发酵工业, 2013, 39(4): 146-150.DOI:10.13995/j.cnki.11-1802/ts.2013.04.042.
[11] JIANG Jiang, XIONG YoulingL.. Role of interfacial protein membrane in oxidative stability of vegetable oil substitution emulsions applicable to nutritionally modif i ed sausage[J]. Meat Science, 2015,109: 56-65. DOI:10.1016/j.meatsci.2015.05.011.
[12] GORDON A, BARBUT S. Mechanisms of meat batter stabilization:a review[J]. Critical Reviews in Food Science and Nutrition, 1992,32(4): 299-332. DOI:10.1080/10408399209527602.
[13] WU Mangang, XIONG YoulingL., CHEN Jie. Role of disulphide linkages between protein-coated lipid droplets and the protein matrix in the rheological properties of porcine myofibrillar protein-peanut oil emulsion composite gels[J]. Meat Science, 2011, 88(3): 384-390.DOI:10.1016/j.meatsci.2011.01.014.
[14] DICKINSON E. Flocculation of protein-stabilized oil-in-water emulsions[J]. Colloids and Surfaces B Biointerfaces, 2010, 81(1): 130-140.DOI:10.1016/j.colsurfb.2010.06.033.
[15] LEE S H, LEFÈVRE T, SUBIRADE M, et al. Changes and roles of secondary structures of whey protein for the formation of protein membrane at soy oil/water interface under high-pressure homogenization[J]. Journal of Agricultural and Food Chemistry, 2007,55(26): 10924-10931. DOI:10.1021/jf0726076.
[16] LEFÈVRE T, SUBIRADE M. Formation of intermolecular beta-sheet structures: a phenomenon relevant to protein fi lm structure at oil-water interfaces of emulsions[J]. Journal of Colloid and Interface Science,2003, 263(1): 59-67. DOI:10.1016/S0021-9797(03)00252-2.
[17] DICKINSON E. Emulsion gels: the structuring of soft solids with protein-stabilized oil droplets[J]. Food Hydrocolloids, 2012, 28(1):224-241. DOI:10.1016/j.foodhyd.2011.12.017.
[18] MEZZENGA R, FISCHER P. The self-assembly, aggregation and phase transitions of food protein systems in one, two and three dimensions[J]. Reports on Progress in Physics Physical Society, 2013,76(4): 046601. DOI:10.1088/0034-4885/76/4/046601.
[19] ZHAI J L, DAY L, AGUILAR M I, et al. Protein folding at emulsion oil/water interfaces[J]. Current Opinion in Colloid and Interface Science, 2013, 18(4): 257-271. DOI:10.1016/j.cocis.2013.03.002.
[20] CHEN X, TUME R K, XU X L, et al. Solubilization of myof i brillar proteins in water or low ionic strength media: classical techniques,basic principles, and novel functionalities[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(15): 3260-3280. DOI:10.1080/104083 98.2015.1110111.
[21] WU Lijun, WU Tao, WU Juqing, et al. Effects of cations on the “salt in” of myof i brillar proteins[J]. Food Hydrocolloids, 2016, 58: 179-183.DOI:10.1016/j.foodhyd.2016.02.028.
[22] CHEN Xing, XU Xinglian, HAN Minyi, et al. Conformational changes induced by high-pressure homogenization inhibit myosin fi lament formation in low ionic strength solutions[J]. Food Research International, 2016, 85: 1-9. DOI:10.1016/j.foodres.2016.04.011.
[23] VERMA A K, BANERJEE R. Low-sodium meat products: retaining salty taste for sweet health[J]. Critical Review in Food Science and Nutrition, 2012, 52(1): 72-84. DOI:10.1080/10408398.2010.498064.
[24] GRAVELLE A J, MARANGONI A G, BARBUT S. Insight into the mechanism of myof i brillar protein gel stability: inf l uencing texture and microstructure using a model hydrophilic fi ller[J]. Food Hydrocolloids,2016, 60: 415-424. DOI:10.1016/j.foodhyd.2016.04.014.
[25] GORDON A, BARBUT S. Effect of chloride salts on protein extraction and interfacial protein film formation in meat batters[J].Journal of the Science of Food and Agriculture, 1992, 58(2): 227-238.DOI:10.1002/jsfa.2740580211.
[26] BARBUT S. Effect of three chloride salts and chopping time on the microstructure and texture of meat batters[J]. Canadian Institute of Food Science and Technology Journal, 1989, 22(3): 284-290.DOI:10.1016/S0315-5463(89)70396-5.
[27] PIGOTT R S, KENNEY P B, SLIDER S, et al. Formulation protocol and dicationic salts affect protein functionality of model system beef batters[J]. Journal of Food Science, 2000, 65(7): 1151-1154.DOI:10.1111/j.1365-2621.2000.tb10256.x.
[28] INGUGLIA E S, ZHANG Z, TIWARI B K, et al. Salt reduction strategies in processed meat products: a review[J]. Trends in Food Science and Technology, 2017, 59: 70-78. DOI:10.1016/j.tifs.2016.10.016.
[29] 吴满刚. 脂肪和淀粉对肌原纤维蛋白凝胶性能的影响机理[D]. 无锡: 江南大学, 2010: 61.
[30] KONG C S, OGAWA H, ISO N. Temperature dependency of compression properties of fi sh-meat gel as affected by added starch[J].Journal of Food Science, 2010, 64(6): 1048-1051. DOI:10.1111/j.1365-2621.1999.tb12279.x.
[31] LIU Jianhua, RU Qiaomei, DING Yuting. Glycation a promising method for food protein modification: physicochemical properties and structure, a review[J]. Food Research International, 2012, 49(1): 170-183.DOI:10.1016/j.foodres.2012.07.034.
[32] KATAYAMA S, SAEKI H. Water solubilization of glycated carp and scallop myosin rods, and their soluble state under physiological conditions[J]. Fisheries Science, 2007, 73(2): 446-452. DOI:10.1111/j.1444-2906.2007.01353.x.
[33] YOUSSEF M K, BARBUT S. Effects of protein level and fat/oil on emulsion stability, texture, microstructure and color of meat batters[J]. Meat Science, 2009, 82(2): 228-233. DOI:10.1016/j.meatsci.2009.01.015.
[34] AMBROSIADIS J, VARELTZIS K P, GEORGAKIS S A. Physical,chemical and sensory characteristics of cooked meat emulsion style products containing vegetable oils[J]. International Journal of Food Science and Technology, 2010, 31(2): 189-194. DOI:10.1111/j.1365-2621.1996.323-26.x.
[35] BARBUT S, WOOD J, MARANGONI A. Potential use of organogels to replace animal fat in comminuted meat products[J]. Meat Science,2016, 122: 155-162. DOI:10.1016/j.meatsci.2016.08.003.
[36] BARBUT S, WOOD J, MARANGONI A. Quality effects of using organogels in breakfast sausage[J]. Meat Science, 2016, 122: 84-89.DOI:10.1016/j.meatsci.2016.08.003.
[37] ASUMINGBEDIAKO N, JASPAL M H, HALLETT K, et al. Effects of replacing pork back fat with emulsif i ed vegetable oil on fatty acid composition and quality of UK-style sausages[J]. Meat Science, 2014,96(1): 187-194. DOI:10.1016/j.meatsci.2013.06.031.
[38] YOUSSEF M K, BARBUT S. Fat reduction in comminuted meat products-effects of beef fat, regular and pre-emulsified canola oil[J]. Meat Science, 2011, 87(4): 356-360. DOI:10.1016/j.meatsci.2010.11.011.
[39] FENG Xiaochao, CHEN Lin, LEI Na, et al. Emulsifying properties of oxidatively stressed myofibrillar protein emulsion gels prepared with(-)-epigallocatechin-3-gallate and NaCl[J]. Journal of Agricultural and Food Chemistry, 2017, 65(13): 2816-2826. DOI:10.1021/acs.jafc.6b05517.
[40] 胡志军, 彭增起, 汪张贵, 等. 肉糜的乳化及斩拌终点的研究进展[J].食品工业科技, 2010(6): 353-357.
[41] 孔保华, 郑冬梅, 刁新平. 斩拌时间和pH值对牛肉凝胶特性的影响[J].食品与发酵工业, 2003, 29(9): 13-16. DOI:10.3321/j.issn:0253-990X.2003.09.004.
[42] 周伟伟, 刘毅, 陈霞, 等. 斩拌终温对乳化型香肠品质影响的研究[J].食品工业科技, 2008, 29(3): 76-78.
[43] JONES K W, MANDIGO R W. Effects of chopping temperature on the microstructure of meat emulsions[J]. Journal of Food Science,1982, 47(6): 1930-1935. DOI:10.1111/j.1365-2621.1982.tb12916.x.
[44] 崔艳飞. 斩拌对肉糜制品乳化特性的影响[D]. 郑州: 河南农业大学,2010: 9.
[45] 李慧敏, 谢月辉, 刘次全, 等. 蛋白质折叠、动力学以及蛋白质-配体结合的物理化学基础[J]. 中国科学: 生命科学, 2014(5): 433-449.DOI:10.1007/s11427-014-4617-2.
[46] SALIS A, NINHAM B W. Models and mechanisms of Hofmeister effects in electrolyte solutions, and colloid and protein systems revisited[J]. Chemical Society Reviews, 2014, 43(21): 7358-7377.DOI:10.1039/c4cs00144c.
[47] GAO Ruichang, WANG Yanmin, MU Jianlou, et al. Effect of L-histidine on the heat-induced aggregation of bighead carp (Aristichthys nobilis) myosin in low/high ionic strength solution[J]. Food Hydrocolloids, 2018, 75: 174-181. DOI:10.1016/j.foodhyd.2017.08.029.
[48] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin is solubilized in a neutral and low ionic strength solution containing L-histidine[J]. Meat Science, 2009, 82(2): 151-154. DOI:10.1016/j.meatsci.2009.01.002.
[49] LEE E, CHOI J H, CHO M. The effect of Hofmeister anions on water structure at protein surfaces[J]. Physical Chemistry Chemical Physics,2017, 19(30): 20008-20015. DOI:10.1039/C7CP02826A.
[50] WILLOW S Y, XANTHEAS S S. Molecular-level insight of the effect of Hofmeister anions on the interfacial surface tension of a model protein[J]. Journal of Physical Chemistry Letters, 2017, 8(7):1574-1577. DOI:10.1021/acs.jpclett.7b00069.
[51] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin filament depolymerizes in a low ionic strength solution containing L-histidine[J]. Meat Science, 2010, 84(4): 742-764. DOI:10.1016/j.meatsci.2009.11.010.
[52] PARRY A D, FRASER D R, SQUIR M J. Fifty years of coiled-coils and alpha-helical bundles: a close relationship between sequence and structure[J]. Journal of Structural Biology, 2008, 163(3): 258-269.DOI:10.1016/j.jsb.2008.01.016.
[53] HOLMES K C. Myosin structure[M]. Dordrecht: Springer, 2008: 35-54.DOI:10.1007/978-1-4020-6519-4_2.
[54] HU Z J, TAYLOR D W, REEDY M K, et al. Structure of myosin fi laments from relaxed Lethocerus fl ight muscle by cryo-EM at 6 Å resolution[J]. Science Advances, 2016, 2(9): e1600058. DOI:10.1126/sciadv.1600058.
[55] FLASHMAN E, WATKINS H C. Localization of the binding site of the C-terminal domain of cardiac myosin-binding protein-C on the myosin rod[J]. Biochemical Journal, 2007, 401(2): 97-102.DOI:10.1042/BJ20060500.
[56] NAKASAWA T, TAKAHASHI M, MATSUZAWA F, et al.Critical regions for assembly of vertebrate nonmuscle myosin Ⅱ[J].Biochemistry, 2005, 44(1): 174-183. DOI:10.1021/bi048807h.
[57] IWASAKI T, YAMAMOTO K. Changes in rabbit skeletal myosin and its subfragments under high hydrostatic pressure[J]. International Journal of Biological Macromolecules, 2003, 33(4/5): 215-220.DOI:10.1016/j.ijbiomac.2003.08.005.
[58] GOTO Y, TAKAHASHI N, FINK A L. Mechanism of acid-induced folding of proteins[J]. Biochemistry, 1990, 29(14): 3480-3488.DOI:10.1021/bi00466a009.
[59] 吴菊清, 邵俊花, 魏朝贵, 等. 离子强度对猪肉肌原纤维蛋白乳化特性和理化特性的影响[J]. 食品科学, 2014, 35(23): 14-19.DOI:10.7506/spkx1002-6630-201423003.
[60] SHAO Junhua, DENG Yamin, JIA Na, et al. Low-field NMR determination of water distribution in meat batters with NaCl and polyphosphate addition[J]. Food Chemistry, 2016, 200: 308-314.DOI:10.1016/j.foodchem.2016.01.013.
[61] SHAO Junhua, DENG Yamin, ZHOU Guanghong, et al. A Raman spectroscopic study of meat protein/lipid interactions at protein/oil or protein/fat interfaces[J]. International Journal of Food Science and Technology, 2015, 50(4): 982-989. DOI:10.1111/ijfs.12695.
[62] SHAO Junhua, ZOU Yufeng, XU Xinglian, et al. Evaluation of structural changes in raw and heated meat batters prepared with different lipids using Raman spectroscopy[J]. Food Research International, 2011, 44(9): 2955-2961. DOI:10.1016/j.foodres.2011.07.003.
[63] ZHANG Ziye, YANG Yuling, TANG Xiaozhi, et al. Effects of ionic strength on chemical forces and functional properties of heat-induced myof i brillar protein gel[J]. Food Science and Technology Research,2015, 21(4): 597-605. DOI:10.3136/fstr.21.597.
[64] FELISBERTO M H F, PICONE C S F, CUNHA R L. Effect of prebiotic ingredients on the rheological properties and microstructure of reduced-sodium and low-fat meat emulsions[J]. LWT-Food Science and Technology, 2015, 60(1): 148-155. DOI:10.1016/j.lwt.2014.08.004.
[65] SPERONI F, SZERMAN N, VAUDAGNA S R. High hydrostatic pressure processing of beef patties: effects of pressure level and sodium tripolyphosphate and sodium chloride concentrations on thermal and aggregative properties of proteins[J]. Innovative Food Science and Emerging Technologies, 2014, 23(3): 10-17.DOI:10.1016/j.ifset.2014.03.011.
[66] KANG Zhuangli, ZOU Yufeng, XU Xinglian, et al. Effect of a beating process, as a means of reducing salt content in Chinese-style meatballs(kung-wan): a physico-chemical and textural study[J]. Meat Science,2014, 96(1): 147-152. DOI:10.1016/j.meatsci.2013.06.019.
[67] YANG Huijuan, HAN Minyi, WANG Xia, et al. Effect of high pressure on cooking losses and functional properties of reduced-fat and reduced-salt pork sausage emulsions[J]. Innovative Food Science and Emerging Technologies, 2015, 29: 125-133. DOI:10.1016/j.ifset.2015.02.013.
[68] COLLINS K D. Ions from the Hofmeister series and osmolytes: effects on proteins in solution and in the crystallization process[J]. Methods,2004, 34(3): 300-311. DOI:10.1016/j.ymeth.2004.03.021.
[69] OMTA A W, KROPMAN M F, WOUTERSEN S, et al. Negligible effect of ions on the hydrogen-bond structure in liquid water[J].Science, 2003, 301: 347-349. DOI:10.1126/science.1084801.
[70] CHEN X, YANG T, KATAOKA S, et al. Specific ion effects on interfacial water structure near macromolecules[J]. Journal of the American Chemical Society, 2007, 129(40): 12272-12279.DOI:10.1021/ja073869r.
Recent Advances in Understanding the Effect of Chaotropic Ions on Emulsifying Properties of Myof i brillar Proteins
LI Ruren, YANG Peng, RONG Liangyan, JIA Na, HE Qing, SHAO Junhua, LIU Dengyong*
(National and Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, College of Food Science and Technology, Bohai University, Jinzhou 121013, China)
Abstract:Excessive salt intake has been increasingly linked to hypertension and consequently increased risk of cardiovascular disease; however, lower salt content will increase quality attributes of emulsion-type meat products, and hence how to avoid such a problem has been one of the research emphases for low-salt meat products. Previous studies demonstrated that the conformation changes of meat batter proteins induced by different salts affects myosin adsorption on the surface of fat globules and ultimately the quality of meat products. In this review, we discuss the effect of the nature of chaotropic ions on the molecular conformation of myosin and the driving forces of conformational transition. It is expected that this review will be helpful for processing high-quality low-salt meat products.
Keywords:myosin; emulsif i cation; salt; fat; chaotropic ions
LI Ruren, YANG Peng, RONG Liangyan, et al. Recent advances in understanding the effect of chaotropic ions on emulsifying properties of myofibrillar proteins[J]. Meat Research, 2018, 32(9): 47-54. DOI:10.7506/rlyj1001-8123-201809009. http://www.rlyj.pub
DOI:10.7506/rlyj1001-8123-201809009. http://www.rlyj.pub
引文格式:李儒仁, 杨鹏, 荣良燕, 等. Chaotropic离子对肌球蛋白乳化特性影响的研究进展[J]. 肉类研究, 2018, 32(9): 47-54.
文章编号:1001-8123(2018)09-0047-08
文献标志码:A
中图分类号:TS251.1
DOI:10.7506/rlyj1001-8123-201809009
*通信作者简介:刘登勇(1979—),男,教授,博士,研究方向为肉品加工及质量控制。E-mail:jz_dyliu@126.com
第一作者简介:李儒仁(1986—),男,副教授,博士,研究方向为肉品加工及质量控制。E-mail:liruren@126.com
基金项目:“十三五”国家重点研发计划重点专项(2018YFD0401200);国家自然科学基金青年科学基金项目(31601489)
收稿日期:2018-07-05