赵茉楠,韩 齐*,俞龙浩,张翼飞,蒋 奕
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
摘 要:对从自然发酵风干肠中分离的6 株乳酸菌的发酵性能进行评价,主要包括测定菌株的生长曲线、产酸能力、对NaCl及NaNO2的耐受能力,同时通过吲哚实验和抗生素敏感性测定对菌株的安全性进行初步评价。结果表明:6 株乳酸菌生长趋势接近,均在8 h左右进入生长稳定期,pH值在0~8 h下降最快,清酒乳杆菌和发酵乳杆菌的产酸能力更强;所有菌株均可在6 g/100 mL NaCl和0.015 g/100 mL NaNO2条件下生长,植物乳杆菌和弯曲乳杆菌的NaCl耐受能力最优,清酒乳杆菌和发酵乳杆菌则对NaNO2具有最强的耐受能力;吲哚实验中6 株乳酸菌的反应结果均为阴性,对实验所选抗生素无耐药性,说明6 株乳酸菌具有较好的发酵性能和安全性,可作为功能性发酵剂用于发酵肉制品的生产。
关键词:发酵肉制品;乳酸菌;发酵性能;发酵剂
发酵作为一种便捷的食品加工及贮藏方式具有改善食品风味、提高营养品质、增强感官特性及延长食品保质期等优点。近年来,随着发酵肉制品消费量的不断增长,肉制品用功能性发酵剂的开发已经成为当前的研究热点。乳酸菌是发酵肉制品中的优势菌群,在发酵过程中可以作为发酵菌株与糖类发生化学反应,产生乳酸和乙酸等物质,并使蛋白质发生降解,产生丰富的氨基酸,使产品具有独特的风味、颜色和质地[1-3]。同时,乳酸菌可以降低发酵过程中产生的有害化学物质(如亚硝酸盐、生物胺等)的含量。段艳[4]的研究也表明,乳酸菌发酵产生的酸性环境有利于亚硝酸盐的分解,对亚硝酸盐含量的降低有促进作用,有助于减少亚硝酸盐的残留量。乳酸菌对腐败菌和致病菌的生长繁殖也具有抑制作用,从而提高产品的安全性和稳定性,延长产品货架期[5]。
乳酸菌作为公认的安全(generally recognized as safe,GRAS)生物,已成为医药和食品生产中使用最广泛的益生菌[6-8],具有抗氧化、免疫调节、减轻炎症性肠病(inflammatory bowel disease,IBD)症状、治疗过敏和某些病毒腹泻以及防止幽门螺杆菌的定殖等功能[9-11]。自然环境[12]、哺乳动物的肠道[13]和发酵食品(发酵肉制品、发酵乳和奶酪)[14-15]都是乳酸菌的良好来源,但是从肉制品中分离的乳酸菌更加适用于发酵肉制品的生产,其发酵性能和风味也要优于其他来源的菌株。赵俊仁[16]、Iboulet-Bisson[17]等已经从发酵香肠中分离出乳酸菌,并对其进行了鉴定。然而,从中国传统发酵香肠中分离乳酸菌的研究报道较少。本研究对前期从天然发酵风干肠中分离出的6 株乳酸菌的发酵性能进行测定,从NaCl耐受能力、NaNO2耐受能力、产酸速率和生长情况方面进行评价,探究它们作为肉制品发酵剂的潜力,为发酵肉制品的生产提供新的发酵菌株和技术支持。
菌种:植物乳杆菌(Lactobacillus plantarum)、弯曲乳杆菌(Lactobacillus curvatus)、清酒乳杆菌(Lactobacillus sake)、发酵乳杆菌(Lactobacillus fermentum)、戊糖片球菌(Pediococcus pentosaceus)和短乳杆菌(Lactobacillus brevis)均分离自自然发酵风干肠,由东北农业大学肉制品实验室分离及保藏。
MRS肉汤培养基 广东环恺微生物科技有限公司;蛋白胨水培养基、Kovacs氏靛基质试剂盒 青岛高科技工业园海博生物技术有限公司;药敏纸片(诺氟沙星、氧氟沙星、环丙沙星、红霉素、阿莫西林、氨苄西林和链霉素) 杭州滨和微生物试剂有限公司;NaCl、NaNO2等均为国产分析纯。
Specord 210 plus紫外-可见分光光度计 德国耶拿分析仪器有限公司;Seven Multi pH S40综合测试仪 瑞士梅特勒-托利多仪器有限公司;LDZX-50 KBS立式压力蒸汽灭菌器 上海电安医疗器械厂;SW-CJ-1 FD超净工作台 苏州安泰空气技术有限公司;SHP-250生化培养箱 上海森信实验仪器有限公司;BCD-439wkk1FYM电冰箱 海信容声(广东)冰箱有限公司;VORTEX-5漩涡混合器 海门市其林贝尔仪器有限公司。
1.3.1 菌株生长曲线及pH值测定
将活化后的6 株乳酸菌以3%接种量分别接种于无菌MRS肉汤培养基中,37 ℃条件下培养24 h,每隔4 h取发酵液,测定其600 nm波长处的吸光度(A)及pH值。以空白MRS液体培养基作为对照,绘制菌株生长曲线及pH值变化曲线。
1.3.2 菌株NaCl耐受能力测定
将活化后的6 株乳酸菌以3%接种量分别接种于NaCl质量浓度为0、2、4、6 g/100 mL的无菌MRS肉汤培养基中,37 ℃条件下培养24 h后取发酵液,测定其600 nm波长处的吸光度,按照公式(1)计算存活率。
式中:A1为NaCl质量浓度为2、4、6 g/100 mL时的吸光度;A0为NaCl质量浓度为0 g/100 mL时的吸光度。
1.3.3 菌株NaNO2耐受能力测定
将活化后的6 株乳酸菌以3%接种量分别接种于NaNO2质量浓度为0、0.005、0.010、0.015 g/100 mL的无菌MRS肉汤培养基中,37 ℃条件下培养24 h后取发酵液,测定其600 nm波长处的吸光度。按照公式(2)计算存活率。
式中:A1为NaNO2质量浓度为0.005、0.010、0.015 g/100 mL时的吸光度;A0为NaNO2质量浓度为0 g/100 mL时的吸光度。
1.3.4 吲哚实验
无菌条件下,将活化后的6 株乳酸菌以3%的接菌量分别接种于蛋白胨水培养基中,37 ℃条件下培养72 h,加入吲哚试剂8~10 滴,同时用大肠杆菌(Escherichia coli)做空白实验,观察实验结果。
1.3.5 菌株对抗生素的敏感性实验
采用平板药敏纸片扩散法对乳酸菌的抗生素敏感性表型进行评价,分别检测对诺氟沙星、氧氟沙星、环丙沙星、红霉素、阿莫西林、氨苄西林和链霉素的敏感性。将不同药敏纸片放置于涂布乳酸菌的固体平板上,以无菌水纸片作为对照。将培养皿置于37 ℃条件下培养24 h,测量药敏纸片周围光圈的大小。
所有实验均重复测定3 次,每个处理组做3 个平行,数据表示为平均值±标准差。采用Statistix 8.1软件进行数据统计分析,差异显著性分析(P<0.05)采用Tukey HSD程序进行;采用Sigmaplot 12.5作图软件绘图。
用作肉制品发酵剂的乳酸菌要求具有较强的生长繁殖能力,乳酸菌在快速生长繁殖过程中产生的乳酸和细菌素等可以降低发酵肉制品的pH值和亚硝酸盐含量,减缓甚至阻止N-亚硝胺的形成,并抑制发酵香肠中腐败菌的生长[18]。
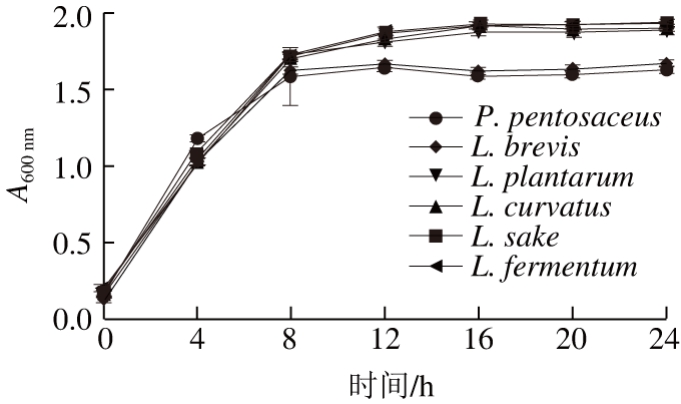
图 1 乳酸菌的生长曲线
Fig. 1 Growth curves of lactic acid bacteria
由图1可知,6 株乳酸菌的生长曲线总体趋势相似。在0~8 h以内菌株迅速生长繁殖,菌体浓度显著增加(P<0.05),戊糖片球菌和短乳杆菌8 h后生长趋于平缓,进入稳定生长期,植物乳杆菌、弯曲乳杆菌、清酒乳杆菌和发酵乳杆菌在8 h后生长均呈现小幅度上升,12 h后生长趋于平缓。植物乳杆菌、弯曲乳杆菌、清酒乳杆菌和发酵乳杆菌的菌体浓度略高于戊糖片球菌和短乳杆菌,说明植物乳杆菌、弯曲乳杆菌、清酒乳杆菌和发酵乳杆菌的生长情况较好。李利等[19]研究得出,L. plantarum SN1在生长2 h后进入对数期,16 h后达到稳定期,与本研究结果基本一致。
pH值是监测肉类发酵程度的重要参数[20]。乳酸菌可以在发酵过程中产生大量的有机酸(主要是乳酸)和其他代谢物,这是导致发酵产品pH值降低的主要原因。酸性环境不仅对乳酸菌的抑菌活性起到重要的作用,对亚硝胺的积累也有显著影响,氨基酸脱羧酶阴性启动子培养物会使pH值快速下降,羧化酶阳性细菌的生长受限,导致发酵香肠中亚硝胺的积累量降低[21]。

图 2 乳酸菌生长过程中的pH值变化
Fig. 2 Changes in pH value during growth of lactic acid bacteria
由图2可知,6 株乳酸菌培养24 h期间的pH值变化趋势相似。0~8 h,乳酸菌发酵液pH值显著下降(P<0.05),由6.0下降至4.2左右,这是由于在此期间菌株处于对数生长期,代谢旺盛,生长繁殖较快,分解糖类物质产生大量乳酸,使pH值迅速降低。其中,戊糖片球菌和短乳杆菌发酵液的pH值下降最快。12 h后各菌株的产酸速率趋于平缓,发酵液的pH值为3.9左右。从产酸角度来看,清酒乳杆菌和发酵乳杆菌的pH值呈现下降趋势且下降程度最大,产酸性能最好。Gao Yurong等[22]的研究也表明,乳酸菌产生的代谢产物的抑菌作用在pH值小于5.5时更有效。Lee等[23]从泡菜中分离出的弯曲乳杆菌、植物乳杆菌和清酒乳杆菌在发酵香肠的生产过程中表现出相对良好的应用潜力,具有较好的生长能力和产酸能力,与本研究结果一致。乳酸菌具有较强的产酸能力有助于保证发酵肉制品的安全性。
NaCl是发酵肉制品中必不可少的添加物,在发酵肉制品中添加一定量的NaCl可赋予产品良好的感官和质构品质,并具有防腐保鲜的作用[24-26]。发酵肉制品生产中NaCl的添加量通常为2.5~3.0 g/100 mL,但随着发酵的进行,产品水分活度降低,NaCl含量会有不同程度的升高,因此,作为肉制品发酵剂使用的乳酸菌需要耐受一定浓度的食盐[27],本研究使用的NaCl质量浓度最大为6 g/100 mL。
表 1 乳酸菌在不同质量浓度NaCl下的存活率
Table 1 Survival rates of lactic acid bacteria at different concentrations of NaCl%
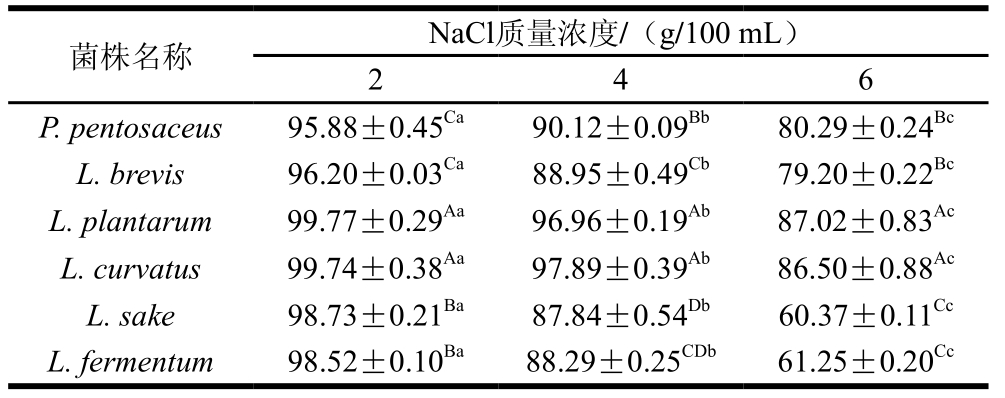
注:同行小写字母不同,表示同一菌株、不同NaCl质量浓度间差异显著(P<0.05);同列大写字母不同,表示不同菌株、相同NaCl质量浓度间差异显著(P<0.05)。
由表1可知:随着培养基中NaCl质量浓度的增加,6 株乳酸菌的存活率均显著下降(P<0.05);当NaCl的质量浓度为2 g/100 mL时,植物乳杆菌和弯曲乳杆菌的存活率最高,可达99.77%左右,其他菌株的存活率也均在95%以上;当NaCl的质量浓度为4 g/100 mL时,植物乳杆菌和弯曲乳杆菌的存活率仍显著高于其他菌株,可达97%左右,其他菌株的存活率均在87%以上,表明NaCl的质量浓度为4 g/100 mL时已经显著影响乳酸菌的生长(P<0.05);当NaCl的质量浓度达到6 g/100 mL时,植物乳杆菌和弯曲乳杆菌的存活率仍可达86%以上,清酒乳杆菌和发酵乳杆菌的存活率最低,约为60%左右,表明此时各菌株的生长受到较大程度的抑制,但仍能生长。因此,植物乳杆菌和弯曲乳杆菌具有较高的NaCl耐受能力,其他乳酸菌的生长虽然受到不同质量浓度NaCl的抑制,但也可以保持一定程度的生长。Drosinos等[28]从一种希腊发酵香肠中分离出107 株植物乳杆菌、21 株弯曲乳杆菌和12 株清酒乳杆菌,并对其进行耐盐性实验,发现清酒乳杆菌、植物乳杆菌和弯曲乳杆菌能够耐受8 g/100 mL的食盐,与本研究结果基本一致。
亚硝酸钠作为肉类加工过程中重要成分,可与肌红蛋白反应形成亚硝基肌红蛋白,是肉制品形成特征粉红色的原因,亚硝酸钠还具有抑制有害微生物、延缓脂质氧化和形成肉类特殊风味的重要作用[29]。乳酸菌具有硝酸盐和亚硝酸盐还原酶活性的能力是筛选用于发酵香肠生产发酵剂的选择标准之一[30]。GB 2760—2014《食品安全国家标准 食品添加剂使用标准》规定,亚硝酸盐在肉制品的最大使用量为0.015 g/100 mL,因此,作为肉制品发酵剂的乳酸菌必须能够耐受一定质量浓度的亚硝酸盐,否则亚硝酸盐的加入会抑制发酵微生物的生长繁殖,影响正常发酵。
表 2 乳酸菌在不同质量浓度NaNO2下的存活率
Table 2 Survival rates of lactic acid bacteria at different concentrations of NaNO2%
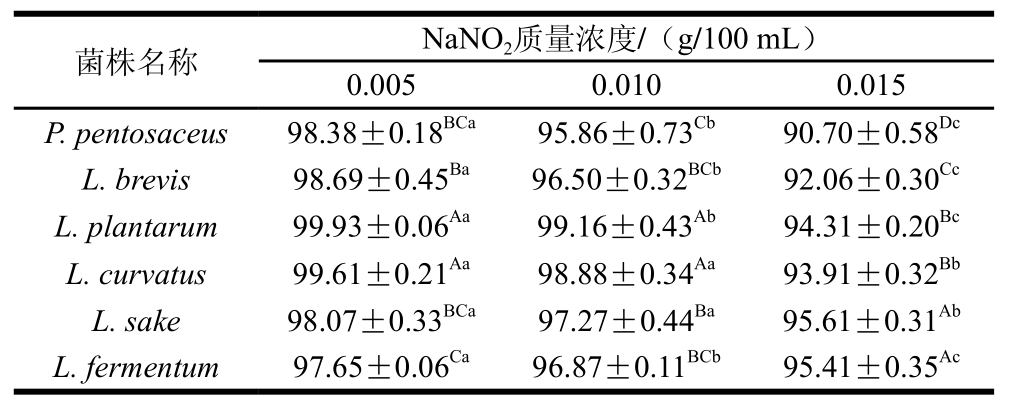
注:同行小写字母不同,表示同一菌株、不同NaNO2质量浓度间差异显著(P<0.05);同列大写字母不同,表示不同菌株、相同NaNO2质量浓度间差异显著(P<0.05)。
由表2可知,随着NaNO2质量浓度的增加,6 株乳酸菌的生长均受到显著抑制(P<0.05),并且菌株之间也具有显著差异(P<0.05)。当NaNO2质量浓度为0.005 g/100 mL时,各菌株耐受能力均较强,植物乳杆菌和弯曲乳杆菌的存活率高达99%以上,其他菌株均在97%左右;当NaNO2质量浓度为0.010 g/100 mL时,植物乳杆菌和弯曲乳杆菌的存活率仍在98%以上,相比其他菌株仍具有较高的耐受性,除了弯曲乳杆菌和清酒乳杆菌的存活率随着NaNO2质量浓度的增加未发生显著变化外,其他菌株均显著下降(P<0.05);当NaNO2质量浓度为0.015 g/100 mL时,不同质量浓度的亚硝酸盐对各菌株的影响与质量浓度0.010 g/100 mL相比显著降低(P<0.05),清酒乳杆菌和发酵乳杆菌的存活率在95%左右。以上结果表明,6 株乳酸菌在不同质量浓度亚硝酸盐条件下的生长能力显著下降,但仍能生长,表明分离的乳酸菌具有良好的亚硝酸盐耐受性,可作为肉制品发酵剂使用。
向培养好的菌液中滴加指示剂后,E.coli空白组的蛋白胨水培养基上部出现红色圆环,6 株乳酸菌菌株(L. plantarum、L. curvatus、L. sake、L. fermentum、P. pentosaceus、L. brevis)的吲哚实验结果均呈阴性,蛋白胨水培养基上部出现黄色圆环,说明未产生吲哚类物质。吲哚实验可以检测菌株是否能分解蛋白质中的色氨酸。色氨酸为人体必需氨基酸,参与人体蛋白质合成、调节免疫功能和促进消化。色氨酸代谢过程发生障碍会引起肝功能衰退、恶性肿瘤等疾病。吲哚实验结果表明,6 株乳酸菌菌株不会分解色氨酸产生吲哚。
表 3 乳酸菌对6 种抗菌药的敏感性
Table 3 Sensitivity of lactic acid bacteria to six antimicrobial agents
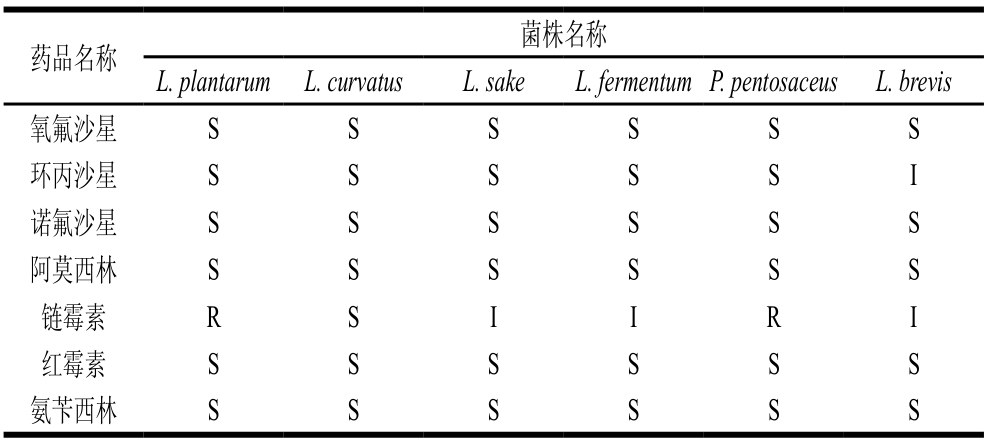
注:S. 敏感;I. 中度敏感;R. 耐药。
由表3可知:6 株乳酸菌对氧氟沙星、诺氟沙星、阿莫西林(青霉素类药物)、红霉素(大环内酯类药物)和氨苄西林均敏感;除短乳杆菌对环丙沙星中度敏感外,其余菌株均为敏感;植物乳杆菌和戊糖片球菌对链霉素(氨基糖苷类药物)有抗性,清酒乳杆菌、发酵乳杆菌和短乳杆菌对链霉素中度敏感,其余菌株对链霉素均敏感。
本研究对分离自自然发酵风干肠的6 株乳酸菌的产酸能力、生长曲线、对NaCl及NaNO2的耐受能力进行评价,结果表明:植物乳杆菌、弯曲乳杆菌、清酒乳杆菌和发酵乳杆菌的生长情况更好,清酒乳杆菌和发酵乳杆菌的pH值在发酵过程中下降最快且程度最大,产酸性能最好;植物乳杆菌和弯曲乳杆菌具有较强的NaCl耐受能力,清酒乳杆菌和发酵乳杆菌具有较强的NaNO2耐受能力;同时通过体外安全性实验中的吲哚实验和耐药性检测,初步证明了6 株乳酸菌的安全性,它们均可以作为潜在的肉制品发酵剂应用于发酵肉制品的生产中。
参考文献:
[1] 张国华, 何国庆. 传统发酵食品中乳酸菌多样性及其功能特性[J]. 中国食品学报, 2013, 13(9): 174-181. DOI:10.16429/j.1009-7848.2013.09.035.
[2] 龙强, 聂乾忠, 刘成国. 发酵肉制品功能性发酵剂研究现状[J].食品科学, 2016, 37(17): 263-269. DOI:10.7506/spkx1002-6630-201617044.
[3] 曹振辉, 刘永仕, 潘洪彬, 等. 乳酸菌的益生功能及作用机制研究进展[J]. 食品工业科技, 2015, 36(24): 366-370. DOI:10.13386/j.issn1002-0306.2015.24.072.
[4] 段艳. 乳酸菌的筛选及其对羊肉干发酵香肠品质特性的影响[D]. 呼和浩特: 内蒙古农业大学, 2013: 46-58.
[5] SWETWIWATHANA A, VISESSANGUAN W. Potential of bacteriocin-producing lactic acid bacteria for safety improvements of traditional Thai fermented meat and human health[J]. Meat Science,2015, 109: 101-105. DOI:10.1016/j.meatsci.2015.05.030.
[6] MORALES-ALAMO D, CALBET J A L. Free radicals and sprint exercise in humans[J]. Free Radical Research, 2014, 48(1): 30-42.DOI:10.3109/10715762.2013.825043.
[7] 雷欣宇, 曾凡坤, 康建平, 等. 乳酸菌的生理功能及其食用制剂制备技术进展[J]. 食品与发酵科技, 2012, 48(2): 5-8. DOI:10.3969/j.issn.1674-506X.2012.02.002.
[8] 尹胜利, 杜鉴, 徐晨. 乳酸菌的研究现状及其应用[J]. 食品科技,2012, 37(9): 25-29. DOI:10.13684/j.cnki.spkj.2012.09.069.
[9] 周凌华, 王豪, 王荫榆, 等. 功能性益生乳酸菌的研究进展[J].天然产物研究与开发, 2012, 24(7): 990-997. DOI:10.3969/j.issn.1001-6880.2012.07.030.
[10] HUTCHINGS J B. Food colour and appearance in perspective[J].Springer US: Food Colour and Appearance, 1999: 1-29.
[11] JI K, JANG N Y, KIM Y T. Isolation of lactic acid bacteria showing antioxidative and probiotic activities from kimchi and infant feces[J].Journal of Microbiology and Biotechnology, 2015, 25(9): 1568-1577.DOI:10.4014/jmb.1501.01.077.
[12] MOHAMMADI R, SOHRABVANDI S, MORTAZAVIAN A M. The starter culture characteristics of probiotic microorganisms in fermented milks[J]. Engineering in Life Sciences, 2012, 12(4): 399-409.DOI:10.1002/elsc.2011.00.125.
[13] HUANG Yunghsin, LAI Yingjang, CHOU Chengchun. Fermentation temperature affects the antioxidant activity of the enzyme-ripened sufu, an oriental traditional fermented product of soybean[J]. Journal of Bioscience and Bioengineering, 2011, 112(1): 49-53. DOI:10.1016/j.jbiosc.2011.03.008.
[14] TAMIME A Y . Lactic acid bacteria-microbiological and functional aspects[J]. International Journal of Dairy Technology, 2013, 66(1): 87-94.DOI:10.1111/1471-0307.12000.
[15] FERRANDO V, QUIBERONI A, REINHEMER J, et al. Resistance of functional Lactobacillus plantarum strains against food stress conditions[J]. Food Microbiology, 2015, 48: 63-71. DOI:10.1016/j.fm.2014.12.005.
[16] 赵俊仁, 孔保华. 自然发酵风干肠中乳酸菌的分离与鉴定[J].食品工业科技, 2010(11): 158-160; 324. DOI:10.13386/j.issn1002-0306.2010.11.042.
[17] RIBOULET-BISSON E, STURME M H, JEFFERY I B, et al. Effect of Lactobacillus salivarius bacteriocin Abp118 on the mouse and pig intestinal microbiota[J]. PLoS One, 2012, 7(2): e31113. DOI:10.1016/j.meatsci.2016.04.004.
[18] WORAPRAYOTE W, MALILA Y, SORAPUKDEE S, et al.Bacteriocins from lactic acid bacteria and their applications in meat and meat products[J]. Meat Science, 2016, 120: 118-132.DOI:10.1371/journal.pone.0031113.
[19] 李利, 孔丽, 张宁, 等. 耐酸耐胆盐乳酸菌的鉴定及筛选[J]. 食品科学, 2015, 36(21): 123-128. DOI:10.7506/spkx1002-6630-2015.21.024.
[20] MATARAGAS M, RANTSIOU K, ALESSANDRIAl V, et al.Estimating the non-thermal inactivation of Listeria monocytogenes in fermented sausages relative to temperature, pH and water activity[J]. Meat Science, 2015, 100(1): 171-178. DOI:10.1016/j.meatsci.2014.10.016.
[21] 王梦姣, 李少英, 李淑芬, 等. 马奶及其制品中肠球菌属乳酸菌的安全性评价[J]. 食品科学, 2014, 35(17): 204-208. DOI:10.7506/spkx1002-6630-2014.17.039.
[22] GAO Yurong, LI Dapeng, LIU Xiaoyan. Effects of Lactobacillus sakei C2 and sakacin C2 individually or in combination on the growth of Listeria monocytogenes, chemical and odor changes of vacuum-packed sliced cooked ham[J]. Food Control, 2015, 47: 27-31. DOI:10.1016/j.foodcont.2014.06.031.
[23] LEE J Y, KIM C J, KUNZ B. Identification of lactic acid bacteria isolated from kimchi, and studies on their suitability for application as starter culture in the production of fermented sausages[J]. Meat Science, 2006, 72(3): 437-445. DOI:10.1016/j.meatsci.2005.08.013.
[24] 顾瑞霞, 谭东兴, 郭久和, 等. 胆汁酸盐和低pH值对乳酸菌活性的影响[J]. 微生物学通报, 1996, 23(3): 144-146. DOI:10.13344/j.microbiol.china.1996.03.005.
[25] 张平, 杨勇, 巩洋, 等. 食盐用量对四川腊肉加工及贮藏过程中肌内脂肪变化的影响[J]. 食品工业科技, 2014, 35(13): 327-331.DOI:10.13386/j.issn1002-0306.2014.13.062.
[26] 刘宏宇, 汪立平, 艾连中, 等. 乳酸菌的抗氧化活性和耐酸耐胆盐性能的研究[J]. 食品工业科技, 2014, 35(2): 92-96. DOI:10.13386/j.issn1002-0306.2014.02.075.
[27] 蔡鲁峰, 杜莎, 谭雅, 等. 乳酸菌肉品发酵剂的发酵特性研究[J]. 食品工业科技, 2015, 36(17): 150-155. DOI:10.13386/j.issn1002-0306.2015.17.022.
[28] DROSINOS E H, MATARAGAS M, XIRAPHI N, et al.Characterization of the microbial flora from a traditional Greek fermented sausage[J]. Meat Science, 2005, 69(2): 307-317.DOI:10.1016/j.meatsci.2004.07.012.
[29] SEBRANEK J G, BACUS J N. Cured meat products without direct addition of nitrate or nitrite: what are the issues[J]. Meat Science,2007, 77(1): 136-147. DOI:10.1016/j.meatsci.2007.03.025.
[30] AMMOR M S, MAYO B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production:an update[J]. Meat Science, 2007, 76(1): 138-146. DOI:10.1016/j.meatsci.2006.10.022.
Fermentation Properties of Lactic Acid Bacteria Isolated from Harbin Dry Sausages
ZHAO Monan, HAN Qi*, YU Longhao, ZHANG Yifei, JIANG Yi(College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
Abstract:The fermentation properties of 6 strains of lactic acid bacteria (LAB) isolated from Harbin dry sausages were evaluated in this study including growth curve, acidification rate and tolerance to salt and nitrite. Safety evaluation was also carried out by indole test and antibiotic susceptibility test. The results showed that the growth curves of the 6 strains were similar; the stationary phase began at about 8 h. The pH value of fermentation broth decreased most rapidly during the fi rst 8 h of fermentation, and Lactobacillus sake and Lactobacillus fermentum exhibited the highest acid producing ability among the LAB isolates. All these strains were tolerant to 6 g/100 mL of NaCl and 0.015 g/100 mL of NaNO2; Lactobacillus plantarum and Lactobacillus curvatus demonstrated the best tolerance to NaCl, while L. sake and L. fermentum exhibited the best tolerance to NaNO2. The results of indole test were negative for all the LAB strains and they showed no resistance to any of the tested antibiotics. So, the LAB isolated from Harbin dry sausages possessed good fermentation characteristics and safety and hence could be useful as a good starter culture for fermented meat products.
Keywords:fermented meat products; lactic acid bacteria; fermentation properties; starter culture
ZHAO Monan, HAN Qi, YU Longhao, et al. Fermentation properties of lactic acid bacteria isolated from Harbin dry sausages[J]. Meat Research, 2018, 32(9): 13-17. DOI:10.7506/rlyj1001-8123-201809003. http://www.rlyj.pub
引文格式:赵茉楠, 韩齐, 俞龙浩, 等. 发酵风干肠中乳酸菌的发酵性能[J]. 肉类研究, 2018, 32(9): 13-17. DOI:10.7506/rlyj1001-8123-201809003. http://www.rlyj.pub
文章编号:1001-8123(2018)09-0013-05
文献标志码:A
中图分类号:TS251.5
DOI:10.7506/rlyj1001-8123-201809003
*通信作者简介:韩齐(1988—),女,讲师,博士,研究方向为肉制品加工及安全控制。E-mail:hanqihappy@foxmail.com
第一作者简介:赵茉楠(1993—),女,硕士研究生,研究方向为食品科学。E-mail:1298700740@qq.com
基金项目:黑龙江八一农垦大学青年创新人才项目(CXRC2017012)
收稿日期:2018-05-15