表1 响应面设计因素编码及水平
Table 1 Codes and levels of independent variables used in response surface methodology
谢 晶 1,2 ,尹义捐 1 ,杨欲成 1 ,金晨钟 1,2, *,王双辉 1,2 ,卢 超 1
(1.湖南人文科技学院农业与生物技术学院,湖南 娄底 417000;2. 湖南人文科技学院,湖南省农田杂草防控技术与应用协同创新中心,湖南 娄底 417000)
摘 要: 采用麻阳鹅鹅全骨为原料,以硫酸软骨素(chondroitin sulfate,CS)的提取率为指标,对运用碱提、复合酶解、醇沉法提取CS的工艺进行研究,确定使用胃蛋白酶进行酶解后,通过单因素试验和响应面优化试验,应用Box-Behnken实验设计建立二次多项式数学模型,进行响应面分析,确定胃蛋白酶酶解提取CS的最佳工艺参数。结果表明:碱提、复合酶解、醇沉法胃蛋白酶酶解提取鹅全骨CS的最佳工艺为加酶量1.55 g/L、酶解时间6.4 h、酶解温度42 ℃、pH值3.09,在此条件下CS的提取率为12.13%;通过高效液相色谱测定可知,提取物为CS和盐酸氨基葡萄糖。
关键词: 鹅全骨;硫酸软骨素;碱提;复合酶解;醇沉法;胃蛋白酶;响应面优化
我国的畜骨和禽骨资源极为丰富,但是由于技术水平的限制,对这一优质营养资源的利用却很落后。我国对畜禽骨的深加工利用率不足1%,造成许多畜禽骨的极度浪费,一般只能将其丢弃或是加工成商品附加值不高的产品,如简单的骨粉、骨泥、饲料和食品调味料等 [1-2] 。鹅骨是一种营养价值非常高的畜禽屠宰加工副产品,在动物体中约占25%,骨骼中90%的蛋白为胶原、骨胶原及软骨素等。但鹅骨在我国畜禽骨开发利用中所占比例较小,随着我国对硫酸软骨素的需求不断增大,从鹅骨中提取硫酸软骨素的研究有着重要意义 [3-4] 。
硫酸软骨素(chondroitin sulfate,CS)是具有硫酸基、羧基和乙酰基的一类糖胺聚糖 [5-6] ,广泛存在于动物软骨、骨、肌腱、肌膜和血管壁中 [7] ,具有增加骨密度 [8] 、促进神经细胞分裂与发育 [9] 、消炎 [10] 等功能。CS具有降血脂、抗肿瘤、抗病毒、抗氧化、提高免疫力等多种药理活性,能够防止动物和人体的动脉硬化,且能防治冠状动脉心脏病的发作 [11-12] 。在国外,用鲨鱼硫酸软骨素来治疗和预防癌症及疑难症,效果明显。随着对CS生理功能及其生化性质的深入研究,在国外CS已成为流行的保健品添加剂,也常作为膳食补充剂用于保护关节 [13-15] 。目前有不少工厂生产CS,但大多采用浓碱法、稀碱法、中性盐法等传统工艺,精制工艺往往要经过除杂、脱色等过程,工艺控制繁琐,因而质量不稳定、收率降低,而且碱、盐易对环境造成污染 [16-19] 。
本研究以麻阳鹅鹅全骨为原料,采取碱提-酶解-醇沉的方法制备CS,重点对酶解这一直接影响CS提取率的关键步骤进行优化研究,以提取率为评价指标,在单因素试验的基础上优化工艺,通过响应面优化分析法最终确定最佳工艺参数。本研究拟通过对鹅全骨CS的提取工艺研究,提高其应用发展前景和经济价值,为其进一步研究和综合利用提供参考。
鹅全骨由湖南省怀化市麻阳县怀化苗家王食品有限公司提供。
木瓜蛋白酶(≥800 000 U/g) 上海瑞永生物科技有限公司;胃蛋白酶(≥12 000 U/g)、胰蛋白酶(≥50 000 U/g) 国药集团化学试剂有限公司;硫酸软骨素A(chondroitin sulfate A,CSA)标准品(纯度≥98.0%)、盐酸氨基葡萄糖标准品(纯度≥99.0%) 上海源叶生物科技有限公司;所有分离用有机溶剂均为国产分析纯。
KQ-250DE数控超声波清洗器 昆山市超声仪器有限公司;TG20KR-D高速冷冻离心机 长沙东旺实验仪器有限公司;Waters E2695高效液相色谱仪 美国Waters公司。
1.3.1 CS的制备工艺流程
鹅骨高温蒸煮→清洗→干燥→粉碎→碱提→过滤→滤液调pH值→加胰蛋白酶酶解→酶灭活→调pH值→加蛋白酶→酶灭活→过滤→滤液加入高岭土、活性炭脱色→抽滤→调节pH值,加入NaCl→醇沉→离心→乙醇洗涤脱水→干燥→粗成品
1.3.2 CS的制备工艺操作要点
1.3.2.1 高温蒸煮与碱解
将鹅骨投入恒温蒸煮锅于90 ℃煮2~4 h,而后放入电热恒温鼓风干燥箱烘烤6~8 h后立即绞碎;称取5 g鹅骨粉,按照原料与质量分数5% NaOH的比例为1∶6.25(m/V)加入NaOH溶液,室温浸提12 h;然后用超声波辅助提取3 h,再用2 mol/L HCl调pH值至6.0~6.8,双层纱布过滤;留下滤液,滤渣再以1∶0.5(m/V)的比例加入质量分数5% NaOH,再用超声波辅助提取1 h,双层滤布过滤;弃滤渣,取滤液,合并2 次滤液,并测量体积,待用。
1.3.2.2 酶解
滤液用2 mol/L HCl调节pH值至8.0~9.0,按照滤液与胰蛋白酶1 000∶1.5(V/m)的比例加入胰蛋白酶,于40~50 ℃水解2 h后,于90 ℃恒温水浴20 min灭活;调节水解液pH值至2.0~4.0,再按1 000∶1.5(V/m)的比例加入胃蛋白酶,40~50 ℃水解4 h;水解完毕后用4 层纱布过滤,并加入高岭土和活性炭(使其终质量分数均为0.5%)进行吸附,同时慢速间歇搅拌4 h或快速升温至90 ℃后间歇搅拌30 min,冷却后抽滤。
1.3.2.3 沉淀
将1.3.2.2节所得滤液调节pH值至6.8~7.2,加入NaCl使其质量分数为3%,再加入2.5 倍体积的体积分数95%乙醇沉淀;待澄清后,弃清液,用体积分数95%的乙醇洗涤沉淀3~4 次,6 000 r/min条件下离心10~15 min,收集沉淀,沉淀物即为CS粗成品。
1.3.2.4 干燥
将上述沉淀物放入电热恒温鼓风干燥箱,于60~80 ℃直接烘干即得粗成品。
1.3.3 实验设计
1.3.3.1 蛋白酶种类的选择
全骨原料表面有很多残存的肌肉和其他结缔组织,还有一层坚韧的软骨膜,它们的存在会影响CS的提取率和纯度。由于全骨中的杂质主要成分为蛋白质,因此选择蛋白酶对全骨进行酶解。
在文献[20-23]的基础上,以蛋白质去除率和CS提取率为指标,筛选最佳酶解蛋白酶。为进一步了解不同种酶对鹅全骨中CS提取率的影响,对木瓜蛋白酶、胰蛋白酶和胃蛋白酶在各自的最佳水解条件下进行实验,对比它们对蛋白质的去除效果和CS提取率。
1.3.3.2 胃蛋白酶酶解条件单因素试验设计
以提取率为指标,对胃蛋白酶的酶解条件进行优
表1 响应面设计因素编码及水平
Table 1 Codes and levels of independent variables used in response surface methodology

1.3.4 指标测定
1.3.4.1 蛋白质去除率
蛋白质去除率按照公式(1)计算。化,对胃蛋白酶加酶量、酶解时间、酶解温度和pH值4 个因素进行单因素试验 [24] 。
将胰蛋白酶处理后的酶解液用胃蛋白酶处理,酶解时间为6 h,酶解温度为45 ℃,pH值为3.0,胃蛋白酶加酶量分别为0.5、1.0、1.5、2.0、2.5 g/L时,考察胃蛋白酶加酶量对CS提取率的影响。
将胰蛋白酶处理后的酶解液用胃蛋白酶处理,酶解时间分别为2、4、6、8、10 h,酶解温度为45 ℃,pH值为3.0,胃蛋白酶加酶量为1.5 g/L时,考察酶解时间对CS提取率的影响。
将胰蛋白酶处理后的酶解液用胃蛋白酶处理,酶解时间为6 h,酶解温度分别为35、40、45、50、55 ℃,pH值为3.0,胃蛋白酶加酶量为1.5 g/L时,考察酶解温度对CS提取率的影响。
将胰蛋白酶处理后的酶解液用胃蛋白酶处理,酶解时间为6 h,酶解温度为45 ℃,pH值分别为2.0、2.5、3.0、3.5、4.0,胃蛋白酶加酶量为1.5 g/L时,考察酶解pH值对CS提取率的影响。
1.3.3.3 响应面优化试验设计
利用响应面法对酶解过程中影响CS提取率的因素及因素间的交互影响进行优化 [25-26] ,即根据Box-Benhnken试验设计原理,结合单因素试验结果,选取胃蛋白酶加酶量(A)、酶解时间(B)、酶解温度(C)和pH值(D),进行4因素3水平试验,利用响应面法分析影响胃蛋白酶水解的主次因素,得出该阶段的最佳工艺条件。响应面设计因素编码及水平如表1所示。
1.3.4.2 总氮含量
酶解液中总氮含量、酶解前碱提液中总氮含量的测定:采用凯氏定氮法 [27] 。
1.3.4.3 CS提取率
CS提取率按照公式(2)计算。
式中:m为提取所得CS粗品的质量/g;m 0 为鹅骨原料质量/g。
1.3.4.4 定性及定量分析
称取25.0 mg经105 ℃干燥4 h的CS标准品和25.0 mg盐酸氨基葡萄糖或样品于烧杯中,加入5.0 mL乙腈,振荡使其分散均匀,再加入水,用超声波使其溶解;转移至50 mL容量瓶中,用水定容至刻度,摇匀,CS质量浓度约为0.5 mg/mL,盐酸氨基葡萄糖质量浓度约为0.5 mg/mL,样品溶液浓度未知。用Waters E2695高效液相色谱仪(流动相:乙腈-戊烷磺酸钠溶液(体积比10∶90),C 18 色谱柱,流速0.8 mL/min、检测波长192 nm)分别对标准溶液、样品溶液进行测定,记录色谱图,并对样品的色谱图与标准品的色谱图进行对照 [28] 。
数据采用平均值±标准差表示,用Design-Expert 8.0.6.1软件进行方差分析和差异显著性比较。
表2 不同蛋白酶处理时的蛋白质去除率和CS提取率
Table 2 Comparison of protein removal and CS extraction with different proteases

由表2可知,3 种酶的蛋白质去除率和CS提取率有明显不同,其中以胃蛋白酶的应用效果最好,从蛋白质去除率和CS提取率来看,胃蛋白酶的综合效果最佳。
2.2.1 胃蛋白酶加酶量对CS提取率的影响
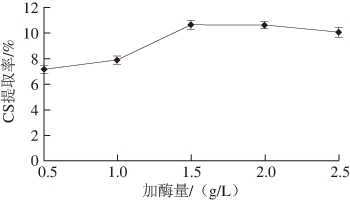
图1 胃蛋白酶加酶量对CS提取率的影响
Fig. 1 Effect of pepsin dosage on extraction yield of CS
由图1可知,在胰蛋白酶加酶量为1.5 g/L,胃蛋白酶加酶量为0.5~1.5 g/L时,CS提取率明显上升,当胃蛋白酶加酶量为1.5 g/L左右时达到极值,之后变化不大。这可能是由于鹅骨中的蛋白质在胰蛋白酶、胃蛋白酶加酶量均为1.5 g/L时水解基本完全,因此胃蛋白酶加酶量为1.5 g/L左右为最佳。
2.2.2 胃蛋白酶酶解时间对CS提取率的影响
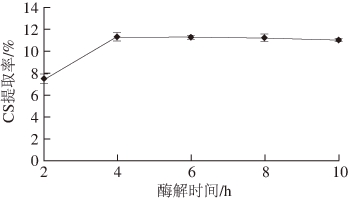
图2 胃蛋白酶酶解时间对CS提取率的影响
Fig. 2 Effect of hydrolysis time on extraction yield of CS
由图2可知,随着胃蛋白酶酶解时间的增加,CS提取率逐渐增大,而在酶解4 h后CS提取率基本没有变化,因此酶解时间4 h为最佳。

图3 胃蛋白酶酶解温度对CS提取率的影响
Fig. 3 Effect of hydrolysis temperature on extraction yield of CS
2.2.3 胃蛋白酶酶解温度对CS提取率的影响由图3可知,CS提取率随胃蛋白酶酶解温度的升高呈上升趋势,但温度超过45 ℃时开始下降。由此可见,酶解温度过高或过低均会影响CS的提取率,这是由于胃蛋白酶在不同温度条件下的酶解程度不一样 [29] 。温度过低时,溶液中分子扩散运动慢,酶没有充分发挥作用;而温度过高时,会对酶产生钝化效用,因此提取鹅全骨中的CS时,酶解温度为45 ℃最佳。
2.2.4 胃蛋白酶酶解pH值对CS提取率的影响
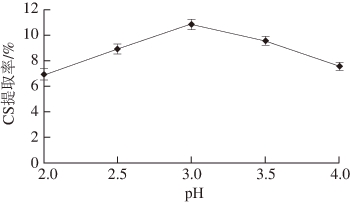
图4 胃蛋白酶酶解pH值对CS提取率的影响
Fig. 4 Effect of hydrolysis pH value on extraction yield of CS
由图4可知,胃蛋白酶酶解pH值对CS提取率的影响较大,这是由于pH值的变化会影响溶液中电荷的分布,直接影响到酶解的效果,因此在酶解过程中应尽量保持pH值的稳定 [30] 。对鹅全骨中CS的提取来说,酶解pH值为3.0时,其提取率最高。
2.3.1 响应面试验结果及其方差分析
在单因素试验基础上,进行4因素3水平的响应面分析,确定酶解的最佳条件,试验方案与结果如表3所示。
表3 Box-Benhnken试验设计及结果
Table 3 Box-Benhnken design and experimental results
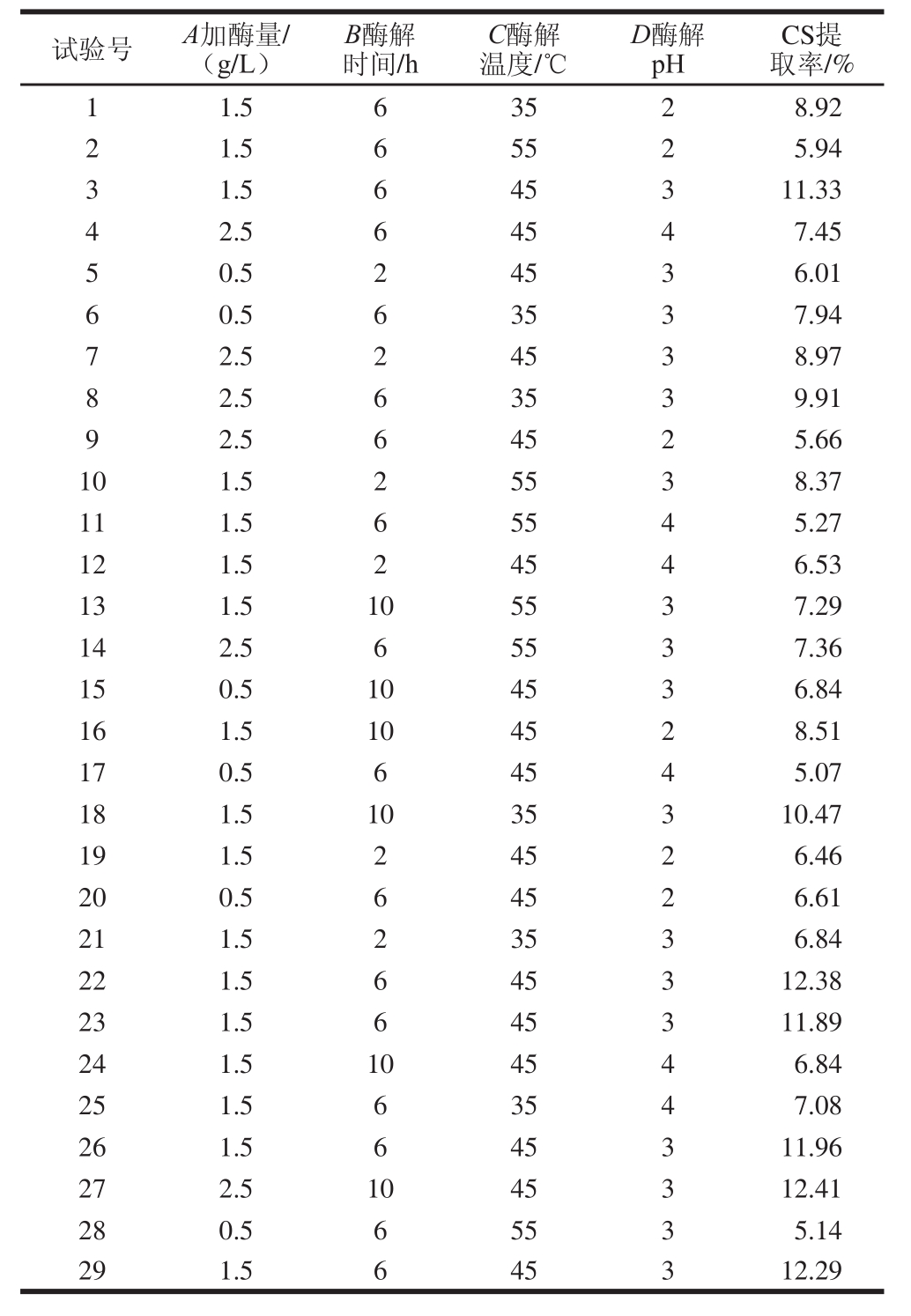
将获得的试验数据采用Design-Expert 8.0.6.1软件进行多元回归拟合,得到胃蛋白酶加酶量(A)、酶解时间(B)、酶解温度(C)和pH值(D)对CS提取率的二次多项式回归模型方程:CS提取率=11.97+1.18A+0.77B-0.98C-0.31D+0.65AB+0.06AC+0.83AD-1.18BC-0.41BD+0.29CD-2.23A 2 -1.45B 2 -2.09C 2 -3.35D 2 。
对该回归模型进行方差分析,并对模型系数进行显著性检验。由表4可知:模型P<0.01,表明响应回归模型达到了极显著水平;失拟项P=0.065 2>0.05,不显著;模型一次项A、C极显著,二次项A 2 、B 2 、C 2 、D 2 极显著,一次项B、交互项AD、BC显著,其余不显著;校正决定系数R 2 Adj 为0.858 2,变异系数为10.97%,大于4%,表明该模型有适当的信号响应;预测复相关系数 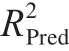 =0.732 6,和校正相关系数
=0.732 6,和校正相关系数 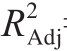 =0.858 2基本符合。上述数据表明,得到的模型与试验数据拟合较好,可直接利用该模型得到胃蛋白酶提取鹅全骨中CS的最佳工艺。
=0.858 2基本符合。上述数据表明,得到的模型与试验数据拟合较好,可直接利用该模型得到胃蛋白酶提取鹅全骨中CS的最佳工艺。
表4 模型的方差分析及显著性检验Table 4 Analysis of variance and signifi cance test of regression model
注:**. 极显著(P<0.01);*. 显著(P<0.05)。
2.3.2 各因素的交互作用分析
响应面的三维图反映出各试验因素的交互作用对响应值的影响并非单一的线性关系,可根据其曲面的不同来判断各试验因素交互作用的强弱。曲面越陡峭,表示因素对响应值的影响越显著;曲面越平整,表示因素对响应值的影响越不显著。通过响应面三维图对胃蛋白酶加酶量(A)和pH值(D)及其交互作用、酶解温度(C)和pH值(D)及其交互作用进行分析与评价,并确定最佳工艺水平范围。

图5 胃蛋白酶加酶量和pH值对CS提取率交互作用的响应曲面图
Fig. 5 Response surface plot showing the interactive effect of pepsin dosage and hydrolysis pH value on extraction yield of CS
由图5可知,在酶解时间为6 h、酶解温度为45 ℃时,当胃蛋白酶酶解pH值较低时,CS提取率随pH值的增大而升高,但当pH值超过3时,CS提取率随pH值的增大而降低。综合分析,在试验正常水平范围内,胃蛋白酶加酶量和pH值分别在1.5~2.0 g/L和2.50~3.50范围内时,CS提取率可以达到最大值。
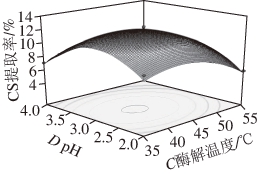
图6 胃蛋白酶酶解温度和pH值对CS提取率交互作用的响应曲面图
Fig. 6 Response surface showing the interactive effect of hydrolysis temperature and pH value on extraction yield of CS
由图6可知,在胃蛋白酶加酶量为1.5 g/L、酶解时间为6 h时,当酶解温度较低时,CS的提取率随温度的升高而增大,但当酶解温度超过45 ℃时,CS提取率随着酶解温度的升高而降低。综合分析,在试验正常水平范围内,酶解温度和pH值分别在40~45 ℃和2.50~3.50范围内时,CS提取率可以达到最大值。
2.3.3 最佳胃蛋白酶酶解提取工艺验证实验
通过模型预测出胃蛋白酶酶解提取CS的最佳工艺为加酶量1.55 g/L、酶解时间6.42 h、酶解温度42.14 ℃、pH值3.09,CS提取率的预测值为12.14%。为了操作方便,把验证实验的提取工艺调整为胃蛋白酶加酶量1.55 g/L、酶解时间6.4 h、酶解温度42 ℃、pH值3.00,进行3 组平行实验,取平均值,得到的实际CS提取率为12.35%,与所预测的最优值无明显差异。
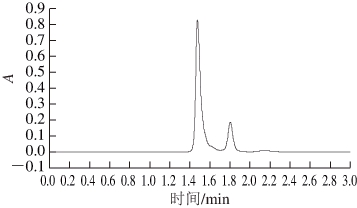
图7 CS标准溶液的高效液相色谱图
Fig. 7 HPLC chromatogram of CS standard solution
由图7~8可知,CS标准品和样品中的CS在高效液相色谱图中的出峰时间基本一致。在Waters E2695高效液相色谱仪分析软件上进行光谱匹配,匹配度达998.992,可确定提取物为CS。
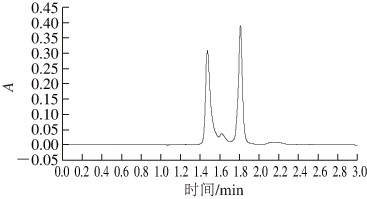
图8 样品中CS的高效液相色谱图
Fig. 8 HPLC chromatogram of CS prepared in this study
以鹅全骨为原料提取CS,在碱提的基础上,采用胰蛋白酶与胃蛋白酶进行分步酶解,并对胃蛋白酶酶解的提取工艺进行优化,得到胃蛋白酶酶解的最佳工艺为加酶量1.55 g/L、酶解时间6.42 h、酶解温度42.14 ℃、pH值3.09,提取率的预测值为12.14%。
对根据响应面优化试验得出的最佳提取工艺进行实验验证,鹅全骨中CS提取率为12%左右。本研究以鹅全骨为原料提取CS的新提取工艺,能更好地利用鹅加工的副产品——鹅全骨,提高资源的合理利用率,为现有CS生产企业提供了改进的生产工艺,为提高产品质量和经济效益及下一步CS的提纯提供了参考。
参考文献:
[1] 尹礼国, 于颖, 徐洲. 鸡骨的综合利用[J]. 肉类工业, 2008, 11(2):8-10.
[2] 李睿, 王海燕, 尚永彪. 鸡骨的综合利用研究进展[J]. 肉类工业,2010, 11(2): 54-56.
[3] 许素文, 谭岸, 金晨钟, 等. 硫酸软骨素脱蛋白工艺优化[J].食品与机械, 2017, 33(7): 184-188. DOI:10.13652/j.issn.1003-5788.2017.07.040.
[4] 吴勤民, 潘道东, 刘琛. 双酶分步水解鹅骨泥工艺的优化[J]. 中国调味品, 2015, 40(6): 27-31. DOI:10.3969/j.issn.1000-9973.2015.06.007.
[5] 熊双丽, 李安林, 金征宇. 猪喉软骨硫酸软骨素体外超氧阴离子自由基清除机理探讨[J]. 食品科学, 2008, 29(2): 362-365.
[6] HE Guidan, YIN Yongguang, YAN Xiaoxia, et al. Optimizsation extraction of chondroitin sulfate fron fish bone by high intensity pulsed electric fields[J]. Food Chemistry, 2014, 164(3): 205-210.DOI:10.1016/j.foodchem.2014.05.032.
[7] 田甲春, 余群力. 胃蛋白酶提取硫酸软骨素工艺优化[J]. 肉类研究,2011, 25(8): 22-25.
[8] 张露勇, 刘婷, 刘师卜. 两种增加骨密度功能保健食品的功效研究[J]. 海军医学杂志, 2016, 37(6): 526-531. DOI:10.3969/j.issn.1009-0754.2016.06.014.
[9] ROBERT M L. Chondroitin sulphate: a complex molecule with potential impacts on a wide range of biological systems[J].Complementary Therapies in Medicine, 2009, 17(1): 56-62.DOI:10.1016/j.ctim.2008.08.004.
[10] 刘宁, 刘雅南, 刘涛, 等. 硫酸软骨素的制备研究及发展现状[J].食品工业科技, 2014, 35(3): 392-395; 400. DOI:10.13386/j.issn1002-0306.2014.03.085.
[11] MORRISON L M, BAJWA G S, ALFIN-SLATER R B, et al.Prevention of vascular lesions by chondroitin sulfate A in the coronary artery and aorta of rats induced by a hypervitaminosis D,cholesterol-containing diet[J]. Atherosclerosis, 1972, 16(1): 105-118.DOI:10.1016/0021-9150(72)90013-5.
[12] MORRISON L M. Reduction of ischemic coronary heart disease by chondroitin sulfate A[J]. Angiology, 1971, 22(3): 165-174.DOI:10.1177/000331977102200308.
[13] 荣晓花. 硫酸软骨素在药品和保健食品中的应用[J]. 山东食品科技,2004, 6(1): 18-19.
[14] HA B J, LEE J Y. The effect of chondroitin sulfate against CCl 4 -induced hepatotoxicity[J]. Biological and Pharmaceutical Bulletin,2003, 26(5): 622-626. DOI:10.1248/bpb.26.622.
[15] WAYNE K W, KATHLEEN G G, ANDREW G B. Determination of chondroitin sulfate innutritional supplements by liquid chromatography[J]. Journal of Liquid Chromatography and Relation Technology, 2007, 23(18): 2851-2860. DOI:10.1081/JLC-100101237.
[16] 陈召国, 杨文革, 胡永红, 等. 响应面法优化猪硫酸软骨素的提取工艺[J]. 食品工业科技, 2011, 36(7): 187-196. DOI:10.13684/j.cnki.spkj.2011.07.050.
[17] 陈晨, 王宝维, 葛文华, 等. 复配酶解法提取鸭硫酸软骨素工艺研究[J]. 中国家禽, 2014, 36(9): 29-34. DOI:10.16372/j.issn.1004-6364.2014.09.009.
[18] 叶琳弘. 鱿鱼软骨中硫酸软骨素的提取、纯化及降血脂活性的研究[D]. 福州: 福建农林大学, 2015: 4-7.
[19] 陈亚. 硫酸软骨素生产工艺的优化研究[D]. 上海: 华东理工大学,2010: 6-10.
[20] 陆雪芹. 鸡胸软骨粉的制备及其对类风湿性关节炎的作用[D]. 无锡: 江南大学, 2008: 14-18.
[21] STURROCK A G O, DEVORE D P. Method for preparation of typeⅡ collagen: US, 5840848[P]. 1998-11-24.
[22] 韩军, 袁信华, 过世东, 等. 从斑点叉尾(鱼回)鱼头中提取明胶的预处理工艺研究[J]. 食品与发酵工业, 2007(12): 88-93. DOI:10.13995/j.cnki.11-1802/ts.2007.12.024.
[23] 吴兰宝, 陈国维, 卫才学. 一种鲨鱼软骨粉胶囊及制备方法: 中国,1201666[P]. 1998-12-16.
[24] 刘魁英. 食品研究常用的试验设计与数据分析方法[J]. 食品科学,2000, 21(12): 103-105.
[25] 王能强, 赵维俊, 梁芳, 等. 聚乙烯醇降解酶生产菌发酵培养基响应面优化研究[J]. 环境科学学报, 2010, 30(6): 81-83. DOI:10.13671/j.hjkxxb.2010.06.018.
[26] YAN R, LI S L, CHUNG H S, et al. Simultaneous quantifi cation of 12 bioactive components of Ligusticum chuanxiong Hort. by high performance liquid chromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2005, 37(1): 87-95. DOI:10.1016/j.jpba.2004.09.054.
[27] 张海德, 胡建. 食品分析[M]. 长沙: 中南大学出版社, 2014: 151-153.[28] 中华人民共和国山东出入境检验检疫局. 硫酸软骨素和盐酸氨基葡萄糖含量的测定液相色谱法: GB/T 20365—2006[S]. 北京: 中国标准出版社, 2006.
[29] GROTJAN H E, Jr, PADRNOS-HICKS P A, KEEL B A. Ion chromatographic method for the analysis of sulfate in complex carbohydrates[J]. Chromatography, 1986, 367(2): 367-375.DOI:10.1016/S0021-9673(00)94857-X.
[30] 宁正祥. 食品成分分析手册[M]. 北京: 中国轻工业出版社, 1998:703-707.
Optimization of Enzymatic Extraction of Chondroitin Sulfate from Goose Bones by Response Surface Methodology
XIE Jing 1,2 , YIN Yijuan 1 , YANG Yucheng 1 , JIN Chenzhong 1,2, *, WANG Shuanghui 1,2 , LU Chao 1
(1.College of Agicuture and Bioteconology, Hunan University of Humanities, Science and Technology, Loudi 417000, China;2.Hunan Provincial Collaborative Innovation Center for Field Weeds Control, Hunan University of Humanities,Science and Technology, Loudi 417000, China)
Abstract: The preparation of chondroitin sulfate (CS) from the bones of Mayang goose was investigated by alkali extraction,sequential enzymatic hydrolysis and ethanol precipitation. Pepsin was selected for the second hydrolysis step (the first hydrolysis step was carried out using trypsin) and hydrolysis conditions were optimized using one-factor-at-a-time method and response surface methodology. The extraction effi ciency of CS was used as response. As a result, a polynomial quadratic regression model was developed using Box-Behnken design. The optimal hydrolysis conditions were determined as follows:enzyme concentration 1.55 g/L, hydrolysis time 6.4 h, temperature 42 ℃ and initial pH 3.09. Under these conditions, the extraction yield of CS was 12.13%. Chondroitin sulfate and glucosamine hydrochloride were identifi ed in the extract by high performance liquid chromatography.
Key words: goose bone; chondroitin sulfate; alkali extraction; enzymatic hydrolysis; ethanol precipitation; pepsin; response surface methodology
XIE Jing, YIN Yijuan, YANG Yucheng, et al. Optimization of enzymatic extraction of chondroitin sulfate from goose bones by response surface methodology[J]. Meat Research, 2018, 32(8): 40-45. DOI:10.7506/rlyj1001-8123-201808007. http://www.rlyj.pub
谢晶, 尹义捐, 杨欲成, 等. 响应面法优化鹅全骨硫酸软骨素的酶法提取工艺[J]. 肉类研究, 2018, 32(8): 40-45.DOI:10.7506/rlyj1001-8123-201808007. http://www.rlyj.pub
文章编号: 1001-8123(2018)08-0040-06
引文格式:
中图分类号: TS251.9
文献标志码: A
*通信作者简介: 金晨钟(1964—),男,研究员,学士,研究方向为生物资源利用与有害生物控制。E-mail:532479626@qq.com
DOI: 10.7506/rlyj1001-8123-201808007
基金项目: 2016年度湖南省大学生研究性学习和创新性实验计划项目(2016-690);湖南人文科技学院重点植物保护学科资助项目
第一作者简介: 谢晶(1984—),女,讲师,博士研究生,研究方向为生物源活性成分提取与利用。E-mail:air_fi sh@126.com
收稿日期: 2018-04-09