表1 菌落特征及菌株形态
Table 1 Colony and morphology characteristics of strains
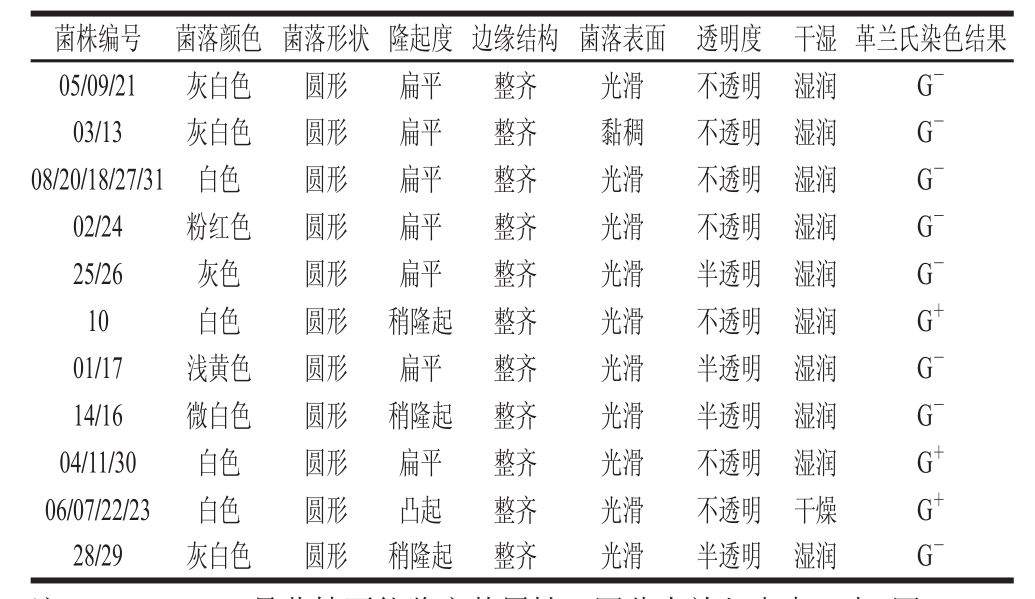
注:12、15、19号菌株不能鉴定其属性,因此未放入表中。表2同。
姬 华 1 ,张雪艳 1 ,刘雅臻 1,2, *,徐雯雯 1 ,王晓静 1 ,田会丽 1 ,伊绪东 1 ,张 玲 1
(1.石河子大学食品学院,新疆 石河子 832000;2.南大港产业园区卫生计生管理服务中心,河北 黄骅 061103)
摘 要: 为研究新疆椒麻鸡中腐败细菌的种类和特性,采用平板划线法分离腐败菌。利用生理生化实验和16S rDNA序列分析方法,对从椒麻鸡中分离的31 株腐败菌进行鉴定。结果表明:所筛选的31 株菌中,肠杆菌20 株、葡萄球菌3 株、气单胞菌2 株、乳酸菌4 株、溶酪大球菌2 株;新鲜椒麻鸡中的主要腐败菌为溶酪大球菌、葡萄球菌和肠杆菌;低温5 ℃贮藏条件下腐败样品中的主要腐败菌为乳酸菌、葡萄球菌和肠杆菌;常温25 ℃贮藏条件下腐败椒麻鸡中的腐败菌主要为肠杆菌、气单胞菌、葡萄球菌和乳杆菌。
关键词: 新疆椒麻鸡;腐败细菌;生理生化实验;16S rDNA
椒麻鸡是新疆特色名菜,色味俱佳,椒麻可口,质地软嫩,广受消费者喜爱。食用前将多种香辛料复配的椒麻汁淋在鸡块上拌匀即形成椒麻鸡特征风味,新疆椒麻鸡中已检测出74 种挥发性香气成分 [1-2] 。椒麻鸡营养丰富,在贮藏及销售过程中容易受到微生物污染,引起椒麻鸡腐败变质,货架期变短。导致肉制品腐败变质的细菌主要有革兰氏阴性菌,如需氧嗜冷假单胞菌(Pseudomonas)、气单胞菌(Aeromonas)和不动杆菌(Acinetobacter)等;革兰氏阳性菌,如葡萄球菌(Staphylococcus)、热死环丝菌(Brochotrix thermosphacta)和乳杆菌(Lactobacillus);革兰氏阳性芽孢杆菌,如蜡样芽孢杆菌(Bacillus cereus)、巨大芽孢杆菌(Bacterium anthracoides)和枯草芽孢杆菌(Bacillus subtilis)等;厌氧梭状芽孢杆菌(Cl ostridium anaerobicus),如腐败梭菌(Clostridium putrificum)、溶组织梭菌(Clostridium histolyticum)和产气荚膜梭菌(Clostridium perfringens)等 [3-5] 。生鸡肉中的特定腐败菌为气单胞菌属(Aeromonas spp.)、假单胞菌属(Pseudomonas spp.)、肠杆菌科(Enterobacteriaceae)、肉杆菌属(Carnobacterium spp.)和热死环丝菌(B. thermosphacta) [6-7] 。Wang Guangyu等 [6] 发现,气单胞菌和假单胞菌属是有氧冷藏条件下黄羽鸡肉中的优势腐败菌,杀鲑气单胞菌(Aeromonas salmonicida)和莓实假单胞菌(Pseudomonas fragi)对鸡肉具有较强的致腐能力。Rouger等 [7] 发现,气调包装条件下生鸡肉中的热死环丝菌、假单胞菌和肉杆菌是优势腐败菌。已有文献报道了各种熟食鸡肉中的腐败菌。徐世明等 [8] 发现,胀袋烧鸡中的主要腐败菌为生孢梭状杆菌(Clostridium sporgenes)、枯草芽孢杆菌(B. subtilis)和短小芽孢杆菌(Bacillus pumilus);张春江等 [9] 鉴定出变质扒鸡产品中的腐败菌主要为肠杆菌(Enterobacteria)、柠檬酸杆菌(Citrobacter)、支芽孢杆菌(Bacillus atrophaeus)和梭菌(Clostridium)等;赖宏刚 [10] 研究发现,酱鸡中的腐败菌主要为铜绿假单胞菌(Pseudomonas aeruginosa)、鼠李糖乳杆菌(Lactobacillus rhamnosus)、腐生葡萄球菌(Staphylococcus saprophyticus)、产气肠杆菌(Enterobacter aerogenes)和热死环丝菌;刘梦茵等 [11] 认为,引起草鸡煲腐败变质的主要菌群为产气肠杆菌(Enterobacter aerogenes)、成团泛生菌(Pantoea agglomerans)、假单胞菌(Pseudomonas)、荧光假单胞菌(Pseudomonas fluorescens)、蜡状芽孢杆菌(B. cereus)及类芽孢杆菌(Paenibacillus)。熟食鸡肉中的主要腐败菌为产芽孢细菌、肠杆菌、葡萄球菌、热死环丝菌和假单胞菌,这些腐败菌来源于原料鸡肉、操作人员及配料的污染。熟食鸡肉中腐败菌的多样性可能与鸡肉的加工工艺和贮藏环境有关。
鸡肉营养丰富,具有适合微生物生长的能量、碳源和其他营养素,是微生物生长的理想介质 [12] ,腐败菌的生长是椒麻鸡变质的重要原因。目前未见有关新疆椒麻鸡中腐败菌多样性的研究报道,本研究对引起新疆椒麻鸡腐败变质的细菌进行分离和鉴定,了解椒麻鸡中腐败细菌的构成,为抑制椒麻鸡中腐败菌的生长和延长椒麻鸡货架期提供理论依据。
从石河子市三家饭店购买新鲜烹制的椒麻鸡,均为当天烹制,从烹制到取样不超过2 h。
麦康凯琼脂(用于培养肠杆菌)、莫匹罗星锂盐改良MRS培养基(用于培养乳酸菌)、STAA琼脂培养基(用于培养热死环丝菌)、MSA培养基(用于培养葡萄球菌)、假单胞CFC选择性培养基(用于培养假单胞菌)、胰酪大豆胨(tryptic soy broth,TSB)液体培养基、胰酪大豆胨琼脂(tryptic soy agar,TSA)培养基、蛋白胨 青岛高科技工业园海博生物技术有限公司;TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒天根生化科技(北京)有限公司;溴麝香草酚蓝(分析纯) 天津市化学试剂一厂;α-萘酚(分析纯)天津市光复精细化工研究所;酚红、L-精氨酸(均为分析纯) 北京索莱宝科技有限公司。
SPX-150B恒温恒湿培养箱 绍兴市苏珀仪器有限公司;TProfessional聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;LDZX-30KBS立式压力灭菌锅 上海申安医疗器械有限公司;BagMixer VW400均质机 法国Interscience公司。
1.3.1 菌株分离
将25 g椒麻鸡鸡肉样品置于无菌均质袋,于5、25 ℃条件下贮藏至腐败。取新鲜椒麻鸡和腐败椒麻鸡样品各25 g,分别加入225 mL 0.1%无菌蛋白胨液,孵育6 h后均质机拍打3 min;取1 mL上清液进行梯度稀释,选择3 个合适的稀释度,涂布于TSA平板;培养后在TSA平板上挑选具有典型生长形态的菌落,在各选择性培养基上反复平板划线分离培养,直至得到纯化的单一菌落,观察菌落的形态及特征。
1.3.2 生理生化实验
生理生化实验包括精氨酸双水解酶实验、葡萄糖氧化发酵实验、接触酶实验和氧化酶实验。根据Brown [13] 推荐的肉中微生物鉴定图谱、《伯杰氏细菌鉴定手册》 [14] 及《常见细菌系统鉴定手册》 [15] 等,将上述实验结果作为初步鉴定菌株的依据。
1.3.3 DNA提取
将从选择性培养基上分离的单一菌落分别接种于TSB肉汤,培养后用TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒提取分离细菌的DNA。
1.3.4 16S rDNA扩增
PCR反应体系:预混液2×Taq PCR mastermix 12.5 μL、ddH 2 O 9.5 μL、引物27F 0.5 μL、引物1492R 0.5 μL、模板2 μL。其中,引物27F:5’-AGAGTTTGATCCTGGCTCAG-3’,1492R:5’-GGTTACCTTGTTACGACTT-3’ [16] 。
PCR反应条件:94 ℃预变性3 min,然后94 ℃变性30 s;56 ℃退火30 s;72 ℃延伸1.5 min,进行30 个循环;最后72 ℃延伸20 min。扩增物送往生工生物工程(上海)股份有限 公司测序。
1.3.5 系统进化树的构建
将测序序列于NCBI GenBank Database中进行BLAST比对,并使用MEGA 6.0软件构建系统发育树。
表1 菌落特征及菌株形态
Table 1 Colony and morphology characteristics of strains

注:12、15、19号菌株不能鉴定其属性,因此未放入表中。表2同。
表2 生理生化实验结果
Table 2 Results of physiological and biochemical tests
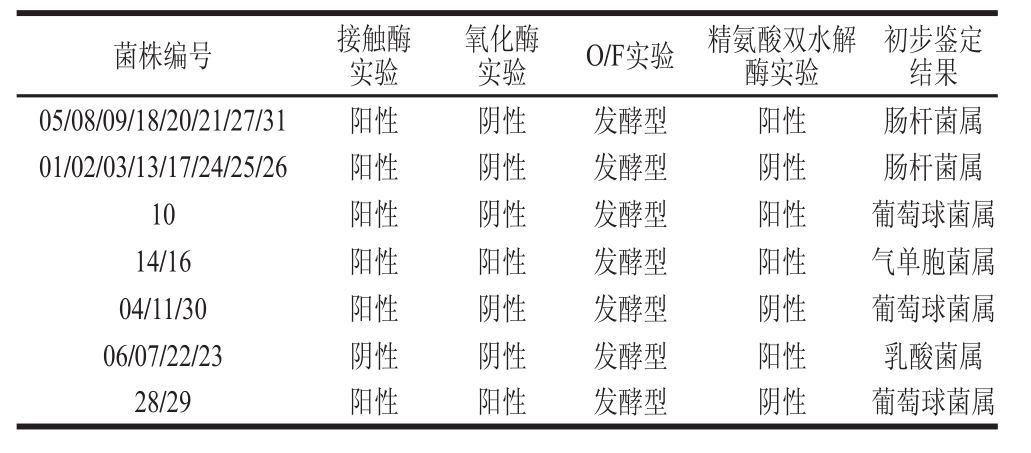
结合Brown [13] 推荐的肉中微生物鉴定图谱、《常见细菌系统鉴定手册》 [15] 以及表1~2中对菌落的描述和生理生化实验结果,可以对筛选出的31株菌株进行初步判断。初步鉴定出01、02、03、05、08、09、13、17、18、20、21、24、25、26、27、31号菌株为肠杆菌属;14、16号菌株为气单胞菌属;04、10、11、28、29、30号菌株为葡萄球菌属;06、07、22、23号菌株为乳酸菌属。
对于12、15、19号菌株,其菌 落形状为圆形,表面光滑、边缘整齐,但是12、19号菌株的接触酶和精氨酸双水解实验结果均为阳性,15号菌株接触酶实验结果为阴性。12、15、19号株菌均为杆状,可初步得知其为杆菌,但是并不能鉴定其属性,因此并未放在表1~2中。
对于筛选出的31 株菌的鉴定仅靠生理生化实验和形态观察是不够的,还需要进一步的深入研究。
提取31 株菌的DNA后,利用PCR扩增其16S rDNA基因片段,31 个菌株均获得长度为1 500 bp 左右的条带,对扩增产物测序,并根据腐败细菌测序结果构建系统发育树。
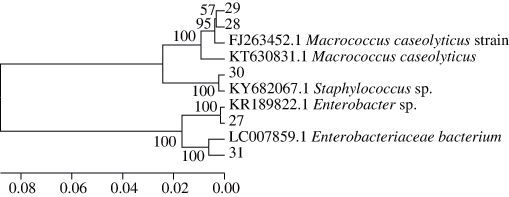
图1 新鲜椒麻鸡中细菌的系统发育树
Fig. 1 Phylogenetic tree of spoilage bacteria isolated from fresh pepper chicken
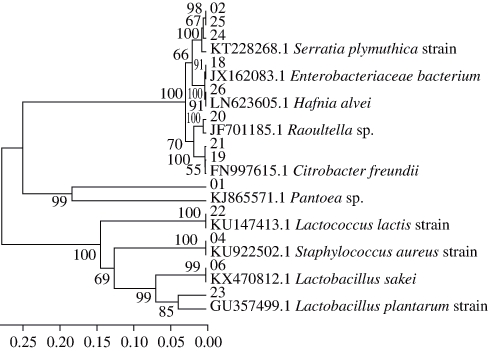
图2 5 ℃条件下腐败椒麻鸡中细菌的系统发育树
Fig. 2 Phylogenetic tree of spoilage bacteria isolated from pepper chicken stored at 5 ℃

图3 25 ℃条件下腐败椒麻鸡中细菌的系统发育树
Fig. 3 Phylogenetic tree of spoilage bacteria isola ted from pepper chicken stored at 25 ℃
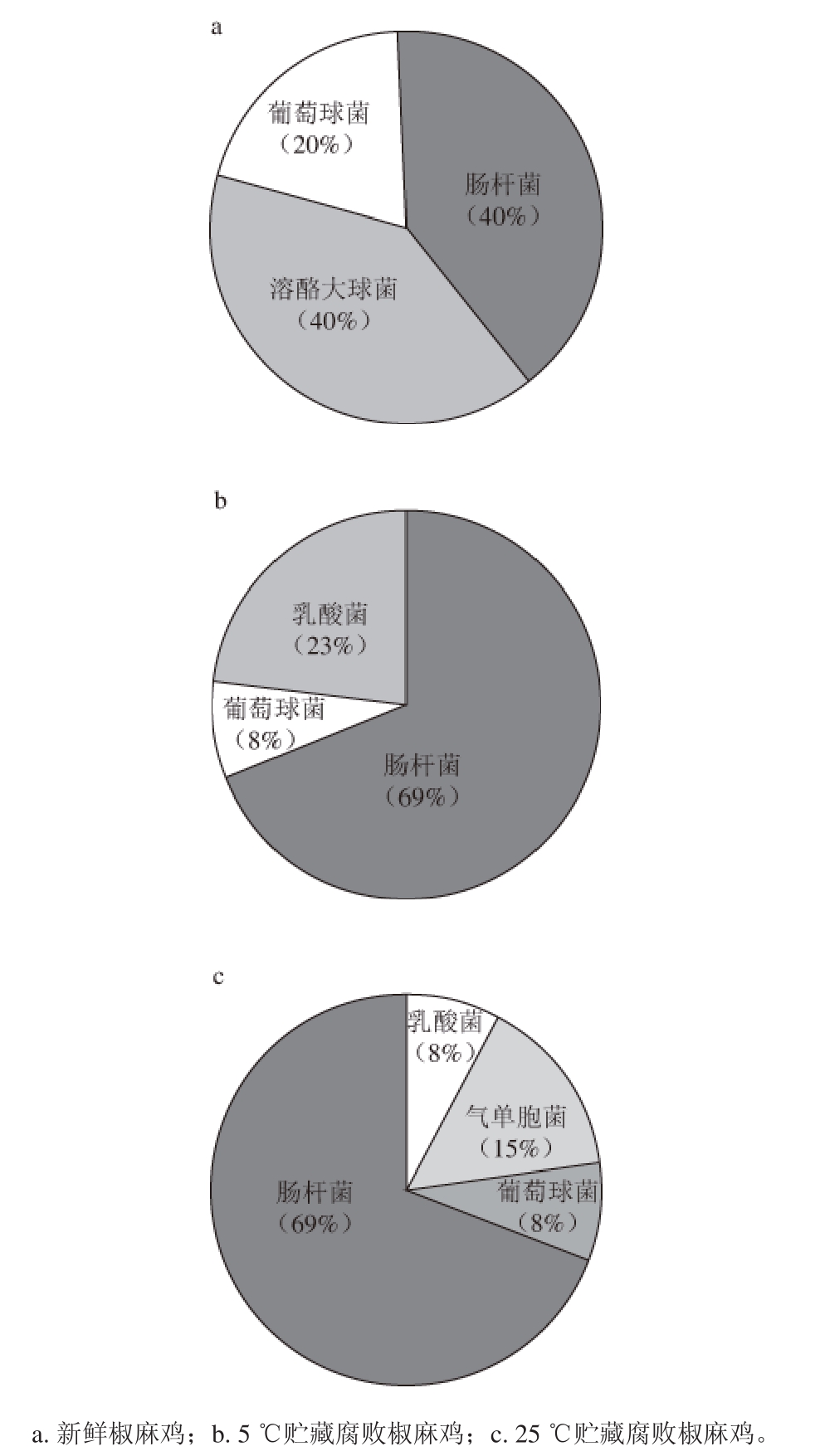
图4 椒麻鸡中的细菌组成
Fig. 4 Bacteria community composition in pepper chicken
从新鲜椒麻鸡中分离的细菌有溶酪大球菌(M. caseolyticus)、葡萄球菌(Staphylococcus)和肠杆菌(Enterobacter spp.);5 ℃条件下腐败椒麻鸡中分离的细菌有乳杆菌(Lactobacillus)、乳球菌(Lactococus)、葡萄球菌(Staphylococcus)和肠杆菌(Enterobacter spp.);25 ℃条件下腐败椒麻鸡中分离的细菌有乳杆菌(Lactobacillus)、气单胞菌(Aeromonas spp.)、葡萄球菌(Staphylococcus)和肠杆菌(Enterobacter spp.)。
由图1、图4a可知,新鲜椒麻鸡中筛选出5 株细菌,包括溶 酪大球菌(M.caseolyticus)2 株、葡萄球菌(Staphylococcus)1 株和肠杆菌(Enterobacter spp.)2 株。
由图2、图4b可知,在5 ℃条件下腐败椒麻鸡中筛选出13 株细菌, 包括乳杆菌(Lactobacillus)2 株、乳球菌(Lactococus)1 株、葡萄球菌(Staphylococcus)1 株和肠杆菌(Enterobacter spp)9 株。其中肠杆菌科微生物有沙雷氏菌(Serratieae)、蜂窝哈夫尼亚菌(Hafnia alvei)、拉乌尔菌(Raoultella)、弗氏柠檬酸杆菌(Citrobacter freundii)和泛菌属(Pantoea spp.)。
由图3、图4c可知,在25 ℃条件下腐败椒麻鸡中筛出13 株细菌,包括乳杆菌(Lactobacillus)1 株、气单胞菌(Aeromonas spp.)2 株、葡萄球菌(Staphylococcus)1 株和肠杆菌(Enterobacter spp.)9 株。其中,肠杆菌科微生物有柠檬酸杆菌(Citrobacter)、产酸克雷伯菌(Klebsiella oxytoca)、拉乌尔菌(Raoultella)、泛菌属(Pantoea spp.)和克吕沃尔氏菌(Kluyvera intermedia)。
在不同温度条件下贮藏的椒麻鸡中均存在肠杆菌科、葡萄球菌属微生物。新鲜椒麻鸡中特有的微生物为溶酪大球菌;5 ℃环境下贮藏的椒麻鸡中特有的腐败微生物为肠杆菌科的沙雷氏菌属和哈夫尼亚菌;25 ℃环境下贮藏的椒麻鸡中特有的腐败微生物为气单胞菌,且5、25 ℃条件下均出现了乳酸菌属的微生物。腐败的椒麻鸡有明显的酸臭味,说明乳酸菌对椒麻鸡的腐败起了很大作用。气单胞菌最适生长温度为30 ℃,因此其存在于25 ℃条件下贮藏的椒麻鸡中。5 ℃条件下贮藏的椒麻鸡样品10 d后才散发酸臭味,有明显腐败现象,而25 ℃条件下贮藏的样品仅3 d就有明显腐败现象。
卤制椒麻鸡是加工中的重要一步,卤制时的温度是制作椒麻鸡的关键工艺,温度直接影响椒麻鸡的口感,这个过程也是杀灭致病性微生物的关键工艺 [17] 。尽管椒麻鸡卤制过程中杀 死了生鸡肉中的微生物,但在新鲜椒麻鸡中仍有多种细菌存在,这可能与加工及贮藏环境、人工交叉污染以及最后加入可能携带细菌的新鲜洋葱等配菜有关,此外空气中也有微生物存在,可以直接或间接地污染禽肉 [18] 。低温(5 ℃)贮藏腐败椒麻鸡中的腐败菌有乳酸菌(Lactobacillus)、葡萄球菌(Staphylococcus)和肠杆菌(Enterobacter spp.);常温(25 ℃)贮藏腐败椒麻鸡中的腐败菌 有肠杆菌科(Enterobacteriaceae)、气单胞菌(Aeromonas spp.)、乳杆菌(Lactobacillus)及葡萄球菌(Staphylococcus)等。乳酸菌一直是肉制品中的优势腐败菌,这与刘勤华等 [19] 对真空包装烧鸡中的腐败菌、Geeraerts等 [20] 对切片熟禽肉微生物群变化的研究结果相符合。Liang等 [21] 用传统的培养方法证实了假单胞菌属、肉杆菌属和环丝菌属是鸡肉串中的优势菌群,这与本研究结果基本一致,但略有差别,这可能与椒麻鸡煮制过程中添加了香辛料有关。刘小莉等 [22] 研究叫花鸡中香辛料对腐败菌的抑制,发现香辛料具有广谱、稳定的抑制作用,因此不同产品的优势腐败菌有所差别。Zhang Huiyun等 [23] 发现,丁香和迷迭香能够延长生鸡肉的冷藏货架期,具有抑菌和抗氧化能力。而椒麻鸡中的主要调料是花椒、麻椒和辣椒,这些调料有抑菌作用。
椒麻鸡中存在腐败细菌的原因可能是在原料运输、生产加工操作过程或销售过程中被污染。门店和市场出售的椒麻鸡主要以有氧散包装方式贮藏,这就增加了细菌交叉污染的概率。鸡肉在后续加工时由于辅料的添加、工人操作等交叉污染,冷藏期间存活的细菌可能会在鸡肉中生长繁殖 [24] ,食用腐败变质的食品极易引起食源性疾病 [25] 。包装和巴氏杀菌能够延长肉制品的货架期,减少食源性疾病的发生。已有文献报道利用气调包装和臭氧处理延长禽肉的货架期:Höll等 [26] 发现,高氧浓度气调包装(CO 2 、O 2 体积比80∶20)时,在4、10 ℃贮藏8 d的鸡肉中,主要腐败菌为热死环丝菌、肉杆菌和假单胞菌;而4 ℃无氧冷藏气调包装(N 2 、CO 2 体积比65∶35)鸡肉中的主要腐败菌为肉杆菌、沙雷氏菌和耶尔森氏菌,10 ℃无氧气调包装(N 2 、CO 2 体积比65∶35)鸡肉中的主要腐败菌为蜂窝哈夫尼亚菌;Rossaint等 [2 7] 研究发现,4 ℃高氮气调包装(N 2 、CO 2 体积比70∶30)贮藏的鸡肉更有利于乳酸菌生长,而4 ℃高氧气调包装(O 2 、CO 2 体积比65∶35)贮藏的鸡肉更有利于热死环丝菌生长,高氧气调包装和高氮气调包装对于鸡肉菌落总数和感官品质的影响并无显著差异;Meredith等 [28] 研究发现,CO 2 、O 2 、N 2 体积比40∶30∶30的气调包装可以减少鸡肉中弯曲菌的数量,使冷藏鸡肉的货架期超过14 d;Gertzou等 [29] 研究发现,利用10 mg/L的氧气处理鸡腿肉1 h时,相比于没有处理的鸡腿,处理后的冷藏鸡肉货架期延长4 d,高浓度氧气可以减少鸡肉中霉菌、酵母、乳酸菌和肠杆菌的数量。崔永慧 [30] 将熟鸡肉进行真空包装,采用低温巴氏杀菌和高温高压巴氏杀菌,结果表明,90 ℃条件下处理30 min、4 ℃冰箱中贮藏和120 ℃条件下处理30 min、常温贮藏为最佳工艺。因此推荐饭店对椒麻鸡进行真空包装和巴氏杀菌后售卖,以提高椒麻鸡的卫生质量,延长其货架期。
本研究从椒麻鸡中分离出31 株菌,经菌体特征、菌落形态、生理生化实验以及16S rDNA序列分析,鉴定出其中包括肠杆菌20 株、葡萄球菌3 株、气单胞菌2 株、乳酸菌4 株及溶酪大球菌2 株。新鲜椒麻鸡中的主要腐败菌为溶酪大球菌(M.caseolyticus)、葡萄球菌(Staphylococcus)和肠杆菌(Enterobacter spp.)。
参考文献:
[1] 耿秋月, 田洪磊, 詹萍, 等. 基于GC-MS技术的新疆椒麻鸡汤料挥发性成分的鉴定与分析[J]. 现代食品科技, 2017, 33(11): 243-250.DOI:10.13982/j.mfst.1673-9078.2017.11.035.
[2] 熊敏, 肖岚, 谷学权, 等. 利用电子鼻评价花椒调味料对椒麻鸡风味的影响[J]. 食品科学, 2010, 31(22): 435-438. DOI:10.7506/spkx1002-6630-201022097.
[3] 徐雅梦, 姜晓冰, 于涛, 等. 真空包装低温熟牛肉中腐败菌的分离与鉴定[J]. 肉类研究, 2017, 31(8): 23-27. DOI:10.7506/rlyj1001-8123-201708005.
[4] PAPADOPOULOU O S, PANAGOU E Z, MOHAREB F R, et al.Sensory and microbiological quality assessment of beef fi llets using a portable electronic nose in tandem with support vector machine a nalysis[J]. Food Research International, 2013, 50(1): 241-249.DOI:10.1016/j.foodres.2012.10.020.
[5] CHAILLOU S, CHAULOTTALMON A, CAEKEBEKE H, et al.Origin and ecological selection of c ore and food-specific bacterial communities associated with meat and seafood spoilage[J]. ISME Journal, 2015, 9(5): 1105-1118. DOI:10.1038/ismej.2014.202.
[6] WANG Guangyu, WANG Huhu, HAN Yiwei, et al. Evaluation of the spoilage potential of bacteria isolated from chilled chicken in vitro,and in situ[J]. Food Microbiology, 2017, 63: 139-146. DOI:10.1016/j.fm.2016.11.015.
[7] ROUGER A, MORICEAU N, PRÉVOST H, et al. Diversity of bacterial communities in French chicken cuts stored under modifi ed atmosphere packaging[J]. Food Microbiology, 2018, 70: 7-16.DOI:10.1016/j.fm.2017.08.013.
[8] 徐世明, 赵瑞连, 宋维娟, 等. 胀袋烤鸡中腐败菌的分离与鉴定[J]. 食品科技, 2011, 36(2): 13-15; 21. DOI:10.13684/j.cnki.spkj.2011.02.014.
[9] 张春江, 黄峰, 张良, 等. 扒鸡加工中主要致腐菌群落结构解析[J].中国食品学报, 2017, 17(2): 227-234. DOI:10.16429/j.1009-7848.2017.02.030.
[10] 赖宏刚. 冷鲜鸡与酱卤制品辐照综合保鲜技术研究[D]. 扬州: 扬州大学, 2017: 13-19.
[11] 刘梦茵, 刘芳, 诸永志, 等. 草鸡煲中腐败菌的分离鉴定[J]. 食品科学, 2011, 32(9): 156-158.
[12] 樊静, 李苗云, 张建威, 等. 肉鸡屠宰加工中的微生物控制技术研究进展[J]. 微生物学志, 2011, 31(2): 80-84. DOI:10.3969/j.issn.1005-7021.2011.02.018.
[13] BROWN M H. Meat microbiology[M]. New York: Applied Science Publishers LTD, 1982: 474-475.
[14] 布坎南 R E, 吉本斯 N E. 伯杰氏细菌鉴定手册[M]. 中国科学院微生物研究所, 译. 北京: 科学出版社, 1984: 274; 382-462; 667; 729; 797.
[15] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社,2001: 66-128; 242-267; 349-370.
[16] 赵文红, 林惠珍, 陈海光, 等. 冰鲜鸭优势腐败菌的鉴定[J].现代食品科技, 2012, 28(7): 728-732. DOI:10.13982/j.mfst.1673-9078.2012.07.021.
[17] 王林, 田俊, 平学仁. 新疆清真风味手撕椒麻鸡加工工艺及其调味配方研究[J]. 新疆职业大学学报, 2012, 20(4): 73-76. DOI:10.3969/j.issn.1009-9549.2012.04.023.
[18] SAMAPUNDO S, BAENST I D, AERTS M, et al. Tracking the sources of psychrotrophic bacteria contaminating chicken cuts during processing[J]. Food Microbiology, 2018. https://doi.org/10.1016/j.fm.2018.06.003.
[19] 刘勤华, 马汉军, 潘润淑, 等. 真空包装烧鸡中腐败细菌的分离、初步鉴定与菌相变化分析[J]. 食品工业科技, 2010, 31(10): 98-100;104. DOI:10.13386/j.issn1002-0306.2010.10.0.
[20] GEERAERTS W, POTHAKOS V, DE VUYST L, et al. Variability within the dominant microbiota of sliced cooked poultry products at expiration date in the Belgian retail[J]. Food Microbiology, 2018, 73:209-215. DOI:10.1016/j.fm.2018.01.019.
[21] LIANG R, YU X, WANG R, et al. Bacterial diversity and spoilagerelated microbiota associated with freshly prepared chicken products under aerobic conditions at 4 ℃[J]. Journal of Food Protection, 2012,75(6): 1057-1062. DOI:10.4315/0362 -028X.J FP-11-439.
[22] 刘小莉, 周剑忠, 孟璐, 等. 天然香辛料对叫化鸡中腐败细菌的抑制作用 研 究[J]. 肉类研究, 2010, 24(8): 49-51. DOI:10.3969/j.issn.1001-8123.2010.08.015.
[23] ZHANG Huiyun, WU Jingjuan, GUO Xinyu. Effects of antimicrobial and antioxidant activities of spice extracts on r aw chicken meat quality[J]. Food Science and Human Wellness, 2016, 5(1): 39-48.DOI:10.1016/j.fshw.2015.11.003.
[24] JR A H, CASON J A, INGRAM K D. Tracking spoilage bacteria in commercial poultry processing and refriger ated storage of poultry carcasses[J]. International Journal of Food Microbiology, 2004, 91(2):155-165. DOI:10.1016/S0168-1605(03) 00377-5.
[25] PINU F R. Early detection of food pathogens and food spoilage microorganisms: application of metabolomics[J]. Trends in Food Science and Technology, 2016, 54: 213-215. DOI:10.1016/j.tifs.2016.05.018.
[26] HÖLL L, BEHR J, VOGEL R F. Identifi cation and growth dynamics of meat spoilage microorganisms in modified atmosphere packaged poultry meat by MALDI-TOF MS[J]. Food Microbiology, 2016, 60:84-91. DOI:10.1016/j.fm.2016.07.003.
[27] ROSSAINT S, KLAUSMANN S, KREYENSCHMIDT J. Effect of high-oxygen and oxygen-free modifi ed atmosphere packaging on the spoilage process of poultry breast fillets[J]. Poultry Science, 2015,94(1): 93-103. DOI:10.3382/ps/peu001.
[28] MERE DITH H, VALDRAMI DIS V, ROTABAKK B T, et al.Effect of different modified atmospheric packaging (MAP) gaseous combinations on Campylobacter and the shelf-life of chilled poultry fillets[J]. Food Microbiology, 2014, 44(6): 196-203. DOI:10.1016/j.fm.2014.06.005.
[29] GERTZOU I N, DROSOS P E, KARABAGIAS I K, et al. Combined effect of ozonation and packaging on shelf life extension of fresh chicken legs during storage under refrigeration[J]. Journal of Food Science and Technology, 2016, 53(12): 1-8. DOI:10.1007/s13197-016-2421-7.
[30] 崔永慧. 袋装鸡肉熟肉制品杀菌工艺的研究[J]. 肉类研究, 2010,24(8): 52-55; 62. DOI:10.3969/j.issn.1001-8123.2010.08.016.
Isolation and Identifi cation of Spoilage Bacteria from Xinjiang Pepper Chicken
JI Hua 1 , ZHANG Xueyan 1 , LIU Yazhen 1,2, *, XU Wenwen 1 , WANG Xiaojing 1 , TIAN Huili 1 , YI Xudong 1 , ZHANG Ling 1
(1.College of Food, Shihezi University, Shihezi 832000, China;2.Health and Family Planning Management Service Center of Nandagang Ind ustrial Park, Huanghua 061103, China)
Abstract: In order to investigate the species and characteristics of spoilage bacteria in Xinjiang pepper chicken, the streak plate method was employed to isolate spoilage bacteria. Thirty-one strains of spoilage bacteria isolated from pepper chicken were identifi ed by physio-biochemical tests and 16S rDNA sequence analysis. The results showed 20 strains of Enterobacter spp.,3 strain s of Staphylococcus, 2 strains of Aeromonas spp., 4 strains of lactic acid bacteria and 2 strain s of Macrococccus caseolyticus were id entified among the 31 strains. The main spoilage bacteria in fresh chicken were M. caseolyticus,Staphylococcus and Enterobacter spp. Lactic acid bacteria, Staphylococcus and Enterobacter spp. were predominant in spoiled samples stored at 5 ℃. The dominant bacteria in spoiled pepper chicken stored at 25 ℃ were Enterobacter spp.,Aeromonas spp., Staphylococcus and Lactobacillus.
Key words: Xinjiang pepper chicken; spoilage bacteria; physio-biochemical tests; 16S rDNA
JI Hua, ZHANG Xueyan, LIU Yazhen, et al. Isolation and identification of spoilage bacteria from Xinjiang pepper chicken[J]. Meat Research, 2018, 32(8): 22-27. DOI:10.7506/rlyj1001-8123-201808004. http://www.rlyj.pub
姬华, 张雪艳, 刘雅臻, 等. 新疆椒麻鸡中腐败细菌的分离与鉴定[J]. 肉类研究, 2018, 32(8): 22-27. DOI:10.7506/rlyj1001-8123-201808004. http://www.rlyj.pub
文章编号: 1001-8123(2018)08-0022-06
引文格式:
中图分类号: TS251.5
文献标志码: A
*通信作者简介: 刘雅臻(1995—),女,本科,研究方向为食品质量与安全。E-mail:609398065@qq.com
DOI: 10.7506/rlyj1001-8123-201808004
基金项目: 国家自然科学基金-新疆联合基金项目(U1703119);国家自然科学基金青年科学基金项目(31301469);石河子大学重大科技攻关计划项目(gxjs2015-zdgg05)
第一作者简介: 姬华(1980—),女,副教授,博士,研究方向为食品质量与安全。E-mail:jihua229@126.com
收稿日期: 2018-03-25