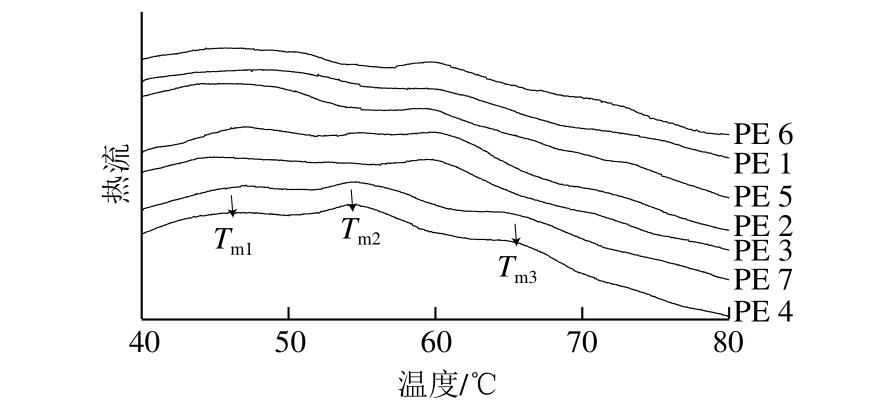
图1 精氨酸/赖氨酸与复合磷酸盐对蛋白提取物热特性的影响
Fig. 1 Effects of Arg/Lys and phosphates on thermal properties of protein extracts
李林贤,李诗义,诸晓旭,宁 诚,周存六*
(合肥工业大学食品科学与工程学院,安徽 合肥 230009)
摘 要:考察以0.55 g/100 mL L-精氨酸(精氨酸)/L-赖氨酸(赖氨酸)+1.5 g/100 mL NaCl溶液为提取剂提取的鸡胸肉蛋白的凝胶特性。差示扫描量热法和动态流变结果表明:与对照组相比,添加精氨酸/赖氨酸的提取剂所对应的蛋白提取物在加热过程中具有3 个明显的变性温度点和4 个明显的温度区间,其在加热和冷却的过程中均具有更高的储能模量;添加精氨酸/赖氨酸的提取剂所对应的蛋白提取物形成的蛋白凝胶具有连续的三维网络结构、更高的保水性和凝胶强度以及更低的蒸煮损失。因此,提取剂中包含精氨酸/赖氨酸的蛋白提取物具有更好的凝胶特性,所形成的凝胶具有更好的保水和质构等特性。
关键词:L-精氨酸;L-赖氨酸;盐溶蛋白;凝胶特性
保水性、蒸煮损失率和质构是肉制品重要的品质特性,取决于肌肉中盐溶蛋白的凝胶特性[1]。肉制品的实际加工过程涉及盐溶蛋白从肌肉组织中的溶出及其随后的凝胶化[2]。但是,盐溶蛋白通常不溶于水或低离子强度的缓冲溶液,而溶于中等或高离子强度的缓冲溶液[3]。因此,目前肉制品的加工主要利用NaCl协同复合磷酸盐增加盐溶蛋白的溶解度[4-5]。过量摄入NaCl和磷酸盐可能对人体健康存在潜在威胁[6-7],因此低钠、低磷肉制品是肉类工业发展的重要方向。然而,减少NaCl和磷酸盐的使用量不利于肉制品的保水和质构特性[6-8],不利于肉制品的品质。因此,迫切需要开发一种在低钠和低磷条件下提高肉制品品质的方法。
L-精氨酸(精氨酸)和L-赖氨酸(赖氨酸)2 种必需氨基酸已在GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中被批准为食品的香精香料,可广泛应用于食品行业。近年来,精氨酸和赖氨酸作为天然的食品添加剂引起了肉类行业的广泛兴趣。Zhou Cunliu[9-10]、Zheng Yadong[11]等研究表明,精氨酸和赖氨酸可以提高低钠低磷肉制品的保水和质构特性,改善肉制品的色泽和风味。精氨酸和赖氨酸也被证实可以提高低KCl条件下肌球蛋白的溶解度[2,12],表明精氨酸/赖氨酸的应用可能会促进肌肉组织中盐溶蛋白的溶出。另外,Qin Hao等[13]研究发现,精氨酸可以改善已溶出的盐溶蛋白热诱导凝胶的保水和质构特性。但是,精氨酸和赖氨酸改善肉制品保水和质构特性的机制尚不明确。
目前,已有一些关于精氨酸/赖氨酸对鸡肉香肠保水与质构等特性影响机制的研究报道。但迄今为止,这些报道均集中在精氨酸/赖氨酸对盐溶蛋白热凝胶性质影响的研究上。由于盐溶蛋白的提取需要在一定的离子强度下才能顺利进行,因此,这些研究的实验条件与实际肉制品加工条件有明显的不同。在低钠无磷及添加精氨酸/赖氨酸的条件下,肌肉组织中溶出的蛋白是否具有良好的凝胶形成能力?针对上述问题,本研究以1.5 g/100 mL NaCl+0.55 g/100 mL精氨酸/赖氨酸溶液为提取剂,研究鸡胸肉蛋白提取物的凝胶特性,探究精氨酸/赖氨酸改善低钠低磷肉制品保水与质构特性的作用机制。
鸡胸肉(3 批,约10 kg,鸡龄约40 d)购自合肥市家乐福超市。
L-精氨酸(食品级,纯度99.5%)、L-赖氨酸(食品级,纯度99.0%) 上海伊卡生物技术有限公司;氯化钠、氯化钾、复合磷酸盐(六偏磷酸钠∶三聚磷酸钠∶焦磷酸钠=1∶2∶2(m/m))、溴酚蓝、甘油十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、戊二醛、冰醋酸、丙酮、盐酸、牛血清白蛋白(bovine serum albumin,BSA)(均为分析纯) 国药集团化学试剂有限公司。
MG-1220绞肉机 佛山市顺德区金仪美电器有限公司;ML104电子分析天平 瑞士梅特勒-托利多仪器有限公司;HR-3 Discovery流变仪、Q2000差示扫描量热仪美国TA仪器公司;FA25高速剪切乳化机 上海弗鲁克流体机械制造有限公司;CT14RD冷冻离心机 杭州纽蓝科技有限公司;752N紫外-可见分光光度计 上海仪表公司;JSM6490LV钨灯丝扫描电子显微镜 日本电子株式会社。
1.3.1 蛋白提取剂的配制
在肉制品实际加工过程中,向肉糜中添加NaCl和复合磷酸盐有利于肌原纤维蛋白的提取。为模拟实际加工条件,配制7 种蛋白提取剂(protein extraction solvents,PES)。PES 1:对照组,1.5 g/100 mL NaCl,pH 6.65;PES 2:1.5 g/100 mL NaCl+0.55 g/100 mL精氨酸,pH 10.73;PES 3:1.5 g/100 mL NaCl+0.55 g/100 mL赖氨酸,pH 10.04;PES 4:1.5 g/100 mL NaCl+0.5 g/100 mL复合磷酸盐,pH 9.38。
考虑到pH值是影响蛋白提取的重要因素,设置2 个pH值对照组。将1.5 g/100 mL NaCl溶液的pH值分别调至与精氨酸和赖氨酸单独添加组相同,即PES 5:1.5 g/100 mL NaCl,pH 10.73;PES 6:1.5 g/100 mL NaCl,pH 10.04。此外,参考GB 2760—2014中规定的同类产品中NaCl与复合磷酸盐的使用量,另设置PES 7:2.5 g/100 mL NaCl+0.5 g/100 mL复合磷酸盐,pH 9.31。
1.3.2 蛋白提取
将鸡胸肉去除皮、结缔组织、脂肪等,剩下的肉用内径5 mm筛孔的MGB-120绞肉机绞碎,此操作重复2 次;将绞碎的肉糜分装并贮藏在-18 ℃,备用。所有操作均在4 ℃条件下进行。
向60 g鸡胸肉肉糜中加入300 mL蛋白提取剂,于组织捣碎机中捣碎,然后在10 000 r/min条件下进行均质乳化,重复3 次,每次20 s;于4 ℃冰箱中平衡过夜,用3 层纱布过滤,除去结缔组织和脂肪,利用GL-21M高速离心机在14 000×g条件下离心20 min,上清液即为蛋白提取物。
将用蛋白提取剂PES 1~7提取所得的蛋白提取物分别命名为PE 1、PE 2、PE 3、PE 4、PE 5、PE 6和PE 7,用于后续的理化性质与热诱导凝胶特性分析。在提取后,立即对蛋白提取物进行pH值测定[9],采用双缩脲法测定浓度,SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)法进行蛋白成分分析[14]。
1.3.3 凝胶制备
参照Chen Xing等[15]的方法制备凝胶,并略作修改。将10 mL蛋白提取物置于10 mL烧杯(内径25 mm,高度35 mm)中,从20 ℃升温至80 ℃,并在80 ℃条件下水浴30 min,之后立即冰浴冷却,然后在4 ℃冰箱中贮藏12 h以供后续研究。
蛋白提取物PE 1~7所形成的蛋白凝胶(protein gel,PG)相应地命名为PG 1、PG 2、PG 3、PG 4、PG 5、PG 6和PG 7。
1.3.4 指标测定
1.3.4.1 pH值
参照Zhou Cunliu等[9]的方法。每个样品测定3 次,取平均值。
1.3.4.2 蛋白热特性
参照Zhou Cunliu等[10]的方法,并稍作修改。采用差示扫描量热法(differential scanning calorimetry,DSC)进行检测,起始温度设置为20 ℃,终止温度设置为85 ℃,以3 ℃/min的速率升温,并于20 ℃条件下平衡5 min,收集其热相变温度点Tm。重复测定3 次。
1.3.4.3 混合体系流变特性
参照Qin Hao等[13]的方法,并略作修改。测试采用振荡模式,选用60 mm平行板,500 μm空隙,频率0.796 Hz;升温过程参数:由20 ℃升温至80 ℃,升温速率2 ℃/min;降温过程参数:由80 ℃降温至20 ℃,降温速率4 ℃/min。重复测定3 次。
1.3.4.4 保水性与蒸煮损失
参照Ma Fei等[16]的方法,均重复测定3 次。
1.3.4.5 凝胶强度
采用TA-XT Plus物性仪测定蛋白凝胶的强度[15]。选用GMIA模式,参数设定如下:探头型号P/0.5,测前速率1.5 mm/s,测中速率l.0 mm/s,测后速率l.0 mm/s,间隔时间5 s,触发力5 g,下压距离4 mm,样品压缩程度35%,触发类型Strain,凝胶强度单位g。实验重复3 次。
应该指出的是,在测定动态流变、热特性以及凝胶化之前再次用0.5 mol/L的KOH溶液将PE 5、PE 6的pH值分别调至与PE 2、PE 3相同,以排除pH值对上述蛋白提取物的理化性质以及热诱导凝胶特性的影响。
1.3.4.6 凝胶微观结构
参照Chen Xing等[8]的方法,并略作修改。将待测的蛋白凝胶样品切成5 mm×5 mm×2 mm的薄片,浸入4%甲醛和2.5%戊二醛混合溶液(二者体积比1∶1)中固定2 h;用0.1 mol/L的磷酸盐缓冲液(pH 7.2)漂洗10 次,然后分别选用体积分数为30%、50%、70%、85%和100%的乙醇溶液进行梯度脱水,每个梯度脱水10 min;最后用无水丙酮溶液脱水,脱水完成的凝胶于真空冷冻干燥机中冷冻干燥24 h。喷金,扫描电子显微镜(scanning electron microscopy,SEM)观察。
使用Excel 2003软件进行数据处理,实验数据表示为平均值±标准差;并用SPSS 19.0软件中的单因素方差分析进行数据的差异显著性分析,P<0.05表示差异显著,P>0.05表示差异不显著;采用Origin 8.5软件绘图。
经测定,蛋白提取物PE 1的蛋白质量浓度为16.07 g/mL,PE 2、3、4、7的蛋白含量明显高于PE 1,表明向1.5 g/100 mL NaCl溶液中添加精氨酸、赖氨酸和复合磷酸盐能够促进蛋白从肌肉组织中溶出。SDS-PAGE结果表明:对于PE 1,在分子质量分别为100、60、50、45、35、28 kDa处发现蛋白条带,与肌浆蛋白的化学成分基本一致[17-20];而PE 2、3、4、7在分子质量分别为15、25、200 kDa处均出现了1 条清晰的宽带,在分子质量为45 kDa处条带加深,表明精氨酸、赖氨酸和复合磷酸盐有利于盐溶蛋白的提取。PE 5、6的蛋白含量和SDS-PAGE结果与PE 1基本一致,表明pH值对肌原纤维蛋白的提取没有明显的促进作用。
2.1.1 蛋白提取物的热特性
热变性温度点(Tm)的变化是衡量蛋白天然结构遭到破坏的一个重要指标,反映了蛋白提取物的化学变化[21]。

图1 精氨酸/赖氨酸与复合磷酸盐对蛋白提取物热特性的影响
Fig. 1 Effects of Arg/Lys and phosphates on thermal properties of protein extracts
表 1 精氨酸/赖氨酸与复合磷酸盐对蛋白提取物Tm的影响
Table 1 Effects of Arg/Lys and phosphates on the Tmof protein extracts℃
注:同行小写字母不同,表示差异显著(P<0.05)。
由图1和表1可知,不同组样品之间的Tm存在明显差异。对照组样品仅在60.55 ℃处有1 个明显的特征峰;而PE 2、3、4、7在46.91~44.28 、54.84~60.35、66.26~72.97 ℃处有3 个明显的特征峰,明显不同于对照组;PE 5、6在59.54~60.01 ℃处显示出单一的特征峰,伴随着72.52~73.64 ℃处1 个肩峰。同样地,Qin Hao[13]、Lei Zhen[22]等也分别在鸡盐溶蛋白和鸡肌动球蛋白中观察到3 个明显的特征峰。
盐溶蛋白的第1个转变峰(Tm1)可能代表肌球蛋白头部热变性,第2个转变峰(Tm2)可能代表肌球蛋白尾部和/或肌浆蛋白热变性,第3个转变峰(Tm3)可能代表肌动蛋白变性[23-24]。因此,如上所述,对照组样品的肌球蛋白、肌动蛋白含量较少,唯一的特征峰最有可能是肌浆蛋白变性引起的。PE 2、3、4、7出现的Tm1、Tm2和Tm3可能分别归因于肌球蛋白头部、肌球蛋白尾部和/或肌浆蛋白以及肌动蛋白的变性。这一结果也进一步表明,将精氨酸/赖氨酸或复合磷酸盐加入到1.5 g/100 mL NaCl溶液中能够有效促进盐溶蛋白的提取。根据SDS-PAGE图谱,PE 5、6出现的肩峰最有可能是由于肌动蛋白的变性引起的。DSC结果的差异性表明蛋白成分不同,因而导致加热过程中发生了不同的化学变化。
与PE 4、7相比,PE 2、3的Tm1向更高的温度方向移动,表明PE 2、3肌球蛋白头部的变性温度增加。Tm1反映巯基通过有限的氧化向二硫键的转变[25]。精氨酸/赖氨酸具有抗氧化能力[7,26],这可能是导致Tm1升高的原因。PE 2、3与PE 4、7 Tm1、Tm2及Tm3的不同表明PE 2、3可能形成了与PE 4、7不同结构的热诱导凝胶。另外,PE 2、3的Tm2和Tm3比PE 4更高(P<0.05),表明PE 2、3的肌球蛋白尾部和/或肌浆蛋白以及肌动蛋白的变性需要在更高的温度下完成。Schneider等[27]研究发现,精氨酸与蛋白有弱的结合能力,能够增加聚集的活化能。因此,推测精氨酸/赖氨酸带有的胍基或ε-氨基基团与蛋白的结合可能是导致更高的Tm2和Tm3的原因。
2.1.2 蛋白提取物的动态流变特性
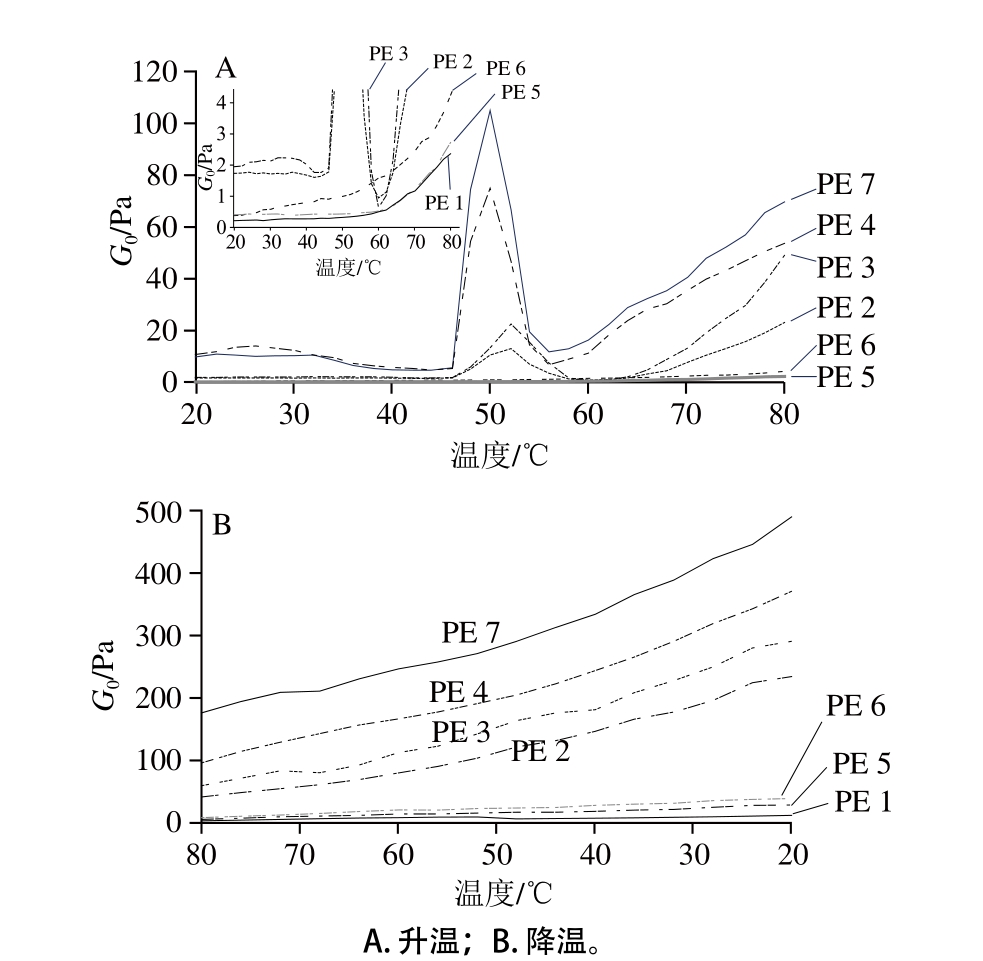
图2 精氨酸/赖氨酸与复合磷酸盐对蛋白升温和降温过程中储能模量的影响
Fig. 2 Effects of Arg/Lys and phosphates on the storage modulus of protein extracts during heating and cooling
储能模量(G0)与弹性相关,可以反映凝胶的强度[28]。由图2A可知,在加热过程中,PE 2、3、4、7中出现了4 个典型的温度区间。Qin Hao[13]、Lei Zhen[22]等也分别在鸡盐溶蛋白和鸡肌动球蛋白中观察到类似的典型温度区间。从20 ℃到46 ℃,G0基本保持不变;但在大约46 ℃时开始急剧上升,52 ℃时达到峰值,这可能由于第2个温度区间涉及二硫键的形成,致使黏性溶液向弹性网络转变,为凝胶网络形成的初始阶段[25];G0在52~60 ℃范围内急剧下降,这可能是由于肌球蛋白的螺旋结构向卷曲转化,导致分子“流动性”增强[23,29];在60~80 ℃的温度范围内,G0再次显著增加,这可能是由于蛋白质之间的交联增加,形成牢固且不可逆的凝胶。
由图2A可知,PE 2、3、4、7的动态流变特性与PE 1、5、6明显不同。在第1个温度范围内,PE 2、3,特别是PE 4、7的G0高于PE 1、5、6(P<0.05),表明PE 2、3,特别是PE 4、7具有更高的凝胶强度,这可能是由于PE 2、3,特别是PE 4、7较高的蛋白浓度。这表明,PE 2、3、4、7在加热过程中具有良好的凝胶形成能力。然而,在加热过程中,PE 1、5、6的G0没有明显变化,这可能是由于PE 1、5、6中盐溶蛋白的浓度较低。同时,PE 1、5、6没有出现4 个典型的温度区间,也表明其在加热过程中可能具有较弱的形成三维网络结构的能力。
PE 2、3、4、7之间的动态流变曲线也存在一些差异。首先,与PE 4、7在50 ℃达到第1个峰值相比,PE 2、3在较高温度(52 ℃)下达到第1个峰值。这一结果表明,由于精氨酸和赖氨酸具有抗氧化作用,精氨酸或赖氨酸的添加可能会延缓肌球蛋白头部的聚集[7,26]。其次,在第2、3、4个温度区间内以及冷却过程中,PE 4特别是PE 7具有比PE 2、3更高的G0,表明PE 4特别是PE 7具有比PE 2、3更好的胶凝能力。此外,在后3 个温度范围内,PE 7的G0比PE 4高,表明在一定范围内离子强度的增加可能有利于蛋白凝胶的形成。
由图2B可知,在冷却过程中,PE 2、3、4、7的G0显著增加,PE1、5、6的G0增加依然不显著,冷却过程中G0的增加表明凝胶强度进一步加强。
2.2.1 保水性和蒸煮损失测定结果
保水性和蒸煮损失可以衡量蛋白凝胶结合水的能力,通常用于客观反映肉类和肉制品的品质和产量[30]。
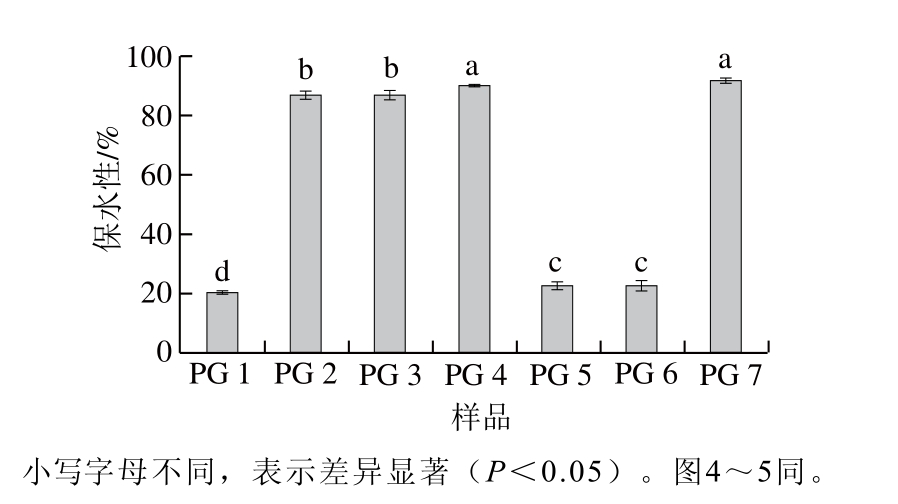
图3 精氨酸/赖氨酸与复合磷酸盐对蛋白凝胶保水性的影响
Fig. 3 Effects of Arg/Lys and phosphates on the WHC of various gels
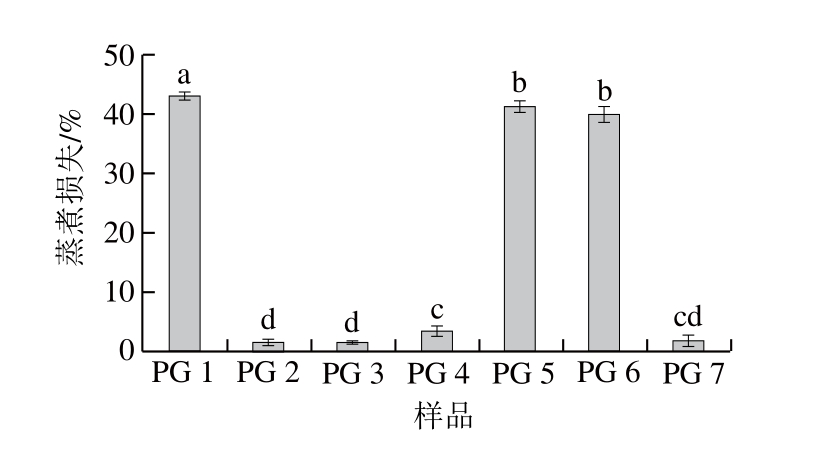
图4 精氨酸/赖氨酸与复合磷酸盐对蛋白凝胶蒸煮损失的影响
Fig. 4 Effects of Arg/Lys and phosphates on the CL of various gels
由图3~4可知,PG 2、3,特别是PG 4、7的保水性显著高于PG 1、5、6(P<0.05),表明PG 2、3、4、7具有更强的保水能力。这可能与PE 2、3、4、7中较高的蛋白浓度,特别是较高的肌球蛋白等盐溶蛋白浓度有关。另一方面,PE 2、3、4、7具有良好的形成三维网络凝胶的能力,这可能有利于保持流动状态的水分,最终导致凝胶的保水性增加,蒸煮损失减少。考虑到在加热前PG 2与PG 5具有相同的pH值,PG 3与PG 6具有相同的pH值,因此在精氨酸/赖氨酸存在条件下,pH值不是引起凝胶保水性增加和蒸煮损失降低的主要原因。PG 2、3的保水性和蒸煮损失显著低于PG 4、7(P<0.05),这可能是由凝胶微观结构的差异导致的。
2.2.2 凝胶强度测定结果

图5 精氨酸/赖氨酸与复合磷酸盐对蛋白凝胶强度的影响
Fig. 5 Effects of Arg/Lys and phosphates on the strength of various gels
凝胶强度是表征蛋白凝胶性质的另一个重要特征。由图5可知,PG 2、3,尤其是PG 4、7的凝胶强度显著高于PG 1、5、6(P<0.05)。此外,PG 4、7具有比PG 2、3更高的凝胶强度(P<0.05),这可能与较高的肌球蛋白等盐溶蛋白浓度以及蛋白溶液的pH值更接近蛋白胶凝的最佳pH值(约6.3)有关[31]。PE 1具有与PE 5、6几乎相同的蛋白浓度,但是其凝胶强度显著高于PG 5、6(P<0.05),这可能是由于与PE 5、6相比,PE 1的pH值更接近盐溶蛋白凝胶化的最佳pH值(约6.3)。这一结果与上文中关于动态流变学特征的描述一致。
2.2.3 凝胶的微观结构测定结果
保水性及凝胶质构特性都与凝胶的微观结构有关[8,13]。由于PE 1、5、6的凝胶强度非常弱,预处理不能顺利进行,因此不能进行SEM分析。
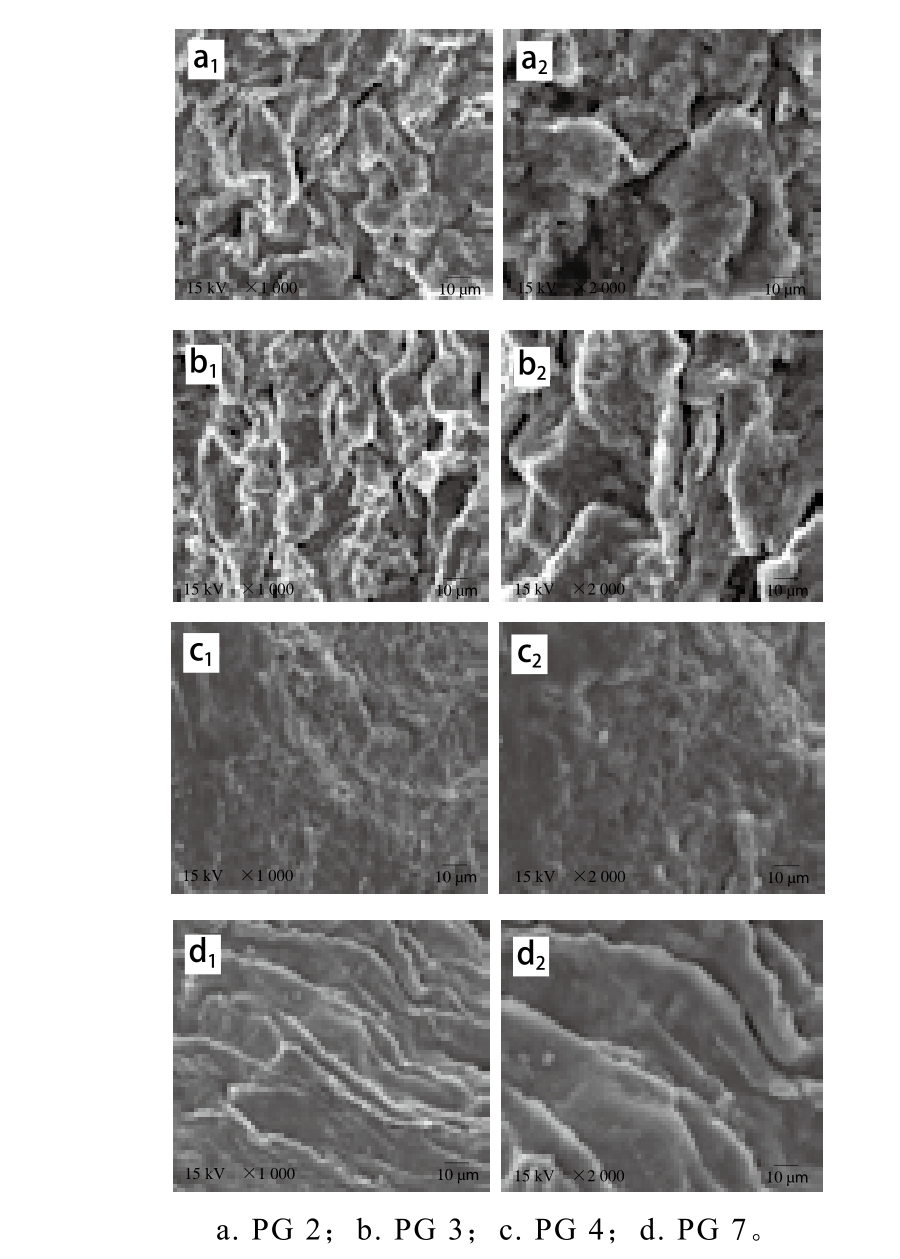
图6 精氨酸/赖氨酸与复合磷酸盐对蛋白凝胶微观结构的影响
Fig. 6 Effects of Arg/Lys and phosphates on themicrostructure of various gels
由图6可知,PG 2、3、4、7均明显观察到连续的三维网络结构,表明它们均具有较好的凝胶形成能力,这与蛋白提取物的动态流变学描述是一致的。另外,PG 2、3形成的凝胶网络结构具有稍大的洞穴,而PG 4、7显示出更加均匀、致密的三维网络凝胶结构,这为PG 4、7具有比PG 2、3更高的持水力和凝胶强度提供了一个合理的解释。
与对照组相比,PG 2、3形成了连续的三维网络凝胶结构。基于目前的研究结果,可以得出结论:0.55 g/100 mL精氨酸/赖氨酸促进了鸡胸肉中盐溶蛋白的提取,使蛋白提取物具有良好的形成连续三维网络凝胶的能力,最终导致所形成的凝胶具有较低的蒸煮损失、较高的持水力和凝胶强度。目前的研究结果有助于理解精氨酸/赖氨酸在提高肉制品产量和品质等方面的作用机制。
与对照组相比,0.55 g/100 mL精氨酸/赖氨酸添加组相应的蛋白提取物的DSC结果表明,出现3 个特征变形峰,动态流变呈现典型的4 个明显的温度区间,所形成的蛋白凝胶具有更好的保水能力和凝胶强度。本研究结果有助于了解精氨酸/赖氨酸提高肉制品保水和质构特性的作用机制。
参考文献:
[1] HAYAKAWA T, YOSHIDA Y, YASUI M, et al. Heat-induced gelation of myosin in a low ionic strength solution containing L-histidine[J].Meat Science, 2012, 90(1): 77-80. DOI:10.1016/j.meatsci.2011.06.002.
[2] GUO Xiuyun, PENG Zengqi, ZHANG Yawei, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015, 170:212-217. DOI:10.1016/j.foodchem.2014.08.045.
[3] LEE H C, KANG I, CHIN K B, et al. Effect of mungbean[Vignaradiata radiata (L.) Wilczek] protein isolates on the microbial transglutaminase-mediated porcine myof i brillar protein gels at various salt concentrations[J]. Meat Science, 2015, 101(9): 2023-2029.DOI:10.1016/j.meatsci.2014.09.035.
[4] HONG G P, CHIN K B. Effects of microbial transglutaminase and sodium alginate on cold-set gelation of porcine myofibrillar protein with various salt levels[J]. Food Hydrocolloids, 2010, 24: 444-451.DOI:10.1016/j.foodhyd.2009.11.011.
[5] YAPAR A, ATAY S, KAYACIER A, et al. Effects of different levels of salt and phosphate on some emulsion attributes of the common carp(Cyprinus carpio L., 1758)[J]. Food Hydrocolloids, 2006, 20: 825-830.DOI:10.1016/j.foodhyd.2005.08.005.
[6] HURTADO S, SAGUER E, TOLDRA M, et al. Porcine plasma as polyphosphate and caseinate replacer in frankfurters[J]. Meat Science,2012, 90(3): 624-628. DOI:10.1016/j.meatsci.2011.10.004.
[7] ZHANG Yawei, ZHANG Lu, HUI Teng, et al. Influence of partial replacement of NaCl by KCl, L-histidine and L-lysine on the lipase activity and lipid oxidation in dry-cured loin process[J]. LWTFood Science and Technology, 2015, 64(2): 966-973. DOI:10.1016/j.lwt.2015.06.073.
[8] CHEN Xing, CHEN Conggui, ZHOU Yanzi, et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids, 2014, 40:262-272. DOI:10.1016/j.foodhyd.2014.03.018.
[9] ZHOU Cunliu, LI Jun, TAN Shengjiang. Effect of L-lysine on the physicochemical properties of pork sausage[J]. Food Science and Biotechnology, 2014, 23(3): 775-780. DOI:10.1007/s10068-014-0104-6.
[10] ZHOU Cunliu, LI Jun, TAN Shengjiang, et al. Effects of L-arginine on physicochemical and sensory characteristics of pork sausage[J].Advance Journal of Food Science and Technology, 2014, 6(5): 660-667.DOI:10.19026/ajfst.6.91.
[11] ZHENG Yadong, XU Peng, LI Shiyi, et al. Effects of L-lysine/L-arginine on the physicochemical properties and quality of sodium-reduced and phosphate-free pork sausage[J]. International Journal of Nutrition and Food Sciences, 2017, 6(1): 12-18. DOI:10.1111/ijfs.13561.
[12] TAKAI E, YOSHIZAWA S, EJIMA D, et al. Synergistic solubilization of porcine myosin in physiologicalsalt solution by arginine[J].International Journal of Biological Macromolecules, 2013, 62(11):647-651. DOI:10.1016/j.ijbiomac.2013.09.035.
[13] QIN Hao, XU Peng, ZHOU Cunliu, et al. Effects of L-arginine on water holding capacity and texture of heat-induced gel of salt-soluble proteins from breast muscle[J]. LWT-Food Science and Technology,2015, 63(2): 912-918. DOI:10.1016/j.lwt.2015.04.048.
[14] HRYNETS Y, OMANA D A, XU Y, et al. Comparative study on the effect of acid- and alkaline-aided extractions on mechanically separated turkey meat (MSTM): chemical characteristics of recovered proteins[J]. Process Biochemistry, 2011, 46(1): 335-343. DOI:10.1016/j.procbio.2010.09.006.
[15] CHEN Xing, LI Yong, ZHOU Ruiyun, et al. L-Histidine improves water retention of heat-induced gel of chicken breast myofibrillar proteins in low ionic strength solution[J]. International Journal of Food Science and Technology, 2016, 51(5): 1195-1203. DOI:10.1111/ijfs.13086.
[16] MA Fei, CHEN Conggui, ZHENG Lei, et al. Effect of high pressure processing on the gel properties of salt-soluble meat protein containing CaCl2and κ-carrageenan[J]. Meat Science, 2013, 95(1): 22-26.DOI:10.1016/j.meatsci.2013.04.025.
[17] TAKAI E, YOSHIZAWA S, EJIMA D, et al. Synergistic solubilization of porcine myosin in physiological salt solution by arginine[J].International Journal of Biological Macromolecules, 2013, 62(11):647-651. DOI:10.1016/j.ijbiomac.2013.09.035.
[18] KRISHNAMURTHY G, CHANG H S, HULTIN H O, et al. Solubility of chicken breast muscle proteins in solutions of low ionic strength[J].Journal of Agricultural and Food Chemistry, 1996, 44(2): 408-415.DOI:10.1021/jf950152r.
[19] COFRADES S, SERRANO A, AYO J, et al. Characteristics of meat batters with added native and preheated defatted walnut[J].Food Chemistry, 2008, 107(4): 1506-1514. DOI:10.1016/j.foodchem.2007.10.006.
[20] 彭增起, 李继红. 磷酸盐混合物对鸡胸肉盐溶蛋白凝胶特性的影响[J]. 食品科学, 2006, 27(7): 58-61. DOI:10.3321/j.issn:1002-6630.2006.07.008.
[21] CHEN X, LI P J, NISHIUMI T, et al. Effects of high-pressure processing on the cooking loss and gel strength of chicken breast actomyosin containing sodium alginate[J]. Food and Bioprocess Technology, 2014, 7(12): 3608-3617. DOI:10.1007/s11947-014-1368-9.
[22] LEI Zhen, FU Yuan, XU Peng, et al. Effects of L-arginine on the physicochemical and gel properties of chicken actomyosin[J].International Journal of Biological Macromolecules, 2016, 92: 1258-1265.DOI:10.1016/j.ijbiomac.2016.08.040.
[23] SUN Jingxin, WU Zhen, XU Xinglian, et al. Effect of peanut protein isolate on functional properties of chicken salt-soluble proteins from breast and thigh muscles during heat-induced gelation[J]. Meat Science, 2012, 91(1): 88-92. DOI:10.1016/j.meatsci.2011.12.010.
[24] DENG Y, ROSENVOLD K, KARLSSON A H, et al. Relationship between thermal denaturation of porcine muscle proteins and waterholding capacity[J]. Journal of Food Science, 2010, 67(5): 1642-1647.DOI:10.1111/j.1365-2621.2002.tb08698.x.
[25] WU Mangang, XIONG Youling, CHEN Jie. Role of disulphide linkages between protein-coated lipid droplets and the protein matrix in the rheological properties of porcine myofibrillar protein-peanut oil emulsion composite gels[J]. Meat Science, 2011, 88(3): 384-390.DOI:10.1016/j.meatsci.2011.01.014.
[26] LASS A, SUESSENBACHER A, WöLKART G, et al. Functional and analytical evidence for scavenging of oxygen radicals by l-arginine[J].Molecular Pharmacology, 2002, 61(5): 1081-1088. DOI:10.1124/mol.61.5.1081.
[27] SCHNEIDER C P, TROUT B L. Investigation of cosolute-protein preferential interaction coeff i cients: new insight into the mechanism by which arginine inhibits aggregation[J]. Journal of Physical Chemistry B,2009, 113(7): 2050-2058. DOI:10.1021/jp808042w.
[28] FELISBERTO M H F, PICONE C S F, CUNHA R L. Effect of prebiotic ingredients on the rheological properties and microstructure of reduced-sodium and low-fat meat emulsions[J]. LWT-Food Science and Technology, 2015, 60(1): 148-155. DOI:10.1016/j.lwt.2014.08.004.
[29] LI Xingke, XIA Wenshui. Effects of chitosan on the gel properties of salt-soluble meat proteins from silver carp[J]. Carbohydrate Polymers,2010, 82(3): 958-964. DOI:10.1016/j.carbpol.2010.06.026.
[30] CHEN Conggui, WANG Rui, SUN Gaojun, et al. Effects of high pressure level and holding time on properties of duck muscle gels containing 1% curdlan[J]. Innovative Food Science and Emerging Technologies, 2010, 11(4): 538-542. DOI:10.1016/j.ifset.2010.05.004.
[31] LESIW T, XIONG Y L. Chicken muscle homogenate gelation properties: effect of pH and muscle fi ber type[J]. Meat Science, 2003,64(4): 399-403. DOI:10.1016/S0309-1740(02)00206-1.
Gelling Properties of Proteins Extracted from Chicken Breast Using Mixed Solutions of NaCl and L-Arginine/L-Lysine
LI Linxian, LI Shiyi, ZHU Xiaoxu, NING Cheng, ZHOU Cunliu*
(College of Food Science and Engineering, Hefei University of Technology, Hefei 230009, China)
Abstract:This paper aimed at the gelling properties of proteins extracted from chicken breast using mixed solutions of 0.55 g/100 mL L-arginine (Arg)/L-lysine (Lys) and 1.5 g/100 mL NaCl. The differential scanning calorimetry and dynamic rheology results showed that compared to the control with NaCl alone, the proteins exhibited three obvious thermal transitions and a four-step process during heating, and higher storage modulus both during heating and cooling. In addition,these proteins had better capacity to form a continuous three-dimensional network together with higher water-holding capacity (WHC) and gel strength, but lower cooking loss (CL). These results suggested that the protein extracts obtained using NaCl solution with added Arg/Lys had excellent thermal gelling properties such as improved WHC and gel strength.
Keywords:L-arginine; L-lysine; salt-soluble meat protein (SSMP); gelling properties
DOI:10.7506/rlyj1001-8123-201806002
收稿日期:2018-03-12
基金项目:国家自然科学基金科学部主任基金项目(21542008)
第一作者简介:李林贤(1994—),女,硕士研究生,研究方向为肉制品加工及副产物综合利用。E-mail:lilinxian@mail.hfut.edu.cn
*通信作者简介:周存六(1970—),男,教授,博士,研究方向为肉制品加工及副产物综合利用。E-mail:zhoucl4@hfut.edu.cn
中图分类号:TS251.55
文献标志码:A
文章编号:1001-8123(2018)06-0006-06
引文格式:
李林贤, 李诗义, 诸晓旭, 等. 氯化钠与L-精氨酸/L-赖氨酸复合提取鸡胸蛋白的凝胶性质[J]. 肉类研究, 2018, 32(6):6-11. DOI:10.7506/rlyj1001-8123-201806002. http://www.rlyj.pub
LI Linxian, LI Shiyi, ZHU Xiaoxu, et al. Gelling properties of proteins extracted from chicken breast using mixed solutions of NaCl and L-arginine/L-lysine[J]. Meat Research, 2018, 32(6): 6-11. DOI:10.7506/rlyj1001-8123-201806002. http://www.rlyj.pub