头孢类药物是以天然头孢菌素C作为原料,经半合成得到的一类β-内酰胺类抗生素[1],对细菌表现出广谱抗菌活性[2],被广泛应用于临床和畜牧渔业[3]。随着我国水产养殖集约化程度的提高,养殖用药增加,往往导致抗生素的滥用[3]。头孢类药物可以引起多种酶、血胆红素含量的升高,引发造血系统功能障碍[4-6]。
欧盟、美国和日本等国家及地区对乳类、肉类及动物内脏中头孢类抗生素的残留量均有严格规定[7-8]。我国目前只明确规定了3 种头孢类药物的最高残留限量[9],分别为头孢氨苄0.2 mg/kg、头孢喹诺0.05 mg/kg、头孢噻呋1.0 mg/kg。
国内外对于头孢类抗生素的检测技术研究以畜禽肌肉、乳、血浆等样品居多[10-20],鱼肉中的头孢类药物检测往往不作为重点,且鲜有报道。国内外报道中头孢类药物的主要检测技术有微生物法、酶联免疫法、毛细管电泳法和色谱法[21-22],一般以液相色谱-串联质谱(high performance liquid chromatography-tandem mass spetrometry,LC-MS/MS)法为仲裁方法。目前,国家标准分析方法中提供了河豚鱼和鳗鱼中5 种头孢类物质残留量的检测方法[23],但该方法缺少对其他鱼类的适用性,且预处理过程试剂用量较大,对样品的净化程度不够,基质效应较大,也容易造成环境污染。本研究以浙江省主要养殖和捕捞区域的乌鳢、草鱼、鳗鱼3 种代表性淡水海鱼为研究对象,建立广泛适用于鱼肉基质中头孢类药物残留检测的LC-MS/MS方法。
1 材料与方法
1.1 材料与试剂
池塘养殖乌鳢,2017年5月取自德清县禹越镇百亩漾生态休闲农庄,体长22.5~32.5 cm,体质量1.25~2.36 kg;池塘养殖草鱼,2017年5月取自浙江恒泽生态农业科技有限公司,体长27.5~29.4 cm,体质量0.98~1.16 kg;海洋捕捞鳗鱼,2017年4月取自温州南麂岛海域,体长43.3~46.1 cm,体质量2.58~3.34 kg。每种鱼类样品各6 批次,每批次6 尾,去皮、去骨后切成0.5 cm见方的肉块,置于搅拌匀浆机中搅成糜状,备用。
头孢氨苄(纯度99.0%)、头孢喹肟(纯度80.1%)、头孢洛宁(纯度95.0%)、头孢匹林(纯度100.0%)、头孢唑啉(纯度96.6%)标准品 德国Dr.Ehrenstorfer公司;乙腈、甲醇、甲酸和正己烷(均为色谱纯) 美国Tedia公司;实验用水均为超纯水。
1.2 仪器与设备
AB-4500 Qtrap液相色谱-串联质谱仪 美国AB Sciex公司;Accucore C18RP-MS色谱柱(2.1 mm×100 mm,2.7 μm) 美国Thermo Fisher公司;Oasis Prime HLB柱(6 mL,200 mg) 美国Waters公司。
1.3 方法
1.3.1 样品处理
称取2.5 g肉糜样品,加入提取溶剂,涡旋振荡/超声15 min,8 000 r/min条件下离心5 min,取上清液。其中,分别选择乙腈、乙腈水溶液(80∶20,V/V)、甲醇和甲醇水溶液(80∶20,V/V)作为提取溶剂,根据提取效果选择合适的提取溶剂。
将Prime HLB小柱(6 mL,200 mg)用3 mL乙腈润湿后上样,样品提取液收集至离心管;氮吹至干,加入2 mL水复溶后振荡1 min,可根据样品性状有选择地加入正己烷除脂;将2 mL复溶后的溶液转移至高速冷冻离心机,12 000 r/min条件下离心10 min,过0.22 μm滤膜,待测。
1.3.2 色谱条件
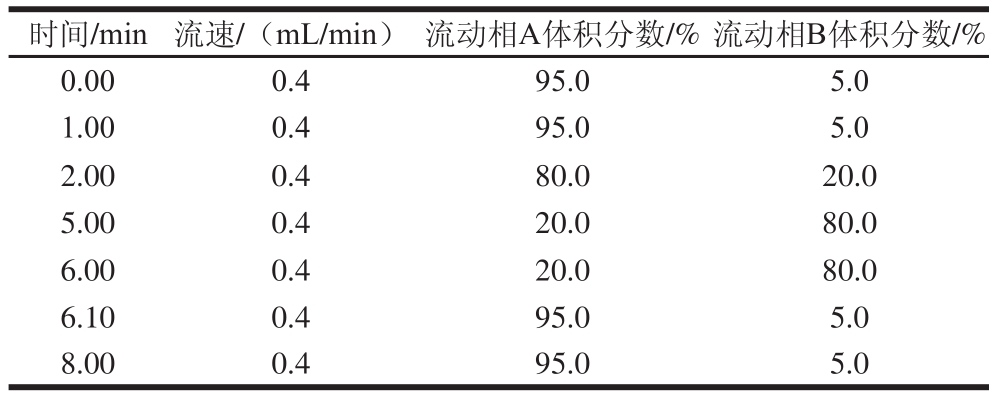
色谱柱:Accucore C18RP-MS(2.1 mm×100 mm,2.7 μm);乙腈为流动相B,梯度洗脱程序如表1所示;流速0.4 mL/min,进样体积5 μL,色谱柱温度30 ℃。
其中,分别选择体积分数0.1%的乙酸水溶液、纯水及体积分数0.1%的乙酸水溶液中加入5 mmol/L乙酸铵作为流动相A,根据目标化合物的分离效果选择合适的流动相。
表1 梯度洗脱程序
Table 1 Gradient elution conditions
1.3.3 质谱条件
电喷雾离子源(electrospray ionization,ESΙ)正离子模式(ESΙ+);多反应监测(multi reaction monitor,MRM);电喷雾电压5 500 V,聚焦电压300 V,去簇电压55 V,碰撞室出口电压20 V;气化温度525 ℃。MRM参数如表2所示。
表2 5 种头孢类药物检测的MRM参数
Table 2 MRM parameters for 5 cephalosporins
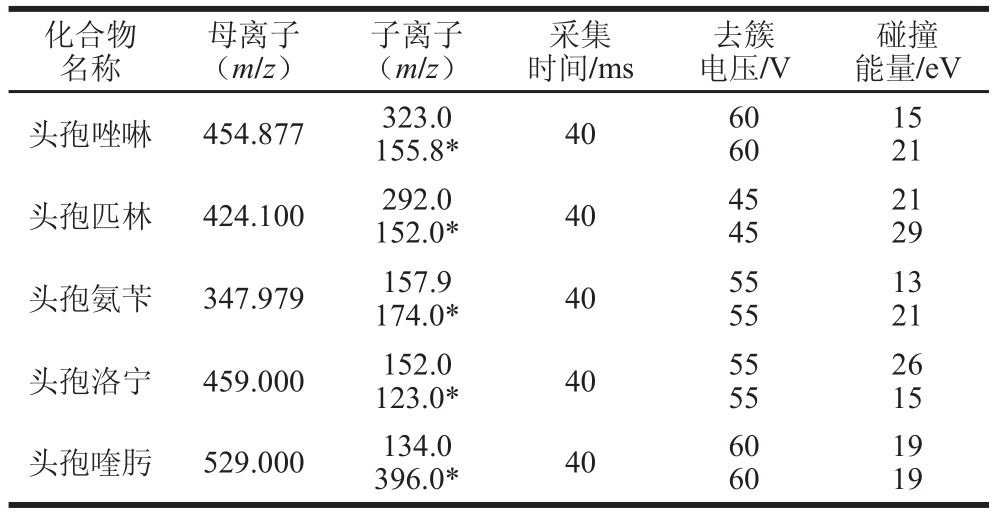
注:*. 定性离子。
1.3.4 基质标准曲线的绘制
用水配制质量浓度为100 μg/mL的标准储备液,4 ℃贮存,根据需要稀释为适当质量浓度的标准工作液。
采用外标法定量,因此需绘制基质标准曲线。将阴性鱼糜样品基质按照1.3.1节中的方法处理,待氮吹至提取液体积为5 mL左右时加入5 种标准物质,使其质量浓度均分别为0、10、25、50、75 μg/L,继续氮吹至干后,复溶、冷冻、离心、过滤。以基质标准工作溶液中5 种头孢类药物的质量浓度为横坐标,对应定量离子的色谱峰面积为纵坐标绘制标准曲线。
1.3.5 目标化合物的定性和定量
使用Sciex-Analyst软件,根据MRM参数扫描对5 种头孢类药物进行定性,试样中被测组分的含量按照下式计算。
式中:X为试样中被测组分的含量/(μg/kg);ρ为由基质标准曲线得到的试样中被测组分的质量浓度/(ng/mL);V为试样定容体积/mL;m为试样质量/g。
1.4 数据处理
采用Excel 2016软件对所得数据进行统计、处理及绘图。
2 结果与分析
2.1 实验条件的优化
2.1.1 提取溶剂的选择
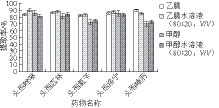
图1 不同提取溶剂的单次提取效果比较
Fig. 1 Comparison of extraction effi ciencies of cephalosporins with different solvents
由图1可知:乙腈水溶液对各组分的提取率均较高,但提取液中的水分去除较为繁琐且费时,影响检测结果的精密度和检测效率;甲醇和甲醇水溶液对头孢喹肟和头孢氨苄的提取率不高;纯乙腈对各组分的提取率均相对较高,而且净化后浓缩方便快捷,目前国内外文献报道中动物肌肉组织中头孢类药物的提取溶剂也以乙腈或乙腈水溶液为主[24-30],因此本研究选择纯乙腈作为提取溶剂。
2.1.2 固相萃取柱的选择
相较于GB/T 22960—2008《河豚鱼和鳗鱼中头孢唑林、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟残留量的测定 液相色谱-串联质谱法》[23]中采用的大体积提取液加旋转蒸发的净化方式,本研究采用小体积提取液加Prime HLB固相萃取的方式进行样品净化。Prime HLB柱对于基质中的蛋白质、脂类等杂质具有明显的净化作用[24],且相较于传统的固相萃取柱,Prime HLB柱不需要经过“活化-上样-淋洗-洗脱”这一过程,可以直接将提取液过柱后收集待用,大大缩短了过柱时间,提高了检测效率,与其他文献报道中的结论相符[26]。
对于脂类含量较高的基质,经Prime HLB柱净化的样品可以进一步加入正己烷除脂,充分振荡、离心后,弃去正己烷层,并将提取液冷冻(4 ℃)离心。实验表明,在12 000 r/min条件下,至少需要离心10 min,使得蛋白质在低温条件下迅速絮集、下沉,进一步提高样品提取液的纯度,减少基质效应。
2.1.3 流动相A的选择
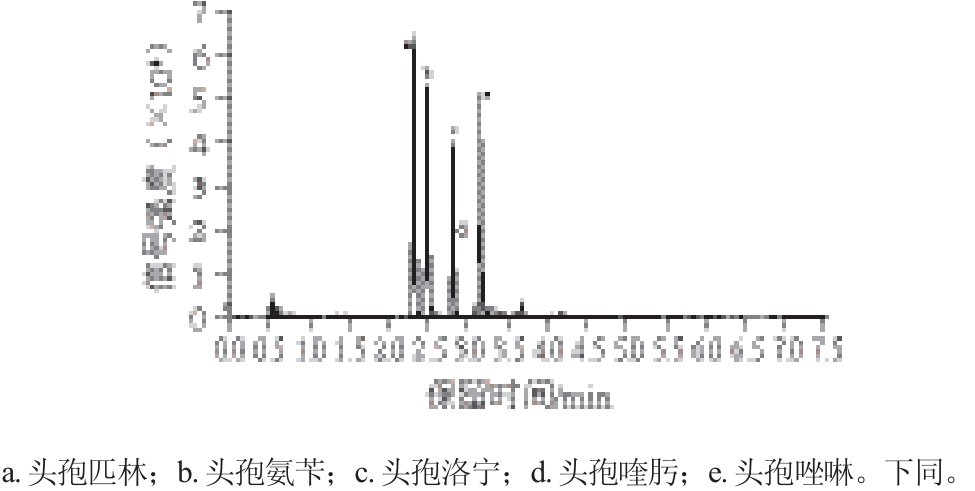
图2 乙酸水溶液作为流动相A的色谱图
Fig. 2 Chromatogram for separation of cephalosporins using aqueous acetic acid as mobile phase A
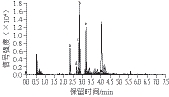
图3 乙酸水溶液中加入5 mmol/L乙酸铵作为流动相A的色谱图
Fig. 3 Chromatogram for separation of cephalosporins using aqueous acetic acid with 5 mmol/L ammonium acetate as mobile phase A
由图2~4可知:体积分数0.1%的乙酸水溶液作为流动相A时,分离得到的色谱峰峰型良好,信号强度相对均衡,不会出现不同物质间信号强度差异太大的情况,适合5 种头孢类药物的分离;体积分数0.1%的乙酸水溶液中加入5 mmol/L乙酸铵作为流动相A时,对药物信号强度的抑制较强;纯水作为流动相A时,不同药物间的信号强度差异较大,容易造成定量不准确。因此选择体积分数0.1%的乙酸水溶液作为流动相A。

图4 纯水作为流动相A的色谱图
Fig. 4 Chromatogram for separation of cephalosporins using pure water as mobile phase A
2.2 5 种头孢类药物的MRM总离子流色谱图
5 种头孢类药物的MRM总离子流色谱图如图5所示。

图5 5 种头孢类药物的MRM总离子流色图谱
Fig. 5 Total ion current (TIC) chromatogram of 5 cephalosporins under MRM mode
2.3 线性范围、检出限和定量限
表3 5 种头孢类药物的线性范围、回归方程和相关系数
Table 3 Linear ranges, regression equations and correlation coeffi cients for 5 cephalosporins

由表3可知,5 种头孢类药物在0~75 μg/kg范围内线性良好。
在本研究的实验条件下,对添加较低量的5 种头孢类药物的空白鱼肉样品进行测定,以3 倍信噪比(RS/N=3)和10 倍信噪比(RS/N=10)确定出5 种头孢类药物的检出限和定量限分别为0.5 μg/kg和2.0 μg/kg。
2.4 准确度、精密度及重复性
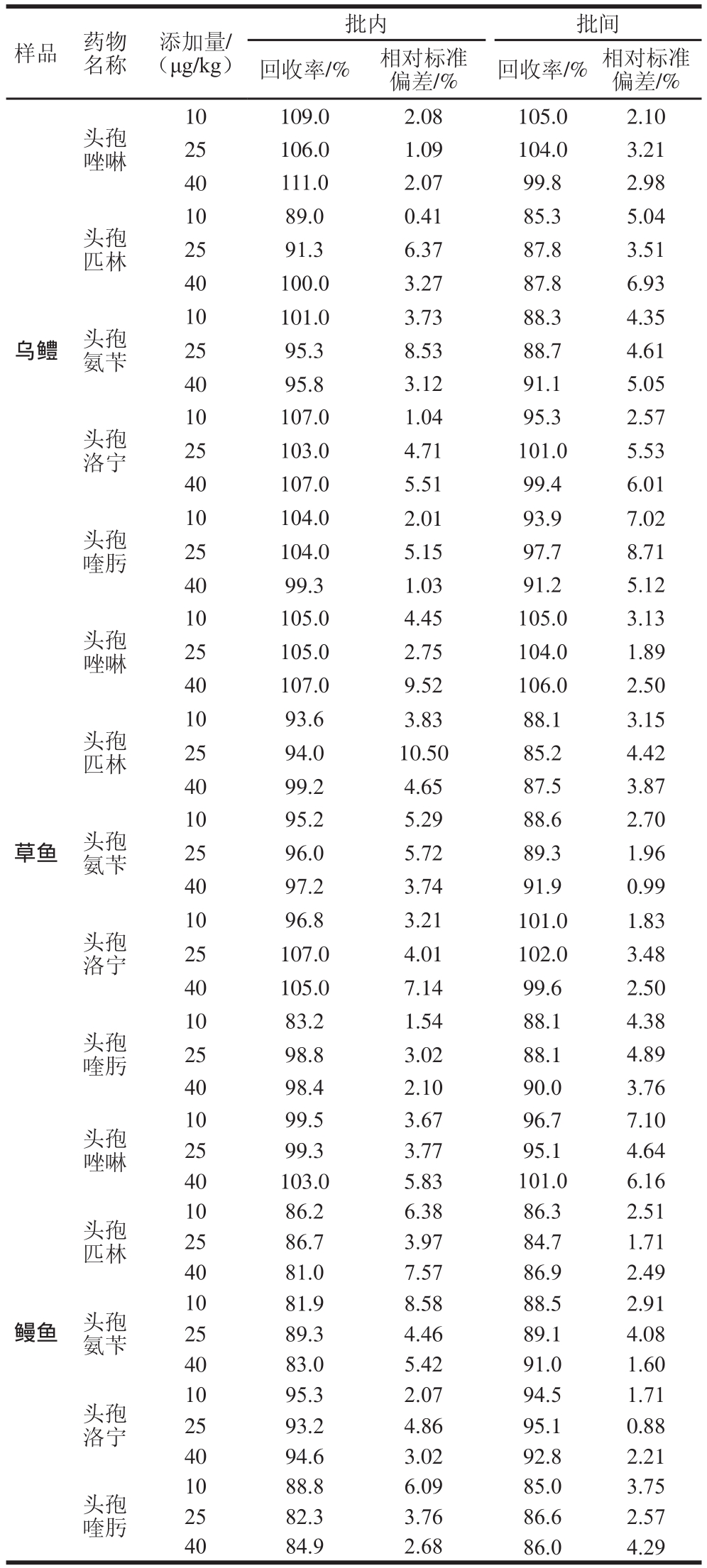
以10、25、40 μg/kg 3 个水平向样品中加入标准物质,样品共6 批次,每个批次设6 个平行样。由表4可知:批内平均加标回收率为81.0%~111.0%,相对标准偏差为0.41%~10.50%;批间平均加标回收率为84.7%~106.0%,相对标准偏差为0.88%~8.71%。经差异显著性分析,3 种鱼肉基质中3 个加标水平的5 种头孢类药物的批内和批间回收率均无显著性差异。
表4 5 种头孢类药物的准确度、精密度及重复性测定结果(n=6)
Table 4 Accuracy and precision of the method (n=6))
2.5 实际样品测定
从本中心实验室各类样品中抽取50 批次来自全省各地周边海域及养殖场的海鱼和淡水鱼作为实际样品,其中草鱼11 批次、黄颡鱼10 批次、鳜鱼5 批次、鲫鱼10 批次、大黄鱼5 批次、乌鳢4 批次、鳗鱼5 批次,采用本研究确定的方法进行测定,同时进行质量控制加标回收实验。结果表明,50 批次样品均未检出上述5 种头孢类药物残留。
2.6 与国标方法的比较
与国标方法对比,本研究所确定方法的优势体现在以下几方面:1)提取溶剂体积由35 mL减少至8 mL,节约了有机试剂用量,减少了对环境的污染;2)样品净化方式由液-液萃取改为固相萃取,能更有效地去除杂质,减少基质效应;3)基质种类由河豚鱼、鳗鱼增加至养殖量更大、养殖范围更广的乌鳢、草鱼和鳗鱼,拓展了方法的应用范围;4)质谱进样时间由15 min减少至8 min,提高了检测效率。
3 结 论
本研究采用LC-MS/MS技术建立鱼肉基质中头孢氨苄、头孢喹肟、头孢洛宁、头孢唑啉和头孢匹林5 种头孢类药物残留量的检测方法,通过绘制基质标准曲线,发现方法准确度和精密度在头孢类药物痕量时仍然符合实验要求。与现有国标方法相比,本研究确定的方法弥补了样品基质、方法普及度方面的不足,降低了检出限和定量限,节约了试剂用量和预处理时间,满足国内外对于头孢类药物残留的检测要求。
参考文献:
[1] 伍艳. 头孢菌素类药物的不良反应分析[J]. 中国当代医药, 2012,19(13): 170-171. DOΙ:10.3969/j.issn.1674-4721.2012.13.095.
[2] 薛雨, 陈宇瑛. 头孢菌素类抗生素的最新研究进展[J]. 中国抗生素杂志, 2011, 36(2): 86-92.
[3] 潘葳, 罗钦, 刘文静. 水产品与水产饲料中药物残留问题的分析及对策[J]. 福建农业学报, 2011, 26(6): 1096-1100. DOΙ:10.3969/j.issn.1008-0384.2011.06.034.
[4] 吴向文. 头孢菌素类药物的作用特点不良反应及合理应用[J]. 基层医学论坛, 2009, 13(17): 560-562. DOΙ:10.3969/j.issn.1672-1721.2009.17.062.
[5] 杨丽. 头孢菌素类药物的不良反应及临床对策[J]. 中国医药导刊,2010, 12(1): 102-103. DOΙ:10.3969/j.issn.1009-0959.2010.01.057.
[6] 屈伟红. 头孢菌素类药物的不良反应及临床对策[J]. 医学理论与实践, 2011, 24(9): 1047-1048. DOΙ:10.3969/j.issn.1001-7585.2011.09.038.
[7] 中国食品安全资源数据库[EB/OL]. (2007-06-28) [2017-10-02].http://www.fsr.org.cn/.
[8] The Japan Food Chemical Research Foundation. Maximum residue limits (MRLs) list of agricultural chemicals in foods[EB/OL]. (2005-11-29) [2017-10-02]. http://www.m5.ws001.squarestart.ne.jp/foundation/agrall.php.
[9] 中华人民共和国农业部. 中华人民共和国农业部公告第235号[EB/OL].(2002-12-24) [2017-10-02]. http://jiuban.moa.gov.cn/zwllm/nybz/200803/t20080304_1028649.htm.
[10] KARAGEORGOU E, MYRIDAKIS A, STEPHANOU E G, et al.Multiresidue LC-MS/MS analysis of cephalosporins and quinolones in milk following ultrasound-assisted matrix solid-phase dispersive extraction combined with the quick, easy, cheap, effective, rugged,and safe methodology[J]. Journal of Separation Science, 2013, 36(12):2020-2027. DOI:10.1002/jssc.201300194.
[11] PEREZ B R, GRZELAKB E M, GOKCEC G, et al. Quechers methodologies as an alternative to solid phase extraction (SPE) for the determination and characterization of residues of cephalosporins in beef muscle using LC-MS/MS[J]. Journal of Chromatography B, 2012,899: 57-65. DOI:10.1016/j.jchromb.2012.05.002.
[12] JIN H E, JIN S E, MAENG H J. Recent bioanalyticalmethods for quantification of third-generation cephalosporins using HPLC and LC-MS(/MS) and their applications in pharmacokinetic studies[J].Biomedical Chromatography, 2014, 28: 1565-1587. DOI:10.1002/bmc.3330.
[13] 郭海霞, 肖桂英, 张禧庆, 等. QuEChERS-超高效液相色谱-串联质谱法同时检测猪肉中121 种兽药[J]. 色谱, 2015, 33(12): 1242-1250.DOΙ:10.3724/SP.J.1123.2015.09016.
[14] 白国涛, 储晓刚, 潘国卿, 等. 超高效液相色谱-串联质谱法测定牛肉中9 种头孢菌素类药物残留[J]. 色谱, 2009, 27(4): 417-420.DOΙ:10.3321/j.issn:1000-8713.2009.04.007.
[15] 吴强, 何生虎, 陈娟, 等. 超高效液相色谱-串联质谱法测定牛羊肉中7 种β-内酰胺类抗生素的残留量[J]. 动物医学进展, 2015, 36(6): 64-68.DOΙ:10.3969/j.issn.1007-5038.2015.06.013.
[16] 班付国, 胡兴娟, 吴宁鹏, 等. 超高效液相色谱-串联质谱法测定猪肉中66 种兽药残留的研究[J]. 中国兽药杂志, 2014, 48(6): 40-51.
[17] 孙雷, 张骊, 汪霞, 等. 超高效液相色谱-串联质谱法对动物源性食品中13 种β-内酰胺类药物残留的检测[J]. 分析测试学报, 2009, 28(5):576-580. DOΙ:10.3969/j.issn.1004-4957.2009.05.015.
[18] 张秀尧, 蔡欣欣. 超高效液相色谱-三重四极杆质谱法快速同时测定牛奶中53 种β-内酰胺类抗生素及其代谢产物的残留[J]. 色谱, 2014,32(7): 693-701. DOΙ:10.3724/SP.J.1123.2014.03019.
[19] 崔风云, 张朝晖, 李建辉, 等. 分散固相萃取-超高效液相色谱串联质谱法测定牛肉中7 种头孢菌素类药物及其代谢物[J]. 食品安全质量检测学报, 2016, 7(2): 575-583.
[20] 范志影, 刘庆生, 石冬冬, 等. 液相色谱-串联质谱法同时测定生鲜乳中四环素类和β-内酰胺类药物残留[J]. 中国畜牧杂志, 2013, 49(9):74-77. DOΙ:10.3969/j.issn.0258-7033.2013.09.019.
[21] 范莹莹, 其鲁, 杨树民. 高效液相色谱与质谱联用检测猪肉中头孢类抗生素的残留[J]. 现代科学仪器, 2007, 17(6): 84-88.
[22] 胡佳丽, 刘小雷, 于东升. 动物源食品中β-内酰胺类抗生素残留的检测现状[J]. 中国畜牧兽医, 2014, 41(1): 226-231.
[23] 中华人民共和国秦皇岛出入境检验检疫局. 河豚鱼和鳗鱼中头孢唑林、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟残留量的测定液相色谱-串联质谱法: GB/T 22960—2008[S]. 北京: 中国标准出版社, 2008.
[24] LI Weiqing, SHEN Haiying, HONG Yunhe, et al. Simultaneous determination of 22 cephalosporins drug residues in pork muscle using liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B,2016, 1022: 298-307. DOI:10.1016/j.jchromb.2016.04.026.
[25] MATTHIAS B, ERHARD Z, MICHAEL P. Residue analysis of 15 penicillins and cephalosporins in bovine muscle, kidney and milk by liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2004, 520: 19-32. DOI:10.1016/j.aca.2004.04.022.
[26] WANG Jianfeng, FAN Xiaojing, LIU Yan, et al. Extraction optimization of sixteen cephalosporins in milk by filtered solid phase extraction and ultra high pressure liquid chromatography coupled to tandem mass spectrometry[J]. Analytical Methods, 2017(9): 1282-1289.DOI:10.1039/c6ay03444f.
[27] HOU Xiaolin, WU Yinliang, LÜ Yan, et al. Development and validation of an ultra high performance liquid chromatography tandem mass spectrometry method for determination of 10 cephalosporins and desacetylcefapirin in milk[J]. Journal of chromatography B, 2013, 931:6-11. DOI:10.1016/j.jchromb.2013.05.006.
[28] 顾蓓乔, 梅光明, 喻亮, 等. 液相色谱-质谱联用法测定水产品头孢菌素类残留量[J]. 浙江海洋学院学报(自然科学版), 2015, 34(3): 222-226.DOΙ:10.3969/j.issn.1008-830X.2015.03.003.
[29] 刘世娟, 王海涛, 徐雅芜, 等. 凝胶渗透色谱/液相色谱串联质谱法测定畜禽及水产品组织中头孢喹肟的残留量[J]. 分析测试学报, 2012,31(4): 480-485. DOΙ:10.3969/j.issn.1004-4957.2012.04.020.
[30] 倪梅林, 崔晓美, 殷居易, 等. 动物组织与水产品中头孢氨苄残留量的液相色谱-串联质谱检测[J]. 分析测试学报, 2009, 28(4): 489-492.DOΙ:10.3969/j.issn.1004-4957.2009.04.025.