传统酸肉为风味独特的发酵产品,色鲜味美,是侗、苗、布依族等少数民族生活中的重要肉食产品[1],深受民众喜爱。但传统酸肉加工受季节的限制,只能一次发酵、多次食用,生产工艺为依据传统经验进行的自然发酵,发酵周期长,一般需要3~6 个月才能食用,民间生产的差异性和随机性很大,发酵条件难控制,产品质量参差不齐;其次,传统加工主要靠高浓度的食盐腌制来延长产品的保质期,长期食用对人体健康有害。为改进传统酸肉的生产工艺,以适应现代化规模生产的要求,一些学者进行了工艺改良研究:代小容[2]对渝黔地区传统酸肉的生产工艺进行优化,减少食盐用量至4.5%,但发酵时间仍需60 d;姜亚等[3]以酸肉的挥发性盐基氮含量、酸价、过氧化值以及亚硝酸盐含量为评价指标,应用L9(34)正交试验优化酸肉发酵工艺,结果表明,糯米粉添加量、食盐添加量、发酵温度和发酵时间4 种因素是影响酸肉安全的主要因素,但发酵时间为2 个月。
自然发酵酸肉中的优势菌群主要是乳杆菌属和片球菌属,其生长代谢与酸肉滋味的形成密切相关[4],通过接种发酵剂能够改进传统发酵肉制品的生产工艺。孔保华等[5]将分离自传统发酵制品的乳酸菌接种到哈尔滨风干肠中,发现这能够改善产品品质、缩短产品的生产周期。Erkkil等[6]将乳酸菌接种于发酵香肠中,发现乳酸菌会迅速增殖成为优势菌,并在40 h内使pH值降低至5以下。Nie Xiaohua等[7]研究植物乳杆菌和戊糖片球菌对发酵肉制品蛋白质水解特性的影响,结果表明,二者有助于发酵肉制品风味的形成。Andreja等[8]用清酒乳杆菌和木糖葡萄球菌生产干发酵香肠,发现游离脂肪酸的含量显著增加,尤其是油酸和亚油酸,这有助于产品营养和风味的提高。Casaubri等[9]将S. xylosus CVS11、L. curvatus AVL3、S. xylosus FVS21接种在意大利香肠中,使得香肠中的蛋白质发生了水解,肌球重链蛋白显示出比肌动蛋白更易降解的特性,同时产品中游离氨基酸和非蛋白氮的含量大大增加。
为使传统酸肉制品满足现代消费者对营养性和安全性的需求,深入研究有益微生物在酸肉发酵中的作用和功能,开发优良的肉制品发酵剂具有十分重要的意义。本研究利用2 株源于贵州侗族原生态酸肉制品的乳酸菌,将其混合,作为发酵剂应用于低盐型酸肉的发酵,以pH值和感官评价为指标,通过单因素及正交试验对酸肉发酵工艺进行优化,确定酸肉快速发酵的工艺参数。并对采用优化工艺制作的酸肉不同发酵时期的质量指标变化情况进行动态监测与分析,以期得到适合酸肉生产的发酵工艺,为实现传统酸肉的标准化生产、缩短生产周期、降低食盐用量以及提高产品风味和营养提供参考。
1 材料与方法
1.1 材料与试剂
新鲜猪五花、干辣椒粉、食盐、花椒、姜均为市售,糯米为侗族特产的香禾糯,辣椒为侗族地区特产。
本研究所采用的2 株乳酸菌为弯曲乳杆菌SR6(Lactobacillus curvatus SR6)和戊糖片球菌SR4-2(Pediococcus pentosaceus SR4-2),由实验室前期从侗族酸肉样品中分离鉴定[10],再经过抗氧化性复筛获得[11]。在耐受能力实验中,2 株乳酸菌均表现出良好的耐酸、耐渗透压、耐亚硝酸盐及人工模拟胃肠液耐受能力,可用于功能性发酵肉食品的开发[12-13]。对照组为不添加乳酸菌,按照传统工艺加工的自然发酵型酸肉。
MRS培养基、平板计数琼脂(plate count agar,PCA)培养基、VRBD琼脂培养基 北京陆桥技术股份有限公司;氢氧化钠、邻苯二甲酸氢钾、硝酸银(均为分析纯) 贵州省博奥瑞杰生物技术有限公司。
1.2 仪器与设备
WSC-3B型便携式精密色差仪 上海仪电物理光学仪器有限公司;HPX-9082 MBE型数显电热培养箱上海博迅实业有限公司医疗设备厂;HZQ-X100型恒温振荡培养箱 太仓市实验设备厂;Testo205型便携式pH计 深圳德图仪表有限公司;HD-4型智能水分活度测量仪 无锡市华科仪器仪表有限公司;L-8800型氨基酸自动分析仪 日本Hitachi公司。
1.3 方法
1.3.1 酸肉制作工艺
课题组到贵州省黔东南苗族侗族自治州黎平县侗族村寨进行实地考察,侗族酸肉的制作工艺如图1所示。

图1 酸肉制作工艺流程
Fig. 1 Flow chart of sour meat production
1.3.2 单因素试验
以感官评分和pH值为评价指标,分别考察食盐添加量、发酵剂接种量、糯米饭添加量和发酵温度对发酵酸肉产品的影响。每个样品的原料肉质量为500 g。
将食盐添加量分别设为4%、6%、8%、10%、12%,发酵剂接种量2%,糯米饭添加量45%,15 ℃条件下发酵30 d;将发酵剂接种量分别设为0.5%、1.0%、2.0%、3.0%、4.0%(弯曲乳杆菌SR6∶戊糖片球菌SR4-2=1∶1),食盐添加量8%,糯米饭添加量45%,15 ℃条件下发酵30 d;将糯米饭添加量分别设为35%、40%、45%、50%、55%,食盐添加量8%,发酵剂接种量2.0%,15 ℃条件下发酵30 d;将发酵温度分别设为5、10、15、20、25 ℃,食盐添加量8%,发酵剂接种量2%,糯米饭添加量45%,发酵30 d。以上条件比例均以占五花肉的质量百分比计算。
1.3.3 正交试验
在单因素试验结果的基础上设计正交试验,确定酸肉的最佳制作工艺。正交试验因素及水平如表1所示。
表1 酸肉制作工艺正交试验因素及水平
Table 1 Coded levels and corresponding actual levels of independent variables used in orthogonal array design

1.3.4 产品的感官评价
参考俞彦波等[14]的方法。由10 名专业人士组成品评小组,分别对产品的颜色、风味进行打分,进行综合感官评价,满分100 分。酸肉的感官评分标准如表2所示。
表2 酸肉的感官评分标准
Table 2 Criteria for sensory evaluation of sour meat

1.3.5 微生物测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[15]和GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》[16]。
1.3.6 理化指标测定
在制作2 组酸肉后立即收集样品(即发酵0 d)进行测定,之后在发酵15、30、60、90、120、150、180 d时分别取样测定。
1.3.6.1 pH值
将样品切成2 cm厚,用Testo205便携式pH计进行测定。
1.3.6.2 总酸含量
参照李华丽[17]的方法。
1.3.6.3 氨基酸态氮含量
参照李华丽[17]的方法。
1.3.6.4 水分含量
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[18]中的直接干燥法。
1.3.6.5 水分活度
将样品放至室温后切碎,铺满样品盒底面,注意装样量为样品盒高度的一半。采用HD-4型智能水分活度测量仪测定样品的水分活度。
1.3.6.6 氯化钠含量
采用间接滴定法[19]测定酸肉的氯化钠含量。
1.3.6.7 色差
将样品切成1 cm厚,用WSC-3B便携式精密色差仪进行测定,分别测定酸肉切片的亮度值(L*)、红度值(a*)和黄度值(b*)。
1.3.6.8 游离氨基酸含量
仪器分析条件:2619#离子交换色谱柱(4.6 mm×150 mm);洗脱液流速0.225 mL/min;茚三酮流速0.3 mL/min;柱压80~130 kg/cm2;茚三酮压力15~35 kg/cm2;氮气压力0.28 kg/cm2;柱温53 ℃;标准样品浓度3 nmol/50 μL;每个样品的分析时间为74 min。以外标法通过峰面积计算样品测定液中氨基酸的含量[20]。
1.4 数据处理
所有实验均重复3 次,结果表示为平均值±标准差。使用Origin 8.6软件作图,使用SPSS 17.0软件对数据进行统计和方差分析(P<0.05),判定数据间的差异显著性。
2 结果与分析
2.1 单因素试验结果
2.1.1 食盐添加量的选择
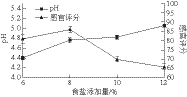
图2 食盐添加量对酸肉pH值和感官评分的影响
Fig. 2 Effect of salt on pH value and sensory evaluation score
由图2可知,对于产酸速率,食盐添加量为8%时,发酵30 d可以使酸肉的pH值达到(4.76±0.05),产酸速率较为适中,此时酸肉的感官评分最高,为(86.00±1.88) 分。食盐添加量为4%的酸肉样品腌制7 d后已腐烂变质,弃去。因此选择食盐添加量为6%、8%、10%进行正交试验。盐用量对酸肉的pH值影响较大,食盐用量越少pH值降低越快,表明食盐对乳酸菌产酸有抑制作用。食盐能够降低发酵肉的水分活度,影响微生物的渗透压[21],因此盐浓度的选择要考虑抑制微生物与防止过度产酸两方面。
2.1.2 发酵剂接种量的选择

图3 发酵剂接种量对酸肉pH值和感官评分的影响
Fig. 3 Effect of inoculum size on pH value and sensory evaluation score
由图3可知,随着发酵剂接种量的增加,酸肉的pH值下降速率变快。接种量为2.0%时,酸肉的pH值降至(4.11±0.03),接种量为3.0%时降至3.9以下。接种量为0.5%~2.0%时,酸肉的感官评分随接种量增大而升高;接种量大于2.0%之后,由于酸味刺激导致感官评分下降。考虑到酸肉保存时间较长、后期乳酸菌继续发酵会导致其酸度过高以及生产成本等因素,选择发酵剂接种量0.5%、1.0%、2.0%进行正交试验。
2.1.3 糯米饭添加量的选择
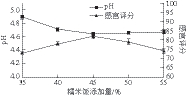
图4 糯米饭添加量对酸肉pH值和感官评分的影响
Fig. 4 Effect of glutinous rice on pH value and sensory evaluation score
由于肉中碳水化合物较少,按少数民族传统工艺配方在酸肉中添加糯米饭,其可作为乳酸菌生长分解碳水化合物的底物,也为酸肉提供了独特的口感和风味。由图4可知,糯米饭的添加量直接影响着酸肉的pH值和感官品质。糯米饭添加量增加有利于乳酸菌产酸,添加量为35%~45%时,酸肉pH值随添加量的增大下降明显,感官评分随之升高;糯米饭添加量大于45%时,酸肉pH值基本保持不变,这可能是由于在30 d的发酵时间内乳酸菌对碳源的利用率有限,而糯米饭添加量过高会影响酸肉口感,感官评分下降。因此,选择糯米饭添加量为40%、45%、50%进行正交试验。
2.1.4 发酵温度的选择
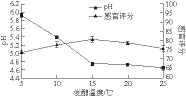
图5 发酵温度对酸肉pH值和感官评分的影响
Fig. 5 Effect of fermentation temperature on pH value and sensory evaluation score
由图5可知,发酵温度越高,酸肉的pH值越低。5~15 ℃温度范围内发酵时,酸肉pH值下降速率加快,15~25 ℃发酵时,酸肉pH值下降较为缓慢。发酵温度15 ℃,发酵至30 d时,酸肉的pH值达(4.74±0.04),此时感官评分最高,为(81.00±1.67) 分。在能够达到所需pH值的基础上,考虑到后期酸肉的继续发酵及合适的贮藏温度,结合贵州少数民族地区制作酸肉的季节为秋、冬季,温度较低,因此选择发酵温度为10、15、20 ℃进行正交试验。
2.2 正交试验结果
表3 正交试验结果与分析
Table 3 Orthogonal array design with experimental results
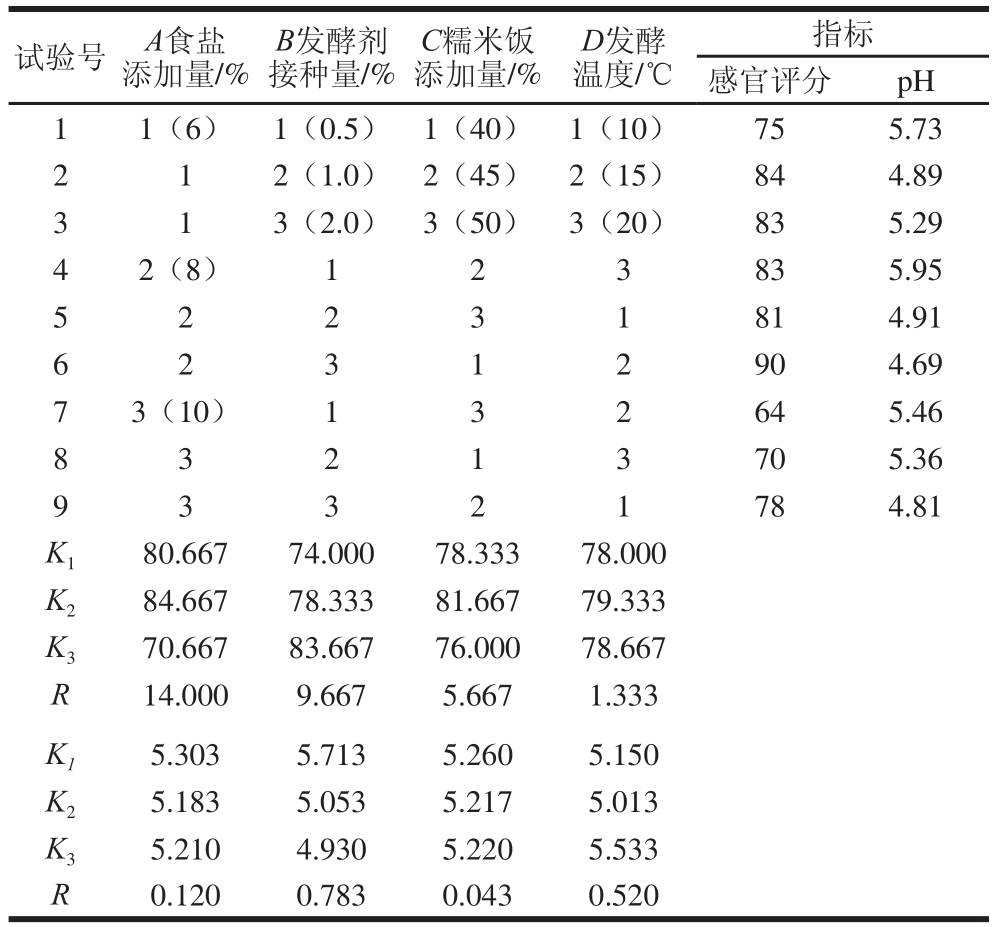
由表3可知:从感官品质来看,酸肉的感官评分越高越好,因此最优水平为A2B3C2D2;从pH值来看,低pH值有利于产品保存,因此最优水平也为A2B3C2D2,即食盐添加量8%、发酵剂接种量2.0%、糯米饭添加量45%、发酵温度15 ℃。
表4 正交试验结果方差分析表
Table 4 Analysis of variance of the experimental results of orthogonal array dessiiggnn

注:*. 影响显著(P<0.05)。
由表4可知,食盐添加量、发酵剂接种量对酸肉的感官评分均影响显著(P<0.05),4 个因素的影响主次顺序为食盐添加量(A)>发酵剂接种量(B)>糯米饭添加量(C)>发酵温度(D),说明食盐添加量的影响作用最大,此结果与李华丽[17]的研究结果一致。发酵剂接种量、发酵温度对酸肉的pH值均影响显著(P<0.05),4 个因素的影响主次顺序为发酵剂接种量(B)>发酵温度(D)>食盐添加量(A)>糯米饭添加量(C),说明乳酸菌的接种量直接影响酸肉的pH值,而乳酸菌在发酵过程中受温度影响较大。
发酵期间的产酸速率越快,则越能抑制杂菌生长,缩短发酵周期,因此制作酸肉时要在较短的时间内使其pH值快速下降到较低水平,并且要保证产品的酸味柔和、不刺激。根据正交试验结果,综合考虑各因素对酸肉感官评分和pH值影响的主次顺序和感官评分仅提供参考这一客观因素,确定酸肉的最佳制作工艺条件为A2B3C2D2,即食盐添加量8%、发酵剂接种量2%、糯米饭添加量45%、发酵温度15 ℃。在此条件下进行验证实验,酸肉的感官评分为(92.00±1.55) 分,pH值为(4.67±0.08)。
2.3 采用优化工艺制作的酸肉发酵期间的质量指标变化
2.3.1 微生物的动态变化

图6 酸肉发酵期间的菌落总数和乳酸菌数变化
Fig. 6 Changes in total bacterial count and lactic acid bacteria count during fermentation
由图6可知,酸肉发酵过程中的菌落总数呈先上升后下降的趋势。发酵0~30 d时,自然发酵组酸肉的菌落总数由(5.29±0.21) (lg(CFU/g))上升到(7.02±0.24) (lg(CFU/g)),乳酸菌数由(4.81±0.22) (lg(CFU/g))上升到(6.93±0.38) (lg(CFU/g));接菌组酸肉的菌落总数由(7.93±0.23) (lg(CFU/g))上升到(9.37±0.25) (lg(CFU/g)),乳酸菌数由(6.05±0.18) (lg(CFU/g))上升到(8.73±0.32) (lg(CFU/g))。以上结果表明,酸肉自然发酵过程中主要是乳酸菌属等厌氧细菌数量增加。但是自然发酵组酸肉发酵60 d后乳酸菌才逐渐形成优势,乳酸菌数达7.32 (lg(CFU/g)),而接种乳酸菌发酵的酸肉,其乳酸菌数在发酵30 d时就显著高于自然发酵组发酵60 d的乳酸菌数(P<0.05)。在发酵后期,接菌组和自然发酵组酸肉的乳酸菌数均先缓慢下降,然后维持在一定数量级动态变化,但接菌组酸肉的乳酸菌数依然高于自然发酵组,说明乳酸菌在发酵过程中占据优势,加快产品成熟,抑制其他腐败菌和致病菌的生长繁殖,保障产品安全[22]。这与Xanthopulos等[23]报道的乳酸菌在发酵和成熟过程中均保持优势菌地位,从而控制发酵全过程相一致。
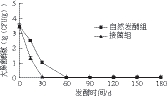
图7 酸肉发酵期间的大肠菌群变化
Fig. 7 Change in coliform count of sour meat during fermentation
由图7可知,接菌组和自然发酵组酸肉的初始大肠菌群数分别为(3.45±0.13)、(3.48±0.16) (lg(CFU/g))。接菌组酸肉经过30 d的发酵后,没有检出肠杆菌,而在对照组酸肉中,直到发酵第60天才没有检出肠杆菌,接种发酵剂明显抑制了酸肉中大肠杆菌的生长繁殖。Fadda等[24]推测快速降低的pH值以及乳酸菌产生的细菌素可能是抑制致病菌的主要原因。
2.3.2 理化指标变化
2.3.2.1 pH值和总酸含量
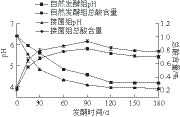
图8 酸肉发酵期间pH值和总酸含量的变化
Fig. 8 Changes in pH value and total acid content of sour meat during fermentation
由图8可知,2 组酸肉的pH值随发酵时间的延长均呈下降趋势,发酵30 d时,自然发酵组酸肉的pH值从起始的(6.41±0.04)下降到(5.59±0.03),而接种乳酸菌组酸肉的pH值从(6.37±0.04)快速降至(4.79±0.02),达到了自然发酵组酸肉发酵60 d的pH值((4.80±0.02)),下降速率显著大于自然发酵组,达到了快速产酸的目的。这主要是由于乳酸菌作为发酵剂接种到肉中后,作为绝对优势菌群分解肉和糯米饭中的碳水化合物,产生乳酸等酸类物质,从而快速降低酸肉的pH值[25]。pH值不仅影响微生物的生长,还对食品中内源酶的活性具有重要意义,是衡量食品风味和口感的重要指标[26]。在整个发酵周期内,接菌组酸肉的pH值均低于自然发酵组。pH值的变化与乳酸菌代谢碳水化合物和蛋白质分解有关[27],在发酵初期,乳酸菌主要分解碳水化合物产生乳酸,使pH值下降,随着发酵时间的延长,碳水化合物被消耗,微生物分解蛋白质,产生了一些氨及胺类等碱性含氮物质,使pH值变化减缓。2 组酸肉的总酸含量在发酵过程中呈先增加而后逐渐降低的趋势,均在发酵90 d时达到最高值,此时自然发酵组和接种乳酸菌组酸肉样品的总酸含量分别比发酵前增加了3.73 倍和3.88 倍。乳酸含量的增加有利于保持肠道中的合适菌群,并促进钙的吸收,具有重要的营养意义[28]。
2.3.2.2 水分含量、水分活度和氨基酸态氮含量
表5 酸肉发酵期间水分含量、水分活度及氨基酸态氮含量的变化Table 5 Changes in water content,water a ctivviittyy, amino acid nitrogen content in sour meat during fermentation

注:同行小写字母不同,表示不同组别间差异显著(P<0.05)。下同。
酸肉发酵初期,肉块浸泡在发酵液中,在发酵过程中吸收了部分发酵液。由表5可知,在发酵15 d时,酸肉的水分含量增大,但是随着发酵的继续进行,2 组酸肉的水分含量均呈现总体下降的趋势。接种乳酸菌发酵的酸肉,其水分含量在发酵30 d时就开始显著低于自然发酵组(P<0.05)。发酵肉制品的发酵过程常常伴随着水分活度的降低,低水分活度是发酵肉制品货架期较长和食用安全性较高的原因。
自然发酵酸肉的水分活度下降速率较慢,接种乳酸菌发酵组酸肉的水分活度下降较快,2 组酸肉的水分活度在发酵30 d时出现显著差异(P<0.05),此时接菌组酸肉的水分活度达到对照组发酵90 d时的水分活度。水分活度降低能够减少微生物能利用的水分,具有协助提高产品的安全性、抑制杂菌生长的作用[29]。因此,接种2 株乳酸菌发酵酸肉能够显著提高产品的保藏性和安全性。
发酵0~120 d内,酸肉的氨基酸态氮含量迅速增加,且接种乳酸菌组酸肉在发酵过程中均显著高于对照组(P<0.05)。接菌组酸肉的氨基酸态氮含量在发酵30 d时达到(69.02±0.19) mg/100 g,显著高于对照组发酵90 d的含量值。通常,传统酸肉的发酵时间为90~180 d,最佳食用时间为发酵180~360 d。本研究结果表明,接种2 株乳酸菌可以使酸肉在发酵30 d即可达到自然发酵90 d的效果。接种2 株乳酸菌发酵后酸肉的氨基酸态氮含量显著增加,可以提高肉制品的营养价值与风味。
2.3.2.3 氯化钠含量

图9 酸肉发酵期间氯化钠含量的变化
Fig. 9 Change in sodium chloride content of sour meat during fermentation
由图9可知,在酸肉的发酵过程中,氯化钠含量呈上升趋势。发酵0~180 d内,接种乳酸菌发酵组酸肉的氯化钠含量从(4.51±0.12)%上升到(4.87±0.11)%,自然发酵组酸肉从(4.49±0.15)%上升到(4.71±0.09)%,这与加工过程中酸肉水分含量的降低有关。虽然发酵初期腌制用食盐的添加量为8%,但2 组酸肉在发酵过程中的含盐量均控制在5%以下,显著低于传统加工酸肉15%~20%的含盐量。采用新工艺制作的酸肉鲜、酸、咸适中,更适合大众的口味,满足了低盐的健康需求。
2.3.2.4 色差
表6 酸肉发酵期间色差值的变化
Table 6 Changes in color parameters of sour meat during fermentation

由表6可知,2 组样品在不同发酵时期的L*、a*和b*均差异显著(P<0.05),发酵后的酸肉颜色鲜红,外表有光泽。接菌组酸肉的L*、a*在发酵30 d时就显著高于对照组酸肉发酵60 d时的值,b*显著低于对照组(P<0.05),说明乳酸菌的加入对发酵香肠的颜色,特别是L*有很大影响,发色效果较佳。Moler等[30]将发酵乳杆菌JCM1173和IF03956应用于无硝发酵肠生产中,获得了稳定的腌肉颜色。
2.3.2.5 游离氨基酸含量
表7 酸肉发酵期间游离氨基酸含量的变化
Table 7 Changes in free amino acid contents in sour meat during fermentattiioonn mg/100 g

注:-. 未检出。
游离氨基酸有助于产品风味的改善[31]。由表7可知,接菌组酸肉含有更高浓度的必需氨基酸,相较于发酵1 d时,其在发酵60 d时的赖氨酸含量增加了62.77 mg/100 g,苯丙氨酸含量增加了100.00 mg/100 g,亮氨酸含量增加了108.98 mg/100 g,异亮氨酸含量增加了44.42 mg/100 g,蛋氨酸含量增加了38.86 mg/100 g,缬氨酸含量增加了57.81 mg/100 g,且均显著高于自然发酵组的增加量(P<0.05),说明接种2 株乳酸菌在一定程度上提高了酸肉的营养价值[32]。与发酵前相比,酸肉的游离氨基酸总量提高了,接菌组酸肉的总游离氨基酸含量在发酵30 d时就接近自然发酵组酸肉发酵60 d时的含量,表明接种的乳酸菌在发酵过程中迅速繁殖。蛋白质在发酵微环境及肌肉蛋白酶的共同作用下降解产生游离氨基酸和多肽[33],增强产品风味和营养价值,也是进一步产生风味物质的底物[34]。
3 结 论
本研究将弯曲乳杆菌SR6和戊糖片球菌SR4-2混合作为发酵剂进行酸肉发酵,采用单因素试验及正交试验对酸肉发酵的工艺条件进行优化,得到优选发酵参数为食盐添加量8%、发酵剂接种量2.0%、糯米饭添加量45%、发酵温度15 ℃。在此工艺条件下,酸肉的发酵时间为30 d,比传统自然发酵缩短了60 d;酸肉的氯化钠含量控制在4.5%~5.0%之间;水分含量和水分活度在发酵过程中显著降低;酸肉的氨基酸态氮、总游离氨基酸和必需氨基酸含量明显升高;L*和a*升高,b*降低,发色效果较佳。因此,将弯曲乳杆菌SR6和戊糖片球菌SR4-2混合发酵剂应用于低盐型酸肉制作可以快速发酵,并提高产品的质量和安全性,具有较好的应用潜力。
参考文献:
[1] 卫飞, 赵海伊, 余文书. 酸肉的营养价值及安全性研究[J]. 粮食科技与经济, 2011, 36(4): 54-56. DOI:10.16465/j.gste.2011.04.008.
[3] 姜亚, 姚波, 张胜男, 等. 多指标优化酸肉发酵工艺[J]. 食品科技,2014, 39(6): 138-140. DOI:10.13684/j.cnki.spkj.2014.06.031.
[4] 周才琼, 李艳芳, 杜木英. 渝黔地区传统酸肉发酵过程中微生物区系研究[J]. 食品工业科技, 2010, 31(4): 171-175. DOI:10.13386/j.issn1002-0306.2010.04.035.
[5] 孔保华, 夏让, 夏秀芳, 等. 直投式发酵剂制备的哈尔滨风干肠在成熟过程中的理化及微生物特性变化[J]. 食品工业科技, 2012, 33(8):168-171; 175. DOI:10.13386/j.issn1002-030S0168-1605(00)00457-8.
[6] ERKKIL S, SUIHKO M L, EEROLA S, et al. Dry sausage fermented by Lactobacillus rhamnosus strains[J]. International Journal of Food Microbiology, 2001, 64(1/2): 205-210. DOI:10.1016/S0168-1605(00)00457-8.
[7] NIE Xiaohua, LIN Shengli, ZHANG Qilin. Proteolytic characterisation in grass carp sausage inoculated with Lactobacillus plantarum and Pediococcus pentosaceus[J]. Food Chemistry, 2014, 145(7): 840-844.DOI:10.1016/j.foodchem.2013.08.096.
[8] ANDREJA D Z, MIRJANA H. Infl uence of starter cultures on the free fatty acids during ripening in tea sausages[J]. European Food Research and Technology, 2007, 224(4): 511-517. DOI:10.1007/s00217-006-0304-2.
[9] CASABURI A, ARISTOY M C, CAVELLA S, et al. Biochemical and sensory characteristics of traditional fermented sausages of Vallo di Diano (Southern Italy) as affected by the use of starter cultures[J]. Meat Science, 2007, 76(2): 295-307. DOI:10.1016/j.meatsci.2006.11.011.
[10] 湛剑龙, 陈韵, 黄林波, 等. 贵州少数民族酸肉、酸鱼中乳酸菌的分离鉴定[J]. 肉类研究, 2013, 27(7): 40-43.
[11] 湛剑龙, 王杨凡, 胡萍. 贵州侗族酸肉中一株抗氧化弯曲乳杆菌LAB26的鉴定及特性[J]. 肉类研究, 2014, 28(6): 1-4.
[12] 娄利娇, 胡萍, 湛剑龙, 等. 分离自贵州侗族苗族发酵肉中两株乳酸菌的耐受特性分析[J]. 中国酿造, 2015, 34(11): 126-130.DOI:10.11882/j.issn.0254-5071.2015.11.029.
[13] 张玉龙, 胡萍, 王晓宇, 等. 侗族酸肉中抗氧化乳酸菌的耐受性及功能特性[J]. 生物加工过程, 2016, 14(6): 35-40. DOI:10.3969/j.issn.1672-3678.2016.06.007.
[14] 俞彦波, 代小容, 周才琼. 酸肉滋味品质的形成及其影响因素研究[J]. 食品与发酵工业, 2010, 19(3): 156-160. DOI:10.13995/j.cnki.11-1802/ts.2010.03.019.
[15] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定:GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016.
[16] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 大肠菌群计数:GB 4789.3—2016[S]. 北京: 中国标准出版社, 2016.
[17] 李华丽. 改进传统湘西酸肉生产工艺研究[D]. 长沙: 湖南农业大学,2005.
[18] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中水分的测定: GB 5009.3—2016[S]. 北京: 中国标准出版社, 2016.
[19] 龚姝, 慎洁, 周振宁, 等. 间接滴定法测定食品中氯化钠含量[J]. 现代农业科技, 2016(2): 293. DOI:10.3969/j.issn.1007-5739.2016.12.180.
[20] 张倩, 郭晓芸, 张海松, 等. 贵州荔波传统酸肉发酵期间理化成分与发酵风味物质分析[J]. 食品科学, 2013, 34(4): 173-177.DOI:10.13386/j.issn1002-0306.2015.13.031.
[21] 徐雯雅. 西式盐水火腿低钠腌制剂的研究[D]. 南京: 南京农业大学,2012. DOI:10.7666/d.Y2360058.
[22] AMEZQUITA A, BRASHEARS M. Competitive inhibition of Listeria monocytogenes in ready-to-eat meat products by lactic acid bacteria[J].Journal of Food Protection, 2002, 65(2): 316-325. DOI:10.4315/0362-028X-65.2.316.
[23] XANTHOPOULOS V, HATZIKAMARI M, ADAMIDIS T, et al.Heterogeneity of Lactobacillus plantarum isolates from Feta cheese throughout ripening[J]. Journal of Applied Microbiology, 2000, 88(6):1056-1064. DOI:10.1046/j.1365-2672.2000.01056.x.
[24] FADDA S, OLIVER G, VIGNOLO G. Protein degradation by Lactobacillus plantarum and Lactobacillus casei in a sausage model system[J]. Journal of Food Science, 2002, 67(3): 1179-1183.DOI:10.1111/j.1365-2621.2002.tb09473.x.
[25] YOO S A, NA C S, PARK S E. et al. Characterization of fermented sausages using Lactobacillus plantarum MLK14-2 as starter culture[J].Journal of the Korean Society for Applied Biological Chemistry, 2015,58(3): 349-358. DOI:10.1007/s13765-015-0052-8.
[26] VAN BA H, AMNA T, HWANG I. Signifi cant infl uence of particular unsaturated fatty acids and pH on the volatile compounds in meat-like model systems[J]. Meat Science, 2013, 94(4): 480-488. DOI:10.1016/j.meatsci.2013.04.029.
[27] 俞彦波, 代小容, 周才琼. 酸肉滋味品质的形成及其影响因素研究[J]. 食品与发酵工业, 2010, 36(3): 156-160. DOI:10.13995/j.cnki.11-1802/ts.2010.03.019.
[29] 黄群, 麻成金, 欧阳玉祝, 等. 传统湘西酸肉发酵动态与Nisin保鲜试验[J]. 食品与发酵工业, 2008, 34(4): 167-170. DOI:10.13995/j.cnki.11-1802/ts.2008.04.011.
[30] MOLER J K S, JENSEN J S, SKIBSTED L H, et al. Microbial formation of nitrite-cured pigment, nitrosylmyoglobin, from metmyoglobin in model systems and smoked fermented sausages by Lactobacillus fermentum strains and a commercial starter culture[J].European Food Research and Technology, 2003, 216(6): 463-469.DOI:10.1007/s00217-003-0681-8.
[31] BERIAIN M, HORCADA A, PURROY A, et al. Characteristics of Lacha and Rasa Aragonesa lambs slaughtered at three live weights[J]. Journal of Animal Science, 2000, 78(12): 3070-3077.DOI:10.2527/2000.78123070x.
[32] 赵俊仁, 孔保华. 复合发酵剂生产风干肠对产品质构及游离氨基酸的影响[J]. 食品工业科技, 2007, 28(10): 132-135. DOI:10.13386/j.issn1002-0306.2007.10.029.
[33] DROSINOS E H, PARAMITHIOTIS S, KOLOVOS G, et al.Phenotypic and technological diversity of lactic acid bacteria and Staphylococci isolated from traditionally fermented sausages in southern Greece[J]. Food Microbiology, 2007, 24(3): 260-271.DOI:10.1016/j.fm.2006.05.001.
[34] 郭晓芸, 龙江, 张亮, 等. 贵州荔波传统酸肉微生物菌群与营养品质评价[J]. 中国酿造, 2009, 28(7): 69-72. DOI:10.3969/j.issn.0254-5071.2009.07.020.