天然蛋白质在外界环境(加热、溶液pH值、高压等)的诱导作用下,分子的空间结构会发生改变,蛋白质分子内部、蛋白质-蛋白质、蛋白质-溶剂之间的作用力也会随之发生改变,最终导致蛋白质的变性聚集,形成新的结构[1],典型的表现就是肌球蛋白的凝胶化过程。肌球蛋白的凝胶化能力是其重要的食品功能特性之一,对于肉糜类产品(如肉丸、火腿肠等)的质构形成具有非常重要的作用。加热、pH值、NaCl或超高压等 处理均可以诱导肌球蛋白形成凝胶[2-7],评价一种处理方法能否使肌球蛋白形成凝胶,首先是看该处理方法能否使肌球蛋白发生 变性和聚集,形成大的凝聚物,因为大的凝聚物的产生是形成优良弹性凝胶的前提[8]。
高密度CO2(dense phase carbon dioxide,DPCD)是近年来兴起的一种非热食品加工技术,主要用于食品的杀菌和钝酶,有研究发现一定强度的DPCD处理也能使食品蛋白质发生变性和聚集[9-12],甚至形成凝胶[13-17]。本课题组前期研究表明,DPCD能够诱导凡纳滨对虾(Litopenaeus vannamei)肉糜形成凝胶,而且所制备凝胶的感官特性、营养特性、微观结构和质构特性等都显著优于热诱导所形成的凝胶[17]。为阐明DPCD诱导虾肉糜形成凝胶的机制,本研究以凡纳滨对虾肌球蛋白为对象,利用原子力显微镜观察DPCD处理温度、压强和处理时间对肌球蛋白微观形貌的影响,探讨DPCD处理过程中肌球蛋白的聚集行为特征,为利用DPCD开发优质的肉类凝胶制品提供参考。
1 材料与方法
1.1 材料与试剂
凡纳滨对虾,规格50~60 尾/kg,购于广东省湛江市霞山区东风水产批发市场,保活运至实验室,用自来水清洗干净后备用。
Lowry法蛋白质含量测定试剂盒 上海荔达生物技术有限公司;三磷酸腺苷(adenosine triphosphate,ATP)、二硫代苏糖醇(dithiothreitol,DTT)(均为分析纯) 广州市齐云生物技术有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electropheresis,SDS-PAGE)凝胶配制试剂盒、SDS蛋白上样缓冲液 碧云天生物技术研究所;即用型蛋白分子质量标准(宽) 宝生物工程(大连)有限公司;CO2(纯度99.9%) 湛江氧气厂;其他试剂均为分析纯。
1.2 仪器与设备
HA221-50-10-C超临界装置 南通市华安超临界萃取有限公司;UV-2550紫外-可见分光光度计 日本岛津仪器有限公司;PHS-3C精密pH计 上海雷磁仪器厂;CR22GⅡ高速冷冻离心机 日本日立公司;DYCZ-24DN双垂直迷你电泳仪、DYY-6C双稳定时电泳仪电源 北京六一仪器厂;5417R冷冻离心机 德国Eppendorf公司;HR3865/00组织匀浆机 荷兰飞利浦公司;JYL-C022绞肉机 山东九阳股份有限公司;Bruker Multimode 8扫描探针显微镜 德国布鲁克公司;云母片长春市泰元氟金云母有限公司。
1.3 方法
1.3.1 肌球蛋白的提取
参考Hwang等[18]的方法。新鲜虾肉搅碎后,称取肉样,加入5 倍体积(m/V)的20 mmol/L磷酸缓冲液(pH 7.0),均质后离心(5 500×g,10 min),取沉淀,重复上述过程2 次;向所得沉淀中加入3 倍体积(m/V)的提取液(包含0.45 mol/L的KCl、5 mmol/L的ATP、7.5 mmol/L的MgCl2和0.15 mmol/L的DTT,pH 6.4),搅拌15 min后离心(10 000×g,10 min);4 层纱布过滤后,取滤液与9 倍体积(V/V)的预冷蒸馏水混合,静置10 min,离心(6 000×g,10 min)得沉淀;向沉淀中加入缓冲液(包含3 mol/L的KCl、0.6 mmol/L的DTT和0.12 mol/L 的Tris-Maleate,pH 7.5),沉淀与缓冲液的配比为5∶1(m/V),于4 ℃静置过夜;再加入包含0.11 mol/L的ATP、55 mmol/L的MgCl2和5.5 mmol/L乙二醇二乙醚二胺四乙酸(ethylene glycol-bis-(2-aminoethyl)ether-N,N,N’,N’-tetraacetic acid,EGTA)的溶液(pH 7.5),沉淀与溶液的配比为10∶1(m/V),于4 ℃静置2 h;向上述溶液中加入硫酸铵(室温条件下1 L溶液中添加243~277 g硫酸铵,使硫酸铵的饱和度为40%~45%),用来分离纯化肌球蛋白,离心(10 000×g,15 min);将沉淀置于0.6 mol/L KCl-20 mmol/L磷酸缓冲液(pH 7.0)中透析至无SO42-检出,期间更换透析液,整个过程中,溶液保持在4 ℃条件下。将透析后的溶液离心(10 000×g,15 min),上清液即为凡纳滨对虾肌球蛋白溶液。
用SDS-PAGE测得上述肌球蛋白溶液的肌球蛋白纯度为96%;采用Lowry法[14],以牛血清蛋白为标准品,测得溶液的蛋白质质量浓度为12~16 mg/mL。使用时稀释到所需质量浓度。
1.3.2 DPCD处理
将1.3.1节所得肌球蛋白溶液稀释至0.01 mg/mL,取3 mL于试管中,用于DPCD处理。
间歇式DPCD处理流程参考张良等[19]的方法。实验开始时,首先打开制冷及冷却循环,设置处理釜所需温度,然后将样品放入处理釜中,密封,开启高压泵泵入CO2气体,待压强上升至所需压强,关闭高压泵,封闭进出处理釜的阀门,维持处理釜内所需的压强和温度,静态处理一段时间后,卸压取出样品,即完成一次处理。
设置处理温度分别为30、35、40、45、50、60 ℃(处理压强25 MPa,处理时间30 min),处理压强分别为5、10、15、20、25、30 MPa(处理温度45 ℃,处理时间30 min),处理时间分别为5、10、15、20、30、40 min(处理温度45 ℃,处理压强25 MPa),利用原子力显微镜观察DPCD处理温度、压强和处理时间对肌球蛋白微观形貌的影响。将水浴热处理设为对照组,水浴热处理的温度水平与DPCD处理一致,处理时间30 min。
1.3.3 原子力显微镜扫描
扫描探针显微镜的探针型号为MPP-11100-10(Rtesp);探针材料为0.01~0.0025 Ohm-cm Antimony(N)Doped Si;探针悬臂规格为厚度3.75 μm、长度125 μm、宽度35 μm、共振频率300 kHz、力常数40 N/m;探针正反面均无涂层。工作模式为智能模式,扫描范围2 μm×2 μm,扫描速率2 Hz,扫描管型号7997JVLR。
样品前处理:将虾肌球蛋白溶液旋涂到预先处理好的干净云母片上,用氮气吹干,制成测试样品。蛋白质颗粒的粒径可以用干燥状态下从云母片基底表面到蛋白质颗粒表面的垂直距离表示,原子力显微镜扫描图还可以反映蛋白质的聚集程度。
1.4 数据处理
利用扫描探针显微镜自带的Nanoscope Aualysis分析软件(德国布鲁克公司)对扫描图进行分析;随机选择10 个蛋白质颗粒,计算其平均粒径大小,结果用平均值±标准差表示;用JMP 10.0软件(赛仕软件有限公司)对数据进行方差分析和Tukey’s HSD多重比较。
2 结果与分析
2.1 未处理凡纳滨对虾肌球蛋白的微观形貌

图1 未处理凡纳滨对虾肌球蛋白的微观形貌
Fig. 1 Micromorphology of myosin from Litopenaeus vannamei
由图1可知,单个肌球蛋白分子呈椭圆球形、表面光滑且有清晰的边缘,测得肌球蛋白的平均分子粒径为4.78 nm。
2.2 DPCD处理温度对凡纳滨对虾肌球蛋白微观形貌的影响
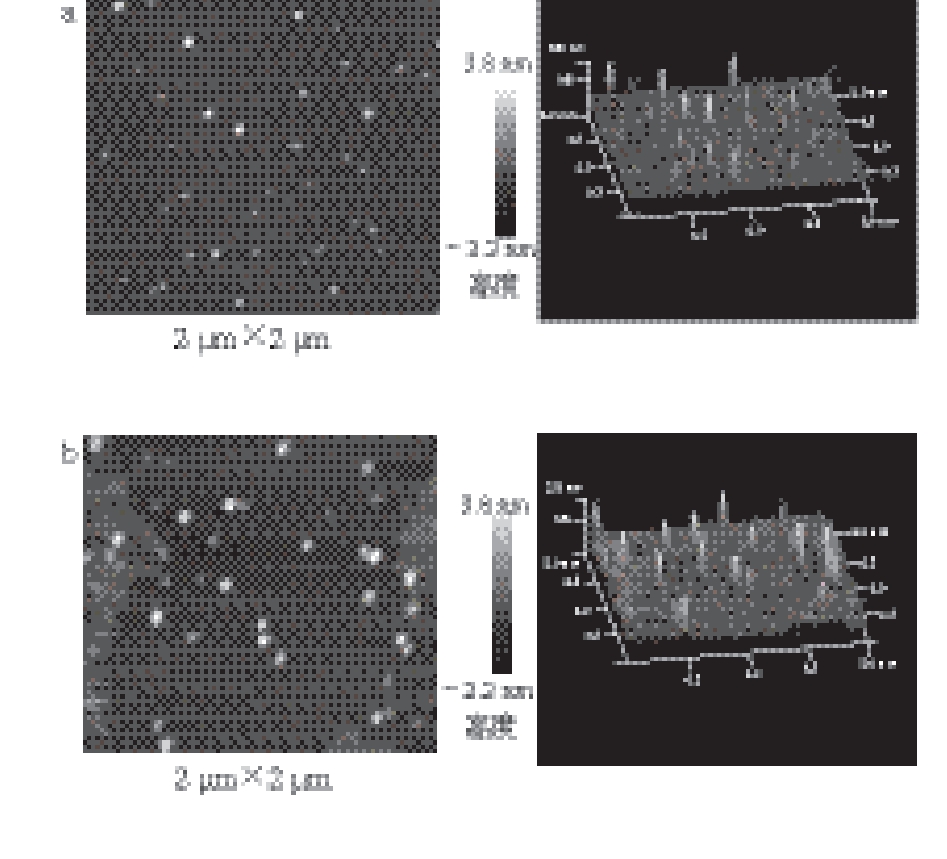
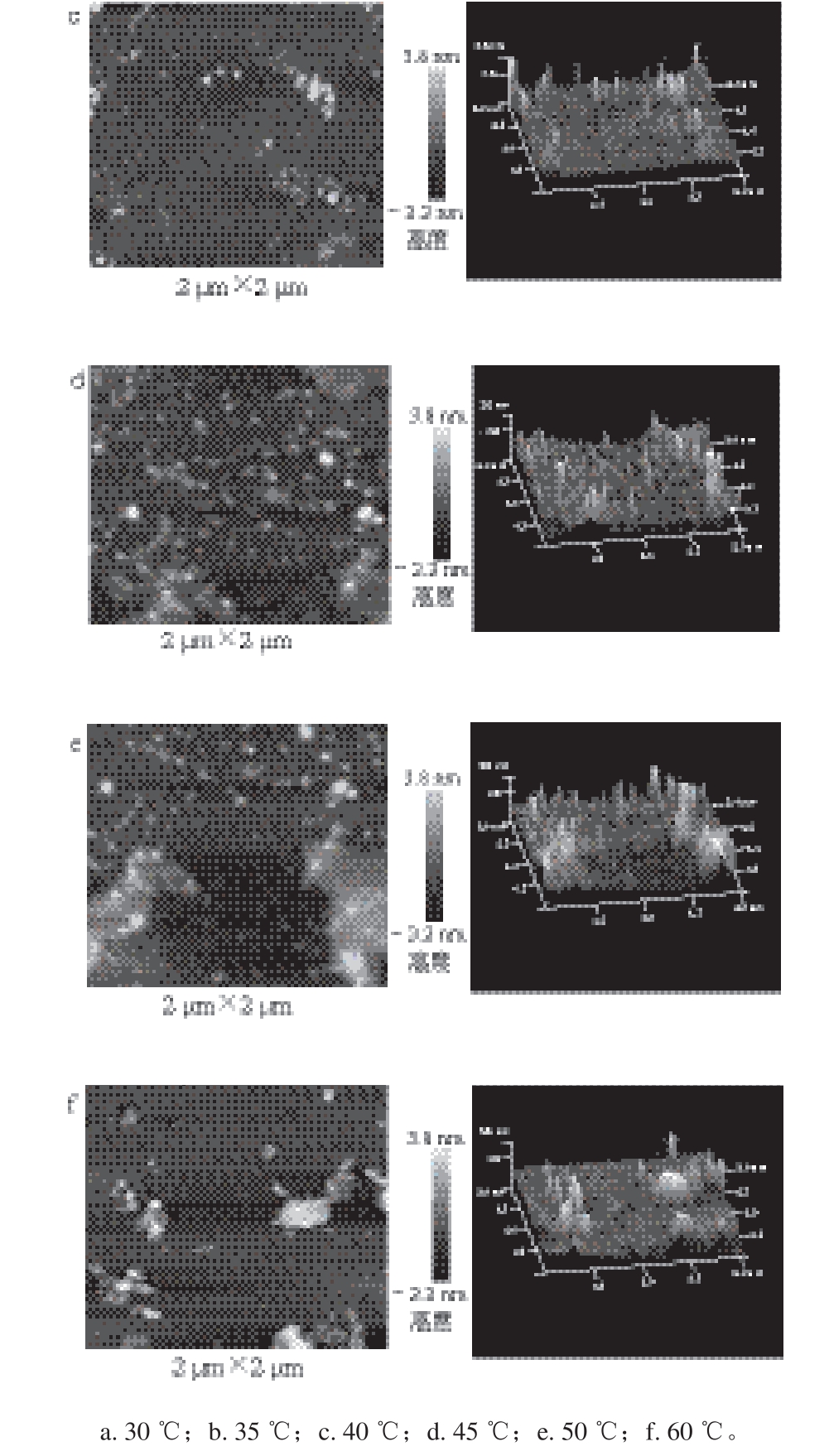
图2 DPCD处理温度对凡纳滨对虾肌球蛋白微观形貌的影响
Fig. 2 Effect of DPCD treatment at different temperatures on micromorphology of shrimp myosin
a. 30 ℃;b. 35 ℃;c. 40 ℃;d. 45 ℃;e. 50 ℃;f. 60 ℃。
图3 水浴热处理温度对凡纳滨对虾肌球蛋白微观形貌的影响Fig. 3 Effect of heat treatment temperature on micromorphology of shrimp myosin

图4 处理温度对凡纳滨对虾肌球蛋白分子平均粒径的影响
Fig. 4 Effect of treatment temperature on average diameter of myosin particles
由图2~4可知,无论是DPCD处理还是单纯热处理,随着处理温度的增加,虾肌球蛋白逐步发生聚集现象(P<0.05),分子平均粒径也显著增加(P<0.05),且当处理温度高于40 ℃后,肌球蛋白的聚集均更加显著(P<0.05),这主要是由于凡纳滨对虾肌球蛋白的热变性温度为42.8 ℃[20],当处理温度接近或高于变性温度后,肌球蛋白就会逐渐发生变性并聚集。在相同温度条件下,DPCD处理的肌球蛋白的分子平均粒径显著小于单独热处理(P<0.05),说明相同温度条件下DPCD诱导肌球蛋白的聚集程度弱于单纯热处理,这可能是由于肌球蛋白在DPCD处理过程中不仅受热效应的影响,还受到高压下CO2分子效应的影响。
在单纯的热处理过程中,主要是溶液中的肌球蛋白分子间的相互作用;而在DPCD处理过程中,不仅存在肌球蛋白分子间的相互作用,还存在DPCD与水分子的相互作用和DPCD与蛋白质分子间的相互作用。DPCD与水分子的相互作用可以使溶液的pH值下降,改变肌球蛋白分子周围的微环境,可能使蛋白质发生变性[21];DPCD与蛋白质分子间的相互作用(如疏水相互作用、氢键、静电作用等[22-23])可能会减弱蛋白质分子间的相互作用。
在肌球蛋白受热诱导形成凝胶的过程中,主要是热效应使肌球蛋白发生变性,进一步引起肌球蛋白分子之间头部与头部和尾部与尾部的相互作用,从而发生聚集,形成凝胶。Sharp等[24]研究肌球蛋白分子的热诱导现象,发现在40 ℃条件下肌球蛋白分子通过头部聚集形成球状低聚物,50 ℃条件下低聚物会进一步发生聚集,温度达到60 ℃时形成具有一定粒径分布的聚合物,在这个过程中肌球蛋白尾部的作用较弱。Hayakawa等[25]利用透射电子显微镜观察不同温度处理后鸡胸肉肌球蛋白分子的微观形貌变化,也发现肌球蛋白分子头部之间的聚集作用始终占主导地位。
在肌球蛋白的DPCD处理过程中不仅有热效应,还有高压下CO2与蛋白质分子间的相互作用[23];随着温度的升高,CO2的分子热运动加剧,增加了CO2与蛋白质的接触机会,从而增强了其相互作用。可能正是由于高压下CO2与蛋白质间的相互作用减弱了蛋白质分子间的相互作用,随着处理温度的升高,肌球蛋白的聚集程度减弱。
Li Renjie等[26]用高压CO2处理类甜蛋白(thaumatinlike protein,TLP),并用原子力显微镜观察到了同样的实验现象。Hu Wanfeng等[27]用35 ℃和8 MPa的高压CO2处理多酚氧化酶20 min,其分子粒径从116 nm增加到627 nm,均与本研究的结果一致。因此,DPCD处理与热处理均能使蛋白质发生变性和聚集,但是单纯热处理与DPCD处理对蛋白质的影响机制有显著差异。
2.3 DPCD处理压强对凡纳滨对虾肌球蛋白微观形貌的影响

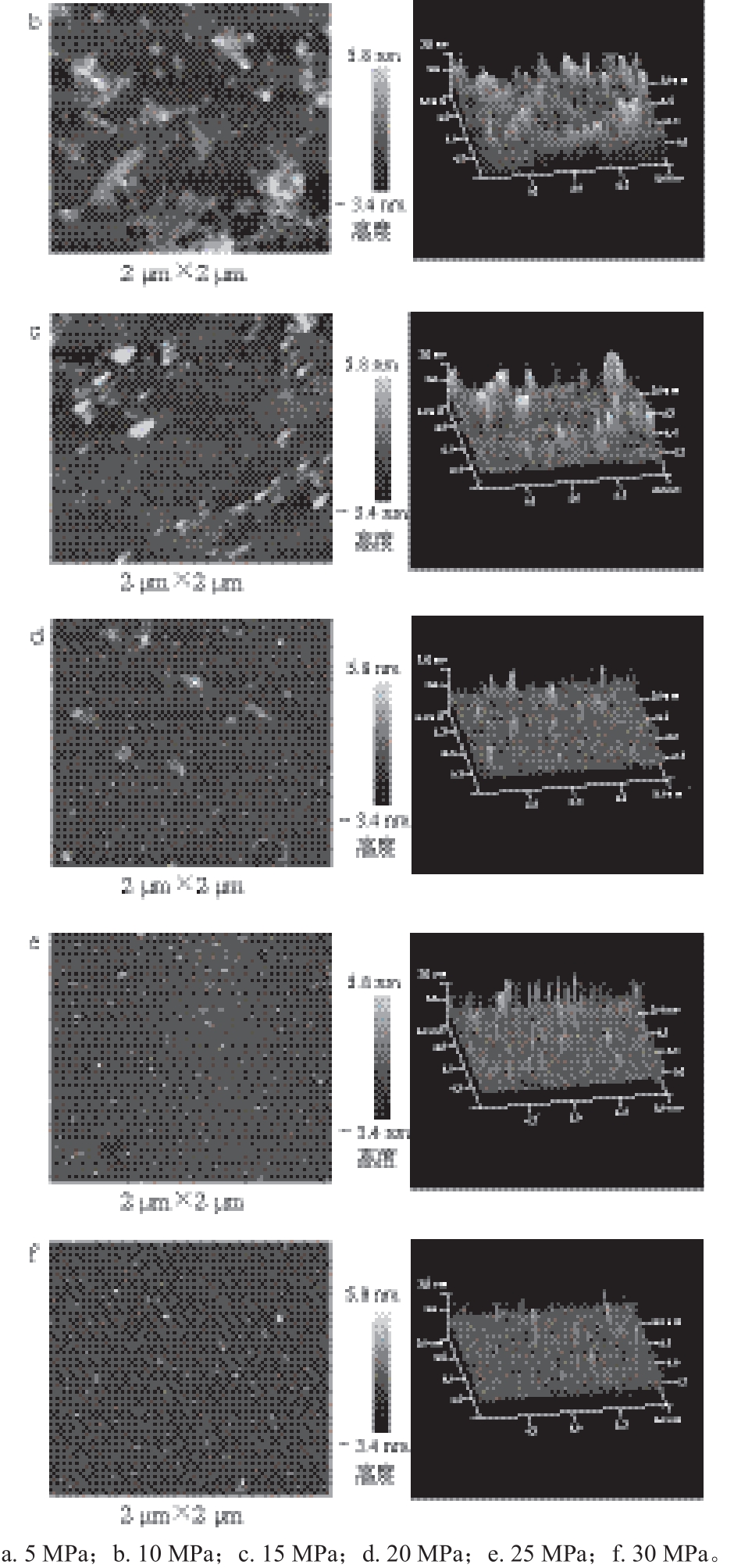
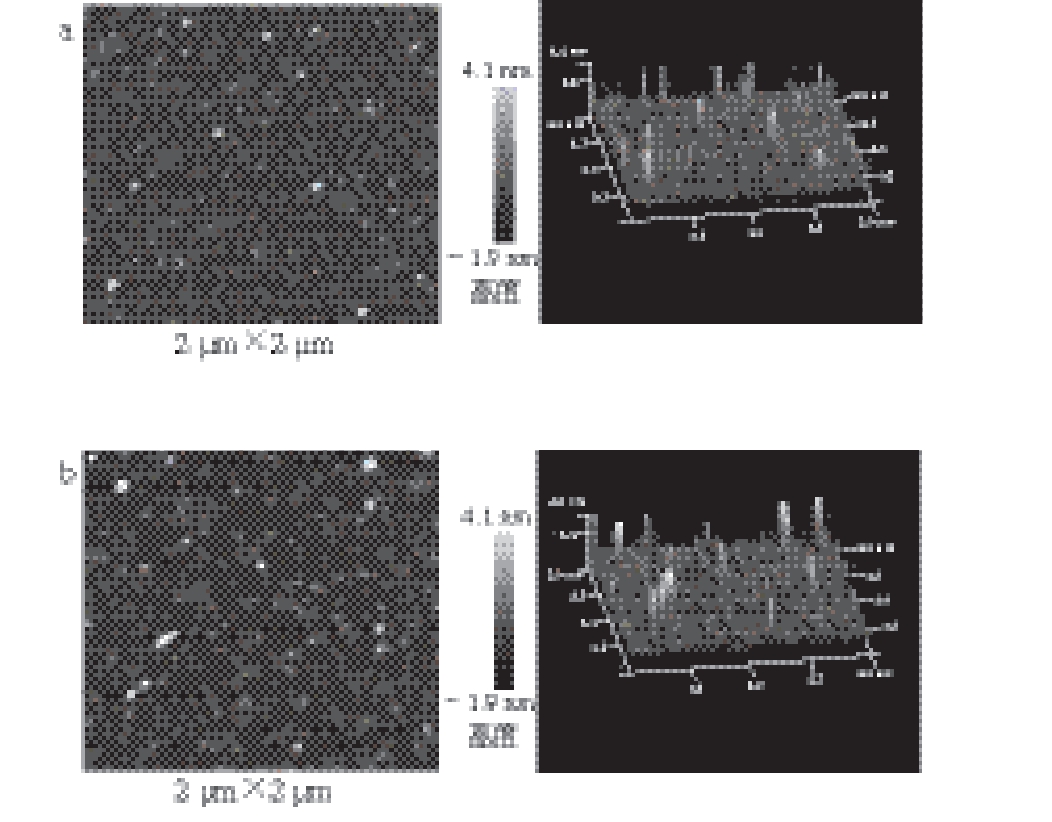
图5 DPCD处理压强对凡纳滨对虾肌球蛋白微观形貌的影响
Fig. 5 Effect of DPCD treatment at different pressures on micromorphology of shrimp myosin
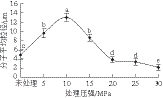
图6 DPCD处理压强对凡纳滨对虾肌球蛋白分子平均粒径的影响
Fig. 6 Effect of DPCD treatment at different pressures on average diameter of myosin particles
由图5~6可知,与未处理时相比,5~10 MPa压强范围内的虾肌球蛋白发生了显著聚集,分子平均粒径逐渐增大(P<0.05),形成了较大的形状不规则的聚集体;当压强为15 MPa时,虾肌球蛋白的聚集程度减弱,分子平均粒径逐渐减小(P<0.05);当压强在20~30 MPa范围内时,虾肌球蛋白的分子平均粒径小于未处理组(P<0.05)。在5~10 MPa范围内时,CO2主要以气体和亚临界气体状态存在,在水中的溶解度相对较低,此时肌球蛋白较大程度的聚集可能主要是由热效应引起的,而CO2与蛋白质间的相互作用较弱。随着处理压强的增加,CO2进入超临界状态,在水中的溶解度也大大增加,显著增强了DPCD与蛋白质间的相互作用,使蛋白质分子之间的相互作用相对减弱,从而使肌球蛋白的聚集程度减弱[23]。
Li Renjie等[26]用高压CO2处理TLP,并用原子力显微镜观察发现,在20 MPa、35 ℃条件下,DPCD处理15 min后,部分TLP聚集,形成规则、致密的聚集体,也有部分TLP被解离,形成更小、不规则的颗粒;Hu Wanfeng等[27]发现,当DPCD处理压强从0.1 MPa增加到1.0 MPa时,大豆蛋白溶液pH值从6.4降至4.9,蛋白质粒径从0.2 μm增至0.5 μm,这均与本研究的结果一致。因此,DPCD既能使蛋白质发生聚集,又能使其发生解离。一般来说,在较低的处理压强下,蛋白质分子间的相互作用强于CO2与蛋白质间的相互作用,蛋白质发生变性后随即发生聚集,分子平均粒径变大;当处理压强较高时,CO2与蛋白质间的相互作用增强,使蛋白质分子间的相互作用减弱,蛋白质虽然发生了变性,但聚集较弱,分子平均粒径较小。
2.4 DPCD处理时间对凡纳滨对虾肌球蛋白微观形貌的影响

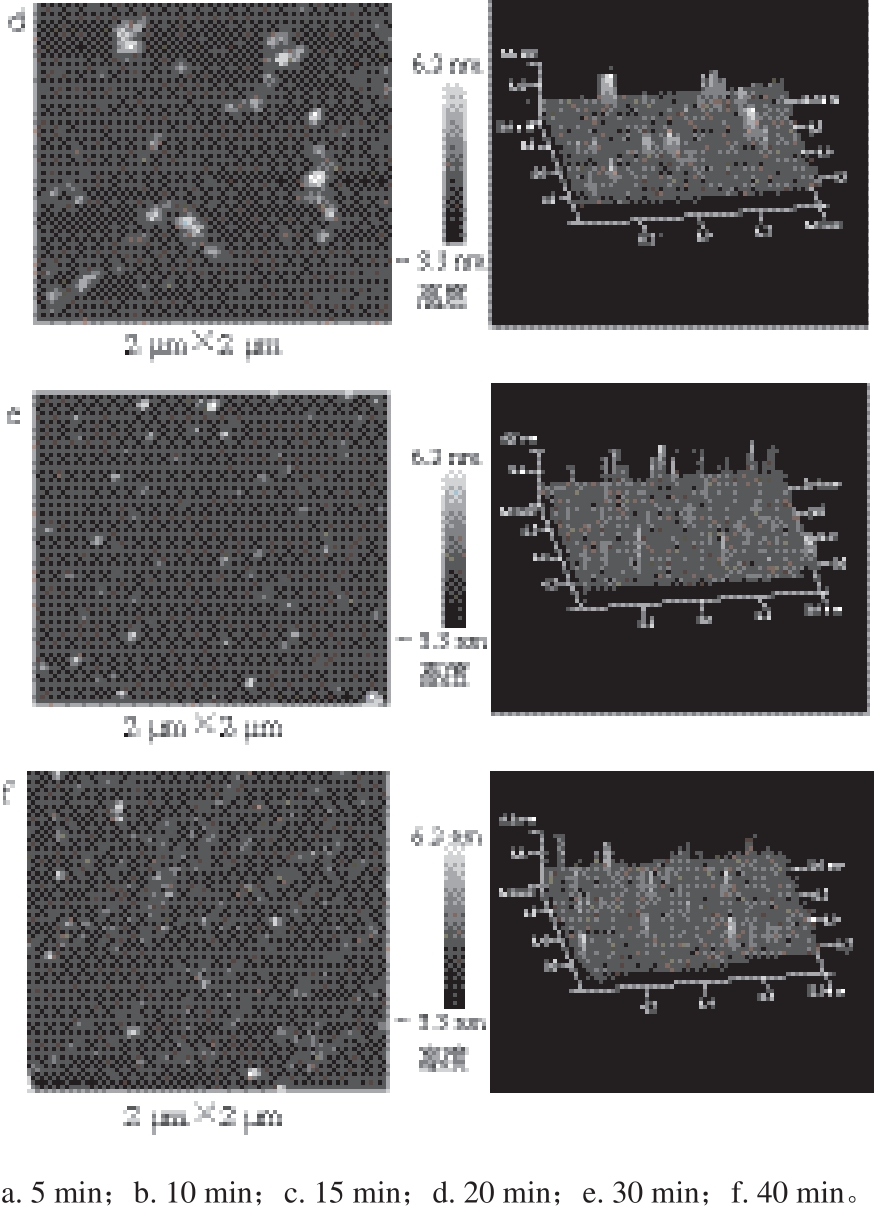
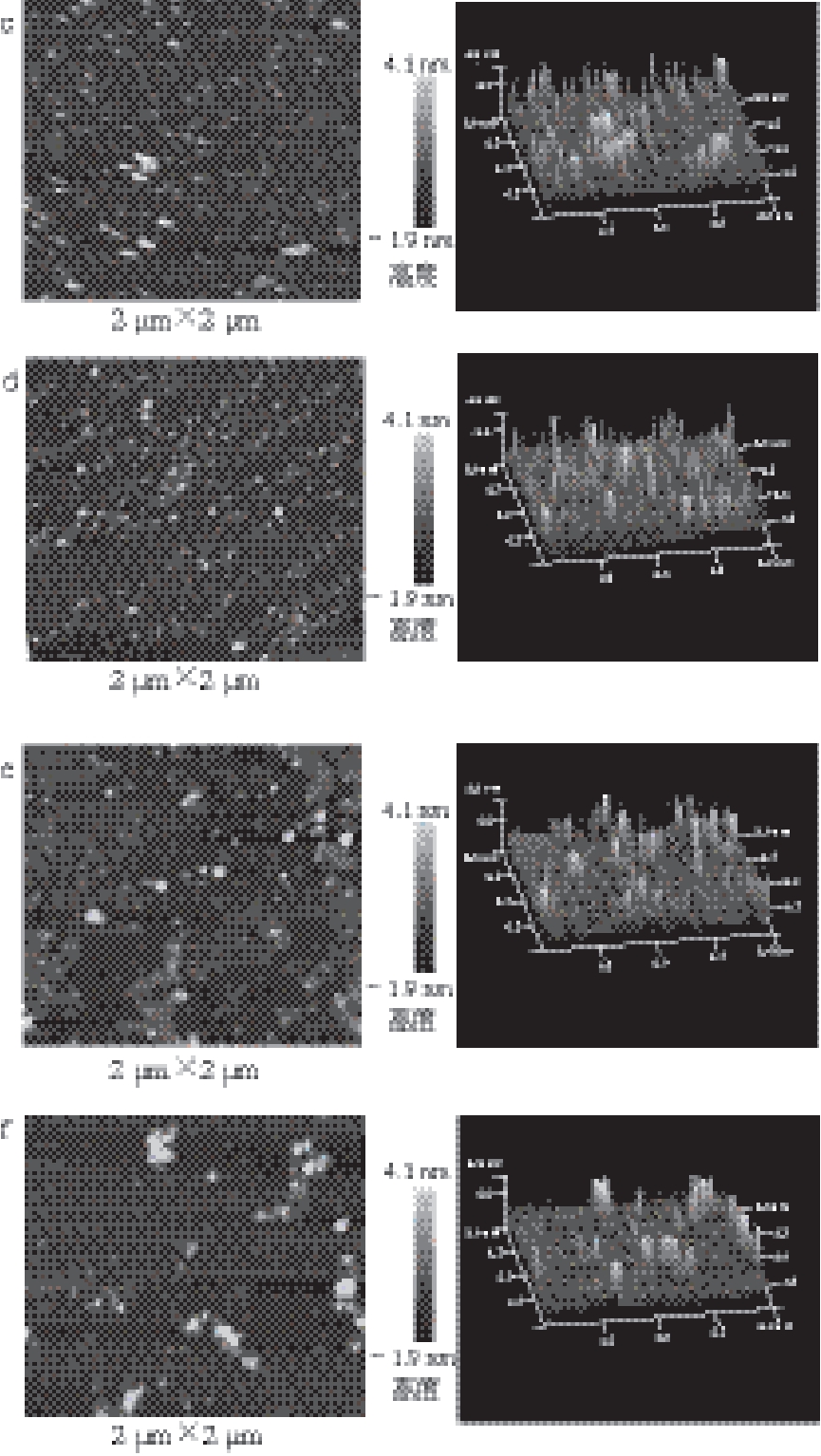
图7 DPCD处理时间对凡纳滨对虾肌球蛋白微观形貌的影响
Fig. 7 Effect of DPCD treatment time on micromorphology of shrimp myosin
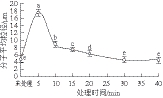
图8 DPCD处理时间对凡纳滨对虾肌球蛋白分子平均粒径的影响
Fig. 8 Effect of DPCD treatment time on average diameter of shrimp myosin particles
由图7~8可知,DPCD处理5 min即可使虾肌球蛋白发生明显的聚集,分子平均粒径显著增加(P<0.05),此时形成的聚集体紧密,而且颗粒粒径大小呈现不均匀分布;随着处理时间的增加,肌球蛋白分子的聚集程度显著减弱(P<0.05),这同样与DPCD与肌球蛋白分子之间的相互作用有关。处理时间短时可能热效应占主导地位,肌球蛋白分子间的相互作用强于DPCD与蛋白质间的相互作用;随着处理时间增加,DPCD与蛋白质的相互作用逐渐增强,使肌球蛋白分子之间的相互作用减弱,从而使肌球蛋白的聚集程度减弱。
由以上分析可知,DPCD能够诱导肌球蛋白发生变性和聚集,但是在不同的DPCD处理强度下,肌球蛋白变性和聚集程度是有差异的,其机制可能包括以下几方面:1)DPCD能使溶液的pH值下降,改变溶液的微环境[21];2)DPCD能使蛋白质的α-螺旋含量下降、β-折叠含量上升,促进蛋白质的变性和聚集[22,28];3)DPCD与蛋白质分子间的相互作用(如疏水相互作用、氢键、静电相互作用等[23])能够影响蛋白质分子间的相互作用等。
3 结 论
3利用原子力显微镜观察DPCD处理对凡纳滨对虾肌球蛋白分子微观形貌的影响,结论如下:1)纯化的肌球蛋白分子呈椭圆球形、表面光滑并且有清晰的边缘,分子平均粒径为4.78 nm;2)DPCD处理能诱导肌球蛋白发生变性和聚集,但在不同的处理强度下,肌球蛋白变性和聚集的程度有显著差异;3)DPCD诱导肌球蛋白变性和聚集过程中,不仅有热效应引起的蛋白质分子间的相互作用,而且还有高压下CO2与蛋白质分子间的相互作用。本研究结果为DPCD诱导蛋白质形成凝胶的机制研究和技术开发提供了参考。
参考文献:
[1] TOTOSAUS A, MONTEJANO J G, SALAZAR J A, et al. A review of physical and chemical protein-gel induction[J]. International Journal of Food Science and Technology, 2002, 37(6): 589-601. DOI:10.1046/j.1365-2621.2002.00623.x.
[2] ISHIOROSHI M, JIMA K S, YASUI T. Heat-induced gelation of myosin: factors of pH and salt concentrations[J]. Journal of Food Science, 1979, 44(5): 1280-1284. DOI:10.1111/j.1365-2621.1979.tb06419.x.
[3] 费英, 韩敏义, 杨凌寒, 等. pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170.DOI:10.3864/j.issn.0578-1752.2010.01.019.
[4] 姜国庆, 刘英丽, 张慧娟, 等. 肌原纤维蛋白热诱导凝胶特性研究进展[J]. 肉类研究, 2013, 27(12): 19-22.
[5] 邵俊杰, 张美琴, 吴光红, 等. 酸碱处理对鱼肉蛋白凝胶特性影响的研究进展[J]. 肉类研究, 2017, 31(3): 56-61. DOI:10.7506/rlyj1001-8123-201703011.
[6] 薛思雯, 钱畅, 王梦瑶, 等. 肌球蛋白高压凝胶机理的研究进展[J].肉类研究, 2016, 30(10): 40-44.
[7] CAO Yingying, XIA Tianlan, ZHOU Guanghong, et al. The mechanism of high pressure-induced gels of rabbit myosin[J].Innovative Food Science and Emerging Technologies, 2012, 16: 41-46.DOI:10.1016/j.ifset.2012.04.005.
[8] 徐幸莲, 韩敏义, 林丽军, 等. 兔骨骼肌肌球蛋白溶液浊度和溶解度研究[J]. 南京农业大学学报, 2003, 26(4): 93-96. DOI:10.7685/j.issn.1000-2030.2003.04.022.
[9] 闫文杰, 崔建云, 戴瑞彤, 等. 高密度二氧化碳处理对冷却猪肉品质及理化性质的影响[J]. 农业工程学报, 2010, 26(7): 346-350.DOI:10.3969/j.issn.1002-6819.2010.07.061.
[10] XU Duoxia, YUAN Fang, JIANG Junping, et al. Structural and conformational modifi cation of whey proteins induced by supercritical carbon dioxide[J]. Innovative Food Science and Emerging Technologies, 2011, 12(1): 32-37. DOI:10.1016/j.ifset.2010.10.001.
[11] YAN Wenjie, XU Baocai, JIA Fei, et al. The effect of high-pressure carbon dioxide on the skeletal muscle myoglobin[J]. Food and Bioprocess Technology, 2016, 9(10): 1716-1723. DOI:10.1007/s11947-016-1747-5.
[12] ZHAO Feng, ZHOU Linyan, WANG Yongtao, et al. Role of peach proteins in juice precipitation induced by high pressure CO2[J]. Food Chemistry, 2016, 209(1): 81-89. DOI:10.1016/j.foodchem.2016.04.025.
[13] 曲亚琳, 张德权, 饶伟丽, 等. 高密度CO2对羊肉糜凝胶特性的影响[J]. 核农学报, 2010, 24(6): 1226-1231. DOI:10.11869/hnxb.2010.06.1226.
[14] 李玉娜, 迟玉杰, 孙强. 高密度CO2对全蛋液功能性质的影响[J]. 食品与发酵工业, 2012, 38(8): 88-92. DOI:10.13995/j.cnki.11-1802/ts.2012.08.039.
[15] FLOREN M L, SPILIMBERGO S, MOTTA A, et al. Carbon dioxide induced silk protein gelation for biomedical applications[J].Biomacromolecules, 2012, 13(7): 2060-2072. DOI:10.1021/bm300450a.
[16] RAO Weili, LI Xin, WANG Zhenyu, et al. Dense phase carbon dioxide combined with mild heating induced myosin denaturation,texture improvement and gel properties of sausage[J]. Journal of Food Process Engineering, 2017, 40(2): e12404. DOI:10.1111/jfpe.12404.
[17] 屈小娟, 刘书成, 吉宏武, 等. 高密度CO2诱导制备虾糜凝胶的特性[J]. 农业工程学报, 2012, 28(20): 282-287. DOI:10.3969/j.issn.1002-6819.2012.20.038.
[18] HWANG G C, WATABE S, HASHIMOTO K. Changes in carp myosin ATPase induced by temperature acclimation[J]. Journal of Comparative Physiology B, 1990, 160(3): 233-239. DOI:10.1007/BF00302588.
[19] 张良, 刘书成, 章超桦, 等. 神经网络优化牡蛎的高密度CO2杀菌工艺[J]. 农业工程学报, 2011, 27(12): 369-373. DOI:10.3969/j.issn.1002-6819.2011.12.069.
[20] 蓝尉冰. 凡纳滨对虾肌肉蛋白组成及其肉糜特性研究[D]. 湛江: 广东海洋大学, 2012: 59.
[21] HU Wanfeng, ZHOU Linyan, XU Zhenzhen, et al. Enzyme inactivation in food processing using high pressure carbon dioxide technology[J]. Critical Reviews in Food Science and Nutrition, 2013,53(2): 145-161. DOI:10.1080/10408398.2010.526258.
[22] GUO M H, LIU S C, ISMAIL M, et al. Changes in the myosin secondary structure and shrimp surimi gel strength induced by dense phase carbon dioxide[J]. Food Chemistry, 2017, 227: 219-226.DOI:10.1016/j.foodchem.2017.01.050.
[23] LIU Shucheng, LIU Yuan, LUO Shuai, et al. Molecular dynamics simulation of the interaction between dense-phase carbon dioxide and the myosin heavy chain[J]. Journal of CO2Utilization, 2017, 21:270-279. DOI:10.1016/j.jcou.2017.07.025.
[24] SHARP A, OFFER G. The mechanism of formation of gels from myosin molecules[J]. Journal of the Science of Food and Agriculture,1992, 58(1): 63-73. DOI:10.1002/jsfa.2740580112.
[25] HAYAKAWA T, YOSHIDA Y, YASUI M, et al. Heat-induced gelation of myosin in a low ionic strength solution containing L-histidine[J]. Meat Science, 2012, 90(1): 77-80. DOI:10.1016/j.meatsci.2011.06.002.
[26] LI Renjie, WANG Yongtao, HU Wanfeng, et al. Changes in the activity, dissociation, aggregation, and the secondary and tertiary structures of a thaumatin-like protein with a high polyphenol oxidase activity induced by high pressure CO2[J]. Innovative Food Science and Emerging Technologies, 2014, 23: 68-78. DOI:10.1016/j.ifset.2014.02.013.
[27] HU Wanfeng, ZHANG Yan, WANG Yuanyuan, et al. Aggregation and homogenization, surface charge and structural change, and inactivation of mushroom tyrosinase in an aqueous system by subcritical/supercritical carbon dioxide[J]. Langmuir, 2011, 27(3):909-916. DOI:10.1021/la103482x.
[28] WINTERS M A, KNUTSON B L, DEBENEDETTI P G, et al.Precipitation of proteins in supercritical carbon dioxide[J]. Journal of Pharmaceutical Sciences, 1996, 85(6): 586-594. DOI:10.1021/js950482q.