表 1 萨拉米发酵工艺及取样点
Table 1 Sampling time points during the fermentation process of Salami
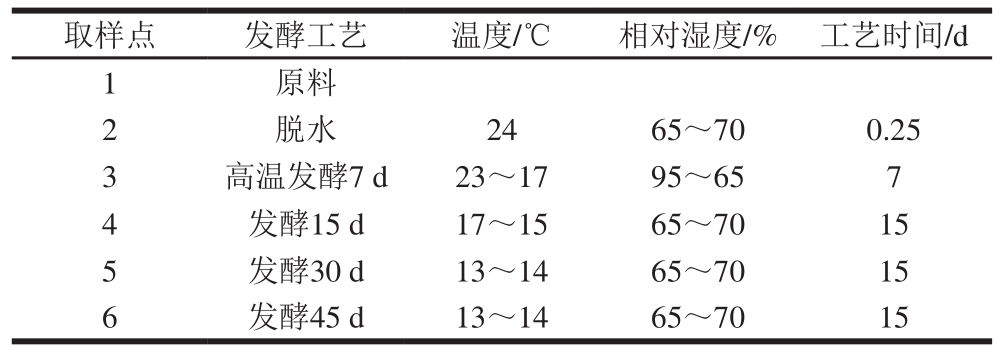
取样点 发酵工艺 温度/℃ 相对湿度/% 工艺时间/d 1原料2脱水 24 65~70 0.25 3 高温发酵7 d 23~17 95~65 7 4 发酵15 d 17~15 65~70 15 5 发酵30 d 13~14 65~70 15 6 发酵45 d 13~14 65~70 15
我国是世界上的肉类生产和消费大国,肉类产业消费大多局限于生鲜肉、传统腌腊肉制品等,品种相对单一。发酵肉制品是指在自然或人工控制条件下,利用微生物的发酵作用,产生具有特殊风味、色泽和质地,并且具有较长保质期的肉制品[1]。发酵香肠一般情况下不需要冷藏保存,其主要利用较低的pH值和较低的水分活度来抑制杂菌和有害致病菌的生长繁殖[2],进而延长货架期,保证产品的质量。米兰萨拉米是一种典型的发酵肉制品,在欧洲有极大的消费市场,但是在我国生产消费量较少,开发生产适合国内消费者食用的萨拉米已经逐渐成为国内肉制品发展的新方向。在发酵肉制品发酵和成熟的过程中,微生物菌群对产品的风味、色泽及安全性起着至关重要的作用[3]。发酵肉制品中常见的有益微生物主要有细菌、霉菌和酵母菌中的部分种属,其中尤以乳酸菌[4]居多。乳酸菌在肉发酵中能提高终产品的卫生[5]和感官质量,是必要的发酵剂,是判定食品质量的一项重要微生物学指标[6]。由于肉制品的原料、初始菌落及加工工艺的不同,产品中产生了不同的风味及滋味物质,造成了不同发酵肉制品的风味各异。
本研究以米兰萨拉米发酵香肠为研究对象,针对其发酵过程中主要发酵菌种的数量变化,研究萨拉米发酵成熟过程中微生物菌群的变化。通过监测萨拉米加工过程中菌落总数、乳酸菌、葡萄球菌、酵母菌及霉菌的变化情况,确定萨拉米发酵成熟过程中微生物菌群的变化趋势及其对产品品质的影响。同时,通过分析发酵肉制品中的风味物质,确定其典型的呈香物质,对于鉴别产品的风味品质具有重要的借鉴意义。另外,分析萨拉米中的风味物质组成及相对含量,这对于推动萨拉米发酵成熟过程中风味形成过程和机理的研究具有重要作用。本研究有利于为米兰萨拉米的生产加工提供理论依据和技术指导,提供一个科学、完整的质量品质评价体系,对于改善米兰萨拉米的质量品质以进一步满足消费者的需求具有重要意义。
原料:冷冻猪肉、香辛料(黑胡椒、大蒜粉、米兰萨拉米专用调料)、食盐、葡萄糖、D-异抗坏血酸钠、硝酸钾、亚硝酸钠等 江苏雨润肉食品有限公司;C6~C20烷烃标准品 美国AccuStandard Inc公司;二硫苏糖醇、乙二胺四乙酸、乙二醇四乙酸、三羟甲基氨基甲烷、柠檬酸、柠檬酸三钠、三氯乙酸、氯仿、甲醇、异丙醇、冰乙酸、乙醚、硫酸铜、氢氧化钠、硫代巴比妥酸、十二烷基硫酸钠、考马斯亮蓝、巯基乙醇、过硫酸胺碳酸钠、盐酸、NaOH、甘氨酸、Na2HPO4、KH2PO4、氯化钾及甲醛溶液均为国产分析纯。
菌种:SM-181型菌种发酵剂:由清酒乳杆菌(Lactobacillus sakei)和木糖葡萄球菌(Staphylococcus xylosus)组成,生物量>2.9×109 CFU/g,购自科汉森(中国)有限公司。
培养基:改良MRS琼脂培养基、葡萄球菌选择性琼脂培养基、沙保弱庆大氯霉素2琼脂培养基、平板计数琼脂培养基,购自北京陆桥技术有限公司。
SW-CJ-1FD单人单面净化工作台 苏州净化设备有限公司;UV-2600紫外-可见分光光度计 日本岛津公司;Allegra-64R台式冷冻离心机 美国Beckman公司;NHWY-200B台式全温度恒温摇床 常州诺基仪器有限公司;2300 KjeltecTM自动凯氏定氮仪 丹麦Foss分析仪器公司;602S稳压稳流电泳仪 北京六一仪器厂;FR-980生物电泳图像分析系统 上海复日科技有限公司;Trace MS气相色谱-质谱联用仪 美国Finnigan公司;DB-5毛细管色谱柱(60 m×0.32 mm,1 μm)美国J&W Scientific公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器有限公司;DC-12H氮吹仪 上海安谱科学仪器有限公司;L-8900氨基酸自动分析仪 日本日立公司。
1.3.1 萨拉米的加工工艺
米兰萨拉米的主要加工工艺为:原料肉→解冻→预斩→绞制→撒料(发酵剂接种)→打散→搅拌→灌装→发酵成熟→剥皮包装[7]
操作要点:原料肉要求无筋膜、淤血及恶性杂质等,采用低温解冻,解冻室温度控制在0~4 ℃,解冻至中心温度达到-2.5~-1.5 ℃即可;将原料肉投入斩拌锅,斩拌至锅内肉块变小易于绞肉后,即可由传送带将肉馅送入绞肉机中,斩拌后肉温不得超过0 ℃,随后采用3.5 mm孔板对预斩后的肉块进行绞制;将混合后的辅料(含菌种发酵剂,添加量10%~13%)均匀撒在传送带上的肉馅表面,经过打散机打散,使肉馅和辅料混合均匀;打散后的肉馅通过传送带送入搅拌机搅拌均匀,颜色均一,肉馅之间有黏连即可停止搅拌,出机待灌装,搅拌后肉温不得超过0 ℃;采用胶原蛋白肠衣灌装,灌装前肠衣用盐水浸泡15~30 min;将称质量后的肉馅倒入灌装机内,进行自动打卡灌装,肠体外面套上收缩网,附上挂绳,两端打卡,灌装后的肠体应饱满紧绷,无肉眼可见气泡;发酵成熟:具体发酵成熟工艺如表1所示;剥皮包装:将产品表面的网套和肠衣去除,剥皮后的产品用刀从中间切成2 段,包装完的产品可直接置于-20 ℃贮藏备用。
表 1 萨拉米发酵工艺及取样点
Table 1 Sampling time points during the fermentation process of Salami

取样点 发酵工艺 温度/℃ 相对湿度/% 工艺时间/d 1原料2脱水 24 65~70 0.25 3 高温发酵7 d 23~17 95~65 7 4 发酵15 d 17~15 65~70 15 5 发酵30 d 13~14 65~70 15 6 发酵45 d 13~14 65~70 15
1.3.2 萨拉米成熟过程中的取样
萨拉米的发酵成熟工艺及取样点如表1所示。对于不同取样样品,先将产品表面的网套和肠衣去除,避免裸露产品表面黏上白霉,进行剥皮包装及贮藏,备用,以原料肉为对照。
1.3.3 萨拉米发酵成熟过程中微生物菌落总数的测定
通过菌落计数的方法研究萨拉米发酵成熟过程中菌落总数、乳酸菌、葡萄球菌、酵母菌和霉菌数量的变化,从而确定发酵成熟过程中微生物菌群的变化[8]。在无菌条件下准确称取剪碎的样品25 g,并匀浆处理,然后置于225 mL的无菌生理盐水中,剧烈振荡使其充分混匀,将混合液进行梯度稀释后涂布于对应的培养基上,在适应的温度条件下培养一定时间(表2)。将每个阶段的萨拉米样品在固体培养基上进行培养,每个样品3 个平行。菌落计数方法参照GB 4789.2—2010《食品安全国家标准食品微生物学检验 菌落总数测定》。
表 2 萨拉米中不同菌属的培养基及培养条件
Table 2 Culture media and conditions for different microbial species in Salami

菌属 培养基 培养温度/℃培养时间/h乳酸菌 改良MRS琼脂培养基 37 48葡萄球菌 葡萄球菌选择性培养基 37 48霉菌与酵母菌 沙保弱庆大氯霉素2琼脂培养基 28 72菌落总数 平板计数琼脂培养基 30 48
1.3.4 萨拉米挥发性风味物质测定
采用顶空吹扫捕集法提取、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术分离鉴定萨拉米中的挥发性风味物质种类及相对含量,并通过感官评定确定产品品质。将萨拉米样品裁剪为1.5 mm见方的肉块,将5 g左右样品置于体积为40 mL的样品瓶中,40 ℃顶空30 min;高纯氦气(99.99%)、275 kPa吹5 s,置于4 ℃保存,最长可保存5 h;将样品加热至60 ℃,氦气40 mL/min吹扫13 min,Tenax吸附剂吸附,捕集阱加热到220 ℃,氦气220 ℃脱附2 min后,直接进入气相色谱仪。捕集阱需在240 ℃保持30 min,以去除可能的残留物或污染物以便下一次进样。
色谱条件:色谱柱:J&W DB-5石英毛细管柱(60 m×0.25 mm,1 μm);载气(氦气)流速1 mL/min;进样接口温度均为250 ℃;升温程序:40 ℃保持3 min,以5 ℃/min速率升至130 ℃,8 ℃/min升至200 ℃,12 ℃/min升至250 ℃,保持7 min;分流比1∶10。
质谱条件:电子电离源;离子源温度280 ℃;电子能量70 eV;激活电压350 V;发射电流200 μA;质量扫描范围30~550 m/z。
所有数据采用SPSS 20.0软件进行邓肯氏多重比较和差异显著性检验,采用Origin 8.6软件进行分析和作图。
2.1.1 菌落总数变化
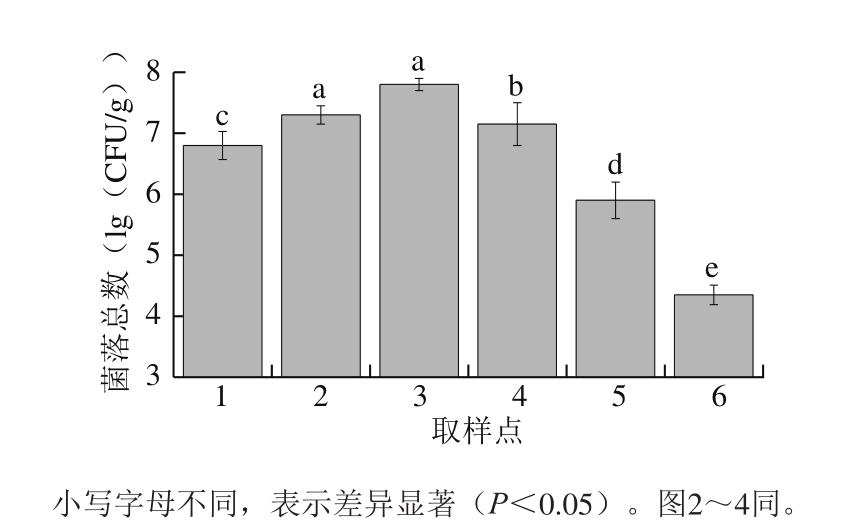
图1 萨拉米发酵成熟过程中的菌落总数变化
Fig. 1 Changes in total number of colonies during processing of Salami
菌落总数是萨拉米产品检测的重要指标之一。由图1可知,在萨拉米加工发酵过程中,菌落总数随着发酵成熟过程呈先显著升高后缓慢增长再显著降低的趋势。原料肉在接种发酵菌后,菌落总数为6.77 (lg(CFU/g));在腌制脱水及高温发酵过程中,由于产品的温度较高、相对湿度较大,水分活度显著提高,导致微生物迅速繁殖;在高温发酵结束后,产品的菌落总数达7.80 (lg(CFU/g));在发酵7~15 d,萨拉米的菌落总数没有太大变化,这与Ruiz-Moyano[9]、Arief[10]、杜莎[11]等的研究结果类似;随着发酵成熟过程的继续进行,萨拉米中的菌落总数呈显著下降趋势(P<0.05),尤其是在发酵45 d的成熟阶段,产品的菌落总数急剧降低至4.32 (lg(CFU/g))。这主要是由于发酵成熟后期营养物质减少、水分散失和发酵温度降低,低水分、低温的条件抑制了产品中微生物的生长;另外,由于发酵过程中乳酸菌的作用使得酸度值不断降低,对微生物的生长也有一定的抑制作用。
2.1.2 乳酸菌数量变化
采用改良MRS培养基,通过钙圈筛选的方法得到乳酸菌数量随发酵时间的变化。由图2可知,接种发酵菌后,萨拉米发酵成熟过程中的乳酸菌数量呈先显著增加后稳定再显著降低的趋势,与菌落总数的变化趋势一致。接种后原料中乳酸菌的数量为6.10 (lg(CFU/g)),并且在脱水、高温发酵成熟以及发酵15 d的成熟阶段,乳酸菌数量持续增加至7.63 (lg(CFU/g));发酵15 d后,产品的乳酸菌数量呈显著降低趋势(P<0.05),发酵成熟结束后为3.22 (lg(CFU/g))。乳酸菌数量在前期加工过程中总体变化趋势较小,进入发酵期后变化显著(P<0.05);而在发酵后期,乳酸菌数量逐渐降低主要是由于水分活度降低,pH值降低,盐浓度上升,使得乳酸菌的生长受到抑制。乳酸菌是米兰萨拉米发酵成熟过程中的主要优势菌种,在发酵成熟过程中能够利用原料中的糖类和含氮类物质进行发酵,产生乳酸,降低产品的pH值[12]。乳酸及少量的副产物,如琥珀酸、甲酸、乙酸等,可赋予产品特殊的风味,分解蛋白质中的氨基酸,产生特有的风味[13-15],减少亚硝胺的生成,提高产品的食用安全性,对维持米兰萨拉米的风味特征有重要贡献。另外,本研究所采用的发酵剂中,清酒乳杆菌是产品发酵剂中的重要发酵菌种之一。Baka等[16]研究发现,清酒乳杆菌能够显著抑制发酵香肠中生物胺的形成。清酒乳杆菌对食源性致病菌单增李斯特菌有较强的抑制作用[17],对萨拉米香肠的发酵和贮藏具有重要作用。
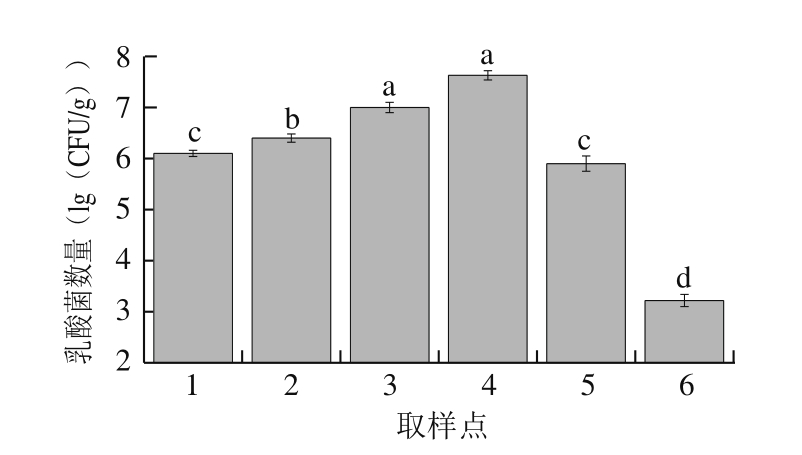
图2 萨拉米发酵成熟过程中乳酸菌数量变化
Fig. 2 Changes in Lactobacillus count during processing of Salami
2.1.3 葡萄球菌数量变化
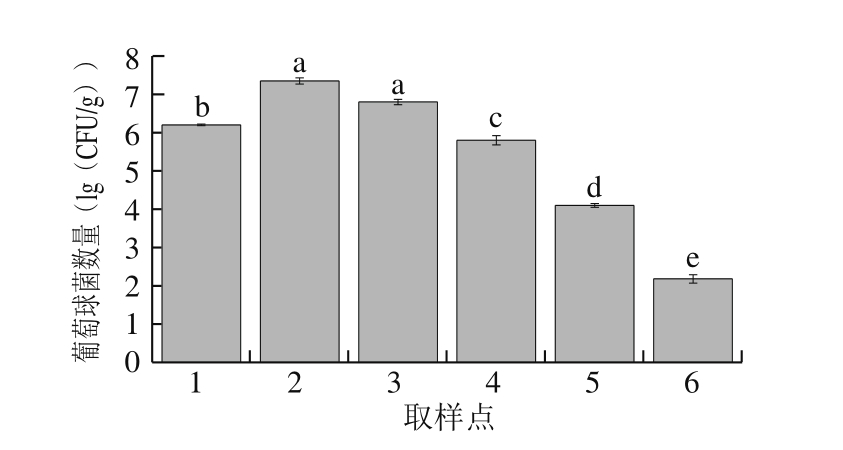
图3 萨拉米发酵成熟过程中的葡萄球菌数量变化
Fig. 3 Changes in Staphylococcus count during processing of Salami
本研究针对发酵剂中另一重要发酵菌种(葡萄球菌),采用选择性培养基对萨拉米发酵成熟过程中葡萄球菌的数量变化进行分析。由图3可知:葡萄球菌的主要生长阶段为脱水阶段,在原料中接种发酵菌后,其数量迅速增加至7.35 (lg(CFU/g));在高温发酵成熟及发酵15 d的成熟阶段,产品中的葡萄球菌数量有轻微降低,这主要是由于萨拉米经过脱水阶段后,产品的水分含量和发酵温度逐渐降低,影响了细菌的发酵;随着发酵时间的继续延长,产品中的酸度累积及水分散失导致葡萄球菌数量急剧下降;在发酵成熟结束后,其数量降低至2.18 (lg(CFU/g))。本研究中的木糖葡萄球菌是肉品发酵剂中常见的凝固酶阴性球菌[18-19],在萨拉米发酵过程中,木糖葡萄球菌对产品中的挥发性风味物质有促进作用,具有硝酸盐还原酶、蛋白质和脂肪水解能力[20-21],产生乙偶姻,乙偶姻发酵产生特殊的萨拉米风味[22],并且对肉制品中的蛋白质和脂质有显著的分解功能,表现出与内源蛋白酶及脂肪水解酶相似的功效[23-24]。
2.1.4 酵母菌和霉菌数量变化
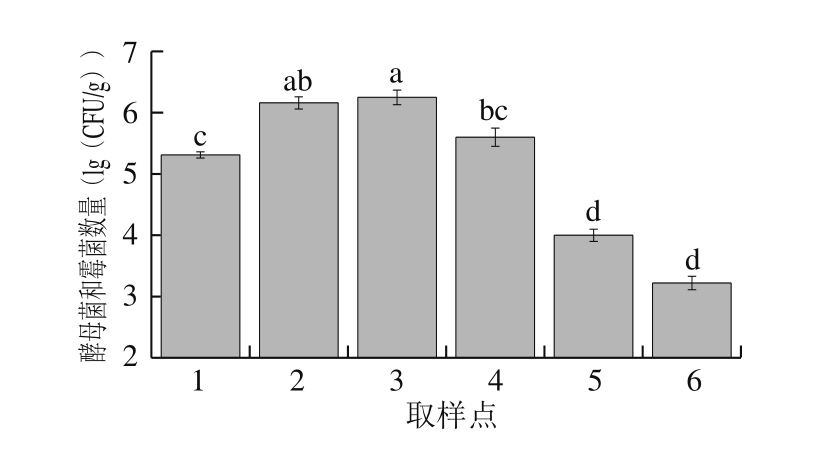
图4 萨拉米发酵成熟过程中的酵母菌和霉菌数量变化
Fig. 4 Changes in yeast/mold count during processing of Salami
由图4可知:由于在原料发酵菌中未添加酵母菌,接种后原料中的酵母菌和霉菌数量仅为5.31 (lg(CFU/g));经过脱水及高温发酵成熟后,其数量显著增加至6.25 (lg(CFU/g));随着发酵过程的继续进行,产品中的酵母菌及霉菌数量逐渐降低至3.22 (lg(CFU/g))。在发酵肉制品中,酵母菌和霉菌主要生长于肉制品表面,使肉制品减少与氧气和光的直接接触,起到抗酸败作用[25-27],对肉制品的香气有重要贡献。在高温发酵阶段,温度和相对湿度较高,霉菌数量显著上升,而霉菌中90%以上是青霉,它随着温度的变化而变化,在萨拉米香肠内部很少发现,说明霉菌的生长与萨拉米加工过程中的环境温度和相对湿度有关。但是随着发酵过程中水分的散失和pH值的降低,产品中的酵母菌和霉菌数量也急剧降低,但酵母菌数量的下降在发酵后期,表明酵母菌有更强的抗酸和抗低水分含量的能力,这与杜莎等[11]的研究结果一致。
由图5及表3可知,分析不同保留时间出现的吸收峰可以得出,萨拉米中共检出58 种挥发性风味物质,分别为烃类(12 种)、醇类(12 种)、醛类(10 种)、酯类(4 种)、酮酸类(7 种)、酚醚类(5 种)及其他(8 种)。不同风味物质的相对含量分别为烃类34.30%、醇类13.29%、醛类17.17%、酯类1.43%、酮酸类8.21%、酚醚类18.39%、其他类7.21%。

图5 萨拉米中挥发性风味物质的GC-MS检测总离子流图
Fig. 5 Total ion current chromatogram of volatile fl avor compounds from Salami detected by GC-MS
表 3 萨拉米中的挥发性风味成分
Table 3 Volatile fl avor components of Salami
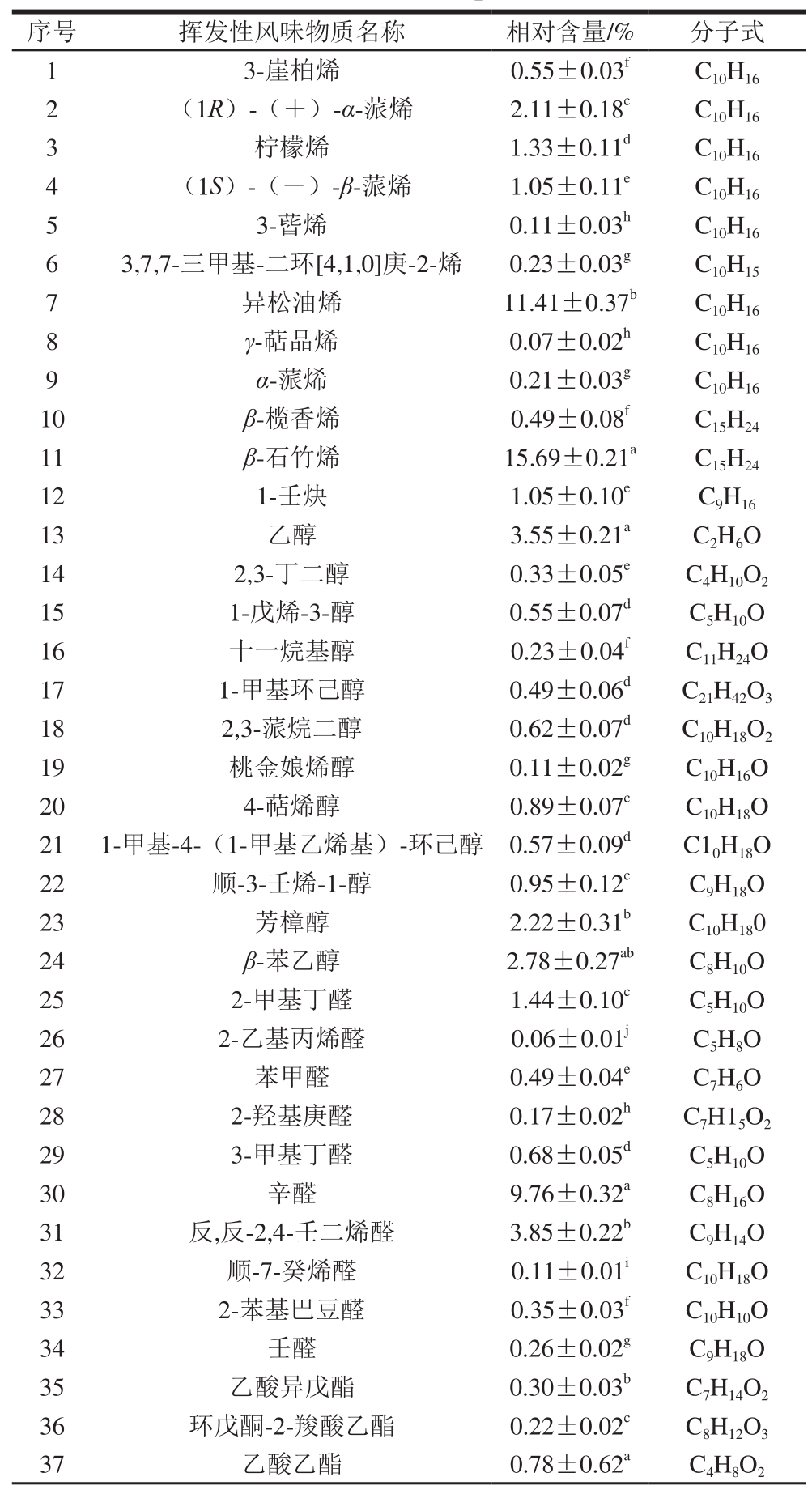
序号 挥发性风味物质名称 相对含量/% 分子式1 3-崖柏烯 0.55±0.03f C10H16 2 (1R)-(+)-α-蒎烯 2.11±0.18c C10H16 3柠檬烯 1.33±0.11d C10H16 4 (1S)-(-)-β-蒎烯 1.05±0.11e C10H16 5 3-蒈烯 0.11±0.03h C10H16 6 3,7,7-三甲基-二环[4,1,0]庚-2-烯 0.23±0.03g C10H15 7异松油烯 11.41±0.37b C10H16 8 γ-萜品烯 0.07±0.02h C10H16 9 α-蒎烯 0.21±0.03g C10H16 10 β-榄香烯 0.49±0.08f C15H24 11 β-石竹烯 15.69±0.21a C15H24 12 1-壬炔 1.05±0.10e C9H16 13 乙醇 3.55±0.21a C2H6O 14 2,3-丁二醇 0.33±0.05e C4H10O2 15 1-戊烯-3-醇 0.55±0.07d C5H10O 16 十一烷基醇 0.23±0.04f C11H24O 17 1-甲基环己醇 0.49±0.06d C21H42O3 18 2,3-蒎烷二醇 0.62±0.07d C10H18O2 19 桃金娘烯醇 0.11±0.02g C10H16O 20 4-萜烯醇 0.89±0.07c C10H18O 21 1-甲基-4-(1-甲基乙烯基)-环己醇 0.57±0.09d C10H18O 22 顺-3-壬烯-1-醇 0.95±0.12c C9H18O 23 芳樟醇 2.22±0.31b C10H180 24 β-苯乙醇 2.78±0.27ab C8H10O 25 2-甲基丁醛 1.44±0.10c C5H10O 26 2-乙基丙烯醛 0.06±0.01j C5H8O 27 苯甲醛 0.49±0.04e C7H6O 28 2-羟基庚醛 0.17±0.02h C7H15O2 29 3-甲基丁醛 0.68±0.05d C5H10O 30 辛醛 9.76±0.32a C8H16O 31 反,反-2,4-壬二烯醛 3.85±0.22b C9H14O 32 顺-7-癸烯醛 0.11±0.01i C10H18O 33 2-苯基巴豆醛 0.35±0.03f C10H10O 34 壬醛 0.26±0.02g C9H18O 35 乙酸异戊酯 0.30±0.03b C7H14O2 36 环戊酮-2-羧酸乙酯 0.22±0.02c C8H12O3 37 乙酸乙酯 0.78±0.62a C4H8O2
续表3
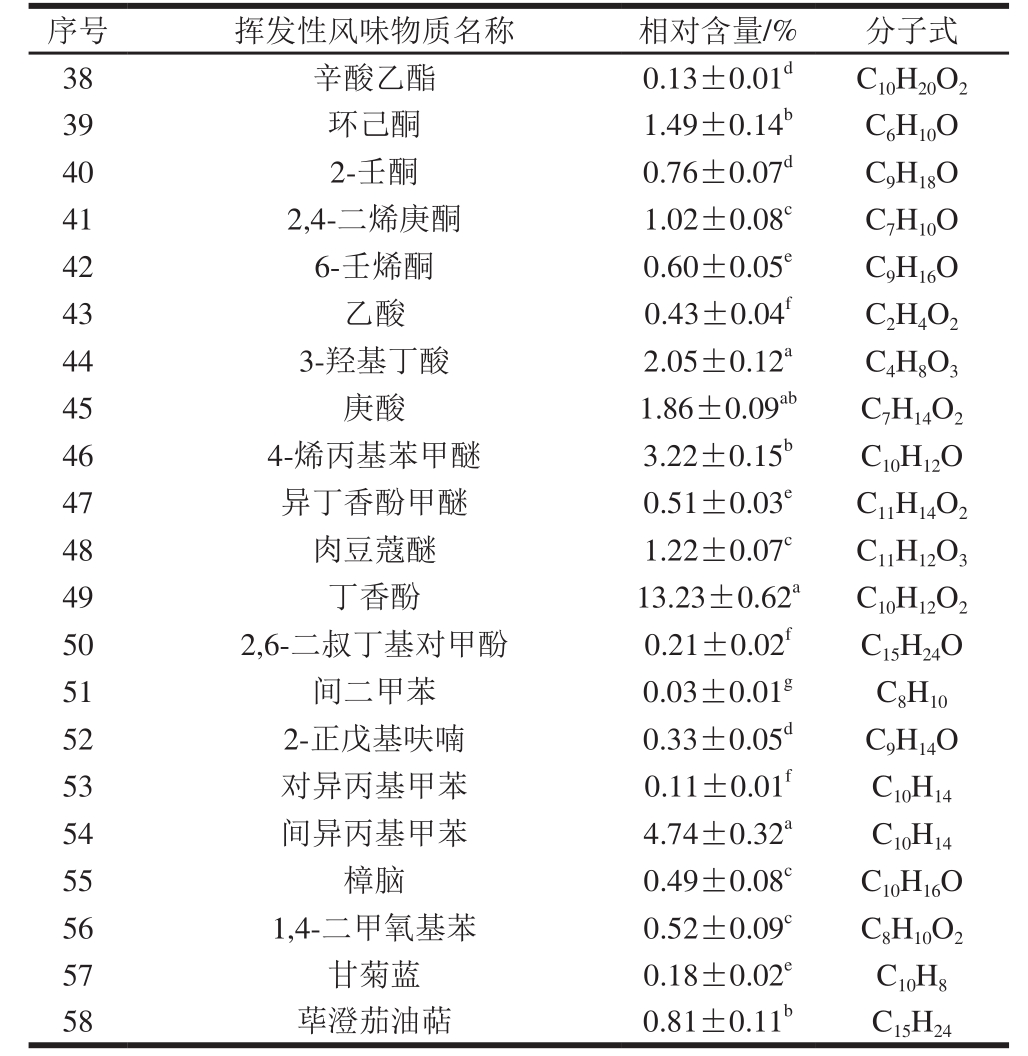
注:同列小写字母不同,表示差异显著(P<0.05)。
序号 挥发性风味物质名称 相对含量/% 分子式38 辛酸乙酯 0.13±0.01d C10H20O2 39 环己酮 1.49±0.14b C6H10O 40 2-壬酮 0.76±0.07d C9H18O 41 2,4-二烯庚酮 1.02±0.08c C7H10O 42 6-壬烯酮 0.60±0.05e C9H16O 43 乙酸 0.43±0.04f C2H4O2 44 3-羟基丁酸 2.05±0.12a C4H8O3 45 庚酸 1.86±0.09ab C7H14O2 46 4-烯丙基苯甲醚 3.22±0.15b C10H12O 47 异丁香酚甲醚 0.51±0.03e C11H14O2 48 肉豆蔻醚 1.22±0.07c C11H12O3 49 丁香酚 13.23±0.62a C10H12O2 50 2,6-二叔丁基对甲酚 0.21±0.02f C15H24O 51 间二甲苯 0.03±0.01g C8H10 52 2-正戊基呋喃 0.33±0.05d C9H14O 53 对异丙基甲苯 0.11±0.01f C10H14 54 间异丙基甲苯 4.74±0.32a C10H14 55 樟脑 0.49±0.08c C10H16O 56 1,4-二甲氧基苯 0.52±0.09c C8H10O2 57 甘菊蓝 0.18±0.02e C10H8 58 荜澄茄油萜 0.81±0.11b C15H24
烃类、醇类、醛类、酮酸类和酚类物质是发酵肉制品风味物质的重要组成部分。烯烃类风味成分大部分阈值较低,且具有明显的果香味;醇类风味物质主要来源于烯烃类物质的氧化、脂肪碳链的断裂及微生物的代谢;醛类中的小分子醛类物质阈值较低,具有明显的香味,来源于醇类物质的进一步氧化;酮酸类风味成分是烃类、醇类成分氧化的最终产物,主要来源于脂肪酸链的氧化及微生物的发酵;酚类风味物质具有明显的芳香味及脂香味,在发酵肉制品中主要来源于微生物的代谢及香辛料;醚类物质在常温条件下大多呈香味,其阈值和呈味特点与碳链的组成有明显的相关性,主要来源于香辛料中的呈味物质,这些特征风味物质均能显著提高发酵肉制品的风味品质[14,21]。
在萨拉米中检测到的12 种烃类挥发性风味物质全部为烯烃类,分别为3-崖柏烯、(1R)-(+)-α-蒎烯、柠檬烯、(1S)-(-)-β-蒎烯、3-蒈烯、3,7,7-三甲基-二环[4,1,0]庚-2-烯、异松油烯、γ-萜品烯、α-蒎烯、β-榄香烯、β-石竹烯和1-壬炔。在萨拉米中检测到较多的烯烃类挥发性物质,这可能是由于添加的香辛料及专用调料及微生物发酵导致。检测到的12 种醇类风味物质分别为乙醇、2,3-丁二醇、1-戊烯-3-醇、十一烷基醇、1-甲基环己醇、2,3-蒎烷二醇、桃金娘烯醇、4-萜烯醇、1-甲基-4-(1-甲基乙烯基)-环己醇、顺-3-壬烯-1-醇、芳樟醇和β-苯乙醇。这些醇类物质对萨拉米的风味品质有重要贡献,例如,萜烯醇和芳樟醇呈明显的木香味,β-苯乙醇则具有清淡的玫瑰花香,在发酵肉制品中的主要来源为烃类及脂肪酸链的氧化及黑胡椒等调味料。检测到的10 种醛类挥发性风味成分分别为2-甲基丁醛、2-乙基丙烯醛、苯甲醛、2-羟基庚醛、3-甲基丁醛、辛醛、反,反-2,4-壬二烯醛、顺-7-癸烯醛、2-苯基巴豆醛和壬醛。其中,2-甲基丁醛和3-甲基丁醛是发酵肉制品中典型的呈味物质,广泛存在于不同的发酵香肠、火腿及腌腊肉制品中,主要来源于氨基酸的脱氨脱羧反应,这主要是由于肉中的蛋白质等物质在微生物及其相应产物的作用下分解为氨基酸,使得蛋白质分解产生小分子风味成分的前体物质,促进萨拉米风味的形成;另外,苯甲醛、辛醛和壬醛等醛类风味成分也具有明显的芳香味,对构成发酵肉制品的风味特征有重要贡献。同时,在萨拉米中共检测到4 种酯类风味成分。检测到的7 种酮酸类物质分别为环己酮、2-壬酮、2,4-二烯庚酮、6-壬烯酮、乙酸、3-羟基丁酸和庚酸。庚酸和2,4-二烯庚酮具有明显的香草味,对发酵肉制品的香味有重要贡献。检测到的2 种酚类物质分别为丁香酚和2,6-二叔丁基对甲酚,具有明显的丁香香味和温和的辛香味,主要来源于香辛料及乳酸菌的发酵,在发酵酸化阶段乳酸菌作用最大,能够赋予产品微酸、醇香的发酵风味。检测到的3 种醚类物质分别为4-烯丙基苯甲醚、异丁香酚甲醚和肉豆蔻醚。其中,4-烯丙基苯甲醚是相对含量最高的醚类,主要来源于大茴香;另外,异丁香酚甲醚也是一种重要的呈香物质,其主要来源于香辛料,是发酵肉制品风味的重要组成部分。另外还检测到苯环类、呋喃类等其他风味成分共8 种,分别为间二甲苯、2-正戊基呋喃、对异丙基甲苯、间异丙基甲苯、樟脑、1,4-二甲氧基苯、甘菊蓝和荜澄茄油萜,这些风味成分的呈味特征大多表现为芳香味及果香味等,主要来源于氨基酸的降解、脂肪氧化、微生物代谢及香辛料,能够增加发酵肉制品风味的多样性。
表 4 萨拉米质量检测结果
Table 4 Sensory and chemical properties of Salami

项目 标准要求 检测结果色泽 表面呈棕色或浅棕色,切面颜色由里向外逐渐变深,有少许正常视力可见的香辛料颗粒及不规则脂肪分布 符合要求组织形态 组织紧密有弹性,形态完整,切片性良好 符合要求气味及滋味 具有该产品固有的传统气味和滋味,有浓郁的发酵香味 合格杂质 无正常视力可见外来杂质 符合要求过氧化值/(g/100 g) ≤0.5 0.04铅含量/(mg/kg) ≤0.45 未检出汞含量/(mg/kg) ≤0.05 未检出总砷含量/(mg/kg) ≤0.5 未检出镉含量/(mg/kg) ≤0.1 未检出铬含量/(mg/kg) ≤1.0 未检出N-二甲基亚硝胺含量/(μg/kg) ≤3.0 未检出亚硝酸盐含量/(mg/kg) ≤30 6盐酸克伦特罗含量/(μg/kg) 不得检出 未检出莱克多巴胺含量/(μg/kg) 不得检出 未检出沙丁胺醇含量/(μg/kg) 不得检出 未检出
以Q/MYB 0007S—2017《发酵肉制品系列》为执行标准,对萨拉米进行检测,检测机构为第三方检测机构。由表4可知,萨拉米所检测项目,包括感官指标、过氧化值、重金属含量、亚硝酸盐含量等指标均符合Q/MYB 0007S—2017标准要求,说明在萨拉米生产过程中,有效控制发酵温度、时间、相对湿度及发酵菌种可以有效提高产品的品质及安全性。
乳酸菌、葡萄球菌、酵母菌和霉菌是米兰萨拉米发酵成熟过程中的主要优势菌,并且随着发酵时间的延长,产品中的微生物数量呈先升高后降低的趋势,其中高温发酵成熟阶段及中温发酵成熟阶段是米兰萨拉米发酵成熟过程中微生物生长的主要阶段。通过GC-MS法分析米兰萨拉米中的挥发性风味物质,共检出58 种挥发性风味物质,分别为烃类(12 种)、醇类(12 种)、醛类(10 种)、酯类(4 种)、酮酸类(7 种)、酚醚类(5 种)及其他(8 种)。发酵过程中,发酵优势菌对萨拉米成熟过程中的风味物质具有积极影响。另外,米兰萨拉米所检测项目的结果均符合Q/MYB 0007S—2017标准的要求。本研究可以为米兰萨拉米的生产加工提供理论依据和技术指导,并提供一个科学、完整的质量品质评价体系,有助于改善米兰萨拉米的质量品质,进一步满足消费者的需求,有助于推进我国肉类工业的发展。
[1] 李家鹏, 田寒友, 邹昊. 国外发酵肉制品微生物限量标准研究[J]. 肉类研究, 2013, 27(1): 38-41.
[2] SAMESHIMA T, MAGOME C, TAKESHITA K, et al. Effect of intestinal Lactobacillus starter cultures on the behaviour of Staphylococcus aureus in fermented sausage[J]. International Journal of Food Microbiology, 1998, 41(1): 1-7. DOI:10.1016/S0168-1605(98)00038-5.
[3] 王保军, 刘双江. 环境微生物培养新技术的研究进展[J]. 微生物学通报, 2013, 40(1): 6-17. DOI:10.13344/j.microbiol.china.2013.01.001.
[4] GEVERS D, DANIELSEN M, HUYS G, et al. Molecular characterization of tet (M) genes in Lactobacillus isolates from different types of fermented dry sausage[J]. Applied and Environmental Microbiology, 2003, 69(2): 1270-1275. DOI:10.1128/AEM.69.2.1270-1275.2003.
[5] 赵玲艳, 邓放明, 杨细平, 等. 生物防腐剂: 乳酸菌素[J]. 中国食物与营养, 2005(2): 27-29.
[6] 白婷, 王卫, 李俊霞, 等. 发酵肉制品的品质评定指标及其进展[J]. 食品科技, 2014, 39(6): 169-173. DOI:10.13684/j.cnki.spkj.2014.09.037.
[7] PAPAMANOLI E, TZANETAKIS N, LITOPOULOU-TZANETAKI E,et al. Characterization of lactic acid bacteria isolated from a Greek dry-fermented sausage in respect of their technological and probiotic properties[J]. Meat Science, 2003, 65(2): 859-867. DOI:10.1016/S0309-1740(02)00292-9.
[8] CASABURI A, ARISTOY M C, CAVELLA S, et al. Biochemical and sensory characteristics of traditional fermented sausages of Vallo di Diano (Southern Italy) as affected by the use of starter cultures[J]. Meat Science, 2007, 76(2): 295-307. DOI:10.1016/j.meatsci.2006.11.011.
[9] RUIZ-MOYANO S, MARTÍN A, JOSÉ-BENITO M, et al. Application of Lactobacillus fermentum HL57 and Pediococcus acidilactici SP979 as potential probiotics in the manufacture of traditional Iberian dryfermented sausages[J]. Food Microbiology, 2011, 28(5): 839-847.DOI:10.1016/j.fm.2011.01.006.
[10] ARIEF I I, WULANDARI Z, ADITIA E L, et al. Physicochemical and microbiological properties of fermented lamb sausages using probiotic Lactobacillus plantarum IIA-2C12 as starter culture[J]. Procedia Environmental Sciences, 2014, 20(2): 352-356. DOI:10.1016/j.proenv.2014.03.044.
[11] 杜莎, 李柯, 黄晴. 人工发酵剂对湘西腊肠微生物菌群和理化特性的影响[J]. 现代食品科技, 2017, 33(4): 241-247. DOI:10.13982/j.mfst.1673-9078.2017.4.037.
[12] PAN D, TANOKURA M. Purification and characterization of an aminopeptidase from Lactobacillus helveticus JCM 1004[J]. Food Chemistry, 2004, 88(4): 511-516. DOI:10.1016/j.foodchem.2004.01.082.
[13] CAMPAGNOL P C, DOS SANTOS B A, TERRA N N, et al. Lysine,disodium guanylate and disodium inosinate as fl avor enhancers in lowsodium fermented sausages[J]. Meat Science, 2012, 91(3): 334-338.DOI:10.1016/j.meatsci.2012.02.012.
[14] HERRANZ B, FERNÁNDEZ M, DE LA HOZ L, et al. Use of bacterial extracts to enhance amino acid breakdown in dry fermented sausages[J]. Meat Science, 2006, 72(2): 318-325. DOI:10.1016/j.meatsci.2005.08.002.
[15] GUTSCHE K A, TRAN T B, VOGEL R F. Production of volatile compounds by Lactobacillus sakei from branched chain α-keto acids[J]. Food Microbiology, 2012, 29(2): 224-228. DOI:10.1016/j.fm.2011.06.010.
[16] BAKA A M, PAPAVERGOU E J, PRAGALAKI T, et al. Effect of selected autochthonous starter cultures on processing and quality characteristics of Greek fermented sausages[J]. LWT-Food Science and Technology, 2011, 44(1): 54-61. DOI:10.1016/j.lwt.2010.05.019.
[17] GAO Yurong, LI Dapeng, LIU Xiaoyan. Bacteriocin-producing Lactobacillus sakei C2 as starter culture in fermented sausages[J].Food Control, 2014, 35(1): 1-6. DOI:10.1016/j.foodcont.2013.06.055.
[18] LATORREMORATALLA M L, BOSCHFUSTÉ J, BOVERCID S,et al. Contribution of enterococci to the volatile profile of slightlyfermented sausages[J]. LWT-Food Science and Technology, 2011,44(1): 145-152. DOI:10.1016/j.lwt.2010.06.033.
[19] OLESEN P T, STAHNKE L H, TALON R. Effect of ascorbate, nitrate and nitrite on the amount of fl avour compounds produced from leucine by Staphylococcus xylosus, and Staphylococcus carnosus[J]. Meat Science, 2004, 68(2): 193-200. DOI:10.1016/j.meatsci.2004.02.017.
[20] CASABURI A, DI M R, CAVELLA S, et al. Proteolytic and lipolytic starter cultures and their effect on traditional fermented sausages ripening and sensory traits[J]. Food Microbiology, 2008, 25(2): 335-347.DOI:10.1016/j.fm.2007.10.006.
[21] RAVYTS F, STEEN L, GOEMAERE O, et al. The application of staphylococci with flavour-generating potential is affected by acidif i cation in fermented dry sausages[J]. Food Microbiology, 2010,27(7): 945-954. DOI:10.1016/j.fm.2010.05.030.
[22] ANDRADE M A, CÓRDOBA J J, CASADO E M, et al. Effect of selected strains of Debaryomyces hansenii on the volatile compound production of dry fermented sausage “salchichón”[J]. Meat Science,2010, 85(2): 256-264. DOI:10.1016/j.meatsci.2010.01.009.
[23] 龙强, 聂乾忠, 刘成国. 发酵香肠研究进展及展望[J]. 食品科学,2017, 38(13): 291-298. DOI:10.7506/spkx1002-6630-201713047.
[24] TJENER K, STAHNKE L H, ANDERSEN L, et al. Addition of α-ketoglutarate enhances formation of volatiles by Staphylococcus carnosus during sausage fermentation[J]. Meat Science, 2004, 67(4):711-719. DOI:10.1016/j.meatsci.2004.02.003.
[25] 程燕. 四川香肠中产蛋白酶和脂肪酶霉菌菌株的分离、鉴定及其初步应用[D]. 雅安: 四川农业大学, 2012: 33-38.
[26] RADULOVIĆ Z, ŽIVKOVIĆ D, MIRKOVIĆ N, et al. Effect of probiotic bacteria on chemical composition and sensory quality of fermented sausages[J]. Procedia Food Science, 2011, 1(2): 1516-1522.DOI:10.1016/j.profoo.2011.09.224.
[27] BOLUMAR T, SANZ Y, FLORES M, et al. Sensory improvement of dry-fermented sausages by the addition of cell-free extracts from Debaryomyces hansenii and Lactobacillus sakei[J]. Meat Science,2006, 72(3): 457-461. DOI:10.1016/j.meatsci.2005.08.010.
Changes of Microbial Flora during the Fermentation of Salami and Their Effect on Flavor